Cloruro de oro (III)
Sabías ...
Esta selección Escuelas fue originalmente elegido por SOS para las escuelas en el mundo en desarrollo que no tienen acceso a Internet. Está disponible como una descarga intranet. Apadrinar un niño para hacer una diferencia real.
| Cloruro de oro (III) | |
|---|---|
 | |
 | |
 | |
Cloruro de oro (III) | |
Otros nombres Cloruro áurico | |
| Identificadores | |
| CAS | 13453-07-1 |
| PubChem | 26030 |
| Propiedades físicas | 8036939 |
| UNII | 15443PR153 |
| ChEBI | CHEBI: 30076 |
| Número RTECS | MD5420000 |
| Imágenes-Jmol 3D | Image 1 |
SONRISAS
| |
InChI
| |
| Propiedades | |
| Fórmula molecular | AuCl 3 (Existe como Au 2 Cl 6) |
| Masa molar | 303.325 g / mol |
| Apariencia | Cristales rojos (anhidro); cristales de oro, amarillo (monohidrato) |
| Densidad | 4,7 g / cm 3 |
| Punto de fusion | 254 ° C (527 K) |
| Solubilidad en agua | 68 g / 100 ml (en frío) |
| Solubilidad | soluble en éter , ligeramente soluble en el líquido de amoníaco |
| Estructura | |
| Estructura cristalina | monoclínico |
| Coordinación geometría | Cuadrada plana |
| Peligros | |
| MSDS | MSDS externa |
| Frases R | R36 / 37/38 |
| Frases S | S26 S36 |
| Principal peligros | Irritante |
| Compuestos relacionados | |
| Otros aniones | Gold (III) de fluoruro Gold (III) bromuro de |
| Otros cationes | Gold (I) cloruro de Silver (I) cloruro de Platinum (II) cloruro de El mercurio (II) cloruro de |
| Página de datos complementaria | |
| Estructura y propiedades | n, ε r, etc. |
| Termodinámica datos | Comportamiento de fase Sólido, líquido, gas |
| Los datos espectrales | UV, IR, RMN , MS |
Excepto cuando se indique lo contrario, los datos se den materiales en su condiciones normales (25 ° C, 100 kPa) | |
| Exenciones y referencias | |
Cloruro de (III) El oro, tradicionalmente llamado cloruro áurico, es un producto químico compuesto de oro y cloro . Con la fórmula molecular Au 2 Cl 6, el tricloruro de nombre de oro es una simplificación, en referencia a la fórmula empírica. Los números romanos en el nombre de indicar que el oro tiene un estado de oxidación de 3, que es común para los compuestos de oro. También hay otro relacionado de cloruro de oro, oro (I) cloruro (AuCl). Ácido cloroáurico, HAuCl 4, el producto formado cuando el oro se disuelve en agua regia, se refiere a veces como "cloruro de oro", "ácido tricloruro de oro" o incluso "oro (III) trihidrato de cloruro." Oro cloruro de (III) es muy higroscópicos y altamente soluble en agua, así como etanol . Se descompone por encima de 160 ° C o en la luz.
Estructura
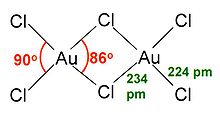
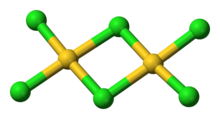
AuCl 3 existe como una cloruro de puenteado dímero tanto como un sólido y en forma de vapor, al menos a bajas temperaturas. Gold (III) de bromuro se comporta de forma análoga. La estructura es similar a la de cloruro de yodo (III).
En oro cloruro de (III), cada centro de oro es cuadrada plana, que es típico de un complejo metálico con ad 8 conteo electrónico. La unión en AuCl 3 se considera un tanto covalente.
Preparación
Oro cloruro de (III) es más a menudo preparó pasando el gas de cloro sobre polvo de oro a 180 ° C:
- 2 Au + 3 Cl 2 → 2 AuCl 3
Otro método de preparación, es la reacción de adición, en donde el oro (3+) se hace reaccionar con cloruro de para producir tetrachloridoaurate (1-); después de lo cual, la tetrachloridoaurate hidrógeno (1-) se calienta para eliminar gas chlorane. Gold (3+) se produce mediante la oxidación con ácido nítrico presente en agua regia:
- Au (s) + 3 NO -
3 (aq) + 6 H + (aq) Au 3+ (ac) + 3 NO 2 (g) + 3 H2O (l)
Au 3+ (ac) + 3 NO 2 (g) + 3 H2O (l) - Au 3+ (ac) + 3 NOCl (g) + 3 NO -
3 (ac) → AuCl 3 (ac) + 6 NO 2 (g) - AuCl 3 (aq) + Cl - (aq)
 AuCl -
AuCl -
4 (aq) - 2 HAuCl 4 (s) → 2 Cl 6 Au (s) + 2 HCl (g)
Reacciones
En contacto con el agua, AuCl 3 forma una serie de especies, a veces descritos como AuCl 3 · H 2 O y su base conjugada [AuCl 3 (OH)] -. La reacción con agentes reductores tales como peróxido de hidrógeno o Fe 2+ hace el oro elemental que se precipita de la solución.
Anhidro AuCl 3 comienza a descomponerse a AuCl en torno a 160 ° C; Sin embargo, esto a su vez sufre desproporción a temperaturas más altas para dar el metal de oro y AuCl 3.
- AuCl 3 → AuCl + Cl 2 (> 160 ° C)
- 3 AuCl → AuCl 3 + 2 Au (> 420 ° C)
AuCl 3 es Lewis formas ácidas y de fácil complejos. Por ejemplo, reacciona con ácido clorhídrico para formar ácido cloroáurico (HAuCl4):
- HCl + AuCl 3 (aq) → H + + [AuCl 4] -
Otras fuentes, tales como cloruro de KCl, también convertir AuCl 3 en AuCl -
4. Las soluciones acuosas de AuCl 3 reaccionan con base acuosa tal como hidróxido de sodio para formar una precipitado de Au (OH) 3, que se disolverá en exceso de NaOH para formar aurato de sodio (NaAuO 2). Si se calienta suavemente, Au (OH) 3 se descompone en de óxido de oro (III), Au 2 O 3, y luego a metal de oro.
Oro cloruro de (III) es el punto de partida para la síntesis de muchos otros compuestos de oro. Por ejemplo, la reacción con cianuro de potasio produce el soluble en agua complejo, K [Au (CN) 4]:
- AuCl 3 + 4 KCN → K [Au (CN) 4] + 3 KCl
Las aplicaciones en síntesis orgánica
AuCl 3 ha atraído el interés de los químicos orgánicos como un catalizador ácido suave durante reacciones de variedades, aunque no hay transformaciones se han comercializado. Gold (III) sales, especialmente Na [AuCl 4] (preparados a partir de AuCl 3 + NaCl ), proporcionan una alternativa a mercurio (II) sales como catalizadores para las reacciones que implican alquinos. Una reacción ilustrativo es la hidratación de alquinos terminales para producir metil cetonas :
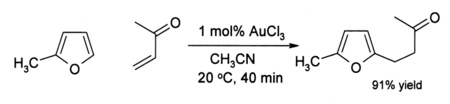
Algunos alquinos someten aminación en presencia de oro (III) catalizadores. Oro cataliza la alquilación de cierta anillos aromáticos y una conversión de furanos a fenoles . Por ejemplo, en solución de acetonitrilo, oro (III) cloruro cataliza la alquilación de 2-metilfurano (Sylvan) por metil vinil cetona en la posición 5:
La eficiencia de este Organogold reacción es digno de mención porque tanto el furano y la cetona son sensibles a reacciones secundarias tales como la polimerización bajo condiciones ácidas. En algunos casos donde alquinos están presentes, fenoles veces se forman:
Esta reacción implica un reordenamiento que da un nuevo anillo aromático.