
Le chlorure de phosphoryle
À propos de ce écoles sélection Wikipedia
Les articles de cette sélection écoles ont été organisés par sujet du programme d'études grâce aux bénévoles d'enfants SOS. Avant de vous décider à propos de parrainer un enfant, pourquoi ne pas en apprendre davantage sur différents organismes de parrainage premier ?
| Le chlorure de phosphoryle | |
|---|---|
 | |
 | |
Le chlorure de phosphoryle ou | |
Autres noms L'oxychlorure de phosphore | |
| Identificateurs | |
| Numéro CAS | 10025-87-3 |
| Numéro RTECS | TH4897000 |
| Propriétés | |
| Formule moléculaire | POCl 3 |
| Masse molaire | 153,33 g / mol |
| Apparence | Liquide clair, incolore, vapeurs dans l'air humide |
| Densité | 1,645 g / cm 3, un liquide |
| Point de fusion | 1,25 ° C (274,4 K) |
| Point d'ébullition | 105,8 ° C (379,0 K) |
| Solubilité dans l'eau | Réagit |
| Viscosité | ? c P au? ° C |
| Structure | |
| Forme moléculaire | tétraédrique |
| Moment de dipôle | 2,54 Ré |
| Risques | |
| FS | MSDS externe |
| Phrases-R | 14-22-26-29-35-48 / 23 |
| Phrases S | 26-45-7 / 8 |
| Principal dangers | Très corrosif, lacrymogène, toxique |
| Des composés apparentés | |
| Des composés apparentés | Chlorure de thiophosphoryle Oxybromure de phosphore |
| Page de données supplémentaire | |
| Structure et propriétés | n, ε r, etc. |
| Thermodynamique données | comportement de phase Solide, liquide, gaz |
| Les données spectrales | UV, IR, RMN , MS |
| Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
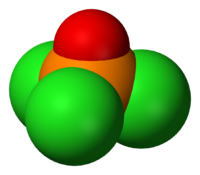
Le chlorure de phosphoryle (communément appelé oxychlorure de phosphore) est un liquide incolore ayant la formule P O Cl 3. Il se hydrolyse dans l'air humide à l'acide phosphorique en dégageant des vapeurs d'étouffement de du chlorure d'hydrogène. Il est fabriqué industriellement à grande échelle à partir de trichlorure de phosphore et de l'oxygène ou le pentoxyde de phosphore. Il est principalement utilisé pour fabriquer des esters de phosphate tels que tricrésylphosphate.
Structure
Comme phosphate, chlorure de phosphoryle est tétraédrique en forme. Il dispose de trois liaisons P-Cl et une très forte P = O double liaison, avec une estimation obligataire énergie de dissociation de 533,5 kJ / mol. Sur la base de longueur de la liaison et électronégativité, la règle Schomaker-Stevenson suggère que la forme de double liaison est très dominant (en contraste avec POF 3). Le P = O obligataire ne ressemble pas à la π obligataire dans un un groupe carbonyle comme dans une cétone. La description appropriée de l'interaction de PO est une question de longue discussion. Manuels âgés favorisent une description qui appelle la participation de la d -orbitals sur le phosphore. Certains de ces orbitales d saillie vers l'atome de O, qui se chevauchent avec p -orbitals sur l'oxygène. Textes plus modernes semblent favoriser une description où le PO π liaison implique le sigma * composants des liaisons P-Cl. Ces descriptions ne considèrent pas un rôle pour D-orbitales.
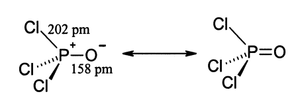
- où h = picomètres
Propriétés chimiques
POCl 3 réagit avec l'eau et les alcools pour donner de l'acide phosphorique ou les esters de phosphate, respectivement, par exemple
- O = PCl 3 + 3 H 2 O → O = P (OH) 3 + 3 HCl
Si l'eau est remplacée par un alcool , les esters phosphates de trialkyle résultent. De telles réactions sont souvent réalisées en présence d'un accepteur d'HCl tel que la pyridine ou une amine . Si POCl 3 est chauffée avec un excès d'un phénol ( ArOH) en présence d'un Lewis catalyseur acide tel que du chlorure de magnésium d'un ester phosphate de triaryle est formée, par exemple:
- 3 C 6 H 5 OH + O = PCl 3 → O = P (OC 6 H 5) 3 + 3 HCl
POCl 3 peut également agir en tant que Base de Lewis, formant produits d'addition avec une variété d'acides de Lewis tels que du tétrachlorure de titane:
- Cl 3 P + -O - + TiCl 4 Cl → P + 3 -O- - TiCl4
Le chlorure d'aluminium produit d'addition (POCl 3 · AlCl 3) est tout à fait stable, et ainsi de POCl 3 peut être utilisé pour enlever complètement AlCl 3 à partir de mélanges réactionnels à la fin d'un Réaction de Friedel-Crafts. POCl 3 réagit avec le bromure d'hydrogène en présence de AlCl 3 pour produire POBr 3.
Préparation
Le chlorure de phosphoryle peut être préparé par la réaction du trichlorure de phosphore avec de l'oxygène à 20-50 ° C (air est inefficace):
Une synthèse alternative implique la réaction de le pentachlorure de phosphore et le pentoxyde de phosphore. Étant donné que ces composés sont des solides, un moyen commode d'effectuer la réaction consiste à chlorer un mélange de PCl 3 et P 4 O 10, qui génère le PCl 5 in situ. Comme le PCl 3 est consommée, le POCl 3 devient le solvant de réaction.
6 PCl 5 + P 4 O 10 → 10 POCl 3
Pentachlorure de phosphore constitue également POCl 3 par réaction avec de l'eau, mais cette réaction est moins facilement contrôlé que la réaction ci-dessus.
Utilisations
L'utilisation la plus importante de chlorure de phosphoryle est dans la fabrication d'esters de triarylphosphate (comme décrit ci-dessus ), tels que le phosphate de triphényle et tricrésylphosphate. Ces esters sont utilisés depuis de nombreuses années comme des retardateurs de flamme et plastifiants pour PVC. Pendant ce temps, les esters de trialkyle tels que le phosphate de tributyle (fabriqué de manière similaire à partir de butan-1-ol) sont utilisés comme les solvants d'extraction liquide-liquide dans retraitement nucléaire et ailleurs.
Dans l'industrie du semi-conducteur, POCl 3 est utilisé comme source de phosphore liquide en toute sécurité dans des processus de diffusion. Le phosphore joue le rôle de dopant utilisé pour créer des couches de type N sur une tranche de silicium.
Dans le laboratoire, POCl 3 est largement utilisé comme un agent déshydratant, par exemple la conversion de les amides à nitriles. De même, certains amides cycliques peuvent être cyclisés en dihydro des dérivés d'isoquinoléine en utilisant le Réaction Bischler-Napieralski.
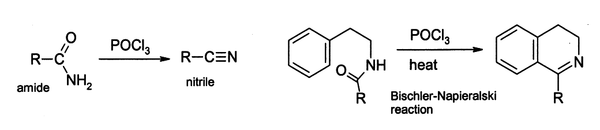
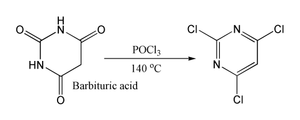
De telles réactions sont censés passer par un chlorure imidoyle; dans certains cas où il est stable, le chlorure d'imidoyle est le produit final. Par exemple pyridones et pyrimidones peuvent être convertis en dérivés de chloro- pyridines et pyrimidines, qui sont des intermédiaires importants dans l'industrie pharmaceutique. Également l'acide barbiturique est converti en 2,4,6-trichloropyrimidine. par réaction avec du POCl 3 à 140 ° C.
En relation avec la chimie est l'utilisation de POCl 3 en acylation activé de des cycles aromatiques via le Réaction pour produire de Vilsmeier-Haack aryle des aldéhydes et des cétones . La réaction utilise le plus souvent un formamide tel que DMF ou la N -phényl- N -methylformamide, et il produit un sel d'iminium qui est facilement hydrolyse en l'aldéhyde sur bilan. Par exemple 9-anthracène donne anthraldéhyde:
