Rutherfordio
Antecedentes de las escuelas de Wikipedia
Esta selección Escuelas fue originalmente elegido por SOS para las escuelas en el mundo en desarrollo que no tienen acceso a Internet. Está disponible como una descarga intranet. Antes de decidir sobre el patrocinio de un niño, ¿por qué no aprender sobre diferentes obras de caridad de patrocinio primero ?
| Rutherfordio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
104 Rf | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| desconocido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | rutherfordio, Rf, 104 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / ˌ r ʌ ð del ər F ɔr d yo ə m / RUDH -ər- PARA dee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría Elemento | metal de transición | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 4, 7, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | [267] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Rn ] 5f 14 6d 2 7s 2 2, 8, 18, 32, 32, 10, 2  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Instituto Conjunto de Investigación Nuclear (1964) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido (prevista) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 23 (estimado) g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 2400 K , 2100 ° C, 3800 (estimado) ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 5800 K, 5500 ° C, 9900 (estimado) ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 4, 3 (valor de referencia) (Estados de oxidación sólo en negrita son conocidos experimentalmente) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 579,9 (estimado) kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1389.4 (estimado) kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 2296.4 (estimado) kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 150 (estimado) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 157 (estimado) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 53850-36-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de rutherfordio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Rutherfordio es un elemento químico con el símbolo Rf y número atómico 104, llamada así en honor del nacido en Nueva Zelanda físico británico Ernest Rutherford . Es un elemento sintético (un elemento que se puede crear en un laboratorio pero no se encuentra en la naturaleza) y radiactivos; la conocida más estable isótopo , 267 Rf, tiene una vida media de aproximadamente 1,3 horas.
En el tabla periódica de los elementos, es una elemento de d-bloque y el primero de la elementos transactínidos. Es un miembro de la Séptimo período y pertenece a la grupo 4 elementos. Experimentos químicos han confirmado que rutherfordio comporta como el más pesado homólogo de hafnio en el grupo 4. Las propiedades químicas de rutherfordio se caracterizan sólo en parte. Se comparan bien con la química de los otros elementos del grupo 4, a pesar de que algunos cálculos habían indicado que el elemento podría mostrar propiedades significativamente diferentes debido a efectos relativistas.
En la década de 1960, las pequeñas cantidades de rutherfordio fueron producidos en los laboratorios de la antigua Unión Soviética y en California . La prioridad del descubrimiento y por lo tanto el denominación del elemento se disputó entre los científicos soviéticos y americanos, y no fue hasta 1997 que Unión Internacional de Química Pura y Aplicada (IUPAC) estableció rutherfordio como el nombre oficial para el elemento.
Historia
Descubrimiento
Rutherfordio se informa detectado por primera vez en 1964 en la Instituto Conjunto de Investigación Nuclear Dubna (entonces en la Unión Soviética ). Los investigadores no bombardearon una plutonio -242 objetivo con neón -22 iones y se separaron los productos de reacción por thermochromatography degradado después de la conversión de cloruros por la interacción con ZrCl4. El equipo identificó actividad fisión espontánea contenida dentro de un cloruro volátil retratar propiedades eka hafnio. Aunque una vida media no se determinó con precisión, los cálculos posteriores indicaron que el producto era más probable rutherfordium-259 (abreviado como 259 Rf en notación estándar ):
- 242
94 Pu + 22
10 Ne → 264- x
104 Rf → 264- x
104 Rf Cl 4
En 1969, investigadores de la Universidad de California, Berkeley concluyente sintetiza el elemento bombardeando un californio -249 objetivo con carbono-12 iones y midió la desintegración alfa del 257 Rf, en correlación con la decadencia hija de nobelio -253:
- 249
98 Cf + 12
6 257 C →
104 Rf + 4 n
La síntesis de América fue confirmado de forma independiente en 1973 y consiguió la identificación de rutherfordio como el padre de la observación de K-alfa Los rayos X en la firma elemental del Rf producto 257 decaimiento, nobelio-253.
Controversia Naming
Los científicos rusos propusieron el nombre de kurchatovio y los científicos estadounidenses sugirieron el nombre rutherfordio para el nuevo elemento. En 1992, la IUPAC / IUPAP Grupo de Trabajo Transfermium (GTT) evaluó las reclamaciones de descubrimiento y llegó a la conclusión de que ambos equipos siempre pruebas contemporáneas a la síntesis del elemento 104 y que el crédito debe ser compartida entre los dos grupos.
El grupo estadounidense escribió una mordaz respuesta a las conclusiones del Grupo de Trabajo Técnico, indicando que habían dado demasiado énfasis en los resultados del grupo de Dubna. En particular, señalaron que el grupo ruso había alterado los detalles de sus afirmaciones varias veces durante un período de 20 años, un hecho que el equipo ruso no niega. También hicieron hincapié en que el Grupo Técnico de Trabajo había dado demasiado crédito a los experimentos químicos realizados por los rusos y acusó al Grupo Técnico de Trabajo de no tener personal debidamente cualificado en el comité. El Grupo Técnico de Trabajo respondió diciendo que este no era el caso y tras haber evaluado cada punto planteado por el grupo estadounidense dijo que no encontraron ninguna razón para alterar su conclusión con respecto a la prioridad del descubrimiento. La IUPAC finalmente usa el nombre sugerido por el equipo americano (rutherfordio) que pueden de alguna manera reflejar un cambio de opinión.
Como consecuencia de la inicial reclamaciones de descubrimiento, una competidora elemento nombrar controversia surgió. Desde los soviéticos afirmaron tener detectó por primera vez el nuevo elemento se sugirió el nombre kurchatovio, Ku, en honor de Igor Kurchatov (1903-1960), ex jefe de Investigación nuclear soviética. Este nombre había sido utilizado en libros de la Bloque soviético como el nombre oficial del elemento. El rutherfordio estadounidenses, sin embargo, propuesto (Rf) para el nuevo elemento para honrar a Ernest Rutherford , quien es conocido como el "padre" de la física nuclear . La Unión Internacional de Química Pura y Aplicada ( IUPAC) adoptó unnilquadium, UNQ, como un temporal, Nombre de elemento sistemático, derivado de los nombres latinos de los dígitos 1, 0 y 4. En 1994, la IUPAC sugirió el nombre dubnium para ser utilizado desde rutherfordio se sugirió para el elemento 106 y IUPAC sintió que el equipo de Dubna debe justamente reconocido por sus contribuciones . Sin embargo, todavía había una disputa sobre los nombres de los elementos 104-107. En 1997 los equipos involucrados resuelvan la disputa y adoptó el nombre actual rutherfordio. El nombre dubnium fue dado a elemento 105 al mismo tiempo.
Nucleosíntesis
Elementos súper pesados como rutherfordio se producen mediante el bombardeo de elementos más ligeros en aceleradores de partículas que induce reacciones de fusión. Considerando que la mayoría de los isótopos de rutherfordium pueden sintetizarse directamente de esta manera, algunos otros más pesados sólo se han observado como productos de desintegración de elementos con mayores números atómicos .
Dependiendo de las energías involucradas, los primeros están separados en "caliente" y "frío". En las reacciones de fusión en caliente,, proyectiles de alta energía muy ligeros son acelerados hacia objetivos muy pesados ( actínidos ), dando lugar a núcleos compuestos en energía de alta excitación (~ 40-50 MeV) que puede evaporarse ya sea de fisión o varios 3 a 5) neutrones (. En las reacciones de fusión en frío, los núcleos condensados producidos tienen una energía de excitación relativamente baja (~ 10-20 MeV), que disminuye la probabilidad de que estos productos serán sometidos a las reacciones de fisión. Mientras los núcleos fundidos se enfríen a la estado fundamental, que requieren emisión de sólo uno o dos neutrones, y por lo tanto, permite la generación de productos más ricos en neutrones. Este último es un concepto diferente de la de la fusión nuclear, donde se reivindica que deberían alcanzarse en condiciones de temperatura ambiente (ver fusión fría).
Estudios de fusión caliente
La síntesis de rutherfordio se intentó por primera vez en 1964 por el equipo de Dubna usando la reacción de fusión en caliente de neón -22 proyectiles con plutonio -242 objetivos:
- 242
94 Pu + 22
10 Ne → 264-x
104 Rf + 3 o 5 n .
El primer estudio produjo evidencia de un fisión espontánea con un 0,3 segundo la vida media y otro en 8 segundos. Mientras que la observación anterior fue finalmente se retractó, este último con el tiempo llegó a ser asociado con el 259 Rf isótopo. En 1966, el equipo soviético repitió el experimento usando un estudio químico de productos de cloruro de volátiles. Identificaron un cloruro volátil con propiedades eka hafnio que cariados rápido a través de la fisión espontánea. Esto dio una fuerte evidencia para la formación de RFCL 4, y aunque no se midió con precisión una vida media, la evidencia más tarde sugirió que el producto era más probable 259 Rf. El equipo repitió el experimento varias veces en los próximos años, y en 1971, se revisó el tiempo medio de fisión espontánea de los isótopos en 4,5 segundos.
En 1969, investigadores de la Universidad de California liderado por Albert Ghiorso, trató de confirmar los resultados originales reportados en Dubna. En una reacción de curio -248 con oxígeno-16, no fueron capaces de confirmar el resultado de la selección soviética, pero se las arregló para observar la fisión espontánea de 260 Rf con una vida media muy corta de 10 a 30 ms:
- 248
96 Cm + 16
8 O → 260
104 Rf + 4 n .
En 1970, el equipo estadounidense estudió también la misma reacción con oxígeno-18 e identificó 261 Rf con una vida media de 65 segundos (más tarde refinado a 75 segundos). Experimentos posteriores a la Laboratorio Nacional Lawrence Berkeley en California también reveló la formación de un isómero de corta duración de 262 Rf (que experimenta la fisión espontánea, con una vida media de 47 ms), y las actividades de fisión espontánea con largos tiempos de vida asignadas tentativamente a 263 Rf.
La reacción de californio -249 con carbono-13 también fue investigado por el equipo de Ghiorso, que indicó la formación de la efímera 258 Rf (que experimenta la fisión espontánea en 11 ms):
- 249
98 Cf + 13
6 258 C →
104 Rf + 4 n .
Al tratar de confirmar estos resultados mediante el uso de en lugar de carbono-12, también observaron la primera alfa disminuye desde 257 Rf.
La reacción de berkelio -249 con nitrógeno -14 se estudió por primera vez en Dubna en 1977, y en 1985, los investigadores no confirmó la formación de los 260 Rf isótopo que sufre rápidamente la fisión espontánea en 28 ms:
- 249
97 Bk + 14
7 N → 260
104 Rf + 3 n .
En 1996 se observó el isótopo 262 Rf en LBNL de la fusión de plutonio-244 con el neón-22:
- 244
94 Pu + 22
10 Ne → 266-x
104 Rf + 4 o 5 n .
El equipo determinó una vida media de 2,1 segundos, en contraste con los informes anteriores de 47 ms y sugirió que las dos semi-vidas pueden deberse a diferentes estados isoméricos de 262 Rf. Los estudios sobre la misma reacción por un equipo en Dubna, conducen a la observación en 2000 de la alfa disminuye desde 261 Rf y fisiones espontáneas de 261m Rf.
La reacción de fusión en caliente utilizando un blanco de uranio se informó por primera vez en Dubna en 2000:
- 238
92 U + 26
12 Mg → 264-x
104 Rf + x n (x = 3, 4, 5, 6).
Observaron decaimientos de 260 Rf y Rf 259, y más tarde para 259 Rf. En 2006, como parte de su programa en el estudio de blancos de uranio en las reacciones de fusión en caliente, el equipo de LBNL también observó 261 Rf.
Estudios de fusión fría
Los primeros experimentos de fusión fría que involucran elemento 104 se realizaron en 1974 en Dubna, mediante el uso de la luz titanio-50 núcleos destinados a objetivos de isótopos de plomo-208:
- 208
82 Pb + 50
22 Ti → 258-x
104 Rf + x n (x = 1, 2, o 3).
La medición de una actividad de fisión espontánea fue asignado a 256 Rf, mientras que los estudios posteriores hechas en el Gesellschaft für Schwerionenforschung Institute (GSI), también midieron las propiedades de desintegración de los isótopos 257 Rf, y 255 RF.
En 1974 investigadores de Dubna investigado la reacción de plomo-207 con titanio-50 para producir el isótopo 255 Rf. En un estudio de 1994 en el GSI utilizando el isótopo de plomo-206, 255 Rf, así como 254 Rf se detectaron. 253 Rf se detectó de manera similar ese año cuando se utilizó el plomo-204 en su lugar.
Estudios Decay
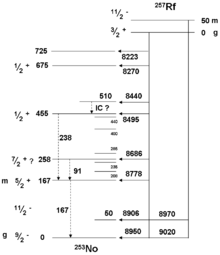
La mayoría de los isótopos con una masa atómica por debajo 262 también se han observado como productos de desintegración de elementos con un mayor número atómico , lo que permite el refinamiento de sus propiedades medidas con anterioridad. Isótopos más pesados de rutherfordio sólo se han observado como productos de desintegración. Por ejemplo, se observaron una serie de eventos de desintegración alfa que terminan en 267 Rf en la cadena de desintegración de darmstadtium -279 desde 2004:
- 279
110 Ds → 275
108 Hs + α → 271
106 Mx + α → 267
104 Rf + α.
Este se sometió a más de fisión espontánea con un tiempo medio de 1,3 h.
Las investigaciones sobre la síntesis de la dubnium -263 isótopo en 1999 en el Universidad de Berna reveló eventos coherentes con captura de electrones para formar 263 Rf. Una fracción rutherfordium se separó, y se observaron varios eventos fisión espontánea con largos tiempos de vida de unos 15 minutos, así como alfa y se desintegra con una vida útil de unos 10 minutos. Informes sobre la cadena de desintegración de flerovium -285 en 2010 mostraron cinco alfa secuencial decae que terminan en 265 Rf, que sufre más de fisión espontánea con un tiempo de vida de 152 segundos.
Cierta evidencia experimental se obtuvo en 2004 por un isótopo más pesado, 268 Rf, en la cadena de desintegración de un isótopo de Ununpentium :
- 288
115 Uup → 284
113 Uut + α → 280
111 Rg + α → 276
109 Mt + α → 272
107 Bh + α → 268
105 Db + α? → 268
104 Rf + ν
e.
Sin embargo, el último paso en esta cadena era incierto. Después de observar los eventos de desintegración cinco alfa que generen dubnium -268, se observaron eventos de fisión espontánea con un tiempo medio de largo. No está claro si estos eventos se deben a dirigir la fisión espontánea de 268 Db, o 268 Db produjo eventos de captura de electrones con largos tiempos medios para generar 268 Rf. En este último caso se produce y se desintegra con un corto tiempo de vida, las dos posibilidades no se pueden distinguir. Dado que la captura de electrones de 268 Db no se puede detectar, estos eventos de fisión espontánea puede ser debido a 268 Rf, en cuyo caso la vida media de este isótopo no puede ser extraído.
Según un informe de 2007 sobre la síntesis de ununtrium , se observó el isótopo 282 113 para someterse a una descomposición similar a formar 266 dB, que experimenta la fisión espontánea, con una vida media de 22 minutos. Dado que la captura de electrones de 266 Db no se puede detectar, estos eventos de fisión espontánea puede ser debido a 266 Rf, en cuyo caso la vida media de este isótopo no puede ser extraído.
Isótopos
| Isótopo | Media vida | Decaimiento modo | Descubrimiento año | Reacción |
|---|---|---|---|---|
| 253 Rf | 48 mS | α, SF | 1994 | 204 Pb (50 Ti, n) |
| 254 Rf | 23 mS | SF | 1994 | 206 Pb (50 Ti, 2n) |
| 255 Rf | 2.3 s | ε ?, α, SF | 1974 | 207 Pb (50 Ti, 2n) |
| 256 Rf | 6.4 ms | α, SF | 1974 | 208 Pb (50 Ti, 2n) |
| 257 Rf | 4.7 s | ε, α, SF | 1969 | 249 Cf (12 C, 4n) |
| 257m Rf | 4.1 s | ε, α, SF | 1969 | 249 Cf (12 C, 4n) |
| 258 Rf | 14,7 ms | α, SF | 1969 | 249 Cf (13 C, 4n) |
| 259 Rf | 3.2 s | α, SF | 1969 | 249 Cf (13 C, 3n) |
| 259m Rf | 2.5 s | ε | 1969 | 249 Cf (13 C, 3n) |
| 260 Rf | 21 ms | α, SF | 1969 | 248 cm (16 O, 4n) |
| 261 Rf | 78 s | α, SF | 1970 | 248 cm (18 O, 5N) |
| 261m Rf | 4 s | ε, α, SF | 2001 | 244 Pu (22 Ne, 5n) |
| 262 Rf | 2.3 s | α, SF | 1996 | 244 Pu (22 Ne, 4n) |
| 263 Rf | 15 min | α, SF | 1999 | 263 Db ( e - , ν e) |
| 263m Rf? | 8 s | α, SF | 1999 | 263 Db ( e - , ν e) |
| 264 Rf | 1? h | α? | desconocido | - |
| 265 Rf | 2,5 min | SF | 2010 | 269 Mx (-, α) |
| 266 Rf | 10 h? | α, SF? | 2007? | 266 Db ( e - , ν e)? |
| 267 Rf | 1.3 h | SF | 2004 | 271 Mx (-, α) |
| 268 Rf | 6 h? | α, SF? | 2004? | 268 Db ( e - , ν e)? |
Rutherfordio no tiene isótopos estables o de origen natural. Varios isótopos radiactivos han sido sintetizados en el laboratorio, ya sea mediante la fusión de dos átomos o mediante la observación de la desintegración de elementos más pesados. Quince isótopos diferentes se han reportado con masas atómicas 253-268 (con la excepción de 264). La mayoría de éstos se desintegran predominantemente a través de vías de fisión espontánea.
Vida veces
Los isótopos más ligeros generalmente tienen vidas medias más cortas; vidas medias de bajo se observaron 50 microsegundos para 253 y 254 Rf Rf. 256 Rf, 258 Rf, 260 Rf son más estables en alrededor de 10 ms, 255 Rf, 257 Rf, 259 Rf, y 262 Rf en vivo entre 1 y 5 segundos y 261 Rf, 265 Rf, y 263 Rf son más estables, en torno al 1, 1,5, y 10 minutos respectivamente. Los isótopos más pesados son los más estables, con 267 de RF que tiene una vida media de alrededor de 1,3 medido h.
Los isótopos más ligeros fueron sintetizados por fusión directa entre dos núcleos más ligeros, y como productos de desintegración. El isótopo más pesado producido por fusión directa es 262 Rf; isótopos más pesados sólo se han observado como productos de desintegración de elementos con números atómicos más grandes, de los cuales sólo 267 Rf se ha confirmado. Isótopos 266 Rf y Rf 268 también pueden haber sido observado como productos de desintegración y se cree que tienen larga vida media de 10 horas y las 6 horas, respectivamente, pero estos han sido medidos indirectamente, a través de estudios sistemáticos. Mientras que el isótopo 264 Rf aún no se ha observado, se prevé que tenga una larga vida media de 1 h. Antes de su descubrimiento, 265 Rf se predice que tienen una vida media más larga, incluso de 13 h, pero tiene una vida media de sólo 2,5 min.
En 1999, científicos estadounidenses de la Universidad de California, Berkeley, anunciaron que habían conseguido sintetizar tres átomos de 293 118. Se informó Estos núcleos padres haber emitido sucesivamente siete partículas alfa para formar 265 núcleos de Rf, pero su reclamo fue retraídos en 2001.
Isomería Nuclear
Varios estudios anteriores sobre la síntesis de 263 Rf han indicado que este nucleido decae principalmente por fisión espontánea, con una vida media de 10-20 minutos. Más recientemente, un estudio de hassium isótopos permitió la síntesis de átomos de 263 Rf descomposición con una vida media más corta de 8 segundos. Estos dos modos de desintegración diferentes deben estar asociados con dos estados isoméricos, pero las asignaciones específicas son difíciles debido al bajo número de eventos observados.
Durante la investigación sobre la síntesis de isótopos rutherfordium que utilizan el 244 Pu (22 Ne, 5n) 261 Rf reacción, el producto se encontró que someterse exclusiva Alpha Decay 8,28 MeV, con una vida media de 78 segundos. Estudios posteriores en GSI en la síntesis de Copernicium isótopos y hassium producidos datos contradictorios, como 261 Rf producida en la cadena de desintegración se encontró que someterse a 8,52 MeV Alpha Decay con una vida media de 4 segundos. Resultados posteriores indicaron una rama fisión predominante. Estas contradicciones llevaron a algunas dudas sobre el descubrimiento de copernicium. El primer isómero está denotada 261a Rf (o simplemente 261 Rf), mientras que el segundo se denota 261b Rf (o 261m Rf). Sin embargo, se cree que el primer núcleo pertenece a un estado fundamental de alto espín y el segundo a un estado metaestable de bajo spin. El descubrimiento y la confirmación de 261b Rf siempre prueba para el descubrimiento de copernicium en 1996.
Un estudio detallado de la producción de 257 núcleos de Rf utilizando la reacción de 208 Pb (50 Ti, n) espectroscópica 257 Rf permitió la identificación de un nivel de isómeros en 257 Rf. El trabajo confirmó que 257 g Rf tiene un espectro complejo de 15 líneas alfa. Un diagrama de estructura de nivel se ha calculado para los dos isómeros. Isómeros similares fueron reportados por 256 Rf también.
Propiedades predichas
Químico
Rutherfordio es la primera Transactínido y el segundo miembro de la serie 6d de metales de transición. Los cálculos sobre su potenciales de ionización, radio atómico, así como radios, las energías orbitales, y los niveles de tierra de sus estados ionizados son similares a la de hafnio y muy diferente de la de plomo . Por lo tanto, se concluyó que las propiedades básicas de rutherfordium se parecerán a los de los demás grupo 4, por debajo de los elementos titanio , circonio , y hafnio. Algunas de sus propiedades se determinaron mediante experimentos en fase gaseosa y la química acuosa. El estado de oxidación +4 es el único estado estable durante los dos últimos elementos y por lo tanto rutherfordio también debe exhibir un 4 estado estable. Además, también se espera rutherfordium para ser capaz de formar un 3 estado menos estable.
Las propiedades químicas de rutherfordium se basaron en el cálculo que indican que los efectos relativistas en la capa de electrones puede ser suficiente que la fuerte orbitales p tienen un nivel de energía más bajo que el orbitales d, lo que le da un configuración electrónica de valencia de 6d 1 7s 2 7p 1 o incluso 2 7s 7p 2, por lo tanto haciendo que el elemento se comporte más como líder de hafnio. Con mejores métodos de cálculo y estudios de las propiedades químicas de los compuestos rutherfordium se pudiera demostrar que rutherfordio actúa de acuerdo con el resto de la grupo 4 elementos.
De una manera análoga a la de circonio y hafnio, rutherfordium se proyecta para formar una alta óxido de punto de fusión muy estable, RfO 2. Reacciona con halógenos para formar tetrahaluros, RFX 4, que se hidrolizan en contacto con el agua para formar oxihalogenuros RfOX 2. Los tetrahaluros son sólidos volátiles existentes como moléculas tetraédricas monoméricas en la fase de vapor.
En la fase acuosa, la 4+ ion Rf hidroliza menos de titanio (IV) y en un grado similar a la de circonio y hafnio, lo que resulta en el 2 + ion RfO. El tratamiento de los haluros con iones haluro promueve la formación de iones complejos. El uso de iones cloruro y bromuro produce los complejos hexahalide RFCL 2-
6 y RFBR 2-
6. Para los complejos de fluoruro, circonio y hafnio tienden a formar complejos de hepta- y octa-. Así, por el ion rutherfordio grande, los complejos RFF 2-
6, RFF 2-
7 y RFF 4-
8 son posibles.
Física y atómica
Se espera Rutherfordium a ser un sólido en condiciones normales. Debe ser un muy pesado metal con una densidad de alrededor de 23 g / cm 3; En comparación, el elemento más denso conocido que ha tenido midió su densidad, osmio , tiene una densidad de 22,61 g / cm 3. Esto resulta de alto peso atómico de rutherfordio, la lantánidos y actínidos contracciones, y efectos relativistas, aunque la producción de suficiente rutherfordio para medir esta cantidad sería poco práctico, y la muestra decaería rápidamente. Se espera que el radio atómico para rutherfordio estar alrededor de 150 pm. Debido a la estabilización relativista de los 7s orbitales y de desestabilización del orbital 6d, los iones Rf + y 2 + Rf se prevé que renunciar a los electrones 6d lugar de 7s electrones, que es lo contrario de la conducta de sus homólogos más ligeros.
Química Experimental
| Fórmula | Nombres |
|---|---|
| RFCL 4 | tetracloruro rutherfordio, rutherfordio (IV) cloruro |
| RFBR 4 | tetrabromuro rutherfordio, rutherfordio (IV) bromuro |
| RfOCl 2 | oxicloruro rutherfordio, rutherfordyl (IV) cloruro, rutherfordio (IV) óxido de dicloruro |
| [RFCL 6] 2- | hexachlororutherfordate (IV) |
| [RFF 6] 2- | hexafluororutherfordate (IV) |
| K 2 [RFCL 6] | hexachlororutherfordate de potasio (IV) |
Fase gaseosa
Los primeros trabajos sobre el estudio de la química de rutherfordio centró en thermochromatography gas y medición de deposición relativa curvas de adsorción de temperatura. El trabajo inicial se llevó a cabo en Dubna, en un intento de reafirmar su descubrimiento del elemento. Un trabajo reciente es más fiable en cuanto a la identificación de los radioisótopos rutherfordium padre. El isótopo 261m Rf se ha utilizado para estos estudios. Los experimentos se basaron en la expectativa de que rutherfordium comenzaría la nueva serie 6d de elementos y por lo tanto debe formar una tetracloruro volátil debido a la naturaleza de la molécula tetraédrica. Rutherfordio (IV) cloruro es más volátil que su homólogo más ligero (IV) de cloruro de hafnio (HfCl4) porque sus bonos son más covalente.
Una serie de experimentos confirmó que rutherfordium se comporta como un miembro típico de grupo 4, formando un cloruro tetravalente (RFCL 4) y bromuro de (RFBR 4), así como oxicloruro (RfOCl 2). Una menor volatilidad se observó para RFCL 4 cuando cloruro de potasio se proporciona como la fase sólida en lugar de gas, altamente indicativo de la formación de K no volátil 2 RFCL 6 sal mixta.
La fase acuosa
Se espera Rutherfordium tener la configuración electrónica [Rn] 5f 14 6d 2 7s 2 y por lo tanto se comportan como el homólogo más pesado de hafnio en el grupo 4 de la tabla periódica. Por consiguiente, debería formar fácilmente un Rf 4+ ion hidratado en solución de ácido fuerte y debe formar complejos fácilmente en ácido clorhídrico , bromhídrico o soluciones de ácido fluorhídrico.
Los estudios de química acuosas más concluyentes de rutherfordio han sido realizadas por el equipo japonés en Instituto Japonés de Investigación de la Energía Atómica con el 261m radioisótopo Rf. Experimentos de extracción de soluciones de ácido clorhídrico usando isótopos de rutherfordio, hafnio, circonio y torio han demostrado un comportamiento no actínidos para rutherfordio. Una comparación con sus homólogos más ligeros coloca rutherfordium firmemente en el grupo 4 y indicó la formación de un complejo hexachlororutherfordate en soluciones de cloruro, de una manera similar a la de hafnio y circonio.
- 261m Rf 4+ + 6 Cl - → [261m RFCL 6] 2-
Muy resultados similares se observaron en las soluciones de ácido fluorhídrico. Las diferencias en las curvas de extracción fueron interpretados como una afinidad más débil para el ion fluoruro y la formación del ion hexafluororutherfordate, mientras que los iones de hafnio y circonio siete u ocho iones fluoruro complejos a las concentraciones utilizadas:
- 261m Rf 4+ + 6 F - → [261m RFF 6] 2-