
Éthylène
Saviez-vous ...
SOS Enfants, qui se déroule près de 200 sos écoles dans le monde en développement, a organisé cette sélection. SOS Enfants a regardé des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
| Éthylène | |
|---|---|
 | |
 |  |
Ethene | |
| Identificateurs | |
| Numéro CAS | 74-85-1 |
| PubChem | 6325 |
| ChemSpider | 6085 |
| UNII | 91GW059KN7 |
| Numéro CE | 200-815-3 |
| KEGG | C06547 |
| ChEBI | CHEBI: 18153 |
| ChEMBL | CHEMBL117822 |
| images de Jmol-3D | Image 1 |
SMILES
| |
InChI
| |
| Propriétés | |
| Formule moléculaire | C 2 H 4 |
| Masse molaire | 28,05 g / mol |
| Apparence | gaz incolore |
| Densité | 1,178 kg / m 3 à 15 ° C, le gaz |
| Point de fusion | -169,2 ° C (104,0 K, -272,6 ° F) |
| Point d'ébullition | -103,7 ° C (169,5 K, -154,7 ° F) |
| Solubilité dans l'eau | 3,5 mg / 100 ml (17 ° C); 2,9 mg / L |
| Solubilité dans l'éthanol | 4,22 mg / L |
| Solubilité dans l'éther diéthylique | bon |
| Acidité (p K a) | 44 |
| Structure | |
| Forme moléculaire | 2h D |
| Moment de dipôle | zéro |
| Thermochimie | |
| Std enthalpie de formation Δ f H | 52,47 kJ / mol |
| Molaire standard entropie S | 219,32 J · K -1 · mol -1 |
| Risques | |
| FS | MSDS externe |
| Classification UE | Extrêmement inflammable (F +) |
| NFPA 704 |  4 3 2 |
| Point d'éclair | -136 ° C |
| D'auto-inflammation température | 542,8 ° C |
| Des composés apparentés | |
| Des composés apparentés | Éthane Acétylène |
| Page de données supplémentaire | |
| Structure et propriétés | n, ε r, etc. |
| Thermodynamique données | comportement de phase Solide, liquide, gaz |
| Les données spectrales | UV, IR, RMN , MS |
Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
L'éthylène ( Nom IUPAC: éthylène) est un hydrocarbure de formule C 2 H 4 ou H 2 C = CH 2. Ce est un gaz incolore, inflammable avec un léger "doux et musquée "odeur à l'état pur. Ce est le plus simple alcène (un hydrocarbure carbone-carbone des doubles liaisons), et le plus simple hydrocarbure insaturé après l'acétylène (C 2 H 2).
L'éthylène est largement utilisé dans l'industrie chimique, et sa production dans le monde entier (plus de 109 millions tonnes en 2006) dépasse celle de tout autre composé organique. L'éthylène est aussi un important naturelle hormone végétale, utilisées dans l'agriculture pour forcer la maturation des fruits.
Structure et propriétés

Cette hydrocarbonée a quatre hydrogène atomes liés à une paire de carbone atomes qui sont reliés par une double liaison. Tous les six atomes qui comprennent l'éthylène sont coplanaires. Le HCH angle est de 119 °, à proximité du 120 ° pour sp² idéale carbone hybridé. La molécule est également relativement rigide: rotation autour de la liaison CC est un processus de haute énergie qui nécessite briser le π-obligataire.
Le π-liaison dans la molécule d'éthylène est responsable de sa réactivité utile. La double liaison est une région de haute densité électronique, il est donc susceptible d'être attaqué par des électrophiles. De nombreuses réactions de l'éthylène sont catalysées par des métaux de transition, qui se lient de manière transitoire à la fois l'éthylène en utilisant π et π * orbitales.
Être une simple molécule, l'éthylène est spectroscopie simple. Son UV-vis spectre est encore utilisé comme un test de méthodes théoriques.
Utilisations
Réactions industriels majeurs de l'éthylène comprennent, par ordre d'échelle: 1) polymérisation, 2) l'oxydation, 3) halogénation et hydrohalogénation, 4) alkylation, 5) hydratation, 6) oligomérisation, et 7) hydroformylation. Au Etats-Unis et l'Europe , environ 90% de l'éthylène est utilisé pour produire trois compounds- chimique l'oxyde d'éthylène, le dichlorure d'éthylène, et éthylbenzène et une variété de types de polyéthylène.

Polymérisation
Polyéthylènes de divers types consomment plus de la moitié de l'éthylène approvisionnement mondial. Polyéthylène, aussi appelé polyéthylène, est en plastique le plus largement utilisé dans le monde, étant principalement utilisé pour faire des films utilisés dans emballage, sacs de transport et poubelle doublures. Linéaire des alpha-oléfines, produit par oligomérisation (formation de polymères courtes) sont utilisés comme précurseurs, des détergents, des plastifiants, des lubrifiants synthétiques, des additifs, et également en tant que co-monomères dans la production de polyéthylènes.
Oxydation
L'éthylène est oxydé pour produire l'oxyde d'éthylène, une matière première clé dans la production de des agents tensioactifs et détergents par éthoxylation. L'oxyde d'éthylène est également hydrolysé pour produire l'éthylène glycol, largement utilisé comme antigel automobile ainsi que des glycols de poids moléculaire supérieur, les éthers de glycol et polyéthylène téréphtalate.
L'éthylène subit une oxydation par le palladium pour donner l'acétaldéhyde. Cette conversion reste un processus industriel important (10M kg / y). Le produit de traitement par l'intermédiaire de la complexation initiale de l'éthylène à un centre de Pd (II).
Halogénation et hydrohalogénation
Grands intermédiaires de la halogénation et hydrohalogénation d'éthylène comprennent le dichlorure d'éthylène, le chlorure d'éthyle et dibromure d'éthylène. L'addition de chlore entraîne "oxychloration", à savoir le chlore lui-même ne est pas utilisé. Certains produits dérivés de ce groupe sont le chlorure de polyvinyle, trichloroéthylène, perchloroéthylène, méthyle chloroforme, chlorure de vinylidène et les copolymères, et le bromure d'éthyle.
Alkylation
Les principaux produits intermédiaires chimiques de la alkylation est l'éthylène avec l'éthylbenzène, le précurseur de le styrène. Le styrène est utilisé principalement dans le polystyrène pour l'emballage et l'isolation, ainsi que dans caoutchouc styrène-butadiène pour les pneus et les chaussures. À plus petite échelle, éthyle toluène , ethylanilines, le 1,4-hexadiène et aluminium alkyles. Les produits de ces intermédiaires comprennent le polystyrène , insaturé polyesters et éthylène-propylène terpolymères.
Réaction Oxo
Le hydroformylation (réaction oxo) des résultats d'éthylène dans le propionaldéhyde, un précurseur de l'acide propionique et alcool n-propylique.
Hydration
Éthylène a longtemps représenté le principal précurseur non fermentatifs à l'éthanol . La méthode originale a entraîné sa conversion le sulfate de diéthyle, suivie d'une hydrolyse. La principale méthode pratiquée depuis le milieu des années 1990 est l'hydratation directe de l'éthylène catalysée par Des catalyseurs acides solides:
- C 2 H 4 + H 2 O → CH 3 CH 2 OH
La dimérisation de n-butènes
L'éthylène peut être dimérisé à n-butène en utilisant des procédés agréés par Lummus ou IFP. Le processus Lummus produit n-butènes mixtes (principalement 2-butènes) alors que le processus IFP produit 1-butène.
usages de niche
Un exemple d'une utilisation de niche est comme agent anesthésique (dans un copolymère éthylène / 15% taux d'oxygène de 85%). Il peut également être utilisé pour accélérer la maturation des fruits, ainsi que d'un gaz de soudage.
Production
Production d'éthylène mondial était de 107 millions de tonnes en 2005, 109 millions de tonnes en 2006. NNFCC renouvelables produits chimiques Fiche d'information: éthanol, 138 millions de tonnes en 2010 et 141 millions de tonnes en 2011. D'ici 2010, l'éthylène a été produit par au moins 117 entreprises dans 55 pays. Pour répondre à la demande sans cesse croissante de l'éthylène, de fortes hausses dans les installations de production sont ajoutés à l'échelle mondiale, en particulier dans le Moyen-Orient et la Chine .
L'éthylène est produit dans la industrie pétrochimique par vapocraquage. Dans ce procédé, les hydrocarbures liquides ou gazeux légers sont chauffés à 750-950 ° C, ce qui induit de nombreux radicalaires réactions suivies par immédiat étancher pour arrêter ces réactions. Ce processus convertit grandes hydrocarbures en plus petits et introduit insaturation. L'éthylène est séparé du mélange complexe résultant répété par compression et distillation . Dans un processus connexes utilisés dans les raffineries de pétrole, les hydrocarbures de haut poids moléculaire sont fissurés plus catalyseurs zéolitiques. Charges plus lourdes, comme huiles de naphta et de gaz ont besoin d'au moins deux tours "étancher" en aval des fours de craquage pour faire recirculer l'essence de pyrolyse dérivées et de l'eau de processus. Lorsque le craquage d'un mélange d'éthane et de propane, seule une colonne de trempe à l'eau est requise.
Les zones d'une usine d'éthylène sont les suivants:
- vapocraquage fours:
- récupération de chaleur primaire et secondaire avec trempe;
- un système de recyclage dilution de vapeur entre les fours et le système de refroidissement;
- compression primaire du gaz craqué (trois étages de compression);
- le sulfure d'hydrogène et l'élimination du dioxyde de carbone (élimination des gaz acides);
- compression secondaire (une ou deux étapes);
- séchage du gaz craqué;
- traitement cryogénique;
- la totalité du flux de gaz de craquage froid va à la tour de déméthanisation. Le courant de tête de la tour de déméthaniseur est constitué de tout l'hydrogène et du méthane qui était dans le courant de gaz craqué. Cryogénique (-250 ° F (-157 ° C)) le traitement de ce courant de tête sépare l'hydrogène à partir de méthane. La récupération du méthane est critique pour le fonctionnement économique d'une usine d'éthylène.
- le courant de fond de la tour de déméthanisation va à la tour de déséthaniseur. Le courant de tête de la tour de déséthaniseur compose de tous les deux C, 's qui étaient dans le courant de gaz craqué. Le flux C 2 contient de l'acétylène, qui est explosif au-dessus de 200 kPa (29 psi). Se il est prévu que la pression partielle de l'acétylène à dépasser ces valeurs, le courant C2 est partiellement hydrogéné. Les C 2 's alors procéder à un séparateur C 2. L'éthylène produit est extrait de la tête de la tour et l'éthane provenant du fond du séparateur est recyclé dans les fours de craquage à nouveau;
- le courant de fond de la tour dééthaniseur va à la tour de dépropanisation. Le courant de tête de la tour de dépropaniseur compose de tous les C 3 's qui étaient dans le courant de gaz craqué. Avant de nourrir l 'C 3 à C 3 séparateur, le flux est hydrogéné pour convertir le méthylacétylène et propadiène ( aliène) mélange. Ce flux est ensuite envoyé au séparateur C 3. Le courant de tête du séparateur C 3 est le produit propylène et le courant de fond est le propane qui est renvoyée dans les fours de craquage ou utilisé comme carburant.
- Le courant de fond de la tour de dépropaniseur est amené à la tour de débutaniseur. Le courant de tête du débutaniseur est tous les quatre C 's qui étaient dans le courant de gaz craqué. Le courant de fond du débutaniseur (pyrolyse essence légère) se compose de tout dans le courant de gaz craqué qui est C 5 ou plus lourd.
Comme la production d'éthylène est très énergivore, beaucoup d'efforts ont été consacrés à la récupération de la chaleur des gaz de quitter les fourneaux. La plupart de l'énergie récupérée à partir du gaz de craquage est utilisé pour faire de la haute pression (1200 psi) vapeur. Cette vapeur est à son tour utilisé pour actionner les turbines pour la compression de gaz de craquage, le compresseur de réfrigération propylène, éthylène et le compresseur de réfrigération. Une usine d'éthylène, une fois la course, n'a pas besoin d'importer la vapeur pour actionner ses turbines à vapeur. Une usine d'éthylène à l'échelle mondiale typique (environ 1,5 milliards de livres d'éthylène par an) utilise un 45 000 chevaux (34 000 kW) compresseur de gaz de craquage, un 30 000 ch (22 000 kW) compresseur de propylène, et un 15 000 ch (11 000 kW) compresseur d'éthylène.
synthèse de laboratoire
Bien que d'une grande valeur industrielle, l'éthylène est rarement utilisé dans le laboratoire et est habituellement acheté. Il peut être produit par déshydratation de l'éthanol avec de l'acide sulfurique ou dans la phase gazeuse avec de l'oxyde d'aluminium .
L'éthylène comme une hormone végétale
L'éthylène sert de hormone dans les plantes . Il agit au niveau de traces tout au long de la vie de la plante en stimulant ou la régulation de la mûrissement des fruits , l'ouverture des fleurs , et la abscission (ou excrétion) de laisse. Hâloirs commerciaux utilisent "générateurs catalytiques" pour faire de l'éthylène gazeux à partir d'une alimentation en liquide d'éthanol. Typiquement, un niveau de 500 à 2000 ppm d'introduction de gaz est utilisé, pendant 24 à 48 heures. Des précautions doivent être prises pour contrôler les niveaux de dioxyde de carbone dans les chambres de maturation lorsque gazage, a été considérée comme haute température de maturation (68F) pour produire du CO 2 niveaux de 10% en 24 heures.
Histoire de l'éthylène en biologie végétale
L'éthylène a été utilisé depuis les anciens Egyptiens, qui Gash figues afin de stimuler la maturation (blessure stimule la production d'éthylène par les tissus de la plante). Les anciens Chinois brûler encens dans des locaux fermés pour améliorer la maturation des poires. En 1864, on a découvert que des fuites de gaz de lampadaires ont conduit à retard de croissance, la torsion des plantes, et l'épaississement anormal de tiges. En 1901, un scientifique russe nommé Dimitry Neljubow a montré que le composant actif était de l'éthylène. Le doute découvert que l'éthylène stimulée abscission en 1917. Ce ne est qu'en 1934 que Gane a signalé que les plantes synthétisent éthylène. En 1935, Crocker proposé que l'éthylène était l'hormone responsable de la maturation des fruits de la plante ainsi que sénescence des tissus végétatifs.
Biosynthèse de l'éthylène dans les plantes
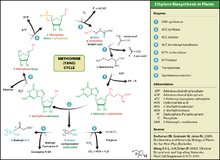
L'éthylène est produit à partir de pratiquement toutes les parties de plantes supérieures, y compris feuilles, tiges, racines, fleurs, fruits, tubercules, et de plants.
"La production d'éthylène est régulée par une variété de facteurs environnementaux et de développement. Au cours de la vie de la plante, la production d'éthylène est induite au cours de certaines étapes de la croissance tels que germination, maturation des fruits, abscission des feuilles, et sénescence des fleurs. La production d'éthylène peut également être induite par une variété d'aspects extérieurs tels que blessure mécanique, des contraintes environnementales et de certains produits chimiques, y compris l'auxine et d'autres régulateurs ".
L'éthylène est biosynthétisée à partir de l'acide aminé methionine à L-méthionine de la S (SAM, également appelé AdoMet) par l'enzyme Met adenosyltransferase. SAM est ensuite converti en 1-aminocyclopropane-1-carboxylique (ACC) par l'enzyme ACC synthase (ACS). L'activité de l'ACS qui détermine le taux de production d'éthylène, par conséquent la régulation de cette enzyme est essentielle pour la biosynthèse d'éthylène. La dernière étape nécessite de l'oxygène et comprend l'action de l'enzyme ACC-oxydase (ACO), anciennement connu sous le nom d'éthylène enzyme formant (EFE). Biosynthèse de l'éthylène peut être induite par l'éthylène endogène ou exogène. Synthèse ACC augmente avec les niveaux élevés de auxines, en particulier l'acide indole acétique (IAA) et cytokinines. ACC synthase est inhibée par acide abscissique.
Perception d'éthylène dans les plantes
L'éthylène peut être perçu par un transmembranaire protéine complexe dimère. Le gène codant pour un récepteur de l'éthylène a été clone dans Arabidopsis thaliana, puis en tomate. récepteurs de l'éthylène sont codées par plusieurs gènes dans Arabidopsis et tomate génomes. Le famille de gènes comprend cinq récepteurs dans Arabidopsis et au moins six dans la tomate, dont la plupart ont été montrés se lier éthylène. ADN des séquences de récepteurs de l'éthylène ont également été identifiées dans de nombreuses autres espèces de plantes et une protéine de liaison d'éthylène a encore été identifiées dans Les cyanobactéries.
Déclencheurs environnementaux et biologiques de l'éthylène
Signaux environnementaux tels que fooding, la sécheresse, la réfrigération, des blessures et attaque pathogène peuvent induire la formation d'éthylène dans les plantes. Dans les inondations, les racines souffrent d'un manque d'oxygène, ou l'anoxie, ce qui conduit à la synthèse de L'acide 1-aminocyclopropane-1-carboxylique (ACC). ACC est transporté vers le haut dans la plante et ensuite oxydé dans les feuilles. Les causes de l'éthylène produit Nastie des feuilles.
Réponses physiologiques des plantes
Comme les autres hormones végétales, l'éthylène est considéré comme ayant effets pléiotropiques. Cela signifie essentiellement que l'on pense qu'au moins certains des effets de l'hormone sont non reliés. Quel est en fait causée par le gaz peut dépendre sur le tissu affecté ainsi que les conditions environnementales. Dans l'évolution des plantes, l'éthylène serait simplement un message qui a été coopté pour des usages non liés par les plantes au cours des différentes périodes de développement évolutif.
Liste des réponses des plantes à l'éthylène
- Semis triple réponse, l'épaississement et le raccourcissement des hypocotyle avec crochet apical prononcée.
- En pollinisation, lorsque le pollen atteint le stigmate, le précurseur de l'éthylène, ACC, est sécrétée à l'pétale, le CAC producteurs d'éthylène avec l'ACC oxydase.
- Stimule feuilles et de fleurs sénescence
- Stimule la sénescence de maturité cellules xylème en préparation pour l'utilisation des plantes
- Induit feuilles abscission
- Induit semences germination
- Induit la croissance des cheveux de la racine - en augmentant l'efficacité d'absorption de l'eau minérale et
- Induit la croissance de racines adventives pendant les inondations
- Stimule épinastie - feuilles pétiole naît, feuille pend et les boucles sur lui-même
- Stimule maturation des fruits
- Induit une montée en climatérique la respiration dans certains fruits qui provoque un dégagement d'éthylène supplémentaire.
- Affecte gravitropisme
- Stimule flexion de nutation
- Inhibe la croissance des tiges et stimule la tige et l'élargissement de la cellule et la croissance de la branche latérale en dehors du stade plantule (voir Réponse Hyponastic)
- Interférence avec transport de l'auxine (avec haute Les concentrations d'auxine)
- Inhibe la croissance des pousses et la fermeture des stomates, sauf dans certaines usines d'eau ou ceux habituellement inondées comme certaines variétés de riz, où l'inverse se produit (conservation CO 2 et O 2)
- Induit floraison ananas
- Inhibe courte journée fleur induite initiation dans Pharbitus nul et Chrysanthemum morifolium
Questions commerciales
Éthylène raccourcit la durée de vie de beaucoup de fruits en hâtant maturation du fruit et floral sénescence. Éthylène raccourciront la durée de vie des fleurs coupées et des plantes en pot en accélérant la sénescence floral et floral abscission. Fleurs et plantes qui sont soumis au stress durant le transport, de manutention, de stockage ou de produits éthylène en provoquant une réduction significative exposition florale. Fleurs affectées par l'éthylène comprennent oeillet, géranium, pétunia, rose, et bien d'autres.
Éthylène peut causer des pertes économiques importantes pour les fleuristes, les marchés, les fournisseurs et les producteurs. Les chercheurs ont développé plusieurs méthodes pour inhiber l'éthylène, y compris l'inhibition de la synthèse de l'éthylène et de l'inhibition de la perception d'éthylène. Aminoéthoxyvinylglycine (AVG), Acide aminooxyacétique (AOA), et sels d'argent sont des inhibiteurs de l'éthylène. Inhibant la synthèse d'éthylène est moins efficace pour réduire les pertes post-récolte depuis éthylène à partir d'autres sources peuvent encore avoir un effet. En inhibant la perception de l'éthylène, des fruits, des fleurs et des plantes ne répondent pas à l'éthylène produite de manière endogène ou à partir de sources exogènes. Les inhibiteurs de la perception d'éthylène comprennent des composés qui ont une forme similaire à l'éthylène, mais ne provoquent pas la réponse à l'éthylène. Un exemple d'un inhibiteur de la perception d'éthylène est 1-méthylcyclopropène (1-MCP).
Les producteurs commerciaux de broméliacées, y compris plants d'ananas, utiliser de l'éthylène pour induire la floraison. Les plantes peuvent être amenés à fleur soit par traitement avec le gaz dans une chambre, ou en plaçant un banana peel côté de l'usine dans un endroit fermé.
Chrysanthemum la floraison est retardée par le gaz d'éthylène et les producteurs ont constaté que le dioxyde de carbone '' brûleurs et les gaz d'échappement des chauffages inefficaces serre peuvent augmenter la concentration d'éthylène à 0,05 vpm retard provoquant la floraison des cultures commerciales.
Ligand
L'éthylène est un ligand dans chimie organométallique. L'un des premiers composés organométalliques, Le sel de Zeise est un complexe de l'éthylène. Des réactifs utiles comprennent l'éthylène contenant Pt (PPh 3) 2 (C 2 H 4) et Rh 2 Cl 2 (C 2 H 4) 4. Le Rh catalysée hydroformylation d'éthylène est menée à l'échelle industrielle à fournir propionaldéhyde.
Histoire
De nombreux géologues et chercheurs pensent que le fameux Oracle grec Delphi (le Pythie) est allé dans son état de transe comme un effet de l'éthylène passant de défauts à la terre.
L'éthylène semble avoir été découvert par Johann Joachim Becher, qui a obtenu en chauffant l'éthanol avec de l'acide sulfurique; il a mentionné le gaz dans son Subterranea Physica (1669). Joseph Priestley mentionne également le gaz dans ses expériences et observations relatives aux diverses branches de la philosophie naturelle: avec une poursuite des observations sur l'air (1779), où il signale que Jan Ingenhousz vu éthylène synthétisée de la même manière par un certain M. Enée à Amsterdam en 1777 et que Ingenhousz suite produit le gaz lui-même. Les propriétés de l'éthylène ont été étudiés en 1795 par quatre néerlandais chimistes, Johann Rudolph Deimann, Adrien van Paets Troostwyck, Anthoni Lauwerenburgh et Nicolas Bondt, qui ont trouvé qu'il différait de l'hydrogène gaz et qu'il contenait la fois du carbone et de l'hydrogène. Ce groupe a également découvert que l'éthylène pourrait être combiné avec le chlore pour produire l'huile des chimistes néerlandais, Le 1,2-dichloroéthane; cette découverte a donné l'éthylène le nom utilisé pour ce moment-là, le gaz oléfiant (gaz fabrication de l'huile.)
Dans le milieu du 19e siècle, le -ène suffixe (une racine grecque antique ajouté à la fin des noms féminins qui signifie «fille de») a été largement utilisés pour se référer à une molécule ou une partie de celui-ci qui contenait une moins d'atomes d'hydrogène de la molécule étant modifié. Ainsi, l'éthylène (C 2 H 4) a été le "fille de éthyle "(C 2 H 5). Le nom de l'éthylène a été utilisé dans ce sens dès 1852.
En 1866, l' allemand chimiste Août Wilhelm von Hofmann a proposé un système de nomenclature d'hydrocarbures dans lequel les suffixes -ane, -ène, -ine, -one, et -Une ont été utilisés pour désigner les hydrocarbures avec 0, 2, 4, 6 et 8 atomes d'hydrogène de moins que leur parent alcane . Dans ce système, l'éthylène est devenu éthène. Le système de Hofmann est finalement devenu la base de la nomenclature de Genève approuvé par le Congrès international des Pharmaciens en 1892, qui reste au cœur de la Nomenclature IUPAC. Cependant, en ce moment, le nom de l'éthylène a été profondément enracinée, et il reste largement utilisé aujourd'hui, en particulier dans l'industrie chimique.
Nomenclature
Les 1 979 règles de nomenclature IUPAC fait une exception pour retenir le nom non systématique éthylène, cependant, cette décision a été renversée dans les règles 1993 de sorte que le nom IUPAC est maintenant éthylène.
Sécurité
Comme tous les hydrocarbures, l'éthylène est un asphyxiant et combustibles. Il a été utilisé comme anesthésique. Il est répertorié comme un CIRC classe 3 cancérogène.
