
Aluminium
Saviez-vous ...
SOS Enfants produite ce site pour les écoles ainsi que ce site de vidéo sur l'Afrique . SOS enfants parrainage est cool!
| Aluminium | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
13 Al | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||
métallique gris argenté  Raies spectrales de l'aluminium | |||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||
| Nom, symbole, nombre | aluminium, Al, 13 | ||||||||||||||||||||||||
| Prononciation | Royaume-Uni / ˌ æ LJ ʉ m ɪ n Je ə m / AL MIN -ee-əm; États-Unis / ə LJ U m ɨ n əm / | ||||||||||||||||||||||||
| Catégorie Metallic | post-métal de transition | ||||||||||||||||||||||||
| Groupe, période, bloc | 13, 3, p | ||||||||||||||||||||||||
| Poids atomique standard | 26,981 5 386 (13) | ||||||||||||||||||||||||
| Configuration électronique | [ Ne ] 3s 2 3p 1 2, 8, 3 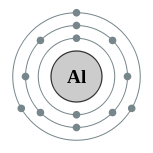 | ||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||
| Prédiction | Antoine Lavoisier (1787) | ||||||||||||||||||||||||
| Premier isolement | Friedrich Wöhler (1827) | ||||||||||||||||||||||||
| Nommé par | Humphry Davy (1807) | ||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||
| Densité (à proximité rt) | 2,70 g · cm -3 | ||||||||||||||||||||||||
| Liquid densité au mp | 2,375 g · cm -3 | ||||||||||||||||||||||||
| Point de fusion | 933,47 K , 660,32 ° C, 1220,58 ° F | ||||||||||||||||||||||||
| Point d'ébullition | 2792 K, 2519 ° C, 4566 ° F | ||||||||||||||||||||||||
| La chaleur de fusion | 10,71 kJ · mol -1 | ||||||||||||||||||||||||
| Chaleur de vaporisation | 294,0 kJ · mol -1 | ||||||||||||||||||||||||
| Capacité thermique molaire | 24,200 J · mol -1 .K -1 | ||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||
| États d'oxydation | 3, 2, 1 ( l'oxyde amphotère) | ||||||||||||||||||||||||
| Électronégativité | 1,61 (échelle de Pauling) | ||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 577,5 kJ · mol -1 | ||||||||||||||||||||||||
| 2ème: 1816,7 kJ · mol -1 | |||||||||||||||||||||||||
| 3ème: 2744,8 kJ · mol -1 | |||||||||||||||||||||||||
| Rayon atomique | 143 h | ||||||||||||||||||||||||
| Rayon covalente | 121 ± 16 heures | ||||||||||||||||||||||||
| Rayon de Van der Waals | 184 h | ||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||
| Crystal structure | cubique à faces centrées  | ||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 28,2 nΩ · m | ||||||||||||||||||||||||
| Conductivité thermique | 237 W · m -1 · K -1 | ||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 23,1 um · m -1 · K -1 | ||||||||||||||||||||||||
| Vitesse du son (tige mince) | ( rt) (laminés) 5000 m · s -1 | ||||||||||||||||||||||||
| Le module d'Young | 70 GPa | ||||||||||||||||||||||||
| Module de cisaillement | 26 GPa | ||||||||||||||||||||||||
| Module Bulk | 76 GPa | ||||||||||||||||||||||||
| Coefficient de Poisson | 0,35 | ||||||||||||||||||||||||
| Dureté Mohs | 2,75 | ||||||||||||||||||||||||
| Dureté Vickers | 167 MPa | ||||||||||||||||||||||||
| Dureté Brinell | 245 MPa | ||||||||||||||||||||||||
| Numéro de registre CAS | 7429-90-5 | ||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||
| Article détaillé: Isotopes de l'aluminium | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Aluminium (ou d'aluminium) est un élément chimique dans la groupe de bore avec le symbole Al et de numéro atomique 13. Il est blanc argenté, et il ne est pas soluble dans l'eau dans des conditions normales.
L'aluminium est le troisième élément le plus abondant (après oxygène et du silicium ), et le la plupart des métaux abondants, dans la Terre de la croûte . Il représente environ 8% en poids de la surface solide de la Terre. métallique en aluminium est si réactif chimiquement que les spécimens indigènes sont rares et limités à l'extrême réduire environnements. Au lieu de cela, on trouve plus de 270 combinés dans différents minerais . Le chef le minerai d'aluminium est bauxite.
L'aluminium est remarquable pour le métal de faible densité et pour sa capacité à résister à la corrosion due au phénomène de passivation. Composants structurels en aluminium et son alliages sont essentiels à la l'industrie de l'aérospatiale et sont importantes dans d'autres domaines de transport et de matériaux de construction. Les composés les plus utiles de l'aluminium, au moins sur une base pondérale, sont les oxydes et les sulfates.
Malgré sa prévalence dans l'environnement, les sels d'aluminium ne sont pas connus pour être utilisé par toute forme de vie. Conformément à son omniprésence, l'aluminium est bien toléré par les plantes et les animaux. En raison de leur prévalence, bénéfiques (ou non) les rôles biologiques potentiels des composés d'aluminium sont d'un intérêt continu.
Caractéristiques

Physique
L'aluminium est un relativement souple, durable, léger, et ductile malléable métal avec une apparence allant de l'argenté au gris terne, en fonction de la rugosité de surface. Il est non magnétique et ne se enflamme pas facilement. Un nouveau film d'aluminium est un bon réflecteur (environ 92%) de la lumière visible et un excellent réflecteur (jusqu'à 98%) de rayonnement infrarouge moyen et lointain. Le limite d'élasticité de l'aluminium pur est 7-11 MPa, tandis que les alliages d'aluminium ont une limite d'élasticité allant de 200 MPa à 600 MPa. L'aluminium a environ un tiers de la densité et rigidité de l'acier . Il est facilement usinée, exprimés, dessiné et extruder.
des atomes d'aluminium sont disposés dans une cubique à faces centrées (cfc) structure. L'aluminium a une énergie empilement faute d'environ 200 MJ / m 2.
L'aluminium est un bon thermique et conducteur électrique, ayant 59% de la conductivité du cuivre, à la fois thermique et électrique, tout en ayant seulement 30% de la densité de cuivre. L'aluminium est capable d'être un supraconducteur , ayant une température critique supraconductrice de 1,2 Kelvin et un champ magnétique critique d'environ 100 gauss (10 milliteslas).
Chimique
Corrosion résistance peut être excellent en raison d'une mince couche de surface d' oxyde d'aluminium qui se forme lorsque le métal est exposé à l'air, empêchant encore l'oxydation. Les plus fortes alliages d'aluminium sont moins résistants à la corrosion due à réactions galvaniques avec allié cuivre . Cette résistance à la corrosion est également souvent fortement réduite par les sels aqueux, en particulier en présence de métaux différents.
En raison de sa résistance à la corrosion, l'aluminium est l'un des rares métaux qui conservent réflectance argenté en forme de poudre fine, ce qui en fait un élément important de peintures de couleur argent. finition miroir en aluminium a le plus haut réflectance de ne importe quel métal dans le 200-400 nm ( UV ) et la 3,000-10,000 nm (mesure IR) régions; 400 à 700 nm dans le spectre visible, il est légèrement dépassé par l'étain et argent et dans le 700-3000 (proche IR) par l'argent, l'or et le cuivre.
L'aluminium est oxydé par l'eau pour produire de l'hydrogène et de la chaleur:
- 2 Al + 3 H 2 O → Al 2 O 3 + 3 H 2
Cette conversion est d'un intérêt pour la production d'hydrogène. Ces défis incluent contourner la couche d'oxyde formée qui inhibe la réaction et les frais liés au stockage de l'énergie par régénération du métal Al.
Isotopes
L'aluminium a de nombreuses connus isotopes , dont le nombre de masse varier de 21 à 42; Toutefois, seulement 27 Al ( isotope stable ) et 26 Al ( isotope radioactif, t 1/2 = 7,2 × 10 5 y) l'état naturel. 27 Al a une abondance naturelle au-dessus de 99,9%. 26 Al est produit à partir de l'argon dans l' atmosphère par causée par spallation rayons cosmiques protons . isotopes de l'aluminium ont trouvé une application pratique dans datant marins sédiments, nodules de manganèse, de glace glaciaire, quartz dans la roche expositions, et météorites. Le rapport de 26 à 10 Al Be a été utilisée pour étudier le rôle du transport, dépôt, les sédiments de stockage, les temps de sépulture, et l'érosion des échelles de temps 10 mai au 10 juin de l'année. Cosmogénique 26 Al a été appliquée pour la première dans les études de la Lune et de météorites. Fragments de météorites, après le départ de leurs organes de tutelle, sont exposés à un bombardement intense de rayons cosmiques au cours de leur Voyage à travers l'espace, entraînant 26 substantielle Al production. Après être tombé à terre, blindage atmosphérique réduit considérablement la production 26 Al et son déclin peut ensuite être utilisée pour déterminer l'âge terrestre de la météorite. Météorite recherche a également montré que 26 Al était relativement abondante au moment de la formation de notre système planétaire. La plupart des scientifiques de météorites croient que l'énergie libérée par la désintégration du 26 Al était responsable de la fusion et la différenciation de certains astéroïdes après leur formation il ya 4,55 milliards années.
Occurrence naturelle
Stable aluminium est créé lorsque l'hydrogène fusionne avec le magnésium soit dans les grandes étoiles ou supernovae .
Dans la croûte terrestre , l'aluminium est (8,3% en poids) de l'élément métallique le plus abondant et le troisième plus abondant de tous les éléments (après l'oxygène et le silicium). En raison de sa forte affinité pour l'oxygène, il ne est presque jamais trouvé à l'état élémentaire; au lieu de cela se trouve dans les oxydes ou des silicates. feldspaths , le groupe le plus commun de minéraux de la croûte de la Terre, sont des aluminosilicates. Aluminium métal natif ne peut être trouvée que dans une phase mineure faible teneur en oxygène environnements de fugacité, comme les intérieurs de certains volcans. Aluminium natif a été rapportée dans suintements froids dans le nord talus continental de la mer de Chine méridionale et Chen et al. (2011) ont proposé une théorie de son origine comme résultant par réduction de tetrahydroxoaluminate Al (OH) 4 - de l'aluminium métallique par des bactéries .
Il se produit également dans les minéraux béryl, cryolite, grenat, spinelle et turquoise . Les impuretés dans Al 2 O 3, tels que le chrome ou le fer rendement le pierres précieuses Ruby et saphir, respectivement.
Bien que l'aluminium est un élément extrêmement commune et répandue, les minéraux d'aluminium communs ne sont pas sources économiques du métal. La quasi-totalité de l'aluminium métallique est produit à partir de la minerai de bauxite (AlO x (OH) 3-2 x). La bauxite se produit en intempéries produit de faible teneur en fer et la roche de silice dans des conditions climatiques tropicales. De grands gisements de bauxite se produisent en Australie, Brésil , Guinée et la Jamaïque et les zones minières primaires pour le minerai sont en Australie , le Brésil, la Chine , l'Inde , la Guinée, l'Indonésie , la Jamaïque, la Russie et le Suriname .
Production et raffinement

formes en aluminium forts de liaisons chimiques avec l'oxygène. Par rapport à la plupart des autres métaux, il est difficile d'extraire à partir de minerais, tels que la bauxite, en raison de la forte réactivité de l'aluminium et le point de fusion élevé de la plupart de ses minerais. Par exemple, la réduction directe avec le carbone , comme cela est utilisé pour produire du fer , ne est pas chimiquement possible parce que l'aluminium est un agent réducteur plus fort que le carbone. Réduction carbothermique indirecte peut être effectuée en utilisant du charbon et Al 2 O 3, qui forme un produit intermédiaire Al 4 C 3, ce qui peut en outre produire de l'aluminium métallique à une température de 1900-2000 ° C. Ce processus est encore en cours de développement; elle nécessite moins d'énergie et produit moins de CO 2 que le Procédé Hall-Héroult, le processus industriel majeur pour l'extraction de l'aluminium. Fusion électrolytique de l'alumine était à l'origine un coût prohibitif en partie parce que du point de fusion élevé de l'alumine ou oxyde d'aluminium, (environ 2000 ° C (3600 ° F)). De nombreux minéraux, cependant, se dissolvent dans une seconde minérale déjà fondu, même si la température de la masse fondue est sensiblement inférieure au point de la première minéral de fusion. Fondu cryolithe a été découvert pour dissoudre l'alumine à des températures nettement inférieure au point de fusion de l'alumine pure sans interférer dans le processus de fusion. Dans le Processus-Héroult Hall, l'alumine est d'abord dissous en fusion cryolite avec calcium fluorure et ensuite réduit par voie électrolytique à l'aluminium à une température comprise entre 950 et 980 ° C (1740 à 1800 ° F). La cryolite est un composé chimique de l'aluminium et de sodium fluorures: (Na 3 AlF 6). Bien cryolithe est trouvé comme un minéral dans Groenland , sa forme synthétique est utilisé dans l'industrie. L'oxyde d'aluminium lui-même est obtenu par raffinage dans la bauxite Procédé Bayer.
Le procédé électrolytique a remplacé le Procédé Wöhler, qui implique la réduction du chlorure d'aluminium anhydre avec du potassium . Les deux de la électrodes utilisées dans l'électrolyse de l'oxyde d'aluminium sont du carbone. Une fois l'alumine raffinée est dissous dans l'électrolyte, il dissocie et ses ions sont libres de se déplacer. La réaction à la la cathode est la suivante:
- Al 3+ + 3 e - → Al
Ici, l'ion aluminium est en cours réduite. Le métal d'aluminium puis coule vers le bas et est soutiré, habituellement jeté dans de grands blocs appelés billettes d'aluminium pour un traitement ultérieur.
Au anode, l'oxygène est formée:
- 2 O 2 → O 2 + 4 e -
Dans une certaine mesure, l'anode de carbone est consommée par la réaction subséquente avec l'oxygène pour former du dioxyde de carbone. Les anodes dans une cellule de réduction doivent donc être remplacées régulièrement, car ils sont consommés dans le processus. Les cathodes ne se détériorent, principalement en raison de processus électrochimiques et mouvement de métal. Après cinq à dix ans, en fonction du courant utilisé dans l'électrolyse, une cellule doit être reconstruit à cause de l'usure de la cathode.
électrolyse de l'aluminium avec le Procédé Hall-Héroult consomme beaucoup d'énergie, mais des procédés alternatifs ont toujours trouvé à être moins viable économiquement et / ou écologiquement. La consommation mondiale d'énergie spécifique moyenne est d'environ 15 ± 0,5 kilowatts-heures par kilogramme d'aluminium produite (52 à 56 MJ / kg). Les usines d'électrolyse les plus modernes atteindre environ 12,8 kW · h / kg (46,1 MJ / kg). (Comparez cela à la chaleur de réaction, 31 MJ / kg, et l' énergie libre de la réaction, 29 MJ / kg). courants de ligne de réduction pour les technologies plus anciennes sont généralement de 100 à 200 kiloampères; fonderies état de l'art fonctionnent à environ 350 kA. Des essais ont été rapportés avec 500 cellules kA.
Le procédé Hall-Héroult produit de l'aluminium d'une pureté supérieure à 99%. Une purification supplémentaire peut être effectuée par la Hoope processus. Le procédé implique l'électrolyse de l'aluminium fondu avec un sel de sodium, de baryum et le fluorure d'aluminium électrolytique. L'aluminium obtenu présente une pureté de 99,99%.
L'énergie électrique représente environ 20% à 40% du coût de production d'aluminium, selon l'emplacement de la fonderie. La production d'aluminium consomme environ 5% de l'électricité produite dans les fonderies américaines ont tendance à être situé là où l'énergie électrique est à la fois abondante et bon marché, comme les Émirats arabes unis avec excès fournitures de gaz naturel et l'Islande et la Norvège avec énergie produite à partir de sources renouvelables. Plus grand du monde fonderies d'alumine sont la République populaire de Chine, la Russie et Québec et Colombie-Britannique Canada .
En 2005, la République populaire de Chine était le premier producteur d'aluminium avec presque un cinquième part du monde, suivie par la Russie, le Canada et les États-Unis, rapporte le British Geological Survey.
Au cours des 50 dernières années, l'Australie est devenue un important producteur de minerai de bauxite et un important producteur et exportateur d'alumine (avant d'être dépassée par la Chine en 2007). L'Australie a produit 68 millions de tonnes de bauxite en 2010. Les dépôts australiens avoir quelques problèmes de raffinage, certains étant élevé en silice, mais ont l'avantage d'être peu profonde et relativement facile à la mienne.
Recyclage

Aluminium est théoriquement recyclable à 100% sans aucune perte de ses qualités naturelles. Selon le International des ressources du Groupe spécial Stocks de métaux dans les rapport de la Société, le global habitant stock d'aluminium en usage dans la société par (dans les voitures, les bâtiments, l'électronique etc.) est de 80 kg. Beaucoup de ceci est dans les pays les plus développés (350-500 kg par habitant) plutôt que les pays moins développés (35 kg par habitant). Sachant stocks par habitant et leur durée de vie approximative est important pour le recyclage de planification.
Récupération du métal via le recyclage est devenu une utilisation importante de l'industrie de l'aluminium. Recyclage était une activité à faible profil jusqu'à la fin des années 1960, lorsque l'utilisation croissante de l'aluminium cannettes portées à la sensibilisation du public.
Recyclage implique la fusion de la ferraille, un processus qui ne requiert que 5% de l'énergie utilisée pour produire de l'aluminium à partir du minerai, si une part importante (jusqu'à 15% de la matière d'entrée) est perdu que scories (oxyde comme de la cendre). Les scories peut subir un autre procédé pour extraire l'aluminium.
En Europe de l'aluminium subit un taux élevé de recyclage, allant de 42% des boîtes de boisson, 85% des matériaux de construction et de 95% des véhicules de transport.
L'aluminium recyclé est connu que l'aluminium secondaire, mais conserve les mêmes propriétés physiques que l'aluminium primaire. Aluminium secondaire est produit dans un large éventail de formats et est utilisé dans 80% des injections en alliage. Une autre utilisation importante est pour l'extrusion.
Écume blanche de la production d'aluminium de première fusion et des opérations de recyclage secondaire contient encore des quantités utiles d'aluminium qui peuvent être extraites industriellement. Le procédé produit des billettes d'aluminium, avec un matériau de déchets hautement complexe. Ces déchets sont difficiles à gérer. Il réagit avec l'eau, libérant un mélange de gaz (y compris, entre autres, l'hydrogène , l'acétylène , et de l'ammoniac ), qui se enflamme spontanément au contact de l'air; contacter avec des résultats de l'air humide dans la libération de grandes quantités d'ammoniac gazeux. Malgré ces difficultés, les déchets ont trouvé une utilisation comme charge dans asphalte et béton.
Composés
état d'oxydation 3
La grande majorité des composés, y compris tous les minéraux contenant Al-et tous les composés d'aluminium commercialement importantes, disposent d'aluminium à l'état d'oxydation 3+. Le nombre de coordination de ces composés varie, mais en général, Al 3+ est de six ou de coordonnées tétracoordonné. Presque tous les composés de l'aluminium (III) sont incolores.
Halogénures
Tous les quatre trihalogénures sont bien connus. Contrairement aux structures des trois trihalogénures plus lourds, fluorure d'aluminium (AlF 3) dispose de six coordonnées Al. L'environnement de coordination octaédrique de AlF 3 est liée à la compacité de ion fluorure, dont six peuvent se adapter autour de la petite Al 3+ centre. AlF 3 sublimes (avec fissuration) à 1291 ° C (2356 ° F). Avec des halogénures lourds, les nombres de coordination sont plus faibles. Les autres sont des trihalogénures dimère ou polymère avec des centres Al tétraédriques. Ces matériaux sont préparés par traitement de l'aluminium métallique avec l'atome d'halogène, bien que d'autres méthodes existent. L'acidification des oxydes ou hydroxydes offre hydrates. En solution aqueuse, les halogénures forment souvent des mélanges contenant généralement de six centres coordonner Al, qui sont tous deux fonction halogénure et ligands aquo. Lorsque l'aluminium et le fluorure sont ensemble en solution aqueuse, ils forment facilement des ions complexes tels que [AlF (H 2 O) 5] 2+, AlF 3 (H 2 O) 3, et [AlF 6] 3-. Dans le cas d'un chlorure, un amas de polyaluminium sont formés tel que [Al 13 O 4 (OH) 24 (H 2 O) 12] 7+.
Oxyde et hydroxydes
Aluminium forme un oxyde stable, connu par son nom de minéral corindon . Sapphire et rubis sont corindon impur contaminé par des traces d'autres métaux. Les deux oxydes-hydroxydes, AlO (OH), sont boehmite et diaspore. Il ya trois trihydroxydes: bayerite, gibbsite, et nordstrandite, qui diffèrent par leur structure cristalline ( polymorphes). La plupart sont fabriqués à partir de minerais par une variété de procédés par voie humide utilisant de l'acide et la base. Le chauffage des hydroxydes conduit à la formation de corindon. Ces matériaux sont d'une importance centrale à la production d'aluminium et sont eux-mêmes extrêmement utile.
carbure d'aluminium (Al 4 C 3) est réalisée en chauffant un mélange des éléments ci-dessus 1000 ° C (1832 ° F). Les cristaux jaune pâle constitués de centres d'aluminium tétraédriques. Il réagit avec l'eau ou les acides dilués pour donner du méthane . Le acétylure, Al 2 (C 2) 3, est réalisée en faisant passer de l'acétylène sur aluminium chauffé.
du nitrure d'aluminium (AlN) est le seul connu pour le nitrure d'aluminium. Contrairement aux oxydes il dispose d'Al centres tétraédriques. Il peut être fabriqué à partir des éléments à 800 ° C (1472 ° F). Il est stable à l'air avec un matériau utile élevée conductivité thermique. phosphure d'aluminium (ALP) est réalisée de manière similaire, et hydrolyse pour donner phosphine:
- AlP + 3 H 2 O → Al (OH) 3 + 3 PH

Une variété de composés de formule empirique AlR 3 AlR et 1,5 Cl 1,5 existent. Ces espèces comprennent généralement des centres Al tétraédriques, par exemple " triméthylaluminium "a la formule Al 2 (CH 3) 6 (voir figure). Avec de grands groupes organiques, triorganoaluminium existe en tant que monomères trois coordonnées, tels que triisobutylaluminium. Ces composés sont largement utilisés dans l'industrie chimique, en dépit du fait qu'ils sont souvent hautement pyrophore. Quelques analogues existent entre les composés organoaluminiques et organo-bore sauf pour les grands groupes organiques.
L'hydrure d'aluminium important est l'hydrure de lithium-aluminium (LiAlH 4), qui est utilisé en tant qu'agent réducteur dans la chimie organique . Il peut être produit à partir de l'hydrure de lithium et de trichlorure d'aluminium:
- 4 LiH + AlCl3 → LiAlH 4 + 3 LiCl
Plusieurs dérivés utiles de LiAlH4 sont connus, par exemple, de sodium bis (2-méthoxyéthoxy) dihydridoaluminate. L'hydrure simple, hydrure d'aluminium ou Alane, reste une curiosité de laboratoire. Ce est un polymère de formule (AlH 3) n, à la différence de l'hydrure de bore correspondant à la formule (BH 3) 2.
États d'oxydation 1 et 2
Bien que la grande majorité des composés de l'aluminium Al 3+ disposent centres, composés avec des états d'oxydation inférieurs sont connus et parfois de l'importance en tant que précurseurs aux espèces Al 3+.
Aluminium (I)
AlF, et AlCl AlBr existent dans la phase gazeuse lorsque le trihalogénure est chauffé avec de l'aluminium. La composition Ali est instable à température ambiante par rapport à la triiodure:
- 3 AlI → AlI 3 + 2 Al
Un dérivé stable de l'aluminium est le monoiodide cyclique produit d'addition formé avec triéthylamine, Al 4 I 4 (NET 3) 4. Également d'intérêt théorique, mais seulement de l'existence éphémère sont Al 2 O et Al 2 S. Al 2 O est effectué en chauffant l'oxyde normale, Al 2 O 3, avec du silicium à 1800 ° C (3272 ° F) dans un vide. De tels matériaux rapidement dismute pour les matières de départ.
Aluminium (II)
Composés très simples Al (II) sont invoqués ou observés dans les réactions de Al métallique avec les oxydants. Par exemple, monoxyde d'aluminium, AlO, a été détectée dans la phase gazeuse et après explosion dans les spectres d'absorption stellaire. Plus enquêtes approfondies sont des composés de formule Al 2 R 4 où R est un grand organique ligand.
Analyse
La présence d'aluminium peut être détectée en utilisant l'analyse qualitative aluminon.
Applications
Utilisation générale
L'aluminium est le plus largement utilisé la métaux non ferreux. La production mondiale d'aluminium en 2005 était de 31,9 millions de tonnes. Il a dépassé celle de tout autre métal sauf fer (837,5 millions de tonnes). Prévisions pour 2012 est de 42 à 45.000.000 tonnes, grâce à la hausse la production chinoise.
L'aluminium est presque toujours allié, ce qui améliore nettement ses propriétés mécaniques, en particulier lorsque trempé. Par exemple, la commune des feuilles d'aluminium et les canettes sont des alliages de 92% à 99% d'aluminium. Le principal des agents d'alliage sont le cuivre, le zinc , le magnésium , le manganèse et le silicium (par exemple, duralumin) et les niveaux de ces autres métaux sont de l'ordre de quelques pour cent en poids.



Parmi les nombreuses utilisations de l'aluminium métallique sont en:
- Transport ( voitures , avions, camions, voitures de chemin de fer, les navires, bicyclettes , etc.) que feuilles, de tubes, pièces moulées, etc.
- Emballage ( boîtes, feuilles, etc.)
- Construction ( fenêtres, portes, bardage, fil de bâtiment, etc.).
- Une large gamme d'articles ménagers, de ustensiles pour la cuisine battes de baseball, montres.
- Éclairage pôles, bateau à voile mâts, bâtons de marche, etc.
- Coques extérieures de l'électronique grand public, aussi les cas pour l'équipement par exemple équipement photographique.
- Lignes de transmission électriques pour la distribution de puissance
- MKM et l'acier Aimants Alnico
- Super aluminium de pureté (SPA, 99,980% à 99,999% Al), utilisé dans l'électronique et les CD .
- dissipateurs de chaleur pour les appareils électroniques tels que transistors et processeurs .
- Matériau de substrat de cuivre plaqués stratifiés métal de base utilisés dans une luminosité élevée Éclairage LED.
- L'aluminium en poudre est utilisé dans peindre, et pyrotechniques tels que combustibles solides pour fusées et thermite.
- L'aluminium peut être mis à réagir avec de l'acide chlorhydrique ou de l'hydroxyde de sodium pour produire du gaz d'hydrogène.
- Une variété de pays, y compris France , l'Italie , la Pologne , la Finlande , la Roumanie , Israël , et l'ex -Yougoslavie , ont publié des pièces de monnaie frappées dans les alliages d'aluminium ou en aluminium-cuivre.
- Certains modèles de guitare sportives diamant en aluminium plaques sur la surface des instruments, généralement chrome ou noir. Kramer et Travis Bean sont tous deux connu pour avoir guitares produites avec cous fait d'aluminium, ce qui donne à l'instrument un son très distinct.
L'aluminium est généralement allié - il est utilisé comme métal pur seulement lorsque la résistance et / ou la maniabilité corrosion est plus importante que la force ou la dureté. Une fine couche d'aluminium peut être déposé sur une surface plane par dépôt en phase vapeur physique ou (très rare) dépôt chimique en phase vapeur chimique ou d'un autre moyen pour former revêtements optiques et miroirs.
Les composés d'aluminium
Parce que l'aluminium est abondante et la plupart de ses dérivés présentent une faible toxicité, les composés de l'aluminium bénéficient applications à grande échelle et parfois larges.
Alumine
L'oxyde d'aluminium (Al 2 O 3) et les oxy-hydroxydes associés et trihydroxydes sont produites ou extraites de minéraux sur une grande échelle. La grande majorité de ce matériel est converti à l'aluminium métallique. Environ 10% de la capacité de production est utilisé pour d'autres applications. Une utilisation principale est comme absorbant, par exemple l'alumine sera éliminer l'eau à partir d'hydrocarbures, pour permettre les processus ultérieurs qui sont empoisonnés par l'humidité. oxydes d'aluminium sont des catalyseurs communs pour les procédés industriels, par exemple la Procédé Claus pour la conversion du sulfure d'hydrogène en soufre en les raffineries et pour la l'alkylation d' amines . De nombreux catalyseurs industriels sont "Supporté", ce qui signifie en général que d'un catalyseur coûteux (par exemple, le platine ) est dispersé sur un matériau de surface spécifique élevée tel que l'alumine. Être un matériau très dur ( dureté Mohs 9), l'alumine est largement utilisé comme un abrasif et la production d'applications qui exploitent son inertie, par exemple, dans lampes au sodium haute pression.
Sulfates
Plusieurs sulfates d'aluminium trouvent des applications. Sulfate d'aluminium (Al 2 (SO 4) 3 (H 2 O) 18) est produite sur l'échelle annuelle de plusieurs milliards de kg. Environ la moitié de la production est consommée dans traitement de l'eau. La prochaine application importante est la fabrication de papier. Il est également utilisé comme mordant, dans extincteur, comme additif alimentaire, dans l'ignifugation, et dans le tannage du cuir. Aluminium sulfate d'ammonium, qui est aussi appelé alun d'ammonium, (NH 4) Al (SO 4) 2 · 12H 2 O, est utilisé en tant que mordant et le tannage du cuir. Sulfate de potassium aluminium ([Al (K)] (SO 4) 2) (H 2 O) 12 est utilisé de manière similaire. La consommation de deux aluns est en baisse.
Chlorures
Le chlorure d'aluminium (AlCl 3) est utilisé en pétrole raffinage et de la production de synthèse caoutchouc et polymères. Même si elle a un nom similaire, le chlorhydrate d'aluminium et a moins très différentes applications, par exemple comme agent de durcissement et un anti-transpirant. Ce est un intermédiaire dans la production de l'aluminium métallique.
composés de niche
Étant donné l'ampleur des composés de l'aluminium, une petite application à grande échelle pourrait encore entraîner des milliers de tonnes. L'un des nombreux composés utilisés à ce niveau intermédiaire comprennent l'acétate d'aluminium, un sel utilisé en solution en tant que astringent. borate d'aluminium (Al 2 O 3 · B 2 O 3) est utilisé dans la production de verre et céramiques. fluorosilicate d'aluminium (Al 2 (SiF 6) 3) est utilisé dans la production de synthèse pierres précieuses, verre et céramique. phosphate d'aluminium (AlPO 4) est utilisé dans la fabrication: de verre et de céramique, pâtes et papiers, cosmétiques, peintures et vernis et en faisant dentaire ciment. L'hydroxyde d'aluminium (Al (OH) 3) est utilisé comme un antiacide, comme mordant, dans l'eau de purification, pour la fabrication de verre et de céramique et dans l'imperméabilisation de tissus. l'hydrure de lithium-aluminium est un puissant agent réducteur utilisé dans la chimie organique . Sont utilisés comme Organoaluminiums Des acides de Lewis et des co-catalyseurs. Par exemple, un cocatalyseur du méthylaluminoxane est de Ziegler-Natta oléfine polymérisation pour produire les polymères vinyliques tels que polyéthylène.
Les alliages d'aluminium dans les applications structurelles

Les alliages d'aluminium ayant un large éventail de propriétés sont utilisées dans les ouvrages d'art. systèmes d'alliage sont classés par un système de numéro ( ANSI) ou par des noms indiquant leurs principaux constituants d'alliage ( DIN et ISO).
La résistance et la durabilité des alliages d'aluminium sont très variables, non seulement en raison des composants de l'alliage spécifique, mais également en raison de traitements thermiques et des procédés de fabrication. Un manque de connaissance de ces aspects a de temps à autre conduit à mal conçue et structures en aluminium gagné une mauvaise réputation.
Une limitation importante de structure en alliages d'aluminium est leur résistance à la fatigue. Contrairement aciers, alliages d'aluminium ont bien définie limite de fatigue, ce qui signifie que la rupture par fatigue se produit éventuellement, en vertu même de très petites sollicitations cycliques. Cela implique que les ingénieurs doivent évaluer ces charges et design pour un la vie fixe plutôt que d'une durée de vie infinie.
Une autre propriété importante des alliages d'aluminium est leur sensibilité à la chaleur. procédures de l'atelier impliquant pas de chauffage sont compliquées par le fait que l'aluminium, contrairement à l'acier, fond sans d'abord rouge incandescent. Les opérations de formage où chalumeau est utilisé donc nécessiter une certaine expertise, puisque aucun signe visuel révèlent à quel point le matériel est à la fusion. Les alliages d'aluminium, comme tous les alliages structuraux, sont également soumis à des contraintes internes suivantes opérations de chauffage tels que le soudage et le moulage. Le problème avec les alliages d'aluminium à cet égard est leur faible point de fusion , ce qui les rend plus sensibles à des distorsions de la chaleur induite par le soulagement du stress. Contrôlée, le soulagement du stress peut être effectué en cours de fabrication par traitement thermique de pièces dans un four, suivi d'un refroidissement en effet graduel recuit des contraintes.
Le point de fusion bas des alliages d'aluminium n'a pas empêché leur utilisation dans les fusées; même pour une utilisation dans la construction de chambres de combustion où les gaz peuvent atteindre 3500 K. Le Agena moteur de l'étage supérieur a utilisé un design en aluminium refroidi par régénération pour certaines parties de la buse, y compris la région de la gorge thermiquement critique.
Un autre alliage d'une certaine valeur est bronze d'aluminium (Cu-Al alliage).
Histoire

Anciens Grecs et Romains utiliser des sels d'aluminium comme mordants de teinture et que astringents pour panser les plaies; alun est encore utilisé comme un hémostatique. En 1761, Guyton de Morveau suggéré d'appeler l'alumine d'alun de base. En 1808, Humphry Davy a identifié l'existence d'une base de métal de l'alun, qu'il a qualifié au premier alumium et de l'aluminium plus tard (voir section étymologie , ci-dessous).
Le métal a été la première fois en 1825 dans une forme impure par danoise physicien et chimiste Hans Christian Ørsted. Il a réagi anhydre du chlorure d'aluminium avec du potassium amalgame, ce qui donne un morceau de métal à la recherche semblable à l'étain. Friedrich Wöhler était au courant de ces expériences et de leur cité, mais après de refaire les expériences de Ørsted il a conclu que ce métal était potassium pur. Il a mené une expérience similaire en 1827 en mélangeant du chlorure d'aluminium anhydre avec du potassium et d'aluminium cédé. Wöhler est généralement crédité d'isoler l'aluminium ( latins alumen , alun), mais aussi orsted peut être répertorié comme son découvreur. En outre, Pierre Berthier découvert aluminium dans le minerai de bauxite et extrait avec succès. Français Henri Etienne Sainte-Claire Deville amélioré la méthode de Wöhler en 1846, et décrit ses améliorations dans un livre en 1859, le chef parmi eux étant la substitution de sodium pour le potassium considérablement plus cher. Deville susceptibles également conçu l'idée de l' électrolyse de l'oxyde d'aluminium dissous dans la cryolite; Charles Martin Hall et Paul Héroult auraient développé le processus plus pratique après Deville.
Avant le Procédé Hall-Héroult a été développé à la fin des années 1880, l'aluminium était extrêmement difficile d'extraire de ses différents minerais. Ce fait aluminium pur plus précieux que l'or. Bars de l'aluminium ont été exposées à l' Exposition Universelle de 1855. Napoléon III de la France est réputée pour avoir donné un banquet où les invités les plus honorés ont reçu des ustensiles en aluminium, tandis que les autres se sont contentés de l'or.
Aluminium a été choisi comme le matériau à être utilisé pour le couronnement 100 onces (2,8 kg) du Monument de Washington en 1884, une époque où une once (30 grammes) coûte le salaire journalier d'un travailleur commune sur le projet. La clé de voûte, qui a été mis en place le 6 Décembre 1884, lors d'une cérémonie de dédicace élaborée, était le plus grand morceau de fonte d'aluminium à l'époque, où l'aluminium était plus cher que l'argent.
Le Entreprises Cowles fournis alliage d'aluminium en quantité dans les États-Unis et l'Angleterre en utilisant les fonderies comme la fournaise de Carl Wilhelm Siemens par 1886. Charles Martin Hall de l'Ohio aux États-Unis et de Paul Héroult France indépendamment développé le procédé électrolytique Hall-Héroult qui a fait extraire l'aluminium à partir de minéraux moins cher et est maintenant la principale méthode utilisée dans le monde entier. Le processus de Hall, en 1888 avec le soutien financier de Alfred E. Hunt, a commencé la Pittsburgh Reduction Company aujourd'hui connu comme Alcoa. Le processus de Héroult a été en production par 1889 à la Suisse au Aluminium Industrie, maintenant Alcan, et au British Aluminium, maintenant Luxfer Group et Alcoa, en 1896 à l'Ecosse .
En 1895, le métal était utilisé comme un matériau de construction aussi loin queSydney, en Australie dans le dôme du bâtiment de la secrétaire en chef.
Beaucoup de marines ont utilisé un alliage d'aluminium superstructure pour leurs navires; le feu à bord de 1975 USS Belknap qui a ravagé sa superstructure en aluminium, ainsi que l'observation des dommages de combat aux navires britanniques pendant la Guerre des Malouines, a conduit à de nombreuses marines de commutation à tous acier superstructures. Le Classe Arleigh Burke était le premier navire américain, construit entièrement en acier.
Fil d'aluminium a été autrefois largement utilisé pour le câblage électrique domestique. En raison de faillites provoqués par corrosion, un certain nombre d'incendies a entraîné.
Étymologie
Deux variantes du nom de métal sont en cours d'utilisation, de l'aluminium et de l'aluminium (en dehors de l'alumium obsolète). Le Union internationale de chimie pure et appliquée (UICPA) a adopté le nom de l'aluminium comme norme internationale pour l'élément en 1990, mais, trois ans plus tard, reconnu aluminium comme une variante acceptable. D'où leur tableau périodique comprend à la fois. IUPAC préfère l'utilisation de l'aluminium dans ses publications internes, bien que presque autant de publications UICPA utilisent l'orthographe aluminium.
La plupart des pays utilisent l'orthographe aluminium. Aux États-Unis, l'orthographe aluminium prédomine. Le Canadian Oxford Dictionary préfère l'aluminium, alors que l'Australien Macquarie Dictionnaire préfère aluminium. En 1926, le American Chemical Society a officiellement décidé d'utiliser l'aluminium dans ses publications; Dictionnaires américains qualifient généralement l'orthographe aluminium comme une variante britannique.
Le nom aluminium provient de son statut de base du alun. C'est emprunté à Vieux français; sa source ultime, alumen, à son tour, est une latine mot qui signifie littéralement «sel amer».
La première citation donnée dans le Oxford English Dictionary for tout mot utilisé comme un nom pour cet élément est alumium, qui chimiste et inventeur britannique Humphry Davy employé en 1808 pour le métal qu'il essayait d'isoler électrolytique du minéral alumine . La citation est de la revue Philosophical Transactions de la Royal Society de Londres: "Si je avais eu le bonheur d'avoir obtenu plus de certaines preuves à ce sujet, et d'avoir procuré les substances métalliques, je étais à la recherche de, je aurais proposé pour les noms de silicium, alumium, le zirconium et glucium ".
Davy réglé sur l'aluminium par le temps, il a publié son livre 1812 Philosophie chimique : «Cette substance semble contenir un métal particulier, mais encore en aluminium n'a pas été obtenue dans un état parfaitement libre, bien que les alliages de ce avec d'autres substances Metalline ont été achetés suffisamment distincts pour indiquer la nature probable de l'alumine ". Mais la même année, un contributeur anonyme à la revue trimestrielle, un journal politico-littéraire britannique, dans une critique du livre de Davy, est opposé à l'aluminium et a proposé le nom d'aluminium , "pour que nous allons prendre la liberté de vous écrire le mot, dans de préférence l'aluminium, qui a un son moins classique ".
Le -ium suffixe conforme à la précédent établi dans les autres éléments nouvellement découvertes de l'époque: le potassium, le sodium, le magnésium, le calcium et de strontium (tous Davy lui isolé). Néanmoins, -UM orthographes pour les éléments ne sont pas inconnus à l'époque, comme par exemple le platine , connu des Européens depuis le 16ème siècle, le molybdène , découvert en 1778, et le tantale , découvert en 1802. Le -um suffixe est compatible avec l'orthographe universelle alumine pour la oxydes, comme l'oxyde de lanthane est l'oxyde de lanthane et la magnésie, l'oxyde de cérium et l'oxyde de thorium sont les oxydes de magnésium , le cérium , et thorium respectivement.
L'orthographe utilisée tout au long du 19e siècle par la plupart des chimistes américains était l'aluminium , mais l'usage commun est moins claire. L' aluminium orthographe est utilisée dans le dictionnaire Webster de 1828. Dans son prospectus de publicité pour sa nouvelle méthode électrolytique de production de métal 1892, Charles Martin Hall a utilisé le -um orthographe, malgré son utilisation constante de l' -ium orthographe dans tous les brevets qu'il déposée entre 1886 et 1903. Il a donc été suggéré que l'orthographe reflète une plus facile mot à prononcer avec un de moins syllabe, ou que l'orthographe sur le dépliant était une erreur. La domination de Temple de la production du métal veillé à ce que l'orthographe aluminium est devenu la norme en Amérique du Nord; l' Unabridged Dictionnaire Webster de 1913, cependant, a continué à utiliser le -ium la version.
Les problèmes de santé
| NFPA 704 |
|---|
 0 0 0 |
| diamant feu pour tir d'aluminium |
Malgré son abondance naturelle, l'aluminium n'a pas de fonction connue en biologie. Il est remarquablement non toxique, le sulfate d'aluminium ayant une DL50 de 6207 mg / kg (voie orale, souris), ce qui correspond à 500 grammes pour une personne de 80 kg. Malgré la très faible toxicité aiguë, les effets sur la santé de l'aluminium sont d'intérêt en vue de la présence répandue de l'élément dans l'environnement et dans le commerce.
Certains toxicité peut être attribuée à un dépôt dans les os et le système nerveux central, ce qui est particulièrement augmenté chez les patients ayant une fonction rénale réduite. Parce que l'aluminium est en concurrence avec le calcium pour l'absorption, l'augmentation des quantités d'aluminium alimentaire peuvent contribuer à la minéralisation osseuse réduite (ostéopénie) observée chez les prématurés et les nourrissons souffrant de retard de croissance. Dans de très fortes doses, l'aluminium peut provoquer une neurotoxicité, et est associée à une fonction altérée de la barrière hémato-encéphalique. Un petit pourcentage de gens sont allergiques à l'aluminium et de l'expérience dermatite de contact, des troubles digestifs, des vomissements ou d'autres symptômes lors d'un contact ou l'ingestion de produits contenant de l'aluminium, comme les déodorants ou des antiacides. Dans ceux sans allergies, l'aluminium est moins toxique que les métaux lourds, mais il existe des preuves d'une certaine toxicité si elle est consommée en quantités excessives. Bien que l'utilisation de l'aluminium n'a pas été démontré ustensiles de conduire à la toxicité de l'aluminium en général, la consommation excessive d' antiacides contenant de composés de l'aluminium et de l'utilisation excessive d'antitranspirants contenant de l'aluminium prévoit plusieurs niveaux d'exposition importants. Des études ont montré que la consommation d'aliments acides ou des liquides avec de l'aluminium augmente de façon significative l'absorption d'aluminium, et de maltol a été montré pour augmenter l'accumulation d'aluminium dans les tissus nerveux et osseus. En outre, l'aluminium augmente des œstrogènes expression des gènes humains dans des cellules de cancer du sein en culture en laboratoire. Les effets de l'oestrogène-like de ces sels ont conduit à leur classification comme metalloestrogen.
Les effets de l'aluminium dans les antisudorifiques a été examinée au cours de plusieurs décennies avec peu de preuves d'irritation de la peau. Néanmoins, sa présence dans les antisudorifiques, les colorants (tels que l'aluminium lac), et les additifs alimentaires est controversée dans certains milieux. Bien qu'il y ait peu de preuves que l'exposition normale à l'aluminium présente un risque pour les adultes en bonne santé, certaines études soulignent les risques associés à une exposition accrue au métal. Aluminium dans les aliments peut être absorbé plus que l'aluminium dans l'eau. Certains chercheurs ont exprimé des préoccupations que l'aluminium dans les antisudorifiques peut augmenter le risque de cancer du sein, et de l'aluminium a été controversée impliqué comme facteur dans la maladie d'Alzheimer . Le Camelford pollution de l'eau de l'incident en cause un certain nombre de personnes qui consomment du sulfate d'aluminium. Les enquêtes sur les effets sur la santé à long terme sont toujours en cours, mais les concentrations cérébrales élevées d'aluminium ont été trouvés dans les examens post-mortem des victimes, et d'autres recherches pour déterminer si il ya un lien avec l'angiopathie amyloïde cérébrale a été commandée.
Selon le Société d'Alzheimer, l'avis médical et scientifique est que des études ont démontré de façon convaincante pas un lien de causalité entre l'aluminium et la maladie d'Alzheimer. Néanmoins, certaines études, tels que ceux sur la cohorte PAQUID, citent exposition à l'aluminium en tant que facteur de risque de la maladie d'Alzheimer . Certains plaques du cerveau ont été trouvés à des niveaux accrus de contenir le métal. La recherche dans ce domaine a été concluants; accumulation d'aluminium peut être une conséquence de la maladie plutôt que d'un agent causal. En tout cas, si il ya une toxicité de l'aluminium, il doit être par un mécanisme très spécifique, puisque l'exposition humaine totale à l'élément sous la forme d'origine naturelle de l'argile dans le sol et la poussière est extrêmement grande sur toute une vie. Existe un consensus scientifique pas encore savoir si l'exposition d'aluminium pourrait augmenter directement le risque de la maladie d'Alzheimer.
Effet sur les plantes
L'aluminium est primaire parmi les facteurs qui réduisent la croissance des plantes sur les sols acides. Bien qu'il soit généralement inoffensif pour la croissance des plantes dans les sols de pH neutre, la concentration dans les sols acides toxiques de Al 3+ cations augmente et perturbe la croissance et la fonction racine.
La plupart des sols acides sont saturés avec de l'aluminium plutôt que des ions hydrogène. L'acidité du sol est donc un résultat de l'hydrolyse de composés de l'aluminium. Ce concept de «potentiel de chaux corrigée" pour définir le degré de saturation de base dans les sols est devenue la base pour les procédures actuellement utilisés dans les laboratoires d'analyse des sols pour déterminer le " besoin de chaux "des sols.
Blé d ' adaptation pour permettre la tolérance d'aluminium est telle que l'aluminium provoque un dégagement de composés organiques qui se lient aux nuisibles aluminium cations . Sorghum est censé avoir le même mécanisme de tolérance. Le premier gène de tolérance d'aluminium a été identifié dans le blé. Il a été montré que la tolérance d'aluminium de sorgho est contrôlé par un seul gène, comme pour le blé. Cela ne veut pas le cas dans toutes les plantes.
