
Point de fusion
Renseignements généraux
Cette sélection de wikipedia a été choisi par des bénévoles aidant les enfants SOS de Wikipedia pour cette sélection Wikipedia pour les écoles. Voir http://www.soschildren.org/sponsor-a-child pour connaître le parrainage d'enfants.
Le point de fusion d'un solide cristallin est la plage de température à laquelle il change état solide à liquide . Bien que l'expression suggère une température donnée et est couramment et incorrectement utilisé tel quel dans la plupart des manuels et la littérature, la plupart des composés cristallins fondent en fait sur une plage de quelques degrés ou moins. Au point de fusion de la phase solide et liquide existe à l'équilibre. Quand considérée comme la température de la variation inverse de liquide à solide, il est désigné sous le point de congélation. En raison de la capacité de certaines substances à supercool, le point de congélation ne est pas considéré comme une propriété caractéristique d'une substance.
Fundamentals

Pour la plupart des substances, fusion et points de congélation sont essentiellement égaux. Par exemple, le point de fusion et le point de congélation de l' élément mercure est 234,32 kelvin (-38,83 ° C ou -37,89 ° F). Toutefois, certaines substances possèdent des températures de transition solide-liquide différents. Par exemple, agar fond à 85 ° C (185 ° F) et se solidifie à partir de 31 ° C à 40 ° C (89,6 ° F à 104 ° F); ce processus est connu sous le nom hystérésis.
Certains matériaux, tels que le verre , peuvent durcir sans cristallisation; ceux-ci sont appelés solides amorphes. Les matériaux amorphes ainsi que certains polymères ne ont pas un véritable point de fusion, il n'y a pas de changement de phase abrupte à toute température spécifique. Au lieu de cela, il ya un changement progressif de leur propriétés viscoélastiques sur une plage de températures. Ces matériaux sont caractérisés par une température de transition vitreuse qui peut être grossièrement définie comme le «genou» point de la densité de la matière par rapport à la courbe de température.
Le point de fusion de l'eau à une atmosphère de pression est très proche de 0 ° C (32 ° F, 273,15 K), ce est également connu comme le point de glace. En présence de nucléation substances du point de congélation de l'eau est le même que le point de fusion, mais en l'absence d'eau peut nucléateurs supercool à -42 ° C (-43,6 ° F, 231 K) avant de les congeler.
Contrairement au point d'ébullition , le point de fusion est relativement insensible à la pression parce que la transition solide / liquide représente seulement un petit changement dans le volume. Les points de fusion sont souvent utilisées pour caractériser les composés organiques et de vérifier le pureté. Le point d'une substance pure de fusion est toujours plus élevée et a une portée plus petite que le point d'une substance impure de fusion. Le plus impureté est présente, plus le point de fusion et la plus large de la gamme. Finalement, un point de fusion minimum sera atteint. Le rapport de mélange qui entraîne le point de fusion le plus bas possible est connu comme le le point eutectique.
L' élément chimique avec le point de fusion le plus élevé est le tungstène , à 3695 K (3422 ° C, 6192 ° F) ce qui en fait un excellent pour une utilisation en tant que filaments dans les ampoules. Le souvent cité carbone ne fond pas à la pression ambiante mais sublime à environ 4000 K; une phase liquide ne existe que des pressions supérieures à 10 MPa et estimée 4300-4700 K. Tantale carbure d'hafnium (HfC 4 5 Ta) est un composé réfractaire avec un point de fusion très élevé de 4488 K (4215 ° C, 7619 ° F). À l'autre extrémité de l'échelle, l'hélium ne gèle pas du tout à la pression normale, même à des températures infiniment proches de zéro absolu ; pressions supérieures à 20 fois la pression atmosphérique normale est nécessaire.
Point de fusion mesures
Beaucoup Il existe des techniques de laboratoire pour la détermination des points de fusion. Un banc Kofler est une bande métallique avec un (température ambiante de gamme à 300 ° C) de gradient de température. Toute substance peut être placé sur une section de la bande révélant son comportement thermique à la température à ce point. Calorimétrie différentielle à balayage donne des informations sur le point de fusion avec son Enthalpie de fusion.
Dispositif de point de fusion de base pour l'analyse des solides cristallins se compose d'un bain d'huile avec une fenêtre transparente (plus de conception de base: un Tube de Thiele) et une loupe simple. Les quelques grains d'un solide sont placés dans un tube de verre mince et partiellement immergées dans le bain d'huile. Le bain d'huile est chauffée (et on l'agite) et à l'aide de la loupe fusion (et la source de lumière externe) des cristaux individuels à une certaine température peut être observé. Dans les dispositifs contemporains cette détection optique est automatisé.
Thermodynamique

Non seulement la chaleur nécessaire pour élever la température de la matière solide à la température de fusion, mais la fusion lui-même a besoin de chaleur appelé le chaleur de fusion.
D'un point de vue thermodynamique, au point de fusion le changement énergie libre de Gibbs ( 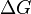 ) De la matière est nul, car le enthalpie (
) De la matière est nul, car le enthalpie (  ) Et l' entropie (
) Et l' entropie (  ) Du matériau sont en augmentation (
) Du matériau sont en augmentation ( 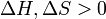 ). Point de fusion phénomène se produit lorsque l'énergie libre de Gibbs du liquide devient inférieure à la matière solide de ce matériau. À différentes pressions cela se produit à une température spécifique. Il peut également être démontré que:
). Point de fusion phénomène se produit lorsque l'énergie libre de Gibbs du liquide devient inférieure à la matière solide de ce matériau. À différentes pressions cela se produit à une température spécifique. Il peut également être démontré que:
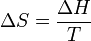
Le "  ","
","  ", Et"
", Et" 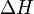 "Dans ce qui précède sont respectivement la température au point de fusion, changement de l'entropie de fusion, et le changement d' enthalpie de fusion.
"Dans ce qui précède sont respectivement la température au point de fusion, changement de l'entropie de fusion, et le changement d' enthalpie de fusion.
Règle de Carnelley
En chimie organique, la règle de Carnelley établie en 1882 par Thomas Carnelley, stipule que haute symétrie moléculaire est associée à point de fusion élevé. Carnelley fondé sa règle sur l'examen de 15 000 composés chimiques. Par exemple, pour trois isomères structurels avec la formule moléculaire C 5 H 12 les point de fusion augmente dans la série isopentane -160 ° C (113 K) n-pentane -129,8 ° C (143 K) et néopentane -18 ° C (255 K). De même, en xylènes et aussi dichlorobenzènes le point de fusion augmente dans l'ordre méta, ortho et para. Pyridine a une symétrie inférieur benzène où son point de fusion inférieur, mais le point de fusion augmente à nouveau avec diazine et triazines. De nombreux composés de cage comme adamantane et cubane avec une haute symétrie ont des points de fusion très élevés.
Un point de fusion élevé résulte d'une haute chaleur de fusion ou d'une faible l'entropie de fusion ou une combinaison. Dans molécules hautement symétriques la phase cristalline est densément emballé avec de nombreuses interactions intermoléculaires efficaces conduisant à un changement d'enthalpie plus élevée lors de la fusion.
