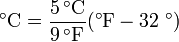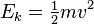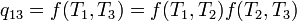Température
À propos de ce écoles sélection Wikipedia
Cette sélection se fait pour les écoles par la charité pour enfants lire la suite . Voulez-vous savoir sur le parrainage? Voir www.sponsorachild.org.uk
La température est un physique propriété d'un système qui sous-tend les notions communes de chaud et de froid; quelque chose qui est généralement plus chaud a la plus grande température. Plus particulièrement, la température est une mesure de l' énergie cinétique d'un échantillon de la matière. La température est un des principaux paramètres de la thermodynamique . A l'échelle microscopique, la température est définie comme l'énergie moyenne des mouvements microscopiques d'une seule particule dans le système par degré de liberté. A l'échelle macroscopique, la température est la propriété physique unique qui détermine la direction d'écoulement de chaleur entre deux objets placés en contact thermique. En l'absence de flux de chaleur se produit, les deux objets ont la même température; autrement la chaleur se écoule de l'objet plus chaud à l'objet plus froid. Ces deux principes fondamentaux sont énoncés dans la droit zéro et la deuxième loi de la thermodynamique, respectivement. Pour un solide, ces mouvements microscopiques sont principalement les vibrations de ses atomes sur leurs sites dans le solide. Pour un gaz monoatomique idéal, les mouvements microscopiques sont les mouvements de translation des particules de gaz constitutifs. Pour un gaz multiatomic, et vibratoire mouvement de rotation devrait être inclus aussi.
La température est mesurée avec thermomètres qui peuvent être calibré à une variété de échelles de température. Dans la plupart des pays (à l'exception du Royaume-Unis , la Jamaïque , et quelques autres pays), le degré Celsius échelle est utilisée pour la plupart des fins de mesure de température. L'ensemble du monde scientifique (États-Unis inclus) de température des mesures en utilisant l'échelle de Celsius et la température thermodynamique utilisant le kelvin échelle, qui est juste à l'échelle Celsius décalé vers le bas de sorte que 0 K = -273,15 ° C, ou zéro absolu . De nombreux domaines de l'ingénierie aux États-Unis, en particulier ceux de haute technologie, utilisent également les échelles Celsius et les degrés kelvin. Toutefois, les États-Unis est le dernier grand pays dans lequel le échelle de température degré Fahrenheit est utilisé par la plupart des profanes, l'industrie, populaire météorologie , et le gouvernement. Autres domaines de l'ingénierie aux États-Unis se appuient également sur le Échelle Rankine (une échelle Fahrenheit décalé) lorsque l'on travaille dans des disciplines thermodynamiques liés tels que combustion.
Vue d'ensemble
Intuitivement, la température est une mesure de la façon dont quelque chose de chaud ou de froid est, bien que le moyen le plus immédiat dans lequel nous pouvons mesurer ce, par le sentir, ne est pas fiable, ce qui entraîne le phénomène de senti température de l'air, qui peuvent différer à divers degrés de la température réelle. Au niveau moléculaire, la température est le résultat du mouvement des particules qui forment une substance. Les hausses de température que l'énergie de cette motion augmente. Le mouvement peut être le mouvement de translation de la particule, ou l'énergie interne de la particule en raison de la vibration moléculaire ou excitation d'un électron le niveau d'énergie. Bien que les équipements de laboratoire très spécialisés est nécessaire pour détecter directement les mouvements de translation, des collisions thermiques thermiques par des atomes ou des molécules de petites particules en suspension dans un fluide produit Mouvement brownien qui peut être vu avec un microscope ordinaire. Les mouvements thermiques des atomes sont très rapides et des températures proches de zéro absolu sont tenus d'observer directement. Par exemple, lorsque les scientifiques à la NIST atteint une température froide record de 700 nK (1 nK = 10 -9 K) en 1994, ils ont utilisé Equipement de réseau optique laser à adiabatique fraîches césium atomes. Ils ont ensuite éteint les lasers et les vitesses de piégeage d'atomes directement mesurées de 7 mm par seconde afin de calculer leur température.
Des molécules , telles que O 2, ont plus degrés de liberté que les atomes simples: ils peuvent avoir des mouvements de rotation et de vibration ainsi que le mouvement de translation. Une augmentation de la température provoque l'énergie de translation moyenne augmente. Il provoque également l'énergie associée à des modes de vibration et de rotation augmente. Ainsi, un gaz diatomique, avec des degrés supplémentaires de rotation de la liberté et de vibrations, nécessite un apport d'énergie plus élevée pour changer la température d'un certain montant, ce est à dire qu'il aura un supérieur capacité thermique d'un gaz monoatomique.
Le processus de refroidissement consiste à enlever l'énergie d'un système. Lorsqu'il n'y a pas plus d'énergie pouvant être retirée, le système est dit être au zéro absolu , qui est le point sur le (absolue) échelle de température thermodynamique , où tout mouvement cinétique dans les particules comprenant la matière cesse et ils sont au repos complet en la (non «classique» de la mécanique quantique ) sens. Par définition, le zéro absolu est une température de 0 précisément kelvins (-273,15 ° C ou -459,67 ° F).
Détails
| Variables conjuguées de la thermodynamique | |
|---|---|
| Pression | Volume |
| ( Stress) | ( Strain) |
| Température | Entropy |
| Potentiel chimique | nombre de particules |
Les propriétés formelles de suivi de la température de sa définition mathématique (voir ci-dessous pour la définition de la loi de zéro et la deuxième définition de la loi) et sont étudiés dans la thermodynamique et la mécanique statistique .
Contrairement à d'autres grandeurs thermodynamiques tels que l'entropie et de la chaleur , dont les définitions microscopiques sont valables même loin de équilibre thermodynamique, la température étant une énergie moyenne par particule ne peuvent être définis à l'équilibre thermodynamique, ou moins à l'équilibre thermodynamique local (voir ci-dessous).
Comme un système reçoit de la chaleur, sa température augmente; de même, une perte de chaleur du système tend à diminuer sa température (au - rare - exception de température négative; voir ci-dessous).
Lorsque deux systèmes sont à la même température, pas de transfert de chaleur se produit entre eux. Quand une différence de température existe, la chaleur aura tendance à se déplacer du système de -température élevée au système de -température inférieur, jusqu'à ce qu'ils soient à l'équilibre thermique. Ce transfert de chaleur peut se produire par l'intermédiaire conduction, convection ou rayonnement ou des combinaisons d'entre eux (voir la chaleur de discussion supplémentaire des divers mécanismes de transfert de chaleur) et certains ions peuvent varier.
La température est également liée à la quantité de l'énergie interne et enthalpie d'un système: plus la température d'un système, plus son énergie interne et enthalpie.
La température est un propriété intensive d'un système, ce qui signifie qu'elle ne dépend pas de la taille du système, la quantité ou le type de matériau dans le système, la même que pour la la pression et la densité . En revanche, la masse , le volume , et l'entropie sont propriétés étendues, et dépendent de la quantité de matière dans le système.
Le rôle de la température dans la nature


La température joue un rôle important dans presque tous les domaines de la science, y compris la physique, la chimie et la biologie.
De nombreuses propriétés physiques des matériaux, y compris l' étape ( solide , liquide , gazeuse ou plasma ), la densité , la solubilité , la pression de vapeur, et la conductivité électrique dépend de la température. La température joue également un rôle important dans la détermination du taux et de l'étendue à laquelle des réactions chimiques se produisent. Ce est une des raisons pourquoi le corps humain a plusieurs mécanismes élaborés pour maintenir la température à 37 ° C, car les températures à seulement quelques degrés de plus peuvent entraîner des réactions nocives avec des conséquences graves. Température commande également le type et la quantité de rayonnement thermique émis par une surface. Une application de cet effet est la ampoule à incandescence, dans lequel un tungstène filament est électriquement chauffé à une température à laquelle des quantités significatives de visible de lumière sont émis.
Température de la dépendance vitesse du son dans l'air c, ρ la densité de l'air et l'impédance acoustique Z vs. la température ° C
| Effet de la température sur la vitesse du son, la densité de l'air et de l'impédance acoustique | |||
| T en ° C | c en m / s | ρ en kg / m³ | Z en N · s / m³ |
| -10 | 325,4 | 1,341 | 436,5 |
| -5 | 328,5 | 1,316 | 432,4 |
| 0 | 331,5 | 1,293 | 428,3 |
| 5 | 334,5 | 1,269 | 424,5 |
| 10 | 337,5 | 1,247 | 420,7 |
| 15 | 340,5 | 1,225 | 417,0 |
| 20 | 343,4 | 1,204 | 413,5 |
| 25 | 346,3 | 1,184 | 410,0 |
| 30 | 349,2 | 1,164 | 406,6 |
Mesure de la température
Mesure de la température à l'aide scientifique moderne thermomètres et échelles de température remonte au moins aussi loin que le début du 18e siècle, lorsque Gabriel Fahrenheit adapté un thermomètre (passage à mercure ) et une échelle à la fois développé par Ole Christensen Rømer. L'échelle de Fahrenheit est encore en usage, aux côtés de l' Celsius échelle et le kelvin échelle.
Unités de température
L'unité de base de la température (symbole: T) dans le Système international d'unités (SI) est le kelvin (Symbole: K). Le kelvin et Celsius (centigrades) échelles sont, par accord international, définie par deux points: zéro absolu et la triple point de Norme Mean Ocean Water Vienne (eau spécialement préparée avec un mélange spécifié de l'hydrogène et l'oxygène isotopes). Zéro absolue est définie comme étant précisément K 0 et -273,15 ° C. Le zéro absolu est où tous mouvement cinétique dans les particules comprenant la matière cesse et ils sont au repos complet dans la (non «classique» de la mécanique quantique ) sens. Au zéro absolu, la matière ne contient energie thermique. En outre, le point triple de l'eau est définie comme étant précisément 273,16 K et 0,01 ° C. Cette définition fait trois choses: 1) qu'il fixe l'ampleur de l'unité de kelvin comme étant précisément une part à 273,16 pièces la différence entre le zéro absolu et le point triple de l'eau; 2) il établit que l'un kelvin a précisément la même ampleur comme une augmentation d'un degré sur le Celsius échelle; et 3) il établit la différence entre les points nuls des deux balances comme étant précisément 273,15 kelvins (K = 0 -273,15 ° C et 273,16 K = 0,01 ° C). Formules pour la conversion de ces unités définissant de température à d'autres échelles peuvent être trouvés à formules de conversion de température.
Dans le domaine de la physique des plasmas , en raison des températures élevées rencontrées et la électromagnétique nature des phénomènes mis en jeu, il est habituel d'exprimer la température en électronvolts (eV) ou kiloélectronvolts (keV), où 1 eV = 11 604 K. Dans l'étude de QCD importe l'on rencontre régulièrement des températures de l'ordre de quelques centaines MeV, ce qui équivaut à environ 10 12 K.
Pour les applications de tous les jours, il est très souvent commode d'utiliser l' Celsius échelle, dans lequel 0 ° C correspond à la température à laquelle l'eau gèle et 100 ° C correspond à la température d'ébullition de l'eau au niveau de la mer. Dans cette échelle une différence de température de 1 degré est identique à une différence de température de 1 K, de sorte que l'échelle est essentiellement la même que l'échelle de Kelvin, mais compensée par la température à laquelle l'eau gèle (273,15 K). Ainsi, l'équation suivante peut être utilisée pour convertir des degrés Celsius en kelvins.
Au Etats-Unis , la Fahrenheit est largement utilisé. Sur cette échelle, le point de congélation de l'eau correspond à 32 ° F et le point à 212 ° F d'ébullition. La formule suivante peut être utilisé pour convertir de Fahrenheit à Celsius:
Voir formules de conversion de température pour les conversions entre la plupart des échelles de température.
Les températures négatives
Pour certains systèmes et les définitions spécifiques de température, il est possible d'obtenir une température négative. Un système avec une température négative ne est pas plus froid que le zéro absolu , mais il se agit plutôt, en un sens, plus chaud que température infinie.
Comparaison des échelles de température
| Commentaire | Kelvin K | Celsius ° C | Fahrenheit ° F | Rankine ° Ra (° R) | Delisle ° D ¹ | Newton N ° | Réaumur ° R (° Ré, ° Re) ¹ | Rømer ° Rø (° R) ¹ |
|---|---|---|---|---|---|---|---|---|
| Zéro absolu | 0 | -273,15 | -459,67 | 0 | 559,725 | -90,14 | -218,52 | -135,90 |
| La plus basse température naturelle enregistrée sur Terre ( Vostok, Antarctique - le 21 Juillet 1983) | 184 | -89 | -128 | 331 | 284 | -29 | -71 | -39 |
| Celsius / "cross-over" température de Fahrenheit | 233,15 | -40 | -40 | 419,67 | 210 | -13,2 | -32 | -13,5 |
| Mélange de glace / sel de Fahrenheit | 255,37 | -17,78 | 0 | 459,67 | 176,67 | -5,87 | -14,22 | -1,83 |
| L'eau gèle (à pression standard) | 273,15 | 0 | 32 | 491,67 | 150 | 0 | 0 | 7,5 |
| La température moyenne à la surface de la Terre | 288 | 15 | 59 | 519 | 128 | 5 | 12 | 15 |
| Moyenne température du corps humain ² | 310,0 ± 0,7 | 36,8 ± 0,7 | 98,2 ± 1,3 | 557,9 ± 1,3 | 94,8 ± 1,1 | 12,1 ± 0,2 | 29,4 ± 0,6 | 26,8 ± 0,4 |
| La plus haute température de surface enregistrée sur Terre ( El Azizia, en Libye - le 13 Septembre 1922) Mais que la lecture est interrogé. | 331 | 58 | 136 | 596 | 63 | 19 | 46 | 38 |
| L'eau bout (au pression standard) | 373,15 | 100 | 212 | 672 | 0 | 33 | 80 | 60 |
| Gaz flamme | ~ 1773 | ~ 1500 | ~ 2732 | |||||
| Titanium fond | 1941 | 1668 | 3034 | 3494 | -2352 | 550 | 1334 | 883 |
| Le surface du Soleil | 5800 | 5526 | 9980 | 10440 | -8140 | 1823 | 4421 | 2909 |
1 L'échelle de température est tombé en désuétude, et de simple intérêt historique.
2 La température normale du corps humain est de 36,8 ± 0,7 ° C, ou de 98,2 ± 1,3 ° C. La valeur couramment donné 98,6 ° F est tout simplement la conversion exacte du XIXe siècle allemand norme de 37 ° C. Comme il ne mentionne pas une fourchette acceptable, il pourrait donc être considéré comme ayant un excès (invalide) précision. Voir Température de la santé humaine (Body Température) pour plus d'informations.
Certains chiffres de ce tableau ont été arrondis.
Fondement théorique de la température
Définition Zeroth-loi de la température
Alors que la plupart des gens ont une compréhension de base du concept de la température, sa définition formelle est assez compliqué. Avant de sauter à une définition formelle, considérons le concept de équilibre thermique. Si deux systèmes avec des volumes fixes sont réunis en contact thermique, les changements seront très probablement lieu dans les propriétés des deux systèmes. Ces changements sont provoqués par le transfert de chaleur entre les systèmes. Un état doit être atteint dans laquelle aucun autre changement, pour mettre les objets en équilibre thermique.
Une base pour la définition de la température peut être obtenue à partir de la Principe zéro de la thermodynamique qui stipule que si deux systèmes, A et B, sont en équilibre thermique et un troisième système C est en équilibre thermique avec le système A alors systèmes B et C seront également en équilibre thermique (étant en équilibre thermique est un relation transitive; en outre, ce est un relation d'équivalence ). Ce est un fait empirique, basée sur l'observation plutôt que la théorie. Depuis A, B, et C sont tous en équilibre thermique, il est raisonnable de dire chacun de ces systèmes part une valeur commune de certains biens. Nous appelons cette température de la propriété.
En règle générale, il ne est pas commode de placer des deux systèmes en contact thermique arbitraires pour voir si elles sont en équilibre thermique et ont donc la même température. En outre, il serait seulement fournir une échelle ordinale.
Par conséquent, il est utile d'établir une échelle de température basé sur les propriétés de certains système de référence. Ensuite, un dispositif de mesure peut être étalonné en fonction des propriétés du système de référence et utilisée pour mesurer la température des autres systèmes. Un tel système de référence est une quantité fixe de gaz. Le loi des gaz parfaits indique que le produit de la pression et de volume (P · V) d'un gaz est directement proportionnelle à la température:
 (1)
(1)
où T est la température, n est le nombre de moles de gaz et R est la constante des gaz. Ainsi, on peut définir une échelle de température en fonction de la pression et le volume de gaz correspondant: la température en kelvins est la pression en pascals de une mole de gaz dans un récipient de un mètre cube, divisée par 8,31 ... En pratique, , un tel thermomètre à gaz ne est pas très pratique, mais d'autres instruments de mesure peut être calibré pour cette échelle.
Il est également intéressant de noter que la pression, le volume et le nombre de moles d'une substance sont tous intrinsèquement supérieure ou égale à zéro. Ceci suggère que la température doit être supérieure ou égale à zéro. En pratique il ne est pas possible d'utiliser un thermomètre à gaz pour mesurer la température de zéro absolu depuis les gaz ont tendance à se condenser en un liquide longue avant que la température atteint zéro. Il est possible d'extrapoler le nombre de degrés au-dessous de la température actuelle du zéro absolu est de la gamme de température où une équation de travaux.
Température des gaz
Pour un le gaz idéal théorie cinétique des gaz utilise la mécanique statistique de relier la température à l'énergie cinétique moyenne des atomes dans le système. Cette énergie moyenne est indépendante de la masse des particules, ce qui semble contre-intuitif à de nombreuses personnes. Température est liée uniquement à l'énergie cinétique moyenne des particules dans un gaz - chaque particule a sa propre énergie qui peuvent ou peuvent ne pas correspondre à la moyenne; la distribution des énergies (et donc les vitesses) des particules dans ne importe quel gaz sont donnés par la Distribution de Maxwell-Boltzmann. La température d'un gaz parfait est lié à son énergie cinétique moyenne par l'équation:
 Où
Où 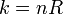 (N = nombre de moles, R = constante des gaz parfaits).
(N = nombre de moles, R = constante des gaz parfaits).
Dans le cas d'un gaz monoatomique, l' énergie cinétique est:
(A noter que le calcul de l'énergie cinétique d'un objet plus complexe, tel qu'une molécule, est un peu plus complexe. Plus degrés de liberté sont disponibles, rotation de manière moléculaire ou les vibrations doivent être inclus.)
La deuxième loi de la thermodynamique affirme que les deux systèmes donnés lors de l'interaction avec l'autre seront ensuite atteindre la même énergie moyenne par particule (et donc la même température). Dans un mélange de particules de masse différents, les particules les plus lourdes se déplacent plus lentement que leurs homologues plus légers, mais auront toujours la même énergie moyenne. Un néon atome se déplace plus lentement par rapport à un atome d'hydrogène molécule de la même énergie cinétique; une particule de pollen se déplace dans une lente Mouvement brownien entre les molécules d'eau en mouvement rapide, etc. Une illustration visuelle de ce de l'Oklahoma State University fait le point plus clair. Particules avec masse différente ont des distributions de vitesse, mais l'énergie cinétique moyenne est la même en raison de la loi des gaz parfaits.
Température du vide
Il est possible d'utiliser la définition de la loi zéro de la température d'assigner une température de quelque chose que nous ne associons pas normalement avec des températures, comme un vide parfait. Parce que tous les objets émettent rayonnement du corps noir, un thermomètre dans un vide loin de sources de rayonnement thermique va rayonner sa propre énergie thermique; diminution de la température indéfiniment jusqu'à ce qu'il atteigne la limite d'énergie du point zéro. A ce stade, il peut être dit être en équilibre avec le vide et, par définition, à la même température. Si nous pouvions trouver un gaz qui se est comporté parfaitement tout le long du zéro absolu de la théorie cinétique des gaz nous dit qu'il permettrait d'atteindre zéro énergie cinétique par particule, et atteindre ainsi la température du zéro absolu. Ainsi, par la loi zéro, un vide isolé parfait est à la température du zéro absolu. A noter que, pour se comporter de préférence dans ce contexte, il est nécessaire que les atomes du gaz ne ont pas à l'énergie du point zéro. Il tournera pas à la matière que ce ne est pas possible parce que la deuxième définition de la loi de la température donnera le même résultat pour tout état de vide unique.
Plus réaliste, pas tel vide idéal existe. Par exemple, un thermomètre dans une chambre à vide qui est maintenu à une certaine température finie (par exemple, la chambre se trouve dans le laboratoire à température ambiante) se équilibrer avec le rayonnement thermique qu'il reçoit de la chambre et dans le temps atteint la température de la chambre. Si une orbite autour de la Terre thermomètre est exposé à une lumière du soleil , puis il se équilibre à la température à laquelle la puissance reçue par le thermomètre du soleil est exactement égale à la puissance rayonnée par une distance le rayonnement thermique du thermomètre. Pour un corps noir cette température d'équilibre est d'environ 281 K (8 ° C). Température moyenne de la Terre (qui est maintenu par l'équilibre similaire) est proche de cette température.
Un thermomètre isolé du rayonnement solaire (à l'ombre de la Terre, par exemple) est toujours exposée au rayonnement thermique de la Terre - va donc montrer une certaine température d'équilibre au cours de laquelle il reçoit et émet quantité égale de l'énergie. Si ce thermomètre est proche de la Terre, puis sa température d'équilibre est d'environ 236 K (-37 ° C) à condition que la surface de la Terre est à 281 K.
Un thermomètre loin de système solaire reçoit toujours Cosmic rayonnement de fond . température d'équilibre d'un tel thermomètre est d'environ 2,725 K, qui est la température d'un gaz de photons constituant corps noir micro-ondes rayonnement de fond à l'état actuel de l'expansion de l'Univers. Cette température est parfois appelée la température de l'espace.
Définition Second-loi de la température
Dans la section précédente température a été définie en termes de la Loi Zéro de la thermodynamique. Il est également possible de définir la température en fonction de la seconde loi de la thermodynamique , qui traite de l'entropie . L'entropie est une mesure du trouble dans un système. La deuxième loi stipule que tout processus entraînera aucun changement ou une augmentation nette de l'entropie de l'univers. Ceci peut être compris en termes de probabilité. Considérons une série de lancers de pièces. Un système parfaitement ordonné serait celui dans lequel chaque tirage soit arrive têtes ou tous toss arrive queues. Cela signifie que pour un ensemble parfaitement ordonné de lancers de pièces, il ya un seul ensemble de toss résultats possibles: le jeu dans lequel 100% de lancers est venu le même.
D'autre part, il existe plusieurs combinaisons qui peuvent entraîner des systèmes désordonnés ou mixtes, où une fraction sont têtes et les queues de repos. Un système désordonné peut être 90% et 10% têtes queues, ou ce pourrait être 40% et 60% têtes queues, et cetera. Comme le nombre de pièce jette augmente, le nombre de combinaisons possibles correspondant aux ordonné imparfaitement systèmes augmente. Pour un très grand nombre de lancers de pièces, le nombre de combinaisons correspondant à ~ 50% ~ 50 têtes et queues domine% et l'obtention d'un résultat significativement différente de 50/50 devient extrêmement improbable. Ainsi, le système progresse naturellement à un état de désordre maximum ou entropie.
Nous avons dit précédemment que la température contrôle le flux de chaleur entre deux systèmes et nous venons de montrer que l'univers, et nous nous attendons à tout système naturel, a tendance à progresser de manière à maximiser l'entropie. Ainsi, nous nous attendons qu'il y ait une relation entre la température et l'entropie. Afin de trouver d'abord examiner la relation de cette relation entre la chaleur let, le travail et la température. Un moteur thermique est un dispositif de conversion de chaleur en travail mécanique et de l'analyse de la Cycle de Carnot fournit les relations nécessaires que nous recherchons. Le travail d'un moteur thermique correspond à la différence entre la chaleur mis dans le système à la température élevée, q H et éjecté de la chaleur à basse température, q C. L'efficacité est le travail divisé par la chaleur mis dans le système ou:
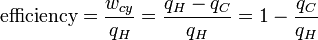 (2)
(2)
où w cy est le travail effectué par cycle. Nous voyons que l'efficacité ne dépend que de q C / q H. Parce q C et q H correspondent au transfert de chaleur aux températures T et T C H, respectivement, q C / q H devrait être une fonction de ces températures:
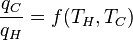 (3)
(3)
Le théorème de Carnot stipule que tous les moteurs réversibles fonctionnant entre les mêmes réservoirs de chaleur sont également efficaces. Ainsi, un moteur thermique fonctionnant entre T 1 et T 3 doit avoir la même efficacité que l'un consistant en deux cycles, une entre T 1 et T 2, et le second entre T 2 et T 3. Cela ne peut être le cas si:
ce qui implique:
Depuis la première fonction est indépendante de T 2, cette température doit annuler sur le côté droit, ce qui signifie f (T 1, T 3) est de la forme g (T 1) / g (T 3) (c.-à-f (T 1, T 3) = f (T 1, T 2) f (T 2, T 3) = g (T 1) / g (T 2) · g (T 2) / g (T 3) = g (T 1) / g (T 3)), où g est une fonction d'une température unique. Nous pouvons maintenant choisir une échelle de température avec la propriété que:
 (4)
(4)
Substituant l'équation 4 à l'arrière dans l'équation 2 donne une relation pour l'efficacité en termes de température:
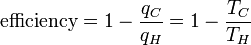 (5)
(5)
Notez que T C = 0 K l'efficacité est de 100% et que l'efficacité devient supérieur à 100% en dessous de 0 K. Depuis un rendement supérieur à 100% viole la première loi de la thermodynamique, cela implique que 0 K est la température minimale possible. En fait, la température la plus basse jamais obtenu dans un système macroscopique était de 20 nK, qui a été réalisé en 1995 au NIST. En soustrayant le côté droit de l'équation 5 de la partie médiane et réarrangement donne:
où le signe négatif indique thermique éjecté du système. Cette relation suggère l'existence d'une fonction d'état, S, définie par:
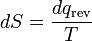 (6)
(6)
où l'indice indique un processus réversible. Le changement de cette fonction de l'Etat autour de ne importe quel cycle est égal à zéro, comme ce est nécessaire pour toute fonction d'état. Cette fonction correspond à l'entropie du système, que nous avons décrite précédemment. Nous pouvons réorganiser l'équation 6 pour obtenir une nouvelle définition de la température en termes d'entropie et de la chaleur:
 (7)
(7)
Pour un système où l'entropie S peut être une fonction S (E) de son énergie E, la température T est donnée par:
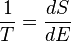 (8)
(8)
ie. l'inverse de la température est le taux d'augmentation de l'entropie par rapport à l'énergie.
![\ Mathrm {K = [^ \ circ C] \ left (\ frac {1 \, K} {1 \, ^ \ circ C} \ right) + 273,15 \, K}](../../images/134/13419.png)