Zéro absolu
Renseignements généraux
Enfants SOS ont produit une sélection d'articles de wikipedia pour les écoles depuis 2005. Voir http://www.soschildren.org/sponsor-a-child pour connaître le parrainage d'enfants.
Le zéro absolu est le plus bas possible la température où rien ne pourrait être plus froid, et aucune chaleur énergétique reste dans une substance. Le zéro absolu est le point à laquelle les molécules ne bougent pas (par rapport au reste du corps) plus que ce qu'ils sont tenus de par une mécanique quantique appelé effet énergie du point zéro. Il existe une limite théorique et ne peut pas être atteint.
Par un accord international, le zéro absolu est défini comme précisément 0 K sur le Kelvin échelle, ce qui est un (absolu) température thermodynamique échelle et -273,15 ° C sur le Celsius échelle (centigrades). Le zéro absolu est aussi précisément équivalent à 0 ° R sur le Échelle Rankine (aussi une échelle de température thermodynamique), et -459,67 ° F sur le Échelle Fahrenheit. Bien qu'il ne est pas possible de refroidir toute substance à 0 K, les scientifiques ont fait de grands progrès dans la réalisation des températures proches du zéro absolu, où la matière expositions effets quantiques tels que la supraconductivité et superfluidité. En fait, en 2000, le Université de technologie d'Helsinki rapporté atteindre des températures de 100 pK (1 × 10 -10 K).
Histoire
Un des premiers à discuter de la possibilité d'un "froid absolue" d'une telle ampleur était Robert Boyle qui, dans ses 1665 nouvelles expériences et observations touchant froide, a déclaré le différend qui est le frigidum primum est très bien connu parmi les naturalistes, certains disputant la terre, d'autres pour l'eau, d'autres pour l'air, et certains des modernes pour nitre, mais tout semblait convenir que:
| " | Il est un organisme ou d'une autre qui est de sa propre nature suprêmement froid et par la participation de tous les autres organismes qui obtiennent cette qualité. | " |
Limiter au «degré de froid '
La question de savoir si il ya une limite au degré de froid possible, et, si oui, où le zéro doit être placé, a d'abord été attaqué par le physicien français Guillaume Amontons en 1702, dans le cadre de ses améliorations dans le thermomètre de l'air et de ses températures de l'instrument ont été indiquées par la hauteur à laquelle une colonne de mercure a été soutenue par une certaine masse d'air, le volume ou "printemps" qui bien sûr varié avec la chaleur à laquelle il a été exposé. Amontons donc fait valoir que le zéro de son thermomètre serait que la température à laquelle le ressort de l'air dans il a été réduit à néant. Sur l'échelle qu'il a utilisé, le point d'ébullition de l'eau a été marquée au 73 et du point de fusion de la glace à 51, de sorte que le zéro de son échelle était équivalente à environ -240 sur l'échelle Celsius.
Cette approximation remarquablement proche de la valeur moderne de -273,15 ° C pour le zéro du thermomètre à air a été encore amélioré par Johann Heinrich Lambert, qui a donné la valeur -270 ° C et a observé que cette température peut être considérée comme froide absolue.
Les valeurs de cet ordre pour le zéro absolu ne ont pas été, cependant, universellement acceptées sur cette période. Pierre-Simon Laplace et Antoine Lavoisier , 1780 dans leur traité sur la chaleur, sont arrivés à des valeurs allant de 1500 à 3000 en dessous du point de congélation de l'eau, et pense que dans tous les cas, il doit être au moins 600 ci-dessous. John Dalton dans sa Philosophie chimique donne dix calculs de cette valeur, et finalement adopté -3000 ° C, selon le zéro naturel de la température.
Etant donné que la température est la mesure de l'énergie cinétique moyenne dans un système, il est possible que certaines molécules atteindre un état d'aucune énergie cinétique tandis que d'autres ont une énergie cinétique plus que l'énergie mesurée. Depuis la moyenne entre les mesures inférieures et supérieures nous donner la température nous lisons, ce est tout à fait possible pour certaines molécules pour atteindre zéro Kelvin.
Le travail de Lord Kelvin
Après JP Joule avait déterminé l'équivalent mécanique de la chaleur, Lord Kelvin a abordé la question d'un point de vue tout à fait différent, et en 1848 a conçu une échelle de température absolue qui était indépendant des propriétés d'une substance particulière et a été fondée uniquement sur la fondamentale lois de la thermodynamique. Il a suivi des principes sur lesquels cette échelle a été construit que son zéro a été placé à -273,150 ° C, presque exactement au même point que le zéro du thermomètre à air.
Informations Complémentaires
Il peut être démontré par les lois de la thermodynamique que zéro absolu ne peut jamais être atteint artificiellement, mais il est possible d'atteindre des températures près d'elle par l'utilisation de cryoréfrigérateurs. Ce est le principe même qui assure aucun la machine peut être efficace à 100%.
Aux très basses températures voisines du zéro absolu, présente de nombreuses propriétés inhabituelles matière dont la supraconductivité , superfluidité et Condensation de Bose-Einstein. Afin d'étudier cette phénomènes, les scientifiques ont travaillé pour obtenir des températures toujours plus bas.
- En 1994, des chercheurs de NIST atteint une température froide puis-record de 700 nK (milliardièmes de kelvin).
- En Novembre 2000, les températures de spin nucléaire inférieures à 100 pK ont été signalés pour une expérience à la Helsinki University of basse température Lab Technology. Cependant, ce était la température d'un degré particulier de la liberté-une propriété quantique appelé spin-pas la température thermodynamique moyenne globale nucléaire à tous les degrés de liberté possibles.
- En Février 2003, le Boomerang Nébuleuse se est révélée être -272,15 ° C; 1 K, l'endroit le plus froid connu en dehors d'un laboratoire. Le nébuleuse est 5000 années-lumière de la Terre et est dans la constellation Centaurus.
Thermodynamique près du zéro absolu
À des températures proches de 0 K, mouvement presque tous moléculaire cesse et 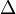 S = 0 pour tout processus adiabatique. Les substances pures peuvent (idéalement) forme parfaite cristaux que T
S = 0 pour tout processus adiabatique. Les substances pures peuvent (idéalement) forme parfaite cristaux que T  0. Max Planck forme forte de l 'de la troisième loi de la thermodynamique affirme l' entropie d'un cristal parfait disparaît au zéro absolu. Toutefois, cela peut ne pas être vrai si l'état de plus basse énergie est dégénéré, ou plus d'un microscopique. L'original Nernst théorème de chaleur rend la demande plus faible et moins controversée que le changement d'entropie pour tout processus isotherme proche de zéro que T
0. Max Planck forme forte de l 'de la troisième loi de la thermodynamique affirme l' entropie d'un cristal parfait disparaît au zéro absolu. Toutefois, cela peut ne pas être vrai si l'état de plus basse énergie est dégénéré, ou plus d'un microscopique. L'original Nernst théorème de chaleur rend la demande plus faible et moins controversée que le changement d'entropie pour tout processus isotherme proche de zéro que T  0
0
L'implication est que l'entropie d'un cristal parfait approche simplement une valeur constante.
Le postulat de Nernst identifie le isotherme T = 0 comme coïncidant avec le adiabatique S = 0, bien que d'autres isothermes et adiabatiques sont distincts. En l'absence de deux adiabatiques croisent, aucun autre adiabatique peut couper le T = 0 isotherme. Par conséquent aucun processus adiabatique initiée à la température de zéro peut conduire à température nulle. (≈ Callen, pp. 189-190)
Une affirmation encore plus fort, ce est qu'il est impossible par une procédure pour réduire la température d'un système à zéro dans un nombre fini d'opérations. (≈ Guggenheim, p. 157)
Un cristal parfait est celui dans lequel l'intérieur la structure en treillis se étend sans interruption dans toutes les directions. L'ordre parfait peut être représenté par translation symétrie le long de trois (généralement pas orthogonale) axes . Chaque élément de la structure en treillis est à sa place, que ce soit un atome ou un groupement moléculaire. Pour des substances ayant deux (ou plusieurs) des formes cristallines stables, tels que le diamant et graphite de carbone , il est une sorte de "dégénérescence chimique". La question reste à savoir si les deux peuvent avoir entropie nulle à T = 0, même si chacun est parfaitement ordonné.
Cristaux parfaits ne se produisent jamais dans la pratique; imperfections, et les matériaux amorphes même ensemble, tout simplement se "figés dans" à basse température, de sorte que les transitions à plus états stables ne se produisent pas.
En utilisant le Modèle Debye, le la chaleur et l'entropie d'un cristal pur spécifiques sont proportionnelles à T 3, tandis que l' enthalpie et potentiel chimique sont proportionnelles à T 4. (Guggenheim, p. 111) Ces quantités tomber vers leurs T = 0 les valeurs et l'approche de limitation avec zéro pentes. Pour les chaleurs spécifiques au moins, la valeur limite se est certainement zéro, comme en témoignent les expériences en dessous de 10 K. Même le moins détaillé Einstein modèle montre cette baisse curieux chaleurs spécifiques. En fait, tous les chaleurs spécifiques disparaissent au zéro absolu, et pas seulement celles des cristaux. De même pour le coefficient de dilatation thermique. Les relations de Maxwell montrent que divers autres quantités disparaissent également. Ces phénomènes étaient imprévue.
Depuis la relation entre les changements dans la énergie de Gibbs , l'enthalpie et l'entropie est
Ainsi, comme le T diminue, Δ Δ G et H se rapprochent les uns des autres (dans la mesure où Δ S est délimitée). Expérimentalement, on constate que tous les processus spontanés (y compris les réactions chimiques ) se traduisent par une diminution de G à mesure qu'ils avancent vers EQuilbrium. Si Δ S et / ou T sont de petite taille, la condition Δ G <0 peut impliquer que Δ H <0, ce qui indiquerait une réaction exothermique qui dégage de la chaleur. Toutefois, cela ne est pas nécessaire; réactions endothermiques peuvent procéder spontanément si le terme T Δ S est assez grand.
Plus que cela, les pentes des dérivés de température Δ G et Δ H convergent et sont égaux à zéro à T = 0, ce qui garantit que Δ G et Δ H sont presque les mêmes sur une gamme considérable de températures, justifiant la approximative empiriques Principe de Thomsen et Berthelot, qui dit que l'état d'équilibre à laquelle un système passe est celui qui évolue le plus grand quantité de chaleur, ce est à dire, un processus réel est la plus exothermique. (Callen, pp. 186-187)
Relation avec Bose Einstein condensats
Un Condensat de Bose-Einstein est une substance qui se comporte très inhabituellement mais seulement à des températures extrêmement basses, peut-être quelques milliardièmes dessus du zéro absolu. Ce est à ce point, le lois de la thermodynamique deviennent très importantes.
Échelles de température absolue
Absolue ou température thermodynamique est traditionnellement mesuré kelvins ( Celsius -scaled incréments), et plus rarement dans le Échelle Rankine ( Incréments Fahrenheit-échelle). Température absolue est déterminée de façon unique à une constante multiplicatif qui spécifie la taille du «degré», de sorte que les rapports de deux températures absolues, T 2 / T 1, sont les mêmes dans toutes les échelles. La définition la plus transparente vient du classique Distribution sur les énergies, ou des analogues quantiques Maxwell-Boltzmann: Statistique de Fermi-Dirac (particules de demi-entier spin) et La statistique de Bose-Einstein (particules de spin entier), qui tous donnent les nombres relatifs de particules (diminution) des fonctions exponentielles d'énergie plus kT. Sur un niveau macroscopique, une définition peut être donnée en termes de l'efficacité de «réversible» moteurs thermiques fonctionnant entre réservoirs thermiques chaudes et froides.
Les températures négatives
Certains systèmes semi-isolé, comme un système de non-interacting spins dans un champ magnétique, peut atteindre des températures négatives; cependant, ils ne sont pas en fait plus froid que zéro absolu. Ils peuvent cependant être considérés comme "plus chaud que T = ∞", que l'énergie se écoule d'un système de température négatif à tout autre système avec température positive lors d'un contact.