
Le cuivre (I) de chlorure
Saviez-vous ...
Enfants SOS offrent un chargement complet de la sélection pour les écoles pour une utilisation sur les intranets des écoles. Le parrainage d'enfants aide les enfants un par un http://www.sponsor-a-child.org.uk/ .
| Le cuivre (I) de chlorure | |
|---|---|
 | |
 | |
Le cuivre (I) de chlorure | |
Autres noms Chlorure cuivreux | |
| Identificateurs | |
| Numéro CAS | 7758-89-6 |
| Numéro RTECS | GL6990000 |
| Propriétés | |
| Formule moléculaire | CuCl |
| Masse molaire | 98,99 g / mol |
| Apparence | poudre blanche, légèrement vert d'impuretés oxydées |
| Densité | 4,140 g / cm 3, solide |
| Point de fusion | 430 ° C (703 K) |
| Point d'ébullition | 1490 ° C (1760 K), |
| Solubilité dans l'eau | 0,0062 g / 100 ml (20 ° C) |
| Structure | |
| Crystal structure | Tetrahedral Fermer emballés ( Zinc structure blende) |
| Risques | |
| FS | ScienceLab.com |
| R / S déclaration | R: 22, 50, 53 S: 22, 60/61 |
| Principal dangers | Irritant |
| NFPA 704 |  0 3
0 |
| Des composés apparentés | |
| D'autres anions | Le cuivre (I) de bromure Le cuivre (I) d'iodure |
| D'autres cations | Cuivre (II) chlorure Argent (I) de chlorure |
| Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
Le cuivre (I) chlorure, communément appelé chlorure cuivreux, ce est la plus faible le chlorure de cuivre , de formule CuCl. Ce solide incolore est un précurseur polyvalent à d'autres composés de cuivre, dont certains à caractère commercial. Il se produit naturellement que le minéral rare nantokite. Contrairement à d'autres halogénures de métaux de transition de la première rangée, il forma une écurie des complexes avec le monoxyde de carbone . Il cristallise dans un diamantoïde motif, ce qui reflète la tendance de cuivre (I) pour former des complexes tétraédriques.
Préparation
Le cuivre (I) de chlorure est produit industriellement par la chloration directe de cuivre:
- 2 Cu + Cl 2 → 2 CuCl
Au laboratoire, le cuivre (I) de chlorure peut être préparé par la réduction de sels de cuivre (II) tels que CuSO 4 en utilisant le dioxyde de soufre, bisulfite de sodium (NaHSO 3), le métabisulfite de sodium, ou le cuivre métallique.
- 2 CuCl 2 + H 2 O + SO 3 2- → 2 CuCl + SO 4 2- + 2 Cl -
Les précipités solides blancs à partir de la solution. Après repos à l'air humide, des échantillons de CuCl deviennent verts due à la formation de chlorures de cuivre (II).
Propriétés chimiques
CuCl est plus accessible et moins toxiques que d'autres acides de Lewis gazeuses. En outre, le cuivre peut exister dans plusieurs états redox, y compris I, II, et III. Cette combinaison de propriétés définir certaines des caractéristiques utiles de cuivre (I) le chlorure. Il est un doux Lewis acide, classé comme douce selon la Concept difficile-Soft acide-base. Ainsi, il a tendance à former stable complexes avec douce Les bases de Lewis telles que triphénylphosphine:
- CuCl + P (C 6 H 5) 3 → [CuCl (P (C 6 H 5) 3)] 4
Bien que CuCl est insoluble dans l'eau, il se dissout dans des solutions aqueuses contenant des molécules donneurs appropriés. Il forme des complexes avec des ions halogénures, par exemple formant H 3 O + CuCl 2 - concentré avec de l'acide chlorhydrique . Il se dissout dans des solutions contenant aussi CN -, S 2 O 3 2-, et NH 3 pour donner des complexes.
Solutions de CuCl dans HCl ou NH 3 absorber le monoxyde de carbone pour former des complexes incolores, tels que le dimère de chlorure ponté [CuCl (CO)] 2. Les mêmes solutions d'acide chlorhydrique réagissent également avec l'acétylène gazeux pour former [CuCl (C 2 H 2)]. ammoniacales solutions de CuCl réagissent avec des acétylènes pour former l'explosif cuivre (I) acétylure. Complexes de CuCl avec des alcènes peuvent être préparés par réduction de CuCl2 par le dioxyde de soufre en présence de l'alcène en solution alcoolique. Complexes avec les diènes tels que 1,5-cyclooctadiène sont particulièrement stable:

Bien que seulement peu soluble dans l'eau, sa solution aqueuse sont instables par rapport à dismutation en Cu et CuCl 2 . En partie pour cette raison échantillons prennent une coloration verte (voir photo en haut à droite).
Utilisations
La principale utilisation de cuivre (I) est le chlorure en tant que précurseur de la oxychlorure de cuivre fongicide. Pour ce cuivre aqueuse de but (I) est généré par le chlorure comproportionation puis air oxydé:
- Cu + CuCl 2 → 2 CuCl
- 6 CuCl + 3/2 O 2 + 3 H 2 O → 2 Cu 3 Cl 2 (OH) 4 + CuCl2
Le cuivre (I) de chlorure catalyse de diverses réactions organiques, comme discuté ci-dessus. Son affinité pour le monoxyde de carbone en présence de chlorure d'aluminium est exploitée dans le processus COPure SM.
En synthèse organique
Dans le Réaction de Sandmeyer. Le traitement d'un arènediazonium sel avec CuCl conduit à un chlorure d'aryle, par exemple:
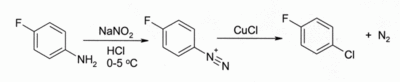 La réaction a une large portée et donne généralement de bons rendements.
La réaction a une large portée et donne généralement de bons rendements.
Les premiers chercheurs ont observé que le cuivre (I) halogénures catalysent addition 1,4 de Des réactifs de Grignard de cétones alpha, bêta-insaturés ont conduit au développement de réactifs organocuprate qui sont largement utilisés aujourd'hui dans synthèse organique:
 Ce constat a conduit au développement de la chimie organocuivre. Par exemple, réagit avec CuCl méthyllithium (CH 3 Li) pour former " Gilman réactifs "tels que (CH 3) 2 CuLi, qui trouvent une large utilisation dans synthèse organique. Les réactifs de Grignard réagissent de manière similaire. Bien que le cuivre (I) d'autres composés tels que cuivre (I) iodure sont maintenant plus souvent utilisé pour ces types de réactions, de cuivre (I) le chlorure est toujours recommandé, dans certains cas:
Ce constat a conduit au développement de la chimie organocuivre. Par exemple, réagit avec CuCl méthyllithium (CH 3 Li) pour former " Gilman réactifs "tels que (CH 3) 2 CuLi, qui trouvent une large utilisation dans synthèse organique. Les réactifs de Grignard réagissent de manière similaire. Bien que le cuivre (I) d'autres composés tels que cuivre (I) iodure sont maintenant plus souvent utilisé pour ces types de réactions, de cuivre (I) le chlorure est toujours recommandé, dans certains cas:
 Ici, Bu désigne un groupe n- un groupe butyle. Sans CuCl, le Réactif de Grignard seul donne un mélange de 1,2- et de 1,4-produits d'addition (ce est à dire, le butyle ajoute au plus près de la C = O).
Ici, Bu désigne un groupe n- un groupe butyle. Sans CuCl, le Réactif de Grignard seul donne un mélange de 1,2- et de 1,4-produits d'addition (ce est à dire, le butyle ajoute au plus près de la C = O).
Dans la chimie des polymères
Le cuivre (I) est également un chlorure intermédiaire formé à partir de cuivre (II) dans la Processus Wacker. CuCl est utilisé comme catalyseur dans Atom Transfer Radical Polymerization (ATRP).
