
Le chlorure d'aluminium
Contexte des écoles Wikipédia
Cette sélection écoles a été choisi par SOS Enfants pour les écoles dans le monde en développement ne ont pas accès à Internet. Il est disponible en téléchargement intranet. Voir http://www.soschildren.org/sponsor-a-child pour connaître le parrainage d'enfants.
| Le chlorure d'aluminium | |
|---|---|
 | |
 | |
Aluminium (III) chlorure | |
Autres noms le trichlorure d'aluminium | |
| Identificateurs | |
| Propriétés | |
| Formule moléculaire | AlCl 3 |
| Masse molaire | 133,34 g mol -1 (anhydre) 241,432 g mol -1 (hexahydrate) |
| Apparence | Solide jaune pâle, hygroscopique. |
| Densité | 2,48 g cm -3 |
| Point de fusion | 190 ° C 463 K ) |
| Point d'ébullition | 178 ° C (451 K) ( subl) |
| Solubilité dans l'eau | 43,9 g / 100 ml (0 ° C) 44,9 g / 100 ml (10 ° C) 45,8 g / 100 ml (20 ° C) 46,6 g / 100 ml (30 ° C) 47,3 g / 100 ml (40 ° C) 48,1 g / 100 ml (60 ° C) 48,6 g / 100 ml (80 ° C) 49 g / 100 ml (100 ° C) |
| Structure | |
| Crystal structure | 6 coordonnée réseau de couche |
| Coordination géométrie | Octahedral (solide) Tétraédrique (liquide) |
| Forme moléculaire | Trigonale plane ( vapeur monomère) |
| Risques | |
| FS | MSDS externe |
| Classification UE | Corrosif (C) |
| Phrases-R | R34 |
| Phrases S | (S1 / 2), S7 / 8, S28, S45 |
| Des composés apparentés | |
| D'autres anions | Le fluorure d'aluminium Bromure d'aluminium l'iodure d'aluminium |
| D'autres cations | Le trichlorure de bore Gallium (III) chlorure Indium (III) chlorure Le thallium (III) chlorure Le chlorure de magnésium |
| Connexe Des acides de Lewis | De fer (III) chlorure Le trifluorure de bore |
| Page de données supplémentaire | |
| Structure et propriétés | n, ε r, etc. |
| Thermodynamique données | comportement de phase Solide, liquide, gaz |
| Les données spectrales | UV, IR, RMN , MS |
| Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
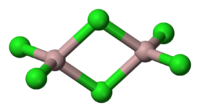
Le chlorure d'aluminium (de AlCl 3) est un composé de l'aluminium et le chlore . Le solide a une fusion et point d'ébullition bas, et est lié de façon covalente. Il sublime à 178 ° C . Molten AlCl3 effectue électricité mal, à la différence plus ionique les halogénures tels que le chlorure de sodium . Il existe à l'état solide comme un réseau de six coordonner couche.
AlCl 3 adopte la structure "YCl 3", mettant en vedette Al 3+ structure en couches près emballé cube. En revanche, AlBr3 a une structure moléculaire plus, avec les Al 3+ centres occupant trous tétraédriques adjacents du cadre de serrée de Br - ions. Lors de la fusion AlCl 3 donne le dimère Al 2 Cl 6, qui peut vaporiser. Au plus élevés températures ce Al 2 Cl 6 dimères se dissocie en trigonal plane AlCl 3, dont la structure est analogue à BF 3.

Le chlorure d'aluminium est hautement déliquescent, et il peut exploser au contact brutal avec l'eau en raison de la forte chaleur hydratation. Aqueuses solutions d'AlCl3 sont ionique et ainsi conduire l'électricité ainsi. De telles solutions se avèrent acide , ce qui indique partielle l'hydrolyse de l'ion Al. Les réactions peuvent être décrites (simplifié) en tant que:
- [Al (H 2 O) 6] 3+ + H 2 O ⇌ [Al (OH) (H 2 O) 5] 2+ + H 3 O +
AlCl 3 est probablement le plus couramment utilisé Acide de Lewis et aussi l'un des plus puissants. Elle trouve une application très répandue dans le industrie chimique comme le classique catalyseur pour Friedel-Crafts, deux acylations et alkylations. Il trouve également utiliser dans polymérisation et réactions d'isomérisation de hydrocarbures. Aluminium forme également une plus faible le chlorure d'aluminium (I) chlorure (AlCl), mais cela est très instable et ne est connu dans la phase vapeur.
Propriétés chimiques
Le chlorure d'aluminium est un puissant Acide de Lewis, capable de former des produits d'addition stables Lewis acide-base avec encore faible Les bases de Lewis telles que benzophénone ou mésitylène. Il ne est pas surprenant forme AlCl 4 -, en présence d' des ions chlorure.
Dans l'eau, les formes d'hydrolyse partielle HCl gazeux ou de H 3 O +, comme décrit dans la description ci-dessus. Les solutions aqueuses se comportent de façon similaire à l'autre en aluminium sels hydratés contenant Al 3+ ions , donnant une gélatineuse précipité de l'hydroxyde d'aluminium par réaction avec la quantité correcte de solution aqueuse d'hydroxyde de sodium :
AlCl 3 ( aq) + 3 NaOH (aq) → Al (OH) 3 ( s ) + 3 NaCl (aq)
Préparation
Le chlorure d'aluminium est fabriqué à grande échelle par le réaction exothermique de l'aluminium métallique avec du chlore ou du chlorure d'hydrogène.
- 2 Al + 3 Cl 2 → 2 AlCl 3
- 2 Al + 6 HCl → 2 AlCl 3 + 3 H 2
Les formes hydratées sont préparées en dissolvant les oxydes d'aluminium avec de l'acide chlorhydrique.
Utilisations
Le Réaction de Friedel-Crafts est l'utilisation importante de chlorure d'aluminium, par exemple dans la préparation de anthraquinone (par la industrie des colorants) de benzène et phosgène. En général Réaction de Friedel-Crafts, une chlorure d'acyle ou halogénure d'alkyle réagit avec un système aromatique comme indiqué:

Avec benzène dérivés , le produit principal est la para isomère. La réaction d'alkylation a de nombreux problèmes associés, tels que dans Friedel-Crafts, de sorte qu'il est moins utilisé que la réaction d'acylation. Pour les deux réactions, le chlorure d'aluminium, ainsi que d'autres matériaux et les équipements, doivent être modérément sec, bien qu'une trace d'humidité est nécessaire à la réaction de se dérouler. Un problème général avec la réaction de Friedel-Crafts est le chlorure d'aluminium que " catalyseur "doit être présent en grand en quantités stoechiométriques pour la réaction afin d'aller à son terme, car il les complexes fortement avec les produits (voir propriétés chimiques ci-dessus). Cela rend très difficile à recycler, donc il doit être détruit après utilisation, générant une grande quantité de déchets corrosifs. Pour cette raison, les chimistes étudient l'utilisation de plus catalyseurs respectueux de l'environnement tels que l'ytterbium (III) triflate ou le dysprosium (III) triflate, qui peut être recyclé .
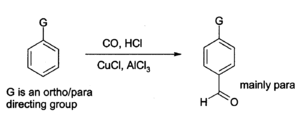
Le chlorure d'aluminium peut également être utilisé pour introduire groupes aldéhyde ONTO des cycles aromatiques, par exemple via le Réaction de Gatterman-Koch, qui utilise du monoxyde de carbone , du chlorure d'hydrogène et un cuivre (I) de chlorure co- catalyseur ):
Le chlorure d'aluminium trouve une grande variété d'autres applications dans la chimie organique . Par exemple, il peut catalyser la " réaction ène ", telles que l'addition de 3-butène-2-one (méthyl vinyl cétone) à carvone:

AlCl 3 est également largement utilisé pour polymérisation et réactions d'isomérisation de des hydrocarbures. Des exemples importants comprennent la fabrication de éthylbenzène, qui avait l'habitude de faire styrène et donc le polystyrène , ainsi que la production de dodécylbenzène, qui est utilisé pour la fabrication de détergents.
Le chlorure d'aluminium combiné avec de l'aluminium en présence d'un arène peut être utilisé pour synthétiser les bis (arène) des complexes métalliques, par exemple bis (benzène) chrome, à partir de certains halogénures métalliques via la dite Synthèse de Fischer-Hafner.
Le chlorure d'aluminium, souvent sous la forme de dérivés tels que chlorhydrate d'aluminium, est une composante commune dans antitranspirants à de faibles concentrations. souffrant d'hyperhidrose ont besoin d'une concentration beaucoup plus élevée (15% ou plus), vendu sous les noms de marque comme Drysol®, Maxim®, ODABAN®, CertainDri®, B + et Drier® Driclor®.
Précautions
AlCl 3 anhydre réagit vivement avec l'eau et bases, précautions afin appropriés sont nécessaires. Sels hydratés sont moins problématiques.
