Ammoniac
Contexte des écoles Wikipédia
Les articles de cette sélection écoles ont été organisés par sujet du programme d'études grâce aux bénévoles d'enfants SOS. Parrainage d'enfants aide les enfants du monde en développement à apprendre aussi.
| Ammoniac | |
|---|---|
 | |
 |  |
Azane | |
Autres noms Hydrogène nitrure Trihydrogen nitrure | |
| Identificateurs | |
| Numéro CAS | 7664-41-7 |
| PubChem | 222 |
| ChemSpider | 217 |
| UNII | 5138Q19F1X |
| Numéro CE | 231-635-3 |
| Numéro ONU | 1005 |
| KEGG | D02916 |
| MeSH | Ammoniac |
| ChEBI | CHEBI: 16134 |
| ChEMBL | CHEMBL1160819 |
| Numéro RTECS | BO0875000 |
| Beilstein Référence | 3587154 |
| Gmelin Référence | 79 |
| 3DMet | B00004 |
| images de Jmol-3D | Image 1 |
SMILES
| |
InChI
| |
| Propriétés | |
| Formule moléculaire | NH 3 |
| Masse molaire | 17,031 g / mol |
| Apparence | Gaz incolore avec une forte odeur âcre |
| Densité | 0,86 kg / m 3 (1,013 bar au point d'ébullition) 0,73 kg / m 3 (1,013 bar à 15 ° C) 681,9 kg / m 3 à -33,3 ° C (liquide) 817 kg / m 3 à -80 ° C (transparent solide) |
| Point de fusion | -77,73 ° C, 195 K, -108 ° F |
| Point d'ébullition | -33,34 ° C, 240 K, -28 ° F |
| Solubilité dans l'eau | 47% (0 ° C) 31% (25 ° C) 28% (50 ° C) |
| Acidité (p K a) | 32,5 (-33 ° C), 10,5 (DMSO) |
| Basicité (p K b) | 4,75 |
| Structure | |
| Forme moléculaire | Pyramide Trigonal |
| Moment de dipôle | 1,42 Ré |
| Thermochimie | |
| Std enthalpie de formation Δ f H | -46 KJ · mol -1 |
| Molaire standard entropie S | 193 J · mol -1 · K -1 |
| Risques | |
| FS | MSDS externe |
| Pictogrammes SGH |     |
| Mentions de danger du SGH | H221, H280, H314, H331, H400 |
| SGH conseils de prudence | P210, P261, P273, P280, P305 + 351 + 338, P310 |
| Indice de l'UE | 007-001-00-5 (anhydre) 007-001-01-2 (solutions) |
| Classification UE | |
| Phrases-R | R10, R23, R34, R50 |
| Phrases S | (S1 / 2), S9, S16, S26, S36 / 37/39, S45, S61 |
| NFPA 704 |  1 3 0 |
| Point d'éclair | gaz inflammable (voir le texte) |
| D'auto-inflammation température | 651 ° C |
| Limites d'explosivité | 15-28% |
| États-Unis Permis limite d'exposition (PEL) | 50 ppm (25 ppm ACGIH- TLV; 35 ppm STEL) |
| Des composés apparentés | |
| D'autres cations | Phosphine Arsine Stibine |
| Des hydrures d'azote liés | Hydrazine L'acide hydrazoïque |
| Des composés apparentés | L'hydroxyde d'ammonium |
| Page de données supplémentaire | |
| Structure et propriétés | n, ε r, etc. |
| Thermodynamique données | comportement de phase Solide, liquide, gaz |
| Les données spectrales | UV, IR, RMN , MS |
Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
L'ammoniac ou Azane est un composé de l'azote et de l'hydrogène avec la formule NH 3. Ce est un gaz incolore gaz avec une caractéristique âcre l'odorat. L'ammoniac contribue de manière significative aux nutritionnels besoins des organismes terrestres en servant comme un précurseur de la nourriture et des engrais . L'ammoniac, soit directement, soit indirectement, est aussi un élément constitutif pour la synthèse de nombreux produits pharmaceutiques et est utilisé dans de nombreux produits de nettoyage commercial. Bien que largement utilisé, l'ammoniac est à la fois caustique et dangereux. La production mondiale d'ammoniac pour 2012 est prévu pour être 198 millions de tonnes, une augmentation de 35% par rapport à l'estimé 2006 la production mondiale de 146,5 millions de tonnes.
L'ammoniac, tel qu'il est utilisé dans le commerce, est souvent appelé ammoniac anhydre. Ce terme souligne l'absence d'eau dans le matériau. Parce que NH 3 bout à -33,34 ° C (-28,012 ° F) à une pression de 1 atmosphère, le liquide doit être stocké sous haute pression ou à basse température. l'ammoniac ou des ménages l'hydroxyde d'ammonium est une solution de NH 3 dans l'eau. La concentration de ces solutions est mesuré en unités de la Échelle Baumé ( densité ), avec 26 degrés Baumé (environ 30% (en poids) de l'ammoniac à 15,5 ° C) étant le produit commercial de haute concentration typique.
Occurrence naturelle
L'ammoniac se trouve à l'état de traces dans l'atmosphère, étant produite à partir de la putréfaction (processus de décomposition) de l'animal azotées et matières végétales. les sels d'ammoniac et d'ammonium sont également présents en petites quantités dans l'eau de pluie, alors que chlorure d'ammonium (sel ammoniac), et sulfate d'ammonium se trouvent dans les districts volcaniques; cristaux de le bicarbonate d'ammonium ont été trouvées dans Patagonie guano. Les reins sécrètent NH 3 pour neutraliser l'excès d'acide. Les sels d'ammonium sont également trouvés distribués par tous les sols fertiles et en eau de mer. Substances contenant de l'ammoniac, ou ceux qui sont semblable à elle, sont appelés ammoniacal. L'ammoniac se trouve sur Pluton , Jupiter et, en petites quantités, sur Uranus .
Propriétés
L'ammoniac est un gaz incolore gaz avec une odeur piquante caractéristique. C'est plus léger que l'air, sa densité étant 0,589 fois celle de l'air . Il est facile à liquéfier en raison de la forte liaison hydrogène entre les molécules; le liquide qui bout à -33,3 ° C et gèle à -77,7 ° C en cristaux blancs.
L'ammoniac peut être commodément désodorisée en la faisant réagir avec soit du bicarbonate de sodium ou l'acide acétique. Ces deux réactions former un sel d'ammonium inodore.
- Solide
- La symétrie du cristal est cubique, Pearson symbole CP16, groupe d'espace P2 1 3 No.198, constante de réseau 0,5125 nm.
- Liquide
- Liquid ammoniac possède de fortes ionisants pouvoirs reflétant sa haute ε de 22 ammoniac liquide a une très haute changement enthalpie standard de vaporisation (23,35 kJ / mol, cf. l'eau 40,65 kJ / mol, le méthane 8,19 kJ / mol, phosphine 14,6 kJ / mol) et peut donc être utilisé dans les laboratoires dans les vaisseaux non isolés sans réfrigération supplémentaire. Voir également la section de l'ammoniac liquide comme solvant .
- Propriétés de solvant
- L'ammoniac est miscible à l'eau. Dans une solution aqueuse, il peut être chassé par ébullition. Le aqueuse est une solution d'ammoniaque de base. La concentration maximale d'ammoniac dans l'eau (a solution saturée) a une densité de 0,880 g / cm 3 et est souvent appelé «ammoniac 0,880. L'ammoniac ne brûle pas facilement ou soutenir combustion, sauf dans des mélanges carburant-air étroites de 15-25% d'air.
- Combustion
- Lorsque mélangé avec l'oxygène , il brûle avec une flamme jaune-vert pâle. A haute température et en présence d'un catalyseur approprié, de l'ammoniaque est décomposé en ses éléments constitutifs. Allumage se produit lorsque le chlore est passé dans l'ammoniac, l'azote et former le chlorure d'hydrogène; si le chlore est présent en excès, le très explosif trichlorure d'azote (NCl 3) est également formé.
Structure
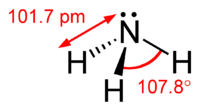
La molécule d'ammoniac a un forme de pyramide trigonale avec un angle de liaison de 107,8 °, comme prévu par la valence électronique shell théorie paire de répulsion (théorie VSEPR). L'atome d'azote central a cinq électrons externes avec un électron supplémentaire de chaque atome d'hydrogène. Cela donne un total de huit électrons ou quatre paires d'électrons qui sont disposés tétraédrique. Trois de ces paires d'électrons sont utilisés comme paires d'obligations, ce qui laisse une paire d'électrons. La paire d'électrons repousser plus fortement que les paires d'obligations, donc l'angle de la liaison ne est pas 109,5 °, comme prévu pour un arrangement tétraédrique régulière, mais est mesurée à 107,8 °. L'atome d'azote dans la molécule a une paire électron célibataire, ce qui rend l'ammoniac une base, d'un accepteur de protons. Cette forme donne la molécule un moment dipolaire et rend polaire. La polarité de la molécule et, surtout, sa capacité à former des liaisons hydrogène, de l'ammoniac rend hautement miscible avec l'eau . L'ammoniac est modérément basique, une solution aqueuse à 1,0 M ayant un pH de 11,6 et, si un acide fort est ajouté à cette solution jusqu'à ce que la solution soit neutre (pH = 7), 99,4% des molécules d'ammoniac sont protonée. Température et salinité affecte également la proportion de NH 4 +. Ce dernier a la forme d'un régulière tétraèdre et est isoélectronique avec le méthane . Il est connu pour avoir la plus grande la capacité de chaleur spécifique d'une substance.
La molécule d'ammoniac subit facilement inversion d'azote à la température ambiante; une analogie utile est un parapluie se tournant à l'intérieur dans un vent fort. La barrière d'énergie à cette inversion est de 24,7 kJ / mol, et la fréquence de résonance est 23,79 GHz, correspondant à d'un rayonnement micro-ondes longueur d'onde de 1,260 cm. L'absorption à cette fréquence était la première spectre de micro-ondes à observer.
Basicité
Une des propriétés les plus caractéristiques de l'ammoniac est sa basicité. Il se combine avec les acides pour former des sels ; ainsi avec de l'acide chlorhydrique qu'elle forme chlorure d'ammonium (sel ammoniac); avec l'acide nitrique , nitrate d'ammonium, etc. Cependant, l'ammoniac parfaitement sec ne sera pas combiner avec parfaitement sec le chlorure d'hydrogène; l'humidité est nécessaire pour provoquer la réaction. Comme expérience de démonstration, ouvert bouteilles de l'ammoniaque concentrée et chlorhydrique nuages de chlorure d'ammonium, produisent des acides qui semblent apparaître "à partir de rien», comme les formes de sel où les deux nuages de diffusion de molécules se rencontrent, quelque part entre les deux bouteilles.
- NH 3 + HCl → NH 4 Cl
Les sels obtenus par action d'ammoniac sur des acides sont connus comme le les sels d'ammonium et contiennent tous le ion ammonium (NH 4 +). Diluer l'ammoniaque aqueuse peut être appliquée sur la peau pour atténuer les effets des venins d'animaux, tels que les acides des insectes et méduses.
La basicité de l'ammoniac est également la base de sa toxicité et de son utilisation en tant que nettoyeur .
- En créant une solution avec un pH beaucoup plus élevé que une solution aqueuse neutre, des protéines ( enzymes) se dénaturer, conduisant à des dommages cellulaires, la mort de la cellule, et finalement la mort de l'organisme.
- La saleté se compose souvent de graisses et d'huiles, qui sont peu solubles dans l'eau. Ammoniac les met en solution aqueuse. L'eau restante, contenant également un excès d'ammoniac, se évapore complètement, laissant une surface propre.
Acidité
Bien que l'ammoniac est bien connu comme une base faible, il peut aussi agir comme un acide extrêmement faible. Ce est une substance protique et est capable de formation de amides (qui contiennent le NH 2 - ion). Par exemple, le lithium se dissout dans de l'ammoniac liquide pour obtenir une solution de amide de lithium:
- Li 2 + 2 NH 3 → 2 LiNH 2 + H 2
Auto-dissociation
Comme l'eau, de l'ammoniac subit autoionisation moléculaire pour former ses acides et de bases conjugués:
- 2 NH 3 (aq)
 NH +
NH +
4 (aq) + NH -
2 (aq)
À pression et température standard, K = [NH +
4] [NH -
2] = 10 -30
Combustion
La combustion de l'ammoniac en azote et en eau est exothermique:
- 4 NH 3 + 3 O 2 → 2 N 2 + 6 H 2 O (g) ( Δ H ° r = -1267,20 kJ / mole)
Le changement enthalpie standard de la combustion, Δ H ° c, exprimée par mole d'ammoniac et la condensation de l'eau formée, est de -382,81 kJ / mol. Diazote est le produit thermodynamique de la combustion: tous les oxydes d'azote sont instables par rapport à l'azote et l'oxygène , qui est le principe de la convertisseur catalytique. Cependant, les oxydes d'azote peuvent être formés en tant que produits de cinétique en présence de catalyseurs appropriés, une réaction de grande importance industrielle dans la production d' acide nitrique :
- 4 NH 3 + 5 O 2 → 4 NO + 6 H 2 O
Une réaction ultérieure conduit à l'eau et NO 2
- 2 NO + O 2 → 2 NO 2
La combustion de l'ammoniac dans l'air est très difficile, en l'absence d'un catalyseur (tel que le platine gaze), lorsque la température de la flamme est généralement inférieure à la température d'inflammation du mélange air-ammoniac. La plage d'inflammabilité de l'ammoniac dans l'air est de 16 à 25%.
Formation d'autres composés
Dans la chimie organique , de l'ammoniac peut agir comme un nucléophile en substitution des réactions. Les amines peuvent être formés par la réaction de l'ammoniac avec des halogénures d'alkyle, bien que le groupe -NH 2 en résulte est aussi nucléophile et secondaires et les amines tertiaires sont souvent formés comme sous-produits. Un excès d'ammoniac contribue à minimiser substitution multiple, et neutralise la l'halogénure d'hydrogène formé. La méthylamine est préparé industriellement par la réaction de l'ammoniac avec chlorométhane, et la réaction de l'ammoniac avec de l'acide 2-bromopropanoic a été utilisé pour préparer racémique alanine dans un rendement de 70%. L'éthanolamine est préparé par une réaction d'ouverture de cycle avec oxyde d'éthylène: la réaction est parfois autorisé à aller plus loin pour produire la diéthanolamine et triéthanolamine.
Les amides peuvent être préparés par la réaction d'ammoniac avec un certain nombre d' acides carboxyliques dérivés. des chlorures d'acyle sont le plus réactif, mais l'ammoniac doivent être présents dans au moins un double excès pour neutraliser la le chlorure d'hydrogène formé. Esters et anhydrides réagissent également avec l'ammoniac pour former des amides. Les sels d'ammonium d'acides carboxyliques peuvent être déshydraté pour amides tant qu'il n'y a pas thermiquement groupes sensibles présents: des températures de 150 à 200 ° C sont nécessaires.
L'hydrogène en ammoniac est capable de remplacement par des métaux , ainsi magnésium brûle dans le gaz avec formation de nitrure de magnésium Mg 3 N 2, et lorsque le gaz est passé sur chauffée sodium ou de potassium , sodamide, NaNH2 et potassamide, KNH2, sont formés. Lorsque cela est nécessaire nomenclature substitutive , Recommandations IUPAC préfèrent le nom "Azane" à l'ammoniac: donc chloramine serait nommé "chloroazane" dans la nomenclature de substitution, pas "chloroammonia".
Ammoniac pentavalent est connu comme λ 5 amine, ou plus communément, ammonium hydrure. Ce solide cristallin ne est stable sous haute pression, et se décompose de nouveau dans trivalent ammoniaque et de l'hydrogène gazeux dans des conditions normales. Cette substance a été étudiée une fois comme un possible carburant de fusée solide en 1966.
L'ammoniac comme ligand
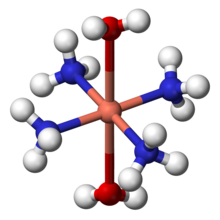
L'ammoniac peut agir en tant que ligand à métal de transition complexes. Il se agit d'un donneur σ-pure, au milieu de la spectrochimique série, et montre intermédiaire comportement dur-mou. Pour des raisons historiques, l'ammoniac est nommé ammine dans la nomenclature de composés de coordination. Certains complexes d'ammine notables comprennent tetraamminediaquacopper (II) ([Cu (NH 3) 4 (H 2 O) 2] 2+), un complexe bleu foncé formé par addition d'ammoniac à la solution de sels de cuivre (II). Il est connu que Le réactif de Schweizer. Diamminesilver (I) ([Ag (NH 3) 2] +) est l'espèce active dans Réaction de Tollens. Formation de ce complexe peut également aider à distinguer entre les précipités des différents halogénures d'argent: chlorure d'argent (AgCl) est soluble dans une solution diluée (2M) d'ammoniac, bromure d'argent (AgBr) ne est soluble dans une solution d'ammoniaque concentrée, alors que l'iodure d'argent (AgI) est insoluble dans l'ammoniaque aqueuse.
complexes ammine de chrome (III) ont été connus à la fin du 19ème siècle, et ont formé la base de Théorie révolutionnaire de Werner Alfred sur la structure des composés de coordination. Werner a noté que deux isomères (fac - et mer -) du complexe [CrCl 3 (NH 3) 3] pourrait être formé, et a conclu les ligands doivent être disposés autour de l'ion métallique à la sommets d'un octaèdre . Cette proposition a été confirmée depuis par Cristallographie aux rayons X.
Un ligand ammine lié à un ion métallique est nettement plus acide que une molécule d'ammoniac libre, bien que la déprotonation en solution aqueuse est encore rare. Un exemple est le réaction de calomel, dans lequel le composé résultant amidomercury (II) est fortement insoluble.
- Hg 2 Cl 2 + 2 NH 3 → Hg + HgCl (NH 2) + NH 4 + + Cl -
Détection et de détermination
les sels d'ammoniac et d'ammonium peuvent être facilement détectées, sous forme de traces infimes, par l'addition de La solution de Nessler, ce qui donne une coloration jaune distincte en présence de la moindre trace de sels d'ammonium ou d'ammonium. bâtons de soufre sont brûlés pour détecter de petites fuites dans les systèmes de réfrigération d'ammoniaque industrielle. De plus grandes quantités peuvent être détectées en chauffant les sels avec un alcali caustique ou avec la chaux vive, lorsque l'odeur caractéristique de l'ammoniac sera à la fois apparente. La quantité d'ammoniac dans les sels d'ammonium peut être estimé quantitativement par distillation des sels formés avec le sodium ou l'hydroxyde de potassium, l'ammoniac dégagé est absorbé dans un volume connu de type acide sulfurique et l'excès d'acide détermine ensuite volumétrique; ou l'ammoniac peut être absorbé dans l'acide chlorhydrique et le chlorure d'ammonium ainsi formé précipite sous forme hexachloroplatinate d'ammonium, (NH 4) 2 PtCl 6.
Azote ammoniacal (NH 3 -N)
Azote ammoniacal (NH 3 -N) est une mesure couramment utilisée pour tester la quantité de Les ions ammonium, d'origine naturelle parmi l'ammoniac, l'ammoniac et renvoyés à travers des processus biologiques, dans des liquides de l'eau ou des déchets. Ce est une mesure utilisée principalement pour quantifier les valeurs dans le traitement des déchets et des systèmes de purification d'eau, ainsi que d'une mesure de la santé des réserves d'eau naturelles ou d'origine humaine. Il est mesuré en unités de mg / L ( milligramme par litre).
Histoire

Les Romains appelaient les dépôts de chlorure d'ammonium qu'ils ont recueillis à partir près du temple de Amon ( grec Ἄμμων Ammon) dans ancienne Libye 'ammoniacus sal (sel d'Amon) en raison de la proximité du temple à proximité. Les sels d'ammoniac ont été connus depuis très longtemps; d'où le terme Hammoniacus sal apparaît dans les écrits de Pline, même si on ne sait pas si le terme est identique avec le sel ammoniac plus moderne ( le chlorure d'ammonium).
Dans la forme de sel ammoniac (NÜSHADIR) ammoniac était important pour les Alchimistes musulmans dès le 8ème siècle, d'abord mentionné par le chimiste Persique Jabir Ibn Hayyan, et les européens alchimistes depuis le 13ème siècle, étant communiquée par Albertus Magnus. Il a également été utilisé par teinturiers dans les Moyen-Age sous la forme d'fermenté urine de modifier la couleur des colorants végétaux. Au 15ème siècle, Basile Valentin a montré que l'ammoniac peut être obtenu par action de bases sur le sel ammoniac. A une période plus tard, quand le sel ammoniac a été obtenue par distillation les sabots et les cornes de bœufs et de neutraliser le carbonate résultant avec de l'acide chlorhydrique , le nom "esprit de corne de cerf" a été appliquée à l'ammoniac.
L'ammoniac gazeux a d'abord été isolé par Joseph Priestley en 1774 et a été appelé par lui «l'air alcaline". Onze ans plus tard en 1785, Claude Louis Berthollet déterminé sa composition.
Le Procédé Haber-Bosch ammoniac pour produire de l'azote de l'air a été développé par Fritz Haber et Carl Bosch en 1909 et breveté en 1910. Il a été utilisé pour la première à l'échelle industrielle par les Allemands pendant la Première Guerre mondiale , suite au blocus allié qui a coupé l'alimentation en nitrates à partir de Chili . L'ammoniac a été utilisé pour produire des explosifs pour soutenir leur effort de guerre.
Avant la disponibilité du gaz naturel pas cher, de l'hydrogène comme un précurseur de la production d'ammoniac a été produit par la électrolyse de l'eau ou en utilisant le processus de chlore-alcali.
Utilisations
Engrais
Environ 83% (en 2004) de l'ammoniac est utilisé comme engrais soit que ses sels, solutions ou anhydres. Lorsqu'il est appliqué sur le sol, il permet d'obtenir des rendements accrus de cultures telles que le maïs et le blé. 30% de l'azote agricole appliquée aux Etats-Unis est sous la forme d'ammoniac anhydre et à travers le monde 110m tonnes sont appliquées chaque année.
Précurseur de composés azotés
L'ammoniac est directement ou indirectement le précurseur de la plupart des composés contenant de l'azote. Pratiquement tous les composés azotés synthétiques sont dérivés de l'ammoniac. Un dérivé important est l'acide nitrique . Ce matériau clé est générée via le Procédé Ostwald par oxydation de l'ammoniac avec de l'air sur une platine catalyseur à 700-850 ° C, ~ 9 atm. L'oxyde nitrique est un intermédiaire dans cette conversion:
- NH 3 + O 2 → 2 HNO 3 + H 2 O
L'acide nitrique est utilisé pour la production d' engrais , explosifs, et de nombreux composés organiques azotés.
Nettoyeur
ammoniac des ménages est une solution de NH 3 dans l'eau (ce est à dire, l'hydroxyde d'ammonium) utilisé comme un nettoyant à usage général pour de nombreuses surfaces. Parce que les résultats d'ammoniac dans un éclat relativement sans laisser de traces, l'une de ses utilisations les plus courantes consiste à nettoyer le verre, la porcelaine et en acier inoxydable. Il est également fréquemment utilisé pour le nettoyage des fours et le trempage articles pour desserrer cuite sur la crasse. l'ammoniac est compris dans des ménages concentration en poids de 5 à 10% d'ammoniac.
Fermentation
Solutions d'ammoniac allant de 16% à 25% sont utilisés dans la industrie de la fermentation comme source d'azote pour les micro-organismes et à ajuster le pH pendant la fermentation.
Agent antimicrobien pour les produits alimentaires
Déjà en 1895, il était connu que l'ammoniac était «fortement antiseptique ... il faut 1,4 grammes par litre de préserver boeuf thé. "L'ammoniac anhydre a été montré efficace comme agent antimicrobien pour l'alimentation animale et qui est actuellement utilisé commercialement pour réduire ou éliminer la contamination microbienne des boeuf . Le New York Times a rapporté en Octobre 2009 sur une société américaine, Beef Products Inc., qui tourne gras parures de bœuf, avec une moyenne entre 50 et 70 pour cent de matières grasses, en sept millions de livres par semaine de bœuf maigre finement texturée («slime rose") en enlevant la graisse utilisant la chaleur et centrifugation, puis désinfecter le produit maigre avec de l'ammoniac; le processus a été évaluée par la US Department of Agriculture aussi efficace et sûre sur la base d'une étude (financée par Beef Products) qui a révélé que le traitement réduit E. coli à des niveaux indétectables. Une enquête plus poussée par le New York Times publié en Décembre 2009 a révélé des problèmes de sécurité sur le processus ainsi que les plaintes des consommateurs concernant le goût et l'odeur de la viande bovine traitée à des niveaux optimaux d'ammoniac. La semaine suivante, le journal a publié un éditorial, "Plus périls de la viande hachée", réitérant les préoccupations posées dans l'article de nouvelles. Plusieurs jours plus tard, l'éditorial a été ajouté avec une rétraction, précisant qu'elle avait erronément déclaré qu'il y avait eu deux rappels de viande hachée en raison de ce processus, et "Pas de viande produite par Beef Products Inc. a été liée à des maladies ou des épidémies."
Utilisations mineures et émergents
Réfrigération - R717
En raison des propriétés de vaporisation de l'ammoniac, il est utile une réfrigérant. Il a été couramment utilisé avant la popularisation de chlorofluorocarbones (fréon). L'ammoniac anhydre est largement utilisé dans les applications de réfrigération industrielle et les patinoires de hockey en raison de sa haute l'efficacité énergétique et un faible coût. Cependant, il souffre des inconvénients de toxicité, qui limitent son utilisation à l'échelle nationale et petite. En plus de son utilisation dans moderne la réfrigération à compression de vapeur, il a été utilisé en mélange avec de l'hydrogène et de l'eau dans les réfrigérateurs à absorption. Le Cycle de Kalina, qui est d'une importance croissante pour les centrales géothermiques, dépend de la plage d'ébullition large du mélange ammoniac-eau.
Comme carburant


L'ammoniac a été utilisé pendant la Seconde Guerre mondiale aux autobus électriques en Belgique, et dans des applications de moteur et de l'énergie solaire avant 1900. ammoniac liquide a également alimenté la Réaction moteur-fusée Motors XLR99, qui a alimenté la X-15 avions de recherche hypersonique. Bien que pas aussi puissant que d'autres combustibles, il n'a laissé aucune suie dans le moteur-fusée réutilisable et sa densité correspond approximativement à la densité de l'oxydant, l'oxygène liquide, qui a simplifié la conception de l'avion.
L'ammoniac a été proposée comme une alternative pratique à combustible fossile pour moteurs à combustion interne. Le pouvoir calorifique de l'ammoniac est de 22,5 MJ / kg (9690 BTU / lb), ce qui est environ la moitié de celle du diesel. Dans un moteur normale, dans lequel la vapeur d'eau ne est pas condensée, la valeur calorifique de l'ammoniac sera d'environ 21% inférieure à ce chiffre. Il peut être utilisé dans les moteurs existants, avec seulement des modifications mineures de carburateurs / injecteurs.
Pour répondre à ces exigences, un capital important serait nécessaire pour augmenter les niveaux de production actuels. Bien que le deuxième produit chimique le plus, l'échelle de production d'ammoniac est une petite fraction de la consommation de pétrole du monde. Il peut être fabriqué à partir de sources d'énergie renouvelables, ainsi que du charbon ou de l'énergie nucléaire. Il est, cependant, nettement moins efficaces que les batteries. Le barrage de 60 MW dans Rjukan Telemark, Norvège produit de l'ammoniac par électrolyse de l'eau pour de nombreuses années à partir de 1913 la production d'engrais pour une grande partie de l'Europe. Si produite à partir du charbon, du CO 2 peut être facilement séquestré (les produits de combustion sont l'azote et de l'eau). En 1981, une entreprise canadienne a converti une Chevrolet Impala 1981 à fonctionner en utilisant l'ammoniac comme combustible.
moteurs d'ammoniac ou des moteurs d'ammoniac, en utilisant l'ammoniac comme fluide de travail, ont été proposées et utilisées occasionnellement. Le principe est similaire à celui utilisé dans un locomotive sans feu, mais avec de l'ammoniac comme fluide de travail, plutôt que de la vapeur ou de l'air comprimé. moteurs d'ammoniac ont été utilisés expérimentalement dans le 19ème siècle par Goldsworthy Gurney au Royaume-Uni et tramways dans la Nouvelle-Orléans.
En tant que stimulant

L'ammoniac a trouvé une utilisation importante dans divers sports - en particulier les sports de force de haltérophilie et Haltérophilie comme un stimulant respiratoire. L'ammoniac est couramment utilisé dans la fabrication illicite de méthamphétamine à travers un Réduction de Birch, le procédé de fabrication Birch méthamphétamine est dangereuse parce que le métal alcalin et l'ammoniac liquide sont tous deux extrêmement réactif, et la température de l'ammoniac liquide rend sensibles à ébullition explosive lorsque des réactifs sont ajoutés.
Textile
Ammoniaque liquide est utilisé pour le traitement de matériaux de coton, donnent une biens similaires mercerisage utilisant alcalis. En particulier, il est utilisé pour le prélavage de la laine.
Gaz de levage
A température et pression normales, l'ammoniac est moins dense que l'atmosphère, et a environ 60% de la puissance de levage de l'hydrogène ou de l'hélium. L'ammoniac a parfois été utilisé pour remplir des ballons météorologiques comme un gaz de gonflage. En raison de son point d'ébullition relativement élevé (par rapport à l'hélium et de l'hydrogène), de l'ammoniaque pourrait être réfrigéré et liquéfié à bord d'un aéronef pour réduire la portance et ajouter ballast (et retourné à un gaz d'ajouter ascenseur et réduire ballast).
Travail du bois
L'ammoniac a été utilisé pour assombrir chêne blanc quartersawn dans Arts & Crafts et des meubles de style Mission. Les vapeurs d'ammoniac réagissent avec les tanins naturels dans le bois et l'amener à changer les couleurs.
Consignes de sécurité
Les É.U Sécurité et administration de la santé au travail (OSHA) a fixé une limite d'exposition de 15 minutes pour l'ammoniac gazeux de 35 ppm en volume dans l'air ambiant et une limite d'exposition de 8 heures de 25 ppm en volume. NIOSH a récemment réduit l'IDLH 500-300 basée sur des interprétations plus conservatrices récents de la recherche originale en 1943. DIVS (danger immédiat pour la vie et la santé) est le niveau auquel un travailleur en bonne santé peut être exposé pendant 30 minutes sans souffrir d'effets irréversibles sur la santé. D'autres organisations ont différents niveaux d'exposition. Normes US Navy [US Bureau of Ships 1962] concentrations maximales admissibles (CMA): exposition continue (60 jours): 25 ppm / 1 heure: 400 vapeur ppm d'ammoniac a un irritant, odeur âcre, piquante qui agit comme un avertissement de potentiellement dangereux exposition. Le seuil d'odeur moyenne est de 5 ppm, bien en dessous de tout danger ou de dommages. L'exposition à des concentrations très élevées d'ammoniac gazeux peut entraîner des lésions pulmonaires et la mort. Bien que l'ammoniac est réglementée dans les États-Unis comme un gaz non inflammable, il répond toujours à la définition d'un matériau qui est toxique par inhalation et nécessite un permis de sécurité dangereux lorsqu'il est transporté en quantités supérieures à 13 248 L (3500 gallons).
Toxicité
La toxicité des solutions d'ammoniac ne provoque généralement pas de problèmes pour l'homme et d'autres mammifères, comme il existe un mécanisme spécifique pour éviter son accumulation dans le sang. L'ammoniac est converti en carbamoyl phosphate par l'enzyme carbamoyle synthétase phosphate, puis pénètre dans la cycle de l'urée, soit d'être incorporés dans des acides aminés ou excrétée dans l'urine. Cependant, les poissons et amphibiens manquent de ce mécanisme, car ils peuvent habituellement éliminer l'ammoniac à partir de leur corps par l'excrétion directe. Ammoniac même à des concentrations diluées est hautement toxique pour les animaux aquatiques, et pour cette raison il est classées comme dangereuses pour l'environnement.
Stockage de l'information
Similaire à propane , l'ammoniac anhydre ébullition inférieur à la température ambiante. Un récipient de stockage apte à 250 psi est adapté pour contenir le liquide. Les composés d'ammonium ne devraient jamais être autorisés à entrer en contact avec bases (moins que dans une réaction prévu et contenu), quantités dangereuses de gaz d'ammoniac pourraient être libérés.
l'utilisation des ménages
Solutions d'ammoniac (5-10% en poids) sont utilisés comme produits d'entretien ménager, en particulier pour le verre. Ces solutions sont irritantes pour les yeux et muqueuses (respiratoires et digestives), et dans une moindre mesure la peau. La prudence devrait être utilisé que le produit chimique ne est jamais mélangé dans ne importe quelle eau de Javel liquide ou un gaz toxique peut entraîner. Le mélange avec du chlore produits -containing ou oxydants forts, tels que ménage l'eau de Javel, peut conduire à des composés dangereux tels que chloramines.
l'utilisation en laboratoire de solutions d'ammoniac

Les risques de solutions d'ammoniac dépend de la concentration: "diluer" des solutions d'ammoniac sont généralement de 5 à 10% en poids (<5,62 mol / L); Solutions «concentré» sont habituellement préparés à> 25% en poids. A 25% (en poids) de la solution a une densité de 0,907 g / cm 3, et une solution qui a une densité plus faible sera plus concentré. Le Classement Union européenne de solutions d'ammoniac est donnée dans le tableau.
| Concentration en poids (p / p) | Molarité | Concentration masse / volume (p / v) | Classification | Phrases R |
|---|---|---|---|---|
| 5-10% | 2,87 à 5,62 mol / L | De 48,9 à 95,7 g / L | Irritant (Xi) | R36 / 37/38 |
| 10 à 25% | 5,62 à 13,29 mol / L | De 95,7 à 226,3 g / L | Corrosif (C) | R34 |
| > 25% | > 13,29 mol / L | > 226,3 g / L | Corrosif (C) Dangereux pour l'environnement (N) | R34, R50 |
- S-Phrases: (S1 / 2), S16, S36 / 37/39, S45, S61.
La vapeur d'ammoniac à partir de solutions concentrées d'ammoniac est sévèrement irritante pour les yeux et les voies respiratoires, et ces solutions devraient uniquement être manipulés dans une hotte. Solutions saturées ("0,880") peuvent développer une pression importante à l'intérieur d'une bouteille fermée par temps chaud, et la bouteille doit être ouvert avec soin; ce ne est généralement pas un problème pour 25% des solutions ("0,900").
Les solutions d'ammoniac ne doivent pas être mélangés avec les halogènes , comme des produits toxiques et / ou explosives sont formés. Un contact prolongé de solutions d'ammoniac avec l'argent , le mercure ou sels d'iodure peuvent également conduire à des produits explosifs: ces mélanges sont souvent formés dans analyse qualitative inorganique, et devrait être légèrement acidifiée mais pas concentré (<6% p / v) avant leur élimination une fois que le test est terminé.
utilisation en laboratoire de l'ammoniac anhydre (gaz ou liquide)
L'ammoniac anhydre est classé comme toxique (T) et dangereux pour l'environnement (N). Le gaz est inflammable ( la température d'auto-inflammation: 651 ° C) et peut former des mélanges explosifs avec l'air (16-25%). Le limite d'exposition admissible (PEL) aux États-Unis est de 50 ppm (35 mg / m 3), tandis que le IDLH est estimé à 300 ppm. L'exposition répétée à l'ammoniac diminue la sensibilité à l'odeur du gaz: normalement l'odeur est détectable à des concentrations inférieures à 50 ppm, mais les individus désensibilisées peut pas le détecter, même à des concentrations de 100 ppm. L'ammoniac anhydre corrode le cuivre - et de zinc -d'une alliages, etc. des raccords en laiton ne doivent pas être utilisés pour le traitement du gaz. Ammoniac liquide peut aussi attaquer le caoutchouc et certains plastiques.
L'ammoniac réagit violemment avec les halogènes. Triiodure d'azote, un primaire explosif, est formé lorsque l'ammoniac entre en contact avec de l'iode . L'ammoniac provoque l'explosif polymérisation de l'oxyde d'éthylène. Il forme aussi explosive fulminante composés avec des composés de l'or , l'argent , le mercure , le germanium ou du tellure , et avec stibine. Réactions violentes ont également été rapportés avec l'acétaldéhyde, solutions d'hypochlorite, ferricyanure de potassium et peroxydes.
Synthèse et production
En raison de ses nombreuses applications, l'ammoniac est l'un des produits chimiques inorganiques les plus hautement produites. Des dizaines d' usines chimiques dans le monde entier produire de l'ammoniac. Consommer plus de 1% de toute la puissance de l'homme, la production d'ammoniac est une composante importante du budget mondial de l'énergie. rapports de recherche de marché total de la production d'ammoniac en 2012 est de 198 millions de tonnes et devrait augmenter d'environ 35 millions de tonnes en 2019. La Chine a produit 28,4% de la production mondiale (de plus en plus à partir de charbon dans le cadre de l'urée de synthèse), suivie par l'Inde avec 8,6%, la Russie avec 8,4%, et le Royaume-Unis avec 8,2%. Environ 80% ou plus de l'ammoniac produit est utilisé pour la fertilisation de cultures agricoles.
Avant le début de la Première Guerre mondiale , la plupart de l'ammoniac a été obtenue par la distillation sèche de produits végétaux et de déchets d'origine animale azotés, y compris chameau bouse, où il a été distillé par la réduction de l'acide nitreux et des nitrites avec de l'hydrogène; en outre, il a été produit par la distillation du charbon , et aussi par la décomposition des sels d'ammonium par des hydroxydes alcalins tels que la chaux vive, le sel le plus généralement utilisé est le chlorure ( sel ammoniac) ainsi:
- NH 24Cl + CaCl 2 → CaO2+ Ca (OH)22 + NH3
L'hydrogène pour la synthèse de l'ammoniac peut également être produit de façon économique à l'aide de la réaction de gaz à l'eau suivie de la réaction de déplacement du gaz à l'eau, produit en faisant passer la vapeur à travers au rouge coke, pour donner un mélange de gaz d'hydrogène et de dioxyde de carbone, suivie de l'élimination du carbone dioxyde "lavage", le mélange de gaz avec de l'eau sous pression (25 atmosphères standard (2500 kPa)); ou en utilisant d'autres sources comme le charbon ou la gazéification du coke.
Usines d'ammoniac production modernes dépendent industriel de production d'hydrogène pour la réaction avec de l'azote atmosphérique en utilisant une magnétite catalyseur ou sur un catalyseur Fe promu sous haute pression (100 atmosphères normales (10 000 kPa)) et la température (450 ° C) pour former de l'ammoniac liquide anhydre. Cette étape est connue comme la boucle de synthèse d'ammoniac (également dénommé procédé Haber-Bosch):
- H 32N +2→ NH 23
L'hydrogène nécessaire à la synthèse de l'ammoniac peut aussi être produit en utilisant économiquement d'autres sources comme le charbon ou la gazéification du coke ou moins économiquement de l'électrolyse de l'eau en oxygène + hydrogène et d'autres solutions de rechange qui sont actuellement peu pratique à grande échelle. À une certaine époque, la plupart des ammoniaque de l'Europe a été produite à partir de l'usine Hydro au Vemork, par voie d'électrolyse. Diverses sources d'électricité renouvelables d'énergie sont aussi potentiellement applicable.
L'ammoniac liquide en tant que solvant
L'ammoniaque liquide est le solvant ionisant non aqueux plus connu et le plus largement étudié. Sa propriété la plus remarquable est sa capacité à dissoudre les métaux alcalins pour former des solutions très colorées, conductrices de l'électricité contenant électrons solvatés. En dehors de ces solutions remarquables, une grande partie de la composition chimique dans l'ammoniac liquide peuvent être classées par analogie avec des réactions apparentées dans des solutions aqueuses. Comparaison des propriétés physiques de NH 3 avec celles de l'eau montre NH 3 a le point de fusion inférieur, point d'ébullition, la densité, la viscosité, la constante diélectrique et la conductivité électrique; cela est dû au moins en partie à la plus faible en liaison H NH 3 et parce qu'une telle liaison ne peut pas former des réseaux réticulés, NH puisque chaque 3 molécule ne dispose que d'une seule paire d'électrons par rapport aux deux H pour chaque 2 molécule d'O. L'auto-ionique constante de dissociation de NH liquide 3 à -50 ° C est d'environ 10 -33 mol 2 · l -2 .
Solubilité des sels
| Solubilité (g de sel par 100 g de liquide NH3) | |
|---|---|
| L'acétate d'ammonium | 253,2 |
| Le nitrate d'ammonium | 389,6 |
| nitrate de lithium | 243,7 |
| Le nitrate de sodium | 97,6 |
| Le nitrate de potassium | 10,4 |
| Le fluorure de sodium | 0,35 |
| Le chlorure de sodium | 157,0 |
| bromure de sodium | 138,0 |
| L'iodure de sodium | 161,9 |
| thiocyanate de sodium | 205,5 |
L'ammoniaque liquide est un solvant ionisant, mais moins que l'eau, et se dissout une gamme de composés ioniques, y compris de nombreux nitrates , nitrites, cyanures et thiocyanates. La plupart des sels d'ammonium sont solubles et agissent comme des acides dans des solutions d'ammoniac liquide. La solubilité des sels d'halogénure augmente à partir de fluorure de iodure. Une solution saturée de nitrate d'ammonium contient soluté 0,83 mole par mole d'ammoniac et a une pression de vapeur inférieure à 1 bar, même à 25 ° C (77 ° F) .
Solutions de métaux
L'ammoniac liquide va se dissoudre les métaux alcalins et les autres métaux électropositifs tels que magnésium , calcium , strontium , baryum , l'europium et l'ytterbium . A de faibles concentrations (<0,06 mol / l), les solutions sont formés d'un bleu profond: ceux-ci contiennent des cations métalliques et des électrons solvatés électrons libres, qui sont entourés par une cage de molécules d'ammoniac.
Ces solutions sont très utiles comme agents réducteurs forts. A des concentrations plus élevées, les solutions sont d'aspect métallique et la conductivité électrique. A basse température, les deux types de solutions peuvent coexister comme phases non miscibles.
Propriétés redox de l'ammoniac liquide
| E° (V, ammoniac) | E° (V, de l'eau) | |
|---|---|---|
| Li++ e- ⇌Li | -2,24 | -3.04 |
| K++ e- ⇌K | -1.98 | -2.93 |
| Na++ e- ⇌Na | -1.85 | -2,71 |
| Zn2++ 2e- ⇌Zn | -0.53 | -0.76 |
| NH4 ++ e- ⇌½ H2+ NH3 | 0,00 | - |
| Cu2++ 2e- ⇌Cu | 0,43 | 0,34 |
| Ag++ e- ⇌Ag | 0,83 | 0,80 |
La gamme de stabilité thermodynamique des solutions d'ammoniac liquide est très étroite, que le potentiel d'oxydation de diazote, E ° (N 2 + 6NH 4 + + 6e - ⇌ 8NH 3 ), est seulement 0,04 V. Dans la pratique, à la fois à l'oxydation de diazote et de la réduction de dihydrogène sont lents. Ceci est particulièrement vrai pour réduire solutions: les solutions de métaux alcalins mentionnés ci-dessus sont stables pendant plusieurs jours, à décomposer lentement à la amide de métal et le dihydrogénophosphate. La plupart des études portant sur des solutions d'ammoniac liquide sont effectués dans des conditions réductrices; Bien que l'oxydation de l'ammoniac liquide est généralement lente, il ya toujours un risque d'explosion, en particulier si des ions de métaux de transition sont présents en tant que catalyseurs possibles.
Le rôle de l'ammoniac dans les systèmes biologiques et les maladies humaines
L'ammoniac est une importante source d'azote pour les systèmes vivants. Bien que l'azote atmosphérique abonde (plus de 75%), quelques créatures vivantes sont capables d'utiliser cet azote. L'azote est nécessaire pour la synthèse d'acides aminés, qui sont les éléments constitutifs des protéines . Certaines plantes comptent sur l'ammoniac et d'autres déchets azotés incorporés dans le sol par décomposition de la matière. D'autres, comme la fixation de l'azote des légumineuses, de bénéficier de relations symbiotiques avec les rhizobiums qui créent ammoniac à partir de l'azote atmosphérique.
Biosynthèse
Dans certains organismes, l'ammoniac est produit à partir de l'azote atmosphérique par des enzymes appelées nitrogénases. L'ensemble du processus est appelé fixation de l'azote . Bien qu'il soit peu probable que les méthodes biomimétiques qui sont compétitifs avec le procédé Haber seront développés, effort intense a été dirigée vers la compréhension du mécanisme de la fixation biologique de l'azote. L'intérêt scientifique de ce problème est motivé par la structure inhabituelle du site actif de l'enzyme, qui est constitué d'un alliage Fe 7 MoS 9 ensemble.
L'ammoniac est également un produit métabolique de l'acide aminé désamination catalysée par des enzymes telles que la glutamate déshydrogénase 1. L'ammoniac est commun excrétion chez les animaux aquatiques. Chez l'homme, il est rapidement converti en urée , qui est beaucoup moins toxique, en particulier moins de base . Cette urée est un composant majeur du poids sec de l'urine. La plupart des reptiles, oiseaux, insectes, escargots et excrètent de l'acide urique uniquement comme déchets azotés.
En physiologie
Ammoniac joue également un rôle à la fois animal normal et anormal physiologie. Il est biosynthétisé par le métabolisme d'acides aminés normale et est toxique à des concentrations élevées. Le foie convertit l'ammoniac en urée à travers une série de réactions connues comme le cycle de l'urée. dysfonctionnement du foie, telles que celle observée dans la cirrhose, peut conduire à des quantités élevées d'ammoniac dans le sang ( de Hyperammonemia ). De même, des défauts dans les enzymes responsables de cycle de l'urée, tels que l'ornithine transcarbamylase, conduisent à une hyperammoniémie. Hyperammoniémie contribue à la confusion et le coma de l'encéphalopathie hépatique, ainsi que la maladie neurologique fréquente chez les personnes présentant des défauts de cycle de l'urée et aciduries organiques.
L'ammoniac est important pour l'équilibre acide animaux / de base normale. Après formation de l'ammonium à partir de la glutamine, la α-cétoglutarate peut être dégradé pour produire deux molécules de bicarbonate, qui sont alors disponibles sous forme de tampons pour les acides alimentaires. Ammonium est excrété dans l'urine, résultant en une perte nette d'acide. L'ammoniac peut se diffuser à travers les tubules rénaux, combiner avec un ion d'hydrogène, et permettre ainsi de plus l'excrétion d'acide.
Excrétion
Les ions ammonium sont un produit de déchets toxiques du métabolisme dans les animaux . Chez les poissons et les invertébrés aquatiques, il est excrété directement dans l'eau. Chez les mammifères, les amphibiens et les requins, il est converti dans le cycle de l'urée à l'urée , car il est moins toxique et peut être stocké de manière plus efficace. Chez les oiseaux, les reptiles, et les escargots terrestres, ammonium métabolique est converti en acide urique, qui est solide, et peut donc être excrété avec la perte d'eau minimale.
En astronomie
L'ammoniac a été détecté dans les atmosphères des géantes gazeuses , y compris les planètes Jupiter , ainsi que d'autres gaz comme le méthane, l'hydrogène et l'hélium . L'intérieur de Saturne peut inclure des cristaux congelés d'ammoniac. Il se trouve naturellement sur Deimos et Phobos - les deux lunes de Mars.
L'espace interstellaire
L'ammoniac a été détecté pour la première dans l'espace interstellaire en 1968, basée sur les émissions de micro-ondes de la direction du noyau galactique . Ce fut la première molécule polyatomique d'être ainsi détectée. La sensibilité de la molécule à un large éventail d'excitations et de la facilité avec laquelle il peut être observé dans un certain nombre de régions a fait l'ammoniac une des molécules les plus importantes pour les études de nuages moléculaires. L'intensité relative des raies d'ammoniac peut être utilisée pour mesurer la température du milieu électroluminescent.
L'espèce isotopique suivante de l'ammoniac ont été détectés:
- NH3,15NH3, NH2 D, NHD2, et ND3
La détection de triplement gaz ammoniac deutéré a été considérée comme une surprise que le deutérium est relativement rare. On pense que les conditions de basses températures permettent cette molécule de survivre et d'accumuler.
Depuis sa découverte interstellaire, NH 3 a prouvé être un outil précieux spectroscopique dans l'étude du milieu interstellaire. Avec un grand nombre de transitions sensibles à un large éventail de conditions d'excitation, NH 3 a été largement astronomique détecté - sa détection a été rapporté dans des centaines d'articles de journaux. Ci-dessous est un échantillon d'articles de revues qui met en évidence la gamme de détecteurs qui ont été utilisés pour identifier l'ammoniac.
L'étude de l'ammoniac interstellaire a été important pour un certain nombre de domaines de la recherche au cours des dernières décennies. Certains d'entre eux sont délimitées ci-dessous et impliquent principalement en utilisant l'ammoniac comme un thermomètre interstellaire.
Les mécanismes de formation interstellaires
L'abondance interstellaire pour l'ammoniac a été mesurée pour une variété d'environnements. Le [NH 3 ] / [H 2 rapport] a été estimé entre 10 -7 dans les petits nuages sombres jusqu'à 10 -5 dans le noyau dense du complexe moléculaire d'Orion Cloud. Bien qu'un total de 18 routes de production totaux ont été proposées, le mécanisme de formation principal interstellaire NH 3 est la réaction:
- NH4 ++ e-→ NH3+ H ·
La constante de vitesse, k , de cette réaction dépend de la température de l'environnement, avec une valeur de 5,2 x 10 -6 à 10 K. La constante de vitesse a été calculée à partir de la formule k = a (T / 300) B . Pour la réaction de formation primaire, un = 1,05 × 10 -6 et B = -0,47. En supposant un NH 4 + abondance de 3 × 10 -7 et une abondance d'électrons de 10 -7 typique des nuages moléculaires, la formation se fera à un taux de 1,6 × 10 -9 cm -3 s -1 dans un nuage moléculaire de densité totale 10 5 cm -3 .
Tous les autres réactions de formation proposées ont des constantes de vitesse comprise entre 2 et 13 ordres de grandeur plus petite, ce qui rend leur contribution à l'abondance de l'ammoniac relativement insignifiante. Comme un exemple de la contribution mineure réactions autre de formation jouent, la réaction:
- H2+ NH2→ NH3+ H
présente une constante de vitesse de 2,2 x 10 -15 . En supposant que H 2 densités de 10 5 et NH 2 / H 2 ratio de 10 -7 , cette réaction procède à un taux de 2,2 × 10 -12 , plus de 3 ordres de grandeur plus lente que la réaction primaire ci-dessus.
Parmi les autres réactions de formation possibles sont:
- H-+ NH4 +→ NH3+ H2
- PNH3 ++ e-→ P + NH3
Mécanismes de destruction interstellaires
Il ya au total 113 réactions proposés menant à la destruction de NH 3 . Parmi ceux-ci, 39 ont été compilés dans de vastes tables de la chimie entre les composés C, N et O. Un examen de l'ammoniac interstellaire cite les réactions suivantes que les mécanismes de dissociation principaux:
- (1) NH3+ H3 +→ NH4 ++ H2
- (2) NH3HCO ++→ NH4 ++ CO
avec des constantes de vitesse de 4,39 x 10 -9 et 2,2 x 10 -9 , respectivement. Les équations ci-dessus (1,2) tournent à une vitesse de 8,8 x 10 -9 et 4,4 x 10 -13 , respectivement. Ces calculs ont assumé les constantes et l'abondance de [NH taux donné 3 ] / [H 2 ] = 10 -5 , [H 3 + ] / [H 2 ] = 2 × 10 -5 , [HCO + ] / [H 2 ] = 2 × 10 -9 , et les densités totales de n = 10 5 , typique de froid, les nuages moléculaires denses,. De toute évidence, entre ces deux réactions primaires, l'équation (1) est la réaction de destruction dominante, avec un taux ~ 10.000 fois plus rapide que l'équation (2). Cela est dû à l'abondance relativement élevée de H 3 + .
Antenne simples détections
observations radio de NH 3 du radiotélescope Effelsberg 100 m révèlent que la ligne de l'ammoniac est séparé en deux composantes - une arête de fond et une âme en suspens. L'arrière-plan correspond bien avec les emplacements précédemment détectés CO. Le 25 m Chilbolton télescope en Angleterre détecté signatures de radio d'ammoniac dans les régions H II , HNH 2 O masers, objets HH, et autres objets associés à la formation des étoiles. Une comparaison des largeurs de ligne d'émission indique que les vitesses turbulentes ou systématiques ne pas augmenter dans les noyaux centraux des nuages moléculaires.
Rayonnement micro-ondes à partir d'ammoniac a été observée dans plusieurs objets galactiques dont W3 (OH), Orion A, W43, W51, et cinq sources dans le centre galactique. Le taux de détection élevé indique que ceci est une molécule commune dans le milieu interstellaire et que les régions à haute densité sont communes dans la galaxie.
Études interférométriques
Observations VLA de NH 3 dans sept régions avec haute vitesse sorties gazeux révélé condensations de moins de 0,1 pc en L1551, S140, et Céphée A. Trois condensations individuelles ont été détectés dans Céphée A, l'un d'eux avec une forme très allongée. Elles peuvent jouer un rôle important dans la création de la sortie bipolaire dans la région.
Ammoniac extragalactique a été imagée en utilisant le VLA dans IC 342. Le gaz chaud a des températures supérieures à 70 K, qui a été déduit de rapports de raies d'ammoniac et semble être étroitement associé avec les parties les plus intimes de la barre nucléaire vu dans CO. NH 3 a également été surveillés par VLA vers un échantillon de quatre ultracompact galactique régions HII: G9.62 + 0,19, + 0,03 G10.47, G29.96-0.02 et G31.41 + 0,31. Sur la base de température et de densité de diagnostic, il est conclu que dans ces touffes générales sont susceptibles d'être les sites de formation d'étoiles massives dans une phase d'évolution précoce avant le développement d'une région HII ultracompact.
Détections infrarouges
Absorption à 2,97 micromètres dues à l'ammoniac solide a été enregistrée à partir de grains interstellaires dans l' objet Becklin-Neugebauer et probablement aussi bien dans NGC 2264-IR. Cette détection a aidé à expliquer la forme physique des raies d'absorption de glace précédemment mal compris et les domaines connexes.
Un spectre du disque de Jupiter a été obtenu à partir de l' Observatoire Airborne Kuiper, couvrant 100 à 300 cm -1 gamme spectrale. L'analyse du spectre fournit des informations sur les propriétés moyennes mondiales de gaz d'ammoniac et une brume de glace d'ammoniac.
Un total de 149 postes de nuages sombres ont été interrogés des preuves de «noyaux denses» en utilisant le (J, K) = (1,1) tournant ligne d'inversion de NH 3 . En général, les noyaux ne sont pas de forme sphérique, avec des rapports d'aspect allant de 1,1 à 4,4. Il est également constaté que les noyaux avec des étoiles ont des lignes plus larges que noyaux sans étoiles.
L'ammoniac a été détectée dans la nébuleuse de Draco et dans un ou éventuellement deux nuages moléculaires, qui sont associés à la haute latitude galactique cirrus infrarouge. La conclusion est importante car ils peuvent représenter les berceaux pour les étoiles de type B de métallicité Population I dans le halo galactique qui auraient pu être supportés dans le disque galactique.
Observations de nuages sombres à proximité
En équilibrant l'émission stimulée et à émission spontanée, il est possible de construire une relation entre la température et la densité d'excitation. En outre, puisque les niveaux d'ammoniac transitoires peuvent être estimés par un système à 2 niveaux à basse température, ce calcul est assez simple. Cette prémisse peut être appliqué à de sombres nuages, régions soupçonnées d'avoir des températures extrêmement basses et des sites possibles pour la future formation d'étoiles. Détections d'ammoniac dans les nuages sombres montrent des lignes-indicatifs très étroites non seulement des basses températures, mais aussi d'un niveau de turbulence intérieure nuage bas. calcul des ratios de ligne fournissent une mesure de la température de trouble qui est indépendant du CO observations précédentes. Les observations d'ammoniac étaient conformes aux mesures de CO de températures de rotation de ~ 10 K. Avec cela, les densités peuvent être déterminées, et ont été calculées à varier entre 10 4 et 10 5 cm -3 dans les nuages sombres. Cartographie des NH 3 donne nuages tailles typiques de 0,1 pc et les masses près de 1 masse solaire. Ces froides, des noyaux denses sont les sites de la future formation d'étoiles.
Régions HII UC
Régions ultra-compact HII sont parmi les meilleurs marqueurs de la formation des étoiles de masse élevée. Le matériau dense environnante régions UCHII est susceptible principalement moléculaire. Depuis une étude complète de la formation d'étoiles massives implique nécessairement le nuage d'où l'étoile formée, l'ammoniac est un outil précieux dans la compréhension de ce matériau moléculaire environnant. Étant donné que ce matériau macromoléculaire peut être résolue spatialement, il est possible de contraindre le chauffage / sources, les températures, les masses et les dimensions des régions ionisants. Composantes de vitesse à décalage Doppler permettent la séparation des régions distinctes du gaz moléculaire qui peuvent tracer des sorties et des noyaux chauds provenant d'étoiles de formage.
Détection extragalactique
L'ammoniac a été détecté dans les galaxies extérieures, et en mesurant simultanément plusieurs lignes, il est possible de mesurer directement la température du gaz dans ces galaxies. ratios de ligne impliquent que les températures de gaz sont chauds (~ 50 K), en provenance de nuages denses avec des tailles de dizaines de pc. Cette image est compatible avec l'image au sein de notre Voie Lactée galaxie chaude dense sous forme de noyaux moléculaires autour nouvellement formé étoiles embarqués dans les grandes nuées du matériau moléculaire à l'échelle de plusieurs centaines de pc (nuages moléculaires géants; CMG).