
Drosophila melanogaster
Renseignements généraux
Cette sélection de wikipedia a été choisi par des bénévoles aidant les enfants SOS de Wikipedia pour cette sélection Wikipedia pour les écoles. Voir http://www.soschildren.org/sponsor-a-child pour connaître le parrainage d'enfants.
| Drosophila melanogaster | |
|---|---|
 | |
| Drosophila melanogaster mâle | |
| Classification scientifique | |
| Uni: | Animalia |
| Embranchement: | Arthropoda |
| Sous-embranchement: | Hexapoda |
| Classe: | Insecta |
| Sous-classe: | Pterygota |
| Infraclasse: | Néoptères |
| Super: | Endoptérygotes |
| Ordre: | Diptères |
| Famille: | Drosophilidae |
| Sous-famille: | Drosophilinae |
| Genre: | Drosophila |
| Sous-genre: | Sophophora |
| Groupe d'espèces: | groupe melanogaster |
| Espèces sous-groupe: | melanogaster sous-groupe |
| complexe d'espèces: | complexe melanogaster |
| Espèce: | D. melanogaster |
| Nom binomial | |
| Drosophila melanogaster Meigen, 1830 | |
Drosophila melanogaster (du grec pour le noir à ventre rosée amant) est un insecte à deux ailes qui appartient à la Diptera, la ordre du mouches. L'espèce est généralement connu sous le nom commun mouche des fruits, et est l'un des plus couramment utilisés organismes modèles en biologie, y compris des études de la génétique , physiologie et la vie l'évolution de l'histoire. Mouche appartenant à la Tephritidae sont aussi appelés les mouches des fruits, ce qui peut prêter à confusion, notamment en Australie, où la mouche des fruits terme est utilisé pour désigner la Tephritidae, un ravageur économique dans la production de fruits.
Apparence physique

Type sauvage mouches des fruits ont briques yeux rouges, sont de couleur jaune-brun, et ont des anneaux noirs transversales à travers leur abdomen. Ils présentent dimorphisme sexuel: les femelles sont environ 2,5 millimètres (0,1 pouces) de long; mâles sont plus petits et à l'arrière de leur corps est plus sombre. Les mâles sont facilement distingués des femelles en fonction des différences de couleur, avec une tache noire distincte à l'abdomen, moins perceptible en a récemment émergé mouches (voir fig), et les sexcombs (une rangée de poils sombres sur la tarse de la première étape). En outre, les hommes ont un amas de poils hérissés (de ptérygopodes) entourant les pièces de reproduction utilisées pour fixer à la femelle pendant l'accouplement. Il ya de vastes images à Fly base.
Cycle de vie

Le D. melanogaster durée de vie est d'environ 30 jours à 29 ° C (84 ° F).
La période de développement pour Drosophila melanogaster varie avec la température, comme beaucoup espèces ectothermes. Le temps le plus court de développement (oeuf à l'adulte), 7 jours, est réalisé à 28 ° C (82 ° F). Les temps de développement augmentent à des températures élevées (30 ° C (86 ° F), 11 jours) en raison de stress thermique. Dans des conditions idéales, le temps de développement à 25 ° C (77 ° F) est de 8,5 jours à 18 ° C (64 ° F), il faut 19 jours et à 12 ° C (54 ° F) il faut plus de 50 jours. Sous des conditions de surpeuplement, les augmentations de temps de développement, tandis que les mouches émergents sont plus petits. Les femelles pondent environ 400 œufs (embryons), environ cinq à la fois, dans les fruits pourris ou autre matériau approprié tel que la décomposition des champignons et flux de sève. Les oeufs, qui sont environ 0,5 millimètres de long, éclosent après 12 à 15 h (à 25 ° C (77 ° F)). La résultante larves croître pendant environ 4 jours (à 25 ° C), tandis que mue deux fois (en larves 2e et 3e stade), à environ 24 et 48 h après l'éclosion. Pendant ce temps, ils se nourrissent sur les micro-organismes qui décomposent le fruit, ainsi que sur le sucre du fruit lui-même. Ensuite, les larves dans le encapsuler pupe et subir une à quatre journée métamorphose (à 25 ° C), après quoi les adultes éclosent (émergent).

Les femelles deviennent réceptifs à courtiser les mâles à environ 8-12 heures après la levée. Mâles effectuent une séquence de cinq modèles de comportement pour les femmes de la cour. Tout d'abord, les hommes se orientent tout en jouant une chanson de cour en étendant horizontalement et vibrant leurs ailes. Peu de temps après, se positionne de mâles à l'arrière de l'abdomen de la femelle dans une posture basse pour TAP et lécher les organes génitaux féminins. Enfin, le mâle se enroule son abdomen, et tente copulation. Les femelles peuvent rejeter les hommes en se éloignant et l'extrusion de leur ovipositeur. La durée moyenne de la copulation succès est de 30 minutes, au cours de laquelle les mâles transférer quelques centaines de cellules (1.76mm) de spermatozoïdes très longues dans le liquide séminal de la femelle. Femelles stockent le sperme, qui peut avoir besoin de rivaliser avec le sperme d'autres mâles stockée pour féconder les oeufs.
Organisme modèle en génétique



Drosophila melanogaster est le plus étudié organisme dans la recherche biologique, en particulier dans la génétique et la biologie du développement. Il existe plusieurs raisons:
- Il est petit et facile à cultiver en laboratoire.
- Il a un temps de génération court (environ deux semaines) et haute fécondité (femelles peuvent pondre> 800 oeufs dans le temps de la vie soit un œuf par 30 min avec assez de nourriture).
- Les larves matures montrent des chromosomes géants dans les glandes salivaires appelées "Les bouffées» de polytènes indiquent les régions de transcription et par conséquent son activité génique.
- Il n'a que quatre paires de chromosomes: trois autosomes et une chromosome sexuel.
- Les mâles ne montrent pas la méiose recombinaison, facilitant les études génétiques.
- Techniques de transformation génétique sont disponibles depuis 1987.
- Son compacte génome était séquencée et d'abord publié en 2000.
Charles W. Woodworth est crédité d'être le premier à reproduire la drosophile en quantité et pour suggérer à NOUS château qu'ils pourraient être utilisés pour la recherche génétique au cours de son temps à Université De Harvard. À partir de 1910, les mouches des fruits ont aidé Thomas Hunt Morgan accomplir ses études sur l'hérédité. "Thomas Hunt Morgan et ses collègues étendues Travaux de Mendel en décrivant l'héritage lié à l'X et en montrant que des gènes situés sur le même chromosome ne montrent pas l'assortiment indépendant. Études de traits liés à l'X ont permis de confirmer que les gènes se trouvent sur les chromosomes, tandis que les études de caractères liés conduit à les premières cartes indiquant l'emplacement des loci génétiques sur les chromosomes "(Freman 214). Les premières cartes de la drosophile chromosomes ont été remplis par Alfred Sturtevant.
Génome
Le génome de D. melanogaster (séquencé en 2000, et à la commissaire Base de données FlyBase) contient quatre paires de chromosomes: X / Y paire, et trois autosomes étiqueté 2, 3 et 4. Le quatrième chromosome est si petit qu'il est souvent ignorée, en dehors de son gène eyeless importante. Son génome séquencé de 120 millions de paires de bases a été annoté et contient environ 13 767 gènes codant pour des protéines qui comprennent environ 20% du génome. Plus de 60% du génome semble être fonctionnel ADN non-codant pour une protéine impliquée dans le contrôle de l'expression génique. La détermination du sexe chez la drosophile se produit par le rapport des chromosomes X à autosomes, pas à cause de la présence d'un chromosome Y que dans la détermination du sexe humain.
Gènes de drosophile sont traditionnellement nommés d'après le quand ils provoquent un phénotype muté. Par exemple, l'absence d'un gène particulier dans Drosophila se traduira par un embryon mutant qui ne développe pas un coeur. Les scientifiques ont ainsi appelé cette tinman gène, nommé d'après le Oz personnage du même nom (cf. Azpiazu & Frasch (1993) Genes and Development: 7:. 1325-1340). Ce système de nomenclature en résulte une plus large gamme de noms de gènes que dans d'autres organismes.
De similarité pour l'homme
Environ 75% des gènes connus de maladies humaines ont un match reconnaissable dans le code génétique des mouches des fruits (Reiter et al (2001) Genome Research: 11 (6): 1114-1125), et 50% de séquences de protéines de mouche ont analogues mammifères. Une base de données en ligne appelé Homophila est disponible pour rechercher des homologues de gènes de maladies humaines dans les mouches et vice versa. drosophile est utilisée comme un modèle génétique de plusieurs maladies humaines, y compris les maladies neurodégénératives La maladie de Parkinson, la chorée de Huntington , l'ataxie spino-cérébelleuse et la maladie d'Alzheimer . La mouche est également utilisé pour étudier les mécanismes sous-jacents le vieillissement et le stress oxydatif, l'immunité , le diabète et le cancer , ainsi que l'abus de drogues.
Développement
Embryogenèse chez la drosophile a été largement étudié, que sa petite taille, le temps de génération court, et la grande taille de la couvée le rend idéal pour les études génétiques. Il est également unique parmi les organismes modèles en ce que le clivage se produit dans un syncytium.
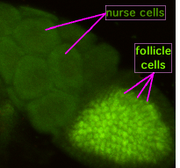
Au cours de l'ovogenèse, ponts cytoplasmiques appelées «canaux périphériques" connecter l'ovocyte formant à cellules nourricières. Les éléments nutritifs et les molécules se déplacent de contrôle du développement des cellules nourricières dans l'ovocyte. Dans la figure de gauche, l'ovocyte de formage peut être vu pour être couverte par les cellules folliculaires de soutien.
Après la fécondation de l'ovocyte ou l'embryon précoce ( embryon syncytial) subit une replication de l'ADN rapide et 13 divisions nucléaires jusqu'à environ 5000 à 6000 germes se accumulent dans le cytoplasme non séparée de l'embryon. À la fin de la 8e division plupart des noyaux ont migré vers la surface, entourant le sac jaune (ne laissant que quelques noyaux, qui deviendra le noyau de jaune). Après la 10ème division des cellules polaires forment à la fin postérieure de l'embryon, la ségrégation de la lignée germinale à partir de la syncytium. Enfin, après que les membranes des cellules de division 13e invaginent lentement, en divisant le syncytium dans des cellules somatiques individuelles. Une fois ce processus terminé gastrulation commence.
Division nucléaire au début embryon de drosophile est si vite arrivé il n'y a pas de points de contrôle appropriées afin erreurs peuvent être faites dans la division de l' ADN . Pour contourner ce problème, les noyaux qui ont fait une erreur détachent de leur centrosomes et tombent dans le centre de l'embryon (sac vitellin) qui ne font pas partie de la mouche.
Le réseau de gènes (interactions de transcription et de protéines) régissant le développement précoce de l'embryon de mouche est l'un des réseaux de gènes mieux compris à ce jour, en particulier la structuration antéro-postérieur (AP) et dorso-ventral (DV) axes (Voir sous morphogenèse).
L'embryon subit bien caractérisée mouvements morphogénétiques pendant la gastrulation et le développement précoce, dont l'extension germe de la bande, la formation de plusieurs sillons, invagination ventrale du mésoderme postérieur et invagination antérieure de l'endoderme (intestin), ainsi qu'une vaste segmentation du corps jusqu'à ce que finalement l'éclosion de la cuticule environnant dans un 1er stade larvaire.
Au cours du développement larvaire, tissus connus comme disques imaginaux développent à l'intérieur de la larve. Disques imaginaux développent pour former la plupart des structures de l'organisme adulte, comme la tête, les jambes, les ailes, le thorax et organes génitaux. Les cellules des disques imaginaux sont mis de côté pendant l'embryogenèse et continuent de croître et se diviser pendant les stades larvaires - contrairement à la plupart des autres cellules de la larve qui ont différencié pour exécuter des fonctions spécialisées et de grandir sans division cellulaire. À la métamorphose, la larve forme un nymphe, à l'intérieur duquel les tissus larvaires sont réabsorbés et les tissus imaginales subir de vastes mouvements morphogénétiques pour former des structures adultes.
Génétique comportementale et neurosciences
En 1971, Ron Konopka et Seymour Benzer publié "mutants de l'horloge de Drosophila melanogaster", un document décrivant les premières mutations qui ont affecté le comportement d'un animal. Mouches de type sauvage montrent un rythme d'activité avec une fréquence d'environ un jour (24 heures). Ils ont trouvé des mutants avec plus rapide et des rythmes plus lents ainsi que les rythmes brisés - mouches qui se déplacent et de repos dans les jaillissements aléatoires. Travail au cours des 30 années suivantes a montré que ces mutations (et d'autres comme eux) affectent un groupe de gènes et de leurs produits qui comprennent une ou biochimique horloge biologique. Cette horloge se trouve dans une large gamme de cellules de mouche, mais les cellules d'horloge portant qui contrôlent l'activité sont plusieurs dizaines de neurones dans le cerveau central de la mouche.
Depuis lors, Benzer et d'autres ont utilisé des écrans de comportement pour isoler des gènes impliqués dans la vision, olfaction, de l'audition, l'apprentissage / mémoire, la cour, la douleur et d'autres processus, tels que la longévité.
Les premiers mutants d'apprentissage et de mémoire (dunce, rutabaga, etc.) ont été isolés par William "Chip" Quinn tandis que dans le laboratoire de Benzer, et ont finalement été montré pour coder des composants d'une voie de signalisation intracellulaire impliquant l'AMP cyclique, la protéine kinase A et un facteur de transcription connu sous le nom CREB. Ces molécules ont été démontré également être impliqués dans la plasticité synaptique chez l'aplysie et les mammifères.
Les mâles chantent pour les femelles pendant la parade nuptiale en utilisant leur aile pour générer des sons, et certains de la génétique du comportement sexuel ont été caractérisés. En particulier, la gène infructueuses a plusieurs formes d'épissage différents, et les mouches mâles exprimant formes d'épissage femmes ont un comportement de femme-like et vice-versa.
En outre, la drosophile a été utilisé dans la recherche neuropharmacologiques, y compris des études de cocaïne et d'alcool.
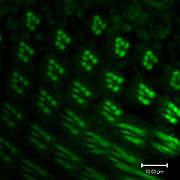
Vision
L' œil composé de la mouche des fruits contient 760 yeux unitaires ou ommatidies, et sont l'un des plus avancés parmi les insectes. Chaque ommatidie contient 8 cellules photoréceptrices (R1-8), les cellules de soutien, les cellules pigmentaires, et une cornée. Mouches de type sauvage ont des cellules pigmentaires rougeâtres, qui servent à absorber l'excès de lumière bleue de sorte que la mouche ne est pas aveuglé par la lumière ambiante.
Chaque cellule photoréceptrice est constituée de deux sections principales, le corps de la cellule et la rhabdomere. Le corps de la cellule contient tandis que le noyau 100 um de long rhabdomere est constitué de piles de brosse à dents en forme de membrane appelées microvillosités. Chaque microvillus est de 1-2 mm de longueur et de 60 ~ nm de diamètre. La membrane de la rhabdomere est emballé avec environ 100 millions de rhodopsine molécules, la protéine visuelle qui absorbe la lumière. Le reste des protéines visuels sont également serrés dans l'espace microvillosités, laissant peu de place à cytoplasme.
Les photorécepteurs de drosophile expriment une variété de rhodopsine isoformes. Les cellules photoréceptrices R1-R6 expriment Rhodopsin1 (Rh1) qui absorbe la lumière bleue (480 nm). Les cellules R7 et R8 expriment une combinaison de deux ou Rh3 Rh4 qui absorbent la lumière UV (345 nm et 375 nm), et rh5 ou rh6 qui absorbent le bleu (437 nm) et vert (508 nm), respectivement. Chaque molécule de rhodopsine est constitué d'une protéine opsine lié par covalence à un caroténoïde chromophore, 11-cis-3-hydroxyretinal.
Comme dans vertébré vision , la transduction visuelle dans invertébrés se produit par une voie couplé à la protéine G. Cependant, dans les vertébrés du La protéine G est la transducine, tandis que le Protéine G chez les invertébrés est Gq (DGQ chez la drosophile). Quand rhodopsine (Rh) absorbe un photon de la lumière de son chromophore, 11-cis-3-hydroxyretinal, est isomérisé en tout-trans-3-hydroxyretinal. Rh subit un changement conformationnel dans sa forme active, métarhodopsine. Métarhodopsine active Gq, qui à son tour active un phospholipase Cp (PLCβ) connu sous le nom Norpa.
PLCβ hydrolyse phosphatidylinositol (4,5) -bisphosphate (PIP 2), un phospholipides trouvé dans le membrane cellulaire, en soluble inositol triphosphate (IP 3) et diacylgycerol (DAG), qui reste dans le membrane cellulaire. DAG ou un dérivé de DAG provoque une calcium sélectif canal ionique connu sous le nom TRP (potentiel de récepteur transitoire) pour ouvrir et calcium et de sodium se écoule dans la cellule. IP 3 est pensé pour se lier à IP 3 récepteurs dans le subrhabdomeric citernes, une extension de la réticulum endoplasmique, et la cause de la libération de calcium , mais ce processus ne semble pas être essentiel pour une vision normale.
Le calcium se lie à des protéines telles que calmoduline (CaM) et un oeil spécifique la protéine kinase C (PKC) connu sous le nom d 'AINC. Ces protéines interagissent avec d'autres protéines et se sont révélés être nécessaires pour fermeture hors de la réponse à la lumière. En outre, des protéines appelées arrestines lient métarhodopsine et empêcher de se activer plus GQ.
Un échangeur sodium / calcium chaux dite pompe le calcium hors de la cellule. Il utilise le gradient de sodium vers l'intérieur pour exporter calcium à une stoechiométrie de 3 Na + / 1 Ca ++.
TRP, AINC, et PLC forment un complexe de signalisation en liant une protéine d'échafaudage appelé INAD. INAD contient cinq domaines de liaison appelés PDZ domaine des protéines qui se lient spécifiquement l'extrémité C-terminale de protéines cibles. Perturbation du complexe par des mutations soit dans les domaines PDZ ou les protéines cibles réduit l'efficacité de la signalisation. Par exemple, la perturbation de l'interaction entre AINC, la protéine kinase C et INAD se traduit par un retard dans l'inactivation de la réponse à la lumière.
Contrairement vertébrés métarhodopsine, invertébrés métarhodopsine peut être reconverti en rhodopsine par absorption d'un photon de lumière orange (580 nm).
Environ les deux tiers du cerveau chez la drosophile (environ 200 000 neurones total) est dédié à traitement visuel. Bien que le résolution spatiale de leur vision est nettement pire que celle des humains, leur résolution temporelle est d'environ dix fois mieux.
Vol
Les ailes d'une mouche sont capables de battre jusqu'à 220 fois par seconde. Mouches via séquences droites de mouvement entrecoupées de virages rapides appelés saccades. Au cours de ces spires, une mouche est capable de tourner de 90 degrés en moins de 50 millisecondes.
On a longtemps pensé que les caractéristiques de la drosophile vol ont été dominées par le la viscosité de l'air, plutôt que de la inertie du corps de mouche. Cependant, la recherche dans le laboratoire du Michael Dickinson a indiqué que les mouches effectuer des virages relevés, où la mouche se accélère, ralentit tout en tournant, et accélère de nouveau à la fin du tour. Ceci indique que l'inertie est la force dominante, comme ce est le cas avec de plus grands animaux volants.
