
HIV
Contexte des écoles Wikipédia
SOS Enfants, un organisme de bienfaisance de l'éducation , a organisé cette sélection. Voir http://www.soschildren.org/sponsor-a-child pour connaître le parrainage d'enfants.
| Virus de l'immunodéficience humaine | |
|---|---|
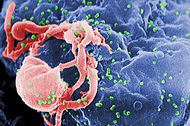 | |
| micrographie électronique à balayage du VIH-1 (en vert) en herbe de lymphocytes cultivés. Plusieurs bosses rondes sur la surface des cellules représentent des sites d'assemblage et le bourgeonnement des virions. | |
| Classification des virus | |
| Groupe: | Groupe VI ( ssRNA-RT) |
| Famille: | Retroviridae |
| Genre: | Lentivirus |
| Espèce | |
| |
Virus de l'immunodéficience humaine (VIH) est un lentivirus (reproduisant lentement rétrovirus) qui provoque le syndrome d'immunodéficience acquise (SIDA), une condition chez l'homme dans lequel défaillance progressive du système immunitaire permet la vie en danger infections opportunistes et les cancers de se développer. L'infection à VIH a lieu par le transfert de sang , sperme, les sécrétions vaginales, pré-éjaculatoire, ou le lait maternel. Dans ces fluides corporels, le VIH est présent que deux particules virales libres et virus dans infectés cellules du système immunitaire.
Le VIH infecte les cellules vitales dans le système immunitaire humain, tels que les cellules T auxiliaires (en particulier Cellules T CD4 +), macrophages, et cellules dendritiques. Infection par le VIH conduit à de faibles niveaux de Cellules T CD4 + par un certain nombre de mécanismes, y compris: apoptose des cellules de voisinage non infectées, assassinat virale directe de cellules infectées, et la destruction des cellules T CD4 + infectés par le CD8 des lymphocytes cytotoxiques qui reconnaissent les cellules infectées. Lorsque le nombre de cellules T CD4 + tombent au-dessous d'un niveau critique, immunité à médiation cellulaire est perdue, et le corps devient de plus en plus sensibles aux infections opportunistes.
Virologie
Classification
| Espèce | Virulence | Infectiosité | Prévalence | Origine présumées |
|---|---|---|---|---|
| VIH-1 | Élevé | Élevé | Mondial | Chimpanzé commun |
| HIV-2 | Inférieur | Faible | Afrique De L'Ouest | Sooty Mangabey |
Le VIH est un membre du genre Lentivirus, qui fait partie de la famille des Retroviridae. Les lentivirus ont beaucoup morphologies et biologiques propriétés en commun. De nombreuses espèces sont infectés par les lentivirus, qui sont responsables de maladies caractéristique de longue durée avec une longue période d'incubation. Les lentivirus sont transmises sous forme simple brin, en positif sens, enveloppé les virus à ARN. Lors de l'entrée dans la cellule cible, le viral ARN génome est converti (transcription inverse) en double-brin de l'ADN par un codée par le virus transcriptase inverse qui est transporté en même temps que le génome viral dans la particule virale. L'ADN viral obtenu est ensuite importées dans le noyau de la cellule et intégré dans l'ADN cellulaire par une codées viralement intégrase et d'accueil des co-facteurs. Une fois intégré, le virus peut devenir latente, permettant au virus et sa cellule hôte pour éviter la détection par le système immunitaire. Autrement, le virus peut être transcrite, la production de nouveaux génomes à ARN et des protéines virales qui sont emballés et libéré de la cellule que de nouvelles particules virales qui commencent le cycle de réplication de nouveau.
Deux types de VIH ont été caractérisés: VIH-1 et VIH-2. VIH-1 est le virus qui a été initialement découvert et appelé LAV fois et HTLV-III. Il est plus plus virulent, infectieux, et est la cause de la majorité des infections à VIH à l'échelle mondiale. L'infectiosité plus faible du VIH-2 par rapport au VIH-1 implique que moins de ceux qui sont exposés au VIH-2 seront infectés par l'exposition. En raison de sa relativement faible capacité de transmission, le VIH-2 est largement confinée à l'Afrique de l'Ouest .
Structure et génome

Le VIH est différent des autres dans la structure des retrovirus. Il est plus ou moins sphérique avec un diamètre d'environ 120 nm, environ 60 fois plus petit qu'un des globules rouges, mais pour un grand virus. Il est composé de deux copies de simple brin positif ARN qui code pour le virus de neuf gènes délimitées par une forme conique capside composée de 2000 copies de la protéine virale p24. L'ARN simple brin est étroitement liée à la nucléocapside, les protéines, p7 et enzymes nécessaires à l'élaboration du virion comme transcriptase inverse, les protéases, ribonucléase et intégrase. Une matrice composée de la protéine virale p17 de la capside entoure assurer l'intégrité de la particule de virion.
Ce est, à son tour, entouré par la enveloppe virale qui est composé de deux couches de molécules appelées gras prises phospholipides de la membrane d'une cellule humaine lorsqu'un bourgeons de particules de virus nouvellement formés à partir de la cellule. Incorporé dans l'enveloppe virale sont des protéines de la cellule hôte et environ 70 copies d'une protéine du VIH complexe qui fait saillie à travers la surface de la particule de virus. Cette protéine, appelée Env, se compose d'un capuchon en trois molécules appelées glycoprotéine (GP) 120, et une tige composée de trois gp41 molécules qui ancrent la structure dans l'enveloppe virale. Ce complexe glycoprotéine permet au virus de se fixer et fusionner avec des cellules cibles pour initier le cycle infectieux. Ces deux protéines de surface, en particulier la gp120, ont été considérées comme des cibles de traitements ou futurs vaccins contre le VIH.
Le génome d'ARN est constituée d'au moins sept points de repère structurels ( LTR, TAR, RRE, PE, SLIP, CRS, et INS), et neuf gènes (gag, pol et env, tat, rev, nef, vif, vpr, vpu, et parfois dixième TeV, qui est une fusion de tat env et rev ), codant pour 19 protéines. Trois de ces gènes, gag, pol et env, contiennent des informations nécessaires pour prendre les protéines structurales de nouvelles particules virales. Par exemple, les codes env pour une protéine appelée gp160 qui est décomposé par une protéase cellulaire pour former gp120 et gp41. Les six gènes restants, tat, rev, nef, vif, vpr, vpu et (ou vpx dans le cas du VIH-2), sont des gènes de régulation pour des protéines qui contrôlent la capacité du VIH à infecter les cellules, produire de nouvelles copies du virus ( répliquer), ni provoquer de maladie.
Les deux protéines Tat (p16 et p14) sont transactivateurs transcription pour le promoteur LTR agissant en liant l'élément TAR ARN. Le TAR peut aussi être transformé en microARN qui régulent le gènes d'apoptose ERCC1 et IER3. Le protéine Rev (p19) est impliqué dans la navette ARN du noyau et le cytoplasme en se liant à la ARN élément RRE. La protéine Vif (p23) empêche l'action de APOBEC3G (une protéine cellulaire qui désamine hybrides ADN: ARN et / ou interfère avec la protéine Pol). Le protéine Vpr (p14) arrestations la division cellulaire au G2 / M. La protéine Nef (p27) régule à la baisse CD4 (le principal de récepteur viral), ainsi que la CMH de classe I et des molécules de classe II.
Nef interagit également avec Domaines SH3. La protéine Vpu (p16) influe sur la libération de nouvelles particules virales de cellules infectées. Les extrémités de chaque brin d'ARN du VIH contiennent une séquence d'ARN appelée longue répétition terminale (LTR). Les régions LTR agissent comme des interrupteurs pour contrôler la production de nouveaux virus et peut être déclenchée par des protéines du VIH ou de la cellule hôte. Le élément de Psi est impliqué dans l'emballage du génome viral et reconnu par protéines Gag et Rev. L'élément de glissement (TTTTTT) est impliqué dans le cadre de lecture dans le cadre de lecture Gag-Pol Pol nécessaire pour rendre fonctionnelle.
Tropisme

Le terme fait référence à tropisme viral qui infecte les types cellulaires du VIH. Le VIH peut infecter une grande variété de cellules immunitaires telles que Cellules T CD4 +, macrophages, et les cellules microgliales. VIH-1 à l'entrée des macrophages et des cellules T CD4 + est médiée par l'interaction de glycoprotéines d'enveloppe du virion (gp120) avec la molécule CD4 sur les cellules cibles et également avec corécepteurs de chimiokines.
Macrophage (M-tropique) souches de VIH-1, ou non souches de syncitia induisant (INS) utilisent le récepteur β -chemokine CCR5 pour l'entrée et sont, par conséquent, capable de se répliquer dans les macrophages et les cellules T CD4 +. Ce corécepteur CCR5 est utilisé par presque toutes les écoles primaires de VIH-1 indépendamment du sous-type génétique viral. En effet, les macrophages jouent un rôle clé dans plusieurs aspects essentiels de l'infection à VIH. Ils semblent être les premières cellules infectées par le VIH et peut-être à l'origine de la production de VIH quand les cellules CD4 + sont épuisées dans le patient. Les macrophages et les cellules microgliales sont les cellules infectées par le VIH dans le système nerveux central. Dans les amygdales et la adénoïdes de patients infectés par le VIH, les macrophages fusionnent en cellules géantes multinucléées qui produisent d'énormes quantités de virus.
T-tropique isole, ou syncitia induisant (SI) souches répliquer dans les cellules T CD4 + primaires ainsi que dans les macrophages et utiliser le récepteur α -chemokine, CXCR4, pour l'entrée. Tropisme double souches VIH-1 sont considérées comme transitoires souches de VIH-1 et sont donc en mesure d'utiliser les deux CCR5 et CXCR4 co-récepteurs pour l'entrée virale.
L'α -chemokine SDF-1, un ligand pour CXCR4, supprime la replication du T-tropiques isolats VIH-1. Elle le fait en sous-réguler l'expression de CXCR4 sur la surface de ces cellules. VIH qui ne utilisent que le récepteur CCR5 sont appelés R5; ceux qui utilisent seulement CXCR4 sont appelés X4, et ceux qui utilisent à la fois, X4R5. Cependant, l'utilisation de corécepteur seule ne explique pas tropisme viral, comme tous les virus R5 ne sont pas en mesure d'utiliser CCR5 sur les macrophages pour une infection productive et le VIH peut également infecter un sous-type de cellules dendritiques myéloïdes, qui constituent probablement un réservoir qui maintient l'infection lorsque le nombre de cellules T CD4 + ont diminué à des niveaux extrêmement bas.
Certaines personnes sont résistants à certaines souches de VIH. Par exemple, les personnes atteintes de la CCR5-Δ32 mutation sont résistantes à l'infection par le virus R5, comme la mutation empêche le VIH de se lier à cette co-récepteur, réduisant ainsi sa capacité à infecter des cellules cibles.
Les rapports sexuels sont le principal mode de transmission du VIH. Les deux X4 et R5 du VIH sont présents dans le liquide séminal, qui est passé d'un mâle à son partenaire sexuel. Les virions peuvent ensuite infecter de nombreuses cibles cellulaires et de diffuser dans tout l'organisme. Toutefois, un processus de sélection aboutit à la transmission du virus prédominant R5 par cette voie. Comment ce processus fonctionne sélective est toujours sous enquête, mais un seul modèle, ce est que spermatozoïdes peut effectuer sélectivement R5 VIH car ils possèdent à la fois CCR3 et CCR5 mais pas CXCR4 sur leur surface et que génitales cellules épithéliales séquestrent préférentiellement virus X4. Chez les patients infectés par le sous-type B du VIH-1, il ya souvent un commutateur co-récepteur dans la maladie à un stade avancé et des variantes T-tropique semblerait que peuvent infecter une variété de cellules T par CXCR4. Ces variantes puis répliquées plus agressive avec virulence accrue qui provoque l'épuisement rapide des lymphocytes T, effondrement du système immunitaire, et les infections opportunistes qui marquent l'avènement du SIDA. Ainsi, au cours de l'infection, l'adaptation du virus à l'utilisation de CXCR4 au lieu de CCR5 peut être une étape clé dans la progression vers le SIDA. Un certain nombre d'études sous-type B individus infectés ont déterminé que entre 40 et 50 pour cent des patients atteints du SIDA peut héberger des virus de l'IS et, il est présumé, les phénotypes X4.
VIH-2 est beaucoup moins pathogène que le VIH-1 et est limité dans sa distribution dans le monde entier. L'adoption de "gènes" accessoires par le VIH-2 et son modèle plus la promiscuité de l'utilisation de corécepteur (y compris les CD4-indépendance) peut aider le virus dans son adaptation à éviter les facteurs de restriction innées présentes dans les cellules hôtes. Adaptation à utiliser la machinerie cellulaire pour permettre la transmission normale et l'infection productive a aussi aidé l'établissement de la replication du VIH-2 chez l'homme. Une stratégie de survie pour tout agent infectieux ne est pas de tuer son hôte mais finalement devenir un organisme commensal. Ayant atteint un faible pathogénicité, au fil du temps, des variantes plus de succès à l'émission seront sélectionnés.
cycle de réplication

Entrée à la cellule
Entre le VIH les macrophages et les cellules CD4 + Lymphocytes T par le adsorption de glycoprotéines sur sa surface à des récepteurs sur la cellule cible suivie par la fusion de la l'enveloppe virale avec la membrane cellulaire et la libération de la capside du VIH dans la cellule.
L'accès à la cellule commence par l'interaction du complexe trimérique enveloppe ( pic gp160) et les deux CD4 et un récepteur de chimiokine (généralement soit CCR5 ou CXCR4, mais d'autres sont connus pour interagir) sur la surface cellulaire. se lie à gp120 intégrine α 4 β 7 activation LFA-1 intégrine centrale impliqués dans la mise en place des synapses virologiques, qui facilitent efficace de cellule à cellule propagation du VIH-1. Le pic de gp160 contient des domaines de liaison à la fois CD4 et les récepteurs de chimiokines.
La première étape de fusion comprend la fixation à haute affinité de la liaison de domaines de CD4 gp120 au CD4. Une fois que la gp120 est lié avec la protéine CD4, le complexe de l'enveloppe subit un changement structurel, exposant les domaines de la gp120 de liaison des chimiokines et leur permettant d'interagir avec le récepteur de chimiokine cible. Ceci permet une fixation à deux volets plus stable, ce qui permet le peptide de fusion gp41 N-terminale de pénétrer dans la membrane cellulaire. Répétez les séquences de la gp41, HR1 et HR2 interagissent alors, provoquant l'effondrement de la partie extracellulaire de la gp41 dans une épingle à cheveux. Cette structure de boucle amène les virus et les membranes cellulaires rapprochés, ce qui permet la fusion des membranes et de l'entrée ultérieure de la capside virale.
Après le VIH est liée à la cellule cible, le VIH ARN et divers enzymes, y compris la transcriptase inverse, l'intégrase, la ribonucléase, et la protéase, sont injectés dans la cellule. Pendant le transport sur la base microtubules vers le noyau, le génome viral simple brin de l'ARN est transcrit en ADN double brin, qui est ensuite intégré dans un chromosome de l'hôte.
VIH peut infecter cellules dendritiques (CD) de ce CD4- CCR5 itinéraire, mais un autre itinéraire à l'aide de type C des récepteurs de lectine spécifique du mannose tels que DC-SIGN peut également être utilisé. PED sont l'une des premières cellules rencontrées par le virus au cours de la transmission sexuelle. Ils sont actuellement semble jouer un rôle important en transmettant le VIH aux lymphocytes T lorsque le virus est capturé dans le muqueuse par les CD. La présence de FES-1, qui se produit naturellement dans neurones, on pense à prévenir l'infection des cellules par le VIH.
Réplication et la transcription
Peu de temps après la capside virale pénètre dans la cellule, un enzyme appelée transcriptase inverse libère le simple brin (+) Génome ARN des protéines virales attachés et le copie dans un ADN complémentaire (ADNc) molécule. Le processus de transcription inverse est extrêmement sujette à erreur, et les mutations résultant peut causer la résistance aux médicaments ou permettent au virus d'échapper au système immunitaire du corps. La transcriptase inverse a également une activité de ribonucléase qui dégrade l'ARN viral au cours de la synthèse d'ADNc, ainsi que l'activité de polymérase d'ADN dépendant de l'ADN qui crée un ADN sens à partir de l'ADNc anti-sens. Ensemble, l'ADNc et son complément forment un ADN double brin viral qui est ensuite transporté dans la noyau de la cellule. L'intégration de l'ADN viral dans la cellule hôte de génome est effectuée par une autre enzyme virale intégrase.

Cet ADN viral intégré peut alors rester en sommeil, dans la phase latente de l'infection à VIH. Pour produire activement le virus, certains cellulaire les facteurs de transcription doivent être présentes, dont le plus important est NF-κ B (NF kappa B), qui est régulée à la hausse lorsque les lymphocytes T sont activés. Cela signifie que les cellules les plus susceptibles d'être tués par le VIH sont ceux qui combattent les infections moment.
Au cours de la réplication virale, l'ADN intégré provirus est transcrit en ARNm, qui est ensuite épissé en petits morceaux. Ces petits morceaux sont exportés à partir du noyau dans le cytoplasme, où ils sont traduites en protéines régulatrices Tat (qui encourage la production de nouveaux virus) et Rev. Comme la protéine Rev nouvellement produite se accumule dans le noyau, il se lie à l'ARNm viraux ARN non épissés et permet de quitter le noyau, où ils sont retenus jusqu'à ce que épissé autrement. A ce stade, les protéines structurales gag et env sont produites à partir de l'ARNm de pleine longueur. L'ARN de pleine longueur est en fait le génome du virus; il se lie à la protéine Gag et est conditionné dans de nouvelles particules virales.
VIH-1 et VIH-2 semblent conditionner leur ARN différemment; VIH-1 se lie à l'ARN approprié quelconque, alors que le VIH-2 sera préférentiellement se lier à l'ARNm qui a été utilisé pour créer la protéine Gag lui-même. Cela peut signifier que le VIH-1 est mieux capable de muter (VIH-1 infection progresse au SIDA plus rapidement que le VIH-2 et est responsable de la majorité des infections mondiales).
Assemblée et la libération

La dernière étape du cycle viral, l'assemblage des nouveaux virions VIH-1, commence à la membrane plasmique de la cellule hôte. La polyprotéine Env (gp160) passe par le réticulum endoplasmique et est transporté vers la complexe de Golgi où il est clivé par furine résultant dans les deux glycoprotéines d'enveloppe du VIH, gp41 et gp120. Ceux-ci sont transportés vers la la membrane plasmique de la cellule hôte où gp41 gp120 ancre à la membrane de la cellule infectée. Gag (p55) et Gag-Pol (p160) polyprotéines associent également avec la surface interne de la membrane plasmique ainsi que l'ARN génomique du VIH comme le virion de formage commence à bourgeonner à partir de la cellule hôte. Le virion bourgeonné est encore immature que le polyprotéines gag doivent encore être clivé dans la matrice réelle, capside et nucléocapside protéines. Ce clivage est médié par la protease virale également emballé et peut être inhibée par médicaments antirétroviraux de la protéase classe des inhibiteurs. Les diverses composantes structurelles assemblent ensuite pour produire un virion VIH maturité. Seuls les virions matures sont alors capables d'infecter une autre cellule.
La variabilité génétique

VIH diffère de nombreux virus en ce qu'il a très élevé variabilité génétique. Cette diversité est le résultat de sa rapide cycle de réplication , à la production d'environ 10 10 virions chaque jour, couplé à un haut taux de mutation d'environ 3 x 10 -5 par base nucléotidique par cycle de réplication et recombinogéniques propriétés de la transcriptase inverse.
Ce scénario complexe conduit à la génération de nombreuses variantes de VIH chez un patient infecté unique au cours d'une journée. Cette variabilité est aggravé quand une cellule est infectée simultanément par deux ou plusieurs souches différentes de VIH. Lorsque l'infection simultanée se produit, le génome des virions de la descendance peut être composée de brins d'ARN à partir de deux souches différentes. Ce virion hybride infecte ensuite une nouvelle cellule où il subit la réplication. Comme cela se produit, la transcriptase inverse, en sautant et-vient entre les deux matrices d'ARN différents, va générer un rétroviral nouvellement synthétisé Séquence d'ADN recombinant qui est un entre les deux génomes parentaux. Cette recombinaison est plus évident quand il se produit entre des sous-types.
Le étroitement liés virus de l'immunodéficience simienne (SIV) a évolué dans de nombreuses souches, classés par espèces hôtes naturels. Souches du SIV Singe vert africain (SIVagm) et mangabey enfumé (SIVsmm) sont considérés comme ayant une longue histoire évolutive avec leurs hôtes. Ces hôtes sont adaptées à la présence du virus, qui est présent à des niveaux élevés dans le sang de l'hôte, mais évoque seulement une réponse immunitaire doux, ne provoque pas le développement de simien SIDA, et ne subit pas la mutation étendue et la recombinaison typique du VIH infection chez l'homme.
En revanche, lorsque ces souches infectent les espèces qui ne sont pas adaptés à SIV (hôtes "hétérologues", tels que les macaques rhésus ou cynomologus), les animaux développent le SIDA et le virus engendre la diversité génétique similaire à ce qui est vu dans l'infection humaine par le VIH. Chimpanzé SIV (SIVcpz), le plus proche parent génétique du VIH-1, est associée à une mortalité accrue et des symptômes similaires au SIDA dans son hôte naturel. VIScpz semble avoir été transmis relativement récente des chimpanzés et les populations humaines, de sorte que leurs hôtes ne ont pas encore adapté au virus. Ce virus a également perdu une fonction de la Gène Nef qui est présent dans la plupart des SIV; sans cette fonction, déplétion des cellules T est plus probable, conduisant à l'immunodéficience.
Trois groupes de VIH-1 ont été identifiés sur la base des différences dans la région de l'enveloppe (env): M, N et O. Le groupe M est le plus répandu et est subdivisé en huit sous-types (ou clades), basé sur l'ensemble du génome, qui sont géographiquement distincts. La plus répandue sont les sous-types B (qui se trouve principalement en Amérique du Nord et en Europe), A et D (qui se trouve principalement en Afrique), et C (trouvés principalement en Afrique et en Asie); ces sous-types forment des branches dans l'arbre phylogénétique représentant la lignée du groupe M du VIH-1. La co-infection avec sous-types distincts donne lieu à des formes recombinantes circulantes (ERC). En 2000, la dernière année pour laquelle une analyse de la prévalence globale de sous-type a été fait, 47,2% des infections dans le monde étaient du sous-type C, 26,7% étaient du sous-type A / CRF02_AG, 12,3% étaient du sous-type B, 5,3% étaient du sous-type D, 3,2% étaient des CRF_AE, et 5,3% restants ont été composé d'autres sous-types et les CRF. La plupart du VIH-1 recherche est centrée sur le sous-type B; peu de laboratoires se concentrent sur les autres sous-types. L'existence d'un quatrième groupe, "P", a été émise sur la base d'un virus isolé en 2009. La souche est dérivée d'apparemment gorille SIV (SIVgor), d'abord isolé à partir gorilles des plaines occidentales en 2006.
La séquence génétique du VIH-2 ne est que partiellement homologue de HIV-1 et plus étroitement ressemble à celle de SIVsmm.
Diagnostic
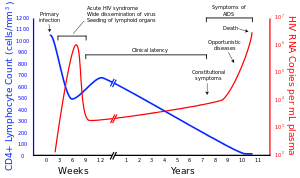
Beaucoup de gens séropositifs ne savent pas qu'ils sont infectés par le virus. Par exemple, en 2001 moins de 1% de la population urbaine sexuellement actifs en Afrique avait été testé, et cette proportion est encore plus faible dans les populations rurales. En outre, en 2001, seuls 0,5% des femmes enceintes qui fréquentent les centres de santé urbains sont conseillés, testé ou de recevoir les résultats des tests. Encore une fois, cette proportion est encore plus faible dans les établissements de santé en milieu rural. Depuis donateurs peuvent donc être conscientes de leur infection, donneur de sang et produits sanguins utilisés en médecine et la recherche médicale sont systématiquement un dépistage du VIH.
VIH-1 test est d'abord par un enzyme-linked immunosorbent assay (ELISA) pour détecter des anticorps dirigés contre le VIH-1. Les échantillons avec un résultat non réactif de la première ELISA sont considérés comme séronégatifs à moins qu'une nouvelle exposition à un partenaire infecté ou partenaire de statut VIH inconnu se est produite. Les échantillons avec un résultat ELISA réactive sont retestés en double exemplaire. Si le résultat de l'un des essais en double est réactif, l'échantillon est signalé comme réactif de manière répétée et subit des tests de confirmation avec un test complémentaire plus spécifique (par exemple, Western blot ou, moins fréquemment, un immunofluorescence (IFA)). Seuls les spécimens qui sont réactivité répétée par ELISA et positive par IFA ou réactive par Western blot sont considérés comme VIH-positif et révélatrice d'une infection par le VIH. Les échantillons qui sont à plusieurs reprises ELISA réactif de temps en temps fournir un résultat Western blot indéterminée, qui peut être soit une réponse d'anticorps incomplet au VIH chez une personne infectée ou des réactions non spécifiques à une personne non infectée.
Bien IFA peut être utilisée pour confirmer l'infection dans ces cas ambigus, ce test ne est pas largement utilisé. En général, un deuxième échantillon devraient être collectées plus d'un mois plus tard et à nouveau testés pour les personnes ayant une durée indéterminée résultats de Western blot. Bien que beaucoup moins couramment disponibles, tests d'acide nucléique (par exemple, l'ARN viral ou proviral méthode d'amplification de l'ADN) peut également aider au diagnostic dans certaines situations. En outre, quelques échantillons testés pourraient fournir des résultats peu concluants en raison d'un échantillon de faible quantité. Dans ces situations, un deuxième échantillon est prélevé et testé pour le VIH.
Tests moderne VIH est extrêmement précis. Un test de dépistage simple est correcte plus de 99% du temps. La chance d'un résultat faussement positif dans le protocole de test en deux étapes standard est estimé à environ 1 250 000 dans une population à faible risque. Test post-exposition est recommandé au début et à six semaines, trois mois et six mois.
Recherche
Recherche sur le VIH / sida comprend tous la recherche médicale qui tente de prévenir, traiter ou guérir le VIH / SIDA ainsi que la recherche fondamentale sur la nature du VIH comme un agent infectieux et le sida, la maladie causée par le VIH.
Actuellement, aucun remède pour le VIH / sida existe. La méthode la plus universellement recommandée pour le la prévention du VIH / SIDA est d'éviter le contact de sang à sang entre les gens et pratiquer autrement sexe sûr. La méthode la plus recommandée pour le traitement du VIH est pour Personnes séropositives reçoivent l'attention d'un médecin qui coordonnerait le patient de la gestion du VIH / SIDA. Il n'y a pas de remède pour le VIH / sida .
De nombreux gouvernements et institutions de recherche participent à la recherche VIH / sida. Cette recherche comprend comportementale interventions de santé, tels que la recherche en l'éducation sexuelle, et le développement de médicaments, tels que la recherche en microbicides pour les maladies sexuellement transmissibles, Vaccins contre le VIH, et médicaments antirétroviraux. D'autres domaines de recherche médicale comprennent les sujets de prophylaxie pré-exposition, prophylaxie post-exposition, et La circoncision et le VIH.
Histoire
Découverte
SIDA a été observé cliniquement en 1981 aux États-Unis. Les premiers cas ont été un groupe de consommateurs de drogues injectables et les hommes homosexuels sans cause connue d'altération de l'immunité qui a montré des symptômes de Pneumonie à Pneumocystis carinii (PCP), une infection opportuniste rare qui a été connu pour se produire chez les personnes ayant un système immunitaire très affaibli. Peu de temps après, les hommes gais supplémentaires ont développé un cancer de la peau rare auparavant appelé Le sarcome de Kaposi (KS). Beaucoup plus de cas de PCP et KS ont émergé, alertant US Centers for Disease Control and Prevention (CDC) et un groupe de travail a été formé CDC de surveiller l'épidémie.
Au début, la CDC ne avait pas un nom officiel de la maladie, se référant souvent à elle par des maladies qui y étaient associées, par exemple, lymphadénopathie, la maladie après quoi les découvreurs du VIH à l'origine appelé le virus. Ils ont également utilisé le sarcome de Kaposi et des infections opportunistes, le nom par lequel un groupe de travail avait été mis en place en 1981. Dans la presse généraliste, le GRID terme, qui se élevait pour immunodéficience liée gay, avait été inventé. La CDC, à la recherche d'un nom, et en regardant les communautés infectées inventé "la maladie 4H», comme il semble désigner les Haïtiens , les homosexuels, les hémophiles et les utilisateurs d'héroïne. Cependant, après avoir déterminé que le sida n'a pas été isolé à la communauté gay, on a réalisé que le GRID terme était trompeuse et le sida a été introduit lors d'une réunion en Juillet 1982. En Septembre 1982, la CDC a commencé à utiliser le nom sida.

En 1983, deux groupes de recherche distincts dirigés par Robert Gallo et Luc Montagnier indépendamment déclaré qu'un nouveau rétrovirus peut avoir été infecte les malades du SIDA, et publié leurs résultats dans le même numéro de la revue Science. Gallo a affirmé que son groupe un virus avait isolé d'un patient atteint du SIDA était remarquablement similaire dans la forme à d'autres virus T-lymphotrope humain (HTLV) son groupe avait été le premier à isoler. Le groupe de Gallo appelé leur nouvellement isolé virus HTLV-III. Dans le même temps, le groupe de Montagnier isole un virus d'un patient présentant un gonflement de la les ganglions lymphatiques du cou et faiblesse physique, deux symptômes classiques du SIDA. Contredisant le rapport du groupe de Gallo, Montagnier et ses collègues ont montré que les protéines de base de ce virus immunologiquement étaient différents de ceux de HTLV-I. Le groupe de Montagnier appelé leur virus associé à la lymphadénopathie virus isolé (VBL). Comme ces deux virus se est avéré être le même, en 1986, LAV et HTLV-III ont été rebaptisé VIH.
Origines
Les deux sont soupçonnés VIH-1 et VIH-2 pour avoir provenu non humain primates en Afrique occidentale et centrale et ont transféré à l'homme (un processus connu sous le nom zoonose) au début du 20e siècle. VIH-1 semble avoir son origine dans le sud du Cameroun à travers l'évolution de SIV (CPZ), un virus de l'immunodéficience simienne (SIV) qui infecte sauvages chimpanzés (VIH-1 descend du SIVcpz endémique dans la sous-espèce de chimpanzés Pan troglodytes troglodytes). Le parent le plus proche du VIH-2 est SIV (SMM), un virus de la mangabey enfumé (Cercocebus atys atys), un vieux singe monde vivant dans litoral Afrique de l'Ouest (du sud du Sénégal à l'ouest de la Côte d'Ivoire ). Nouveaux singes du monde comme le hibou singe sont résistants à l'infection VIH-1, peut-être en raison d'un génomique la fusion de deux gènes viraux de résistance. VIH-1 est pensé pour avoir franchi la barrière des espèces à au moins trois reprises, donnant lieu à trois groupes de virus, M, N et O.
Il existe des preuves que les humains qui participent à activités de viande de brousse, soit en tant que chasseurs ou comme vendeurs de viande de brousse, communément acquérir SIV. Cependant, un virus SIV est faible, et il est généralement supprimée par le système immunitaire humain dans les semaines suivant l'infection. On pense que plusieurs transmissions du virus d'un individu à en succession rapide sont nécessaires pour permettre assez de temps pour muter en VIH. En outre, en raison de son taux de transmission de personne à personne relativement faible, il ne peut se répandre dans la population en présence d'un ou plusieurs canaux de transmission à haut risque, qui sont censés avoir été absent en Afrique avant le 20e siècle .
Canaux de transmission spécifiques proposées à haut risque, ce qui permet au virus de se adapter à l'homme et se propage dans toute la société, dépendent de la date proposée pour le passage de l'animal à l'homme. Les études génétiques du virus suggèrent que le plus récent ancêtre commun du groupe VIH-1 M remonte à vers 1910. Les partisans de cette rencontre le lien de l'épidémie de VIH avec l'émergence de le colonialisme et la croissance des grandes villes africaines coloniales, conduisant à des changements sociaux, y compris un degré plus élevé de la promiscuité sexuelle, la propagation de la prostitution, et la fréquence élevée concomitante de ulcérations génitales (tels que syphilis) dans les villes coloniales naissantes. Bien que les taux de transmission du VIH lors de rapports vaginaux sont faibles dans des circonstances ordinaires ils sont augmentés de nombreuses fois si l'un des partenaires souffre d'un infection sexuellement transmissible entraînant des ulcères génitaux. Début des années 1900 villes coloniales étaient notables en raison de leur forte prévalence de la prostitution et des ulcères génitaux dans la mesure où à partir de 1928 autant que 45% des résidents des femmes de l'est de Kinshasa ont été pensé pour avoir été prostituées et à partir de 1933 environ 15% de tous les résidents de la même ville ont été infectées par l'une des formes de syphilis.
Un autre point de vue que les pratiques médicales dangereuses en Afrique au cours des années suivantes la Seconde Guerre mondiale, comme la réutilisation non stérile des seringues à usage unique lors de la vaccination de masse, des campagnes de traitement antibiotique et anti-paludisme, étaient le vecteur initial qui a permis au virus de se adapter à l'homme et propagation.
Le cas plus tôt bien documenté du VIH chez un humain remonte à 1959 à Congo . Le virus peut avoir été présente aux États-Unis dès 1966.
