
L'hydrure de lithium
Contexte des écoles Wikipédia
Enfants SOS offrent un chargement complet de la sélection pour les écoles pour une utilisation sur les intranets des écoles. SOS Enfants a regardé des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
| L'hydrure de lithium | |
|---|---|
 | |
| Identificateurs | |
| Numéro CAS | 7580-67-8 |
| Propriétés | |
| Formule moléculaire | LiH |
| Masse molaire | 7,95 g mol -1 |
| Apparence | incolore à gris solide |
| Densité | 0,82 g cm -1, solide |
| Point de fusion | 692 ° C |
| Solubilité dans l'eau | Réagit |
| Risques | |
| Classification UE | Inflammable (F) |
| Des composés apparentés | |
| D'autres cations | l'hydrure de sodium, l'hydrure de potassium |
| Des composés apparentés | le borohydrure de lithium, l'hydrure de lithium et d'aluminium |
| Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
Hydrure de lithium ( Li H) est le composé de lithium et de l'hydrogène. Ce est un solide cristallin incolore, bien que les échantillons commerciaux apparaissent en gris. Caractéristique d'un hydrure de type sel, il a un point de fusion élevé (689 ° C ou 1272 ° F). Sa densité est de 780 kilogrammes par mètre cube. Il a une capacité de chaleur standard de 29,73 J / mol * k avec une conductivité thermique qui varie avec la composition et la pression (d'au moins 10 à 5 W / m * K à 400 K) et diminue avec la température.
Ce est un solide inflammable et très réactif avec l'eau, la production du composé corrosif l'hydroxyde de lithium, ainsi que de l'hydrogène.
- LiH + H 2 O → H 2 + LiOH
Synthèse
Il est produit en faisant réagir du lithium métallique avec de l'hydrogène gazeux:
- Li 2 + H 2
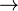 2 LiH
2 LiH
Utilisations
LiH a de nombreuses utilisations, en tant que déshydratant, comme un précurseur pour la synthèse de l'hydrure de lithium-aluminium , dans les générateurs d'hydrogène, à la fois comme un agent de refroidissement et de blindage en les réacteurs nucléaires, et dans la fabrication de céramiques. LiH a la plus haute teneur en hydrogène (en pourcentage en masse) de ne importe quel hydrure de solution saline. La teneur en hydrogène de LiH est trois fois celle du NaH (bien que son stoechiométrie est identique), parce que le lithium est plus léger que le sodium , faisant LiH d'intérêt pour le stockage d'hydrogène.
Le lithium correspondant deutérure, formule couvercle, est le en combustible de fusion armes thermonucléaires. Dans ogives de la Teller-Ulam la conception, le couvercle est compressé et chauffé par l'explosion de la fission primaire au point où la fusion se produit. Lithium deutérure, contrairement tritium, est non-radioactif.
Sécurité
LiH est inflammable dans l'air, et il réagit de façon explosive avec l'eau pour donner LiOH corrosive avec le gaz d'hydrogène.
Dans la culture populaire
En La science-fiction livre de Larry Niven Protector, son caractère Brennan décrit les sous-produits d'un bussard statoréacteur comme étant un assortiment de produits chimiques étranges, y compris "l'hydrure de lithium ... un produit chimique normalement impossible ..." Le livre a été publié en 1973.
