
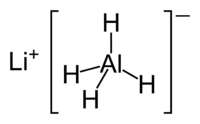
Hydrure de lithium aluminium
Contexte des écoles Wikipédia
SOS croit que l'éducation donne une meilleure chance dans la vie des enfants dans le monde en développement aussi. Un lien rapide pour le parrainage d'enfants est http://www.sponsor-a-child.org.uk/
| Hydrure de lithium aluminium | |
|---|---|
 | |
 | |
 | |
Hydrure de lithium aluminium | |
Autres noms LAH, l'alanate de lithium, | |
| Identificateurs | |
| Numéro CAS | 16853-85-3 |
| Numéro RTECS | BD0100000 |
| Propriétés | |
| Formule moléculaire | LiAlH4 |
| Masse molaire | 37,95 g / mol |
| Apparence | cristaux blancs (échantillons purs) poudre grise (matériel commercial) |
| Densité | 0,917 g / cm 3, solide |
| Point de fusion | 150 ° C (423 K), décomposition |
| Solubilité dans l'eau | réactif |
| Structure | |
| Crystal structure | monoclinique |
| Risques | |
| R / S déclaration | R: 15 S: 7/8, 24/25, 43 |
| Principal dangers | hautement inflammable |
| NFPA 704 |  2 3
2 |
| Des composés apparentés | |
| Connexe hydrure | l'hydrure d'aluminium le borohydrure de sodium l'hydrure de sodium |
| Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
Hydrure de lithium aluminium ( Li Al H 4), généralement abrégé de LAH, est un agent réducteur utilisé dans synthèse organique. Il est plus puissant que le connexes réactif borohydrure de sodium en raison de la plus faible Al-H obligations, comparativement à la liaison BH. Il vous permet de convertir des esters, des acides carboxyliques et des cétones correspondantes dans les alcools ; et amide, nitro, un nitrile, imine, oxime, et composés d'azides dans les amines .
Disponibilité et de manutention
LAH est un blanc échantillons solides, mais commerciales sont presque toujours gris en raison de la contamination par des traces d' aluminium métallique. Ce matériau peut être purifié par recristallisation à partir de éther diéthylique. Purifications à grande échelle utilisent une Extracteur Soxhlet. Communément, la matière grise impur est utilisé dans la synthèse, car les impuretés sont inoffensifs et facilement séparé des produits organiques. Le produit pur est pyrophore. Certains matériaux commerciaux contiennent huile minérale pour inhiber les réactions avec l'humidité atmosphérique, mais le plus souvent il est emballé dans des sacs en plastique étanches à l'humidité.
LAH réagit violemment avec l'eau , y compris l'humidité atmosphérique. Le produit de réaction selon l'équation suivante: idéalisée
- LiAlH 4 + 4 H 2 O → LiOH + Al (OH) 3 + 4 H 2 ↑
Cette réaction fournit une méthode utile pour produire de l'hydrogène dans le laboratoire. Échantillons vieillis, exposées à l'air apparaissent souvent blanc parce qu'ils ont absorbé suffisamment d'humidité pour produire un mélange des composés incolores l'hydroxyde de lithium et l'hydroxyde d'aluminium.
Préparation
LAH a été préparé à partir de la réaction entre l'hydrure de lithium (LiH) et du chlorure d'aluminium :
- 4 LiH + AlCl3 → LiAlH 4 + 3 LiCl
En plus de ce procédé, la synthèse industrielle implique la préparation initiale d'aluminium hydrure de sodium à partir des éléments sous haute pression et température:
- Na + Al + 2 H 2 → NaAlH4
LAH est ensuite préparé par réaction de métathèse selon l':
- NaAlH4 + LiCl → LiAlH 4 + NaCl
dans laquelle un produit avec un rendement élevé de LAH. LiCl est éliminé par filtration à partir d'un éther solution de LAH, avec précipitation subséquente de LAH pour donner un produit contenant environ 1% en poids / poids de LiCl.
Autres tetrahydridoaluminiumates
Une variété de sels analogues à LAH sont connus. NaH peut être utilisé pour produire efficacement de l'hydrure d'aluminium et de sodium (NaAlH4) par dans métathèse THF:
- LiAlH 4 + NaH → NaAlH4 + LiH
Hydrure d'aluminium et de potassium (KAlH 4) peut être produit de manière similaire à diglyme comme solvant:
- LiAlH 4 + KH KAlH → 4 + LiH
L'inverse, ce est à dire, la production de LAH de l'hydrure de sodium soit d'aluminium ou l'hydrure d'aluminium potassium peut être obtenu par réaction avec LiCl dans l'éther diéthylique ou THF:
- NaAlH4 + LiCl → LiAlH 4 + NaCl
- KAlH 4 → + LiCl + LiAlH 4 KCl
"Magnésium alanate" (Mg (AlH 4) 2) se pose même en utilisant MgBr 2:
- 2 LiAlH 4 + MgBr2 → Mg (AlH 4) 2 + 2 LiBr
Utilisation dans la chimie organique
Hydrure de lithium aluminium est largement utilisé en chimie organique comme un agent réducteur. Malgré des problèmes de manipulation associés à sa réactivité, il est même utilisé à la petite à l'échelle industrielle, bien que pour les réductions d'échelle bis réactif au sodium connexes (2-méthoxyéthoxy) aluminium, communément connu sous le nom Red-Al, est plus souvent utilisé. A ces fins, il est généralement utilisé en solution dans l'éther diéthylique, et un traitement aqueux est généralement effectuée après la réduction afin d'éliminer les sous-produits inorganiques.
LAH est le plus couramment utilisé pour la réduction de les esters et les acides carboxyliques en alcools primaires; avant l'avènement de LiAlH4 ce était une conversion difficile impliquant sodium métal dans bouillante éthanol (la Réduction Bouveault-Blanc). Aldéhydes et cétones peuvent également être réduits en alcools par LAH, mais cela se fait généralement en utilisant des réactifs plus douces telles que NaBH 4. α, β-cétones insaturés sont réduits en alcools allyliques. Quand époxydes sont réduits en utilisant LAH, le réactif se attaque à la moins entravé extrémité de l'époxyde, produisant généralement un alcool secondaire ou tertiaire. Epoxycyclohexanes sont réduits en alcools axiales préférentiellement.
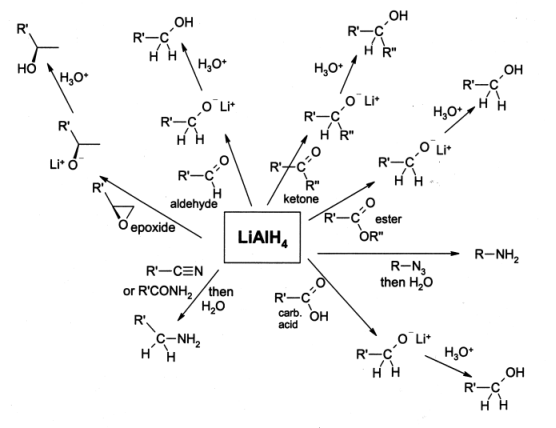
Utilisation LAH, les amines peuvent être préparées par réduction de la amides ,, oximes, des nitriles, des composés nitro ou des groupes alkyle azides.
Hydrure de lithium aluminium réduit également halogénures d'alkyle à alcanes , même si cette réaction est rarement employée. iodures d'alkyle réagissent le plus rapide, suivi par les bromures et chlorures alkyle puis alkyle. Halogénures primaires sont le plus réactif suivi par halogénures secondaires. Halogénures tertiaires ne réagissent que dans certains cas.
Hydrure de lithium aluminium ne réduit pas simples alcènes , arènes, et alcynes ne sont réduites que si un alcool groupe est à proximité.
La chimie inorganique
LAS est largement utilisée pour préparer des groupes principaux et des hydrures de métaux de transition du métal correspondant halogénures.
La décomposition thermique
À la salle LAH de température est métastable. Pendant le stockage prolongé, il peut lentement se décomposer en trois Li AlH 6 et LiH. Ce procédé peut être accéléré par la présence de catalyseurs , par exemple des éléments Ti , Fe , V .
Lorsque LAH chauffée se décompose en trois étapes mécanisme de réaction.
- LiAlH 4 → ⅓ Li 3 AlH 6 ⅔ + Al + H 2 (R1)
- ⅓ Li 3 AlH 6 → LiH + ⅓ Al + ½ H 2 (R2)
- LiH + Al → LiAl + ½ H 2 (R3)
R1 est généralement initiée par le fusion de LAH autour d'une température de 150-170 ° C immédiatement suivie par décomposition en solide Li 3 AlH 6. De 200 à 250 ° C Li 3 AlH 6 décomposent en LiH (R2) qui se décomposent ensuite en LiAl au-dessus de 400 ° C (R3). R1 est effectivement irréversible, parce que LiAlH 4 est métastable. La réversibilité de R2 n'a pas encore été établi de façon concluante. R3 est réversible avec une pression d'équilibre d'environ 0,25 bar à 500 o C. R1 et R2 peuvent se produire à la température ambiante avec des catalyseurs appropriés.
Selon les réactions R1-R3 LiAlH 4 contient 10,6% en poids de l'hydrogène qui rend LAH un potentiel hydrogène support de stockage pour l'avenir pile à combustible alimenté véhicules. Vélo seulement R2 stockerait 5,6% en poids dans le matériau en une seule étape (comparables aux deux étapes de NaAlH4).
données de solubilité
LAH est soluble dans de nombreux éthérés solutions. Toutefois, il peut se décomposer spontanément en raison de la présence d'impuretés catalytiques, cependant, il semble être plus stable en THF. Ainsi, THF est préféré par rapport par exemple l'éther de diéthyle, même en dépit de la faible solubilité.
| Température (o C) | |||||
| Solvant | 0 | 25 | 50 | 75 | 100 |
| De l'éther diéthylique | - | 5,92 | - | - | - |
| THF | - | 2,96 | - | - | - |
| Monoglyme | 1,29 | 1,80 | 2,57 | 3,09 | 3,34 |
| Diglyme | 0,26 | 1,29 | 1,54 | 2,06 | 2,06 |
| Triglyme | 0,56 | 0,77 | 1,29 | 1,80 | 2,06 |
| Tétraglyme | 0,77 | 1,54 | 2,06 | 2,06 | 1,54 |
| Dioxane | - | 0,03 | - | - | - |
| l'éther dibutylique | - | 0,56 | - | - | - |
Notez que l'hydrure de lithium et d'aluminium ne doit pas être utilisé avec de l'eau, qui réagit violemment comme décrit par l'équation suivante.
- LiAlH 4 + 4 H 2 O → Li + + Al 3+ + 4 OH - + 4 H 2
Crystal structure
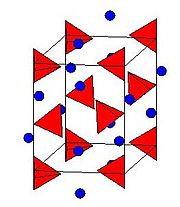
Le structure cristalline de LAH appartient à la système cristallin monoclinique et la groupe d'espace est P2 1 c. La structure cristalline de LAH est illustrée à droite. La structure se compose de Li atomes entourés par cinq AlH quatre tétraèdres . Les centres Li + sont liés à un atome d'hydrogène un atome de chacun des tétraèdres entourant la création d'un arrangement bipyramide. Le cellule unitaire est définie comme suit: a = 4,82, b = 7,81, et c = 7,92 Å, α = γ = 90 ° et β = 112 °. A des pressions élevées (> 2.2GPa) une transition de phase se produit pour donner β-LAH.
Données thermodynamiques
Le tableau résume thermodynamiques données pour LAH et réactions impliquant LAH, sous la forme de norme enthalpie , entropie et énergie libre de Gibbs changement, respectivement.
| Réaction | AH o (kJ / mol) | ΔS o (J / (mol K)) | Ag o (kJ / mol) | Commentaire |
| Li (s) + Al (s) + 2 H 2 (g) → LiAlH4 (s) | -116,3 | -240,1 | -44,7 | Formation standard à partir des éléments. |
| LiH (s) + Al (s) + 3/2 H 2 (g) → LiAlH4 (s) | -25,6 | -170,2 | 23,6 | Utiliser AH o f (LIH) = -90,5, ΔS o f (LIH) = -69,9, et Ag o f (LIH) = -68,3. |
| LiAlH4 (s) → LiAlH 4 (l) | 22 | - | - | La chaleur de fusion. Valeur est probablement peu fiable. |
| LiAlH 4 (l) → ⅓ Li 3 AlH 6 (s) + ⅔ Al (s) + H 2 (g) | 3,46 | 104,5 | -27,68 | ΔS o calculée à partir de valeurs déclarées de AH o et Ag o. |
