
Le rhodium (III) chlorure
Saviez-vous ...
Cette sélection se fait pour les écoles par la charité pour enfants lire la suite . Tous les enfants disponibles pour le parrainage de SOS Enfants des enfants sont pris en charge dans une maison de famille près de la charité. Lire la suite ...
| Les données de sécurité | |
|---|---|
 | |
Autres noms Trichlorure de rhodium | |
| Identificateurs | |
| Numéro CE | 233-165-4 |
| Numéro RTECS | VI9290000 |
| Propriétés | |
| Formule moléculaire | RhCl 3 |
| Masse molaire | 209,26 g / mol (anhydre) |
| Apparence | solide rouge foncé |
| Densité | 5,38 g / cm 3, solide |
| Point de fusion | 450 ° C (incertaine) |
| Point d'ébullition | 717 ° C |
| Solubilité dans l'eau | soluble |
| Acidité (p K a) | en solution acide |
| Structure | |
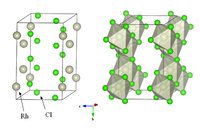
| Crystal structure | YCl 3 |
| Coordination géométrie | octaédrique |
| Thermochimie | |
| Std enthalpie de formation Δ f H | -234 KJ / mol |
| Risques | |
| Classification UE | non listé |
| Point d'éclair | ininflammable |
| Des composés apparentés | |
| D'autres anions | Le rhodium (III) fluorure Le rhodium (III) bromure Le rhodium (III) de l'iodure |
| D'autres cations | Cobalt (II) chlorure Iridium (III) chlorure |
| Des composés apparentés | Le ruthénium (III), le chlorure de Palladium (II) chlorure |
| Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
Le rhodium (III) chlorure se réfère généralement à trichlorure de rhodium hydraté, un composé répondant à la formule moléculaire RhCl 3 (H 2 O) 3. Un autre éminent chlorure de rhodium est RhCl 3, un solide polymère avec la structure AlCl 3. Travailleurs inexpérimentés confondent parfois les deux chlorures de rhodium, mais leur comportement est complètement différent. La plupart de chimie attribué à "trichlorure de rhodium" nécessite l'utilisation de la forme hydratée. Certaines procédures d'appel à un chlorure de rhodium implique l'utilisation de Na 3 RhCl 6, qui est aussi une moléculaire, d'où réactive, sous forme de Rh (III).
Rhodium (III) chlorures sont les produits de la séparation de rhodium à partir de l'autre des métaux du groupe du platine.
Propriétés
RhCl 3 (H 2 O) x existe rouge foncé diamagnétique cristaux. Il est légèrement hygroscopique. Il est soluble dans l'eau pour donner des solutions rougeâtres qui, en fonction de l'âge de la solution, contenant des proportions variables de RhCl 3 (H 2 O) 3, [RhCl 2 (H 2 O) 4] + et [RhCl (H 2 O) 5] 2+.
Préparation
RhCl 3 (H 2 O) 3 est obtenu par action de l'acide chlorhydrique sur hydratée rhodium (III) oxyde. RhCl 3 (H 2 O) 3 peut être cristallisé à partir d'une solution concentrée dans de l'acide chlorhydrique . Cette méthode permet d'éliminer l'azote contenant des impuretés.
RhCl 3 est préparé par réaction du chlore avec du rhodium éponge à 200-300 ° C. La réaction correspondante du fondu de chlorure de sodium Na 3 donne RhCl 6.
complexes de coordination
RhCl 3 (H 2 O) 3 est utilisé pour préparer une variété de complexes, comme illustré ci-dessous. Les complexes Rh (III) sont généralement cinétique inerte avec une géométrie octaédrique. Rh dérivés (I) ont tendance à être plane carrée.
Ammines
des solutions d'éthanol de RhCl 3 (H 2 O) 3 réagit avec l'ammoniac pour donner le chlorure d'pentammine [RhCl (NH 3) 5] 2+. Zinc réduction de ce cation, suivie par l'addition de sulfate donne l'hydrure incolore [[RhH (NH 3) 5] SO 4. Notez que les complexes de NH 3 sont généralement appelés "ammines".
Thioéthers
Éthanoliques solutions de RhCl 3 (H 2 O) 3 réagit avec les sulfures de dialkyle.
- RhCl 3 (H 2 O) 3 + 3 SR 2 → RhCl3 (SR 2) 3 + 3 H 2 O
AEC et mer les stéréoisomères de ces composés ont été isolés.
Phosphines tertiaires
La réaction de RhCl 3 (H 2 O) 3 dans des conditions douces avec des phosphines tertiaires donne des produits d'addition semblables à des complexes mentionnés ci-dessus thioéther. Lorsque ces réactions sont conduites à point d'ébullition de l'éthanol solution, on obtient Rh (I) dérivés tels que RhCl (PPh3) 3, Le catalyseur de Wilkinson. Dans ce cas, l'éthanol sert probablement comme agent réducteur, offrant acétaldéhyde.
- RhCl 3 (H 2 O) 3 + 3 + PPh 3 CH 3 CH 2 OH → RhCl (PPh 3) 3 + CH 3 CHO + 2 HCl + 3 H 2 O
Alternativement, PPh 3 / H 2 O pourrait être réducteur, offrant OPPh 3 et HCl.
Pyridine
Après ebullition dans un mélange d'éthanol et pyridine (Py), RhCl 3 (H 2 O) 3 donne trans- [RhCl 2 (py) 4)] Cl. L'influence de la réduction de l'éthanol est apparent parce que la réaction correspondante dans l'eau donne fac-RhCl 3 (pyridine) 3, analogue aux dérivés thioéther. L'oxydation de la solution éthanolique aqueuse de pyridine et RhCl 3 (H 2 O) 3 par air offre bleu paramagnétique [Cl (py) 4 Rh-O 2 Rh (py) 4 Cl] 5+.
Alcènes
La réaction de RhCl 3 (H 2 O) 3 avec des oléfines donne des composés du type Rh 2 Cl 2 (alcène) 4. Le plus souvent, dialcènes sont employés dans cette réaction, tels que le norbornadiène et le 1,5-cyclooctadiène. Des exemples de sa grande réactivité de ses complexes d'alcène, lorsque le 1,3-cyclooctadiène est traité avec RhCl 3 (H 2 O) 3 dans de l'éthanol, on obtient le complexe de 1,5-cyclooctadiène. Les ligands de dioléfine peuvent être éliminés par décomplexation en utilisant le cyanure.
Le monoxyde de carbone
L'agitation a methanol solution de RhCl 3 (H 2 O) 3 sous 1 bar de monoxyde de carbone produit l'anion dicarbonyldichlororhodate (I), [RhCl 2 (CO) 2] -. Le traitement des solides RhCl 3 (H 2 O) 3 CO avec écoulant donne [RhCl (CO) 2] 2, un solide rouge qui à son tour se dissout dans des alcools en présence de chlorure de donner le dichlorure précité.
Nombreux Rh-CO-PR 3 (R = groupe organique) composés ont été préparés dans le cadre de vastes enquêtes sur hydroformylation catalyse. RhCl (PPh 3) 3 réagit avec le CO pour donner trans-RhCl (CO) (PPh 3) 2, analogue à stoechiométriquement mais moins réactifs que Complexe de Vaska. Ce même composé peut être préparé en utilisant du formaldehyde à la place du CO. Trans-RhCl (CO) (PPh 3) 2 réagit avec un mélange de NaBH 4 et PPh 3 donne RhH (CO) (PPh 3) 3.
Rhodium et de la catalyse
Commençant en particulier dans les années 1960, RhCl 3 (H 2 O) 3 a été démontré que catalytiquement actif pour une variété de réactions impliquant CO, H 2, et l'alcène . Par exemple, RhCl 3 (H 2 O) 3 a été montré pour dimériser l'éthène à un mélange de cis et trans 2-butène:
- 2 C 2 H 4 → CH 3 -CH = CH-CH 3
(Malheureusement cette réaction échoue pour alcènes supérieurs).
Au cours des décennies suivantes, cependant, la catalyse à base de rhodium a souligné réactions dans des solvants organiques utilisant des ligands organiques à la place de H 2 O. Ainsi, la dimérisation de l'éthylène a été montré pour impliquer catalyse par Rh 2 Cl 2 (C 2 H 4) 4. Ceci et beaucoup découvertes connexes a nourri le jeune alors domaine de "catalyse homogène", dans lequel les catalyseurs sont dissous dans le milieu avec le substrat. Avant cette époque, la plupart des catalyseurs métalliques étaient «hétérogène», ce est à dire les catalyseurs étaient solides et les substrats étaient soit liquide ou de gaz.
Un progrès significatif dans la catalyse homogène a été la découverte que PPh 3 -derived sont particulièrement complexes à activité catalytique, ainsi que soluble dans les solvants organiques. Mieux connu des catalyseurs de phosphine est soutenu RhCl (PPh3) 3,: qui catalyse l' hydrogénation et l'isomérisation d'alcènes. Le hydroformylation. des alcènes est catalysée par la RhH connexe (CO) (PPh 3) 3. Catalyse par le rhodium est si efficace qu'il a déplacé considérablement la technologie précédente sur la base des catalyseurs de cobalt moins coûteux.
Sécurité
Rhodium (III) chlorure ne est pas répertorié dans l'annexe I de La directive 67/548 / CEE, mais elle est généralement classé comme nuisible, R22: Nocif en cas d'ingestion. Certains composés de Rh ont été étudiés en tant que médicaments anticancéreux. Le rhodium est pas un élément essentiel.
Il est inscrit à l'inventaire de la Toxic Substances Control Act (TSCA).
