
L'acide formique
À propos de ce écoles sélection Wikipedia
Enfants SOS offrent un chargement complet de la sélection pour les écoles pour une utilisation sur les intranets des écoles. parrainage SOS enfant est cool!
| L'acide formique | |
|---|---|
 |  |
L'acide formique | |
Autres noms acide carboxylique de l'hydrogène | |
| Identificateurs | |
| Numéro CAS | 64-18-6 |
| Numéro RTECS | LQ4900000 |
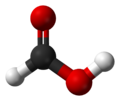
| images de Jmol-3D | Image 1 |
SMILES
| |
| Propriétés | |
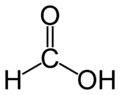
| Formule moléculaire | CH 2 O 2 HCOOH |
| Masse molaire | 46,0254 g / mol |
| Apparence | Liquide incolore, fumant |
| Densité | 1,22 g / mL, liquide |
| Point de fusion | 8,4 ° C (47,1 ° F) |
| Point d'ébullition | 100,8 ° C (213,3 ° F) |
| Solubilité dans l'eau | Miscible |
| Acidité (p K a) | 3,744 |
| Viscosité | 1,57 c P à 26 ° C |
| Structure | |
| Forme moléculaire | Planar |
| Moment de dipôle | 1,41 D (gaz) |
| Risques | |
| FS | MSDS externe |
| Phrases-R | R10, R35 |
| Phrases S | (S1 / 2), S23, S26, S45 |
| Principal dangers | Corrosif; irritant; sensibilisateur. |
| NFPA 704 |  2 3 0 |
| Point d'éclair | 69 ° C (156 ° F) |
| Des composés apparentés | |
| Connexes acides carboxyliques | Acide acétique L'acide propionique |
| Des composés apparentés | Formaldéhyde Méthanol |
| Page de données supplémentaire | |
| Structure et propriétés | n, ε r, etc. |
| Thermodynamique données | comportement de phase Solide, liquide, gaz |
| Les données spectrales | UV, IR, RMN , MS |
| Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
L'acide formique (systématiquement appelé acide formique) est le plus simple de l'acide carboxylique . Sa formule est H C O OH ou CH 2 O 2. Ce est un intermédiaire importante dans la synthèse chimique a lieu et naturellement, notamment dans le venin de l'abeille et la fourmi piqûres.
Dans la nature , il se trouve dans la piqûres et morsures de nombreux insectes de l'ordre des hyménoptères , principalement des fourmis . Ce est également un important produits de combustion résultant de alimenté en carburant alternatif véhicules en feu méthanol (et l'éthanol , de la contamination par l'eau ) lorsqu'il est mélangé avec essence. Son nom vient du latin mot pour fourmi, formica, se référant à son début isolement par la distillation des organes de fourmis. Un composé chimique tel qu'un sel de la neutralisation de l'acide formique avec un de base, ou un ester dérivé de l'acide formique, est désigné sous le formiate (ou méthanoate). Le formiate d'ions a la formule HCOO -.
Propriétés
L'acide formique est miscible avec l'eau et la plupart polaires organiques solvants , et peu soluble dans des hydrocarbures. Dans les hydrocarbures et dans la phase vapeur, il est en fait constitué de dimères à liaison hydrogène plutôt que de molécules individuelles. Dans la phase gazeuse, les résultats de cette formant des liaisons hydrogène dans écarts graves de la loi des gaz parfaits. Acide formique liquide et solide est constitué d'un réseau infini de manière efficace des molécules d'acide formique à liaison hydrogène.
Part d'acide formique plupart des propriétés chimiques d'autres acides carboxyliques , bien que dans des conditions normales elle ne formera pas un navigateur chlorure d'acyle ou un anhydride d'acide. Jusqu'à très récemment, toutes les tentatives pour former un de ces dérivés ont permis de monoxyde de carbone à la place. Il a maintenant été montré que l'anhydride peut être produit par réaction du fluorure de formyle avec du formiate de sodium à -78 ° C, et le chlorure en faisant passer du HCl dans une solution de 1-formimidazole en monochlorométhane à -60 ° C. La chaleur peut également provoquer la décomposition de l'acide formique et le monoxyde de carbone et l'eau. Part de l'acide formique certains de la propriétés de réduction de aldéhydes.
L'acide formique est unique parmi les acides carboxyliques dans sa capacité à participer à des réactions d'addition avec des alcènes . Formique et alcènes réagissent facilement pour former formate esters. En présence de certains acides, notamment sulfurique et acide fluorhydrique, toutefois, une variante de la Réaction de Koch a lieu à la place, et l'acide formique ajoute à l'alcène pour produire un acide carboxylique plus grande.
La plupart des sels de formiate sont simples eau soluble . Ce est également un composé bi-fonctionnel.
Production
Une quantité importante de l'acide formique est produit comme sous-produit dans la fabrication d'autres produits chimiques, en particulier l'acide acétique . Cette production est insuffisante pour répondre à la demande actuelle pour l'acide formique et de l'acide formique doit être produite pour son propre bien.
Lorsque le methanol et le monoxyde de carbone sont combinés en présence d'un fort base, le dérivé de l'acide formique Résultats de formiate de méthyle, selon le équation chimique
Dans l'industrie, cette réaction est effectuée en phase liquide à pression élevée. Les conditions réactionnelles typiques sont de 80 ° C et 40 atm. La base la plus largement utilisée est le méthylate de sodium. L'hydrolyse du formiate de méthyle produit de l'acide formique:
Hydrolyse directe de formiate de méthyle nécessite un grand excès d' eau pour procéder efficacement, et certains producteurs effectuer par une voie indirecte faisant d'abord réagir le formiate de méthyle avec l'ammoniac pour produire formamide, puis l'hydrolyse du formamide avec l'acide sulfurique pour produire de l'acide formique:
Cette technique a ses propres problèmes, en particulier l'élimination de la sulfate d'ammonium sous-produit, l'énergie de sorte que certains fabricants ont récemment développé des moyens efficaces de séparation de l'acide formique à partir du grand excès d'eau utilisée dans l'hydrolyse directe. Dans un de ces procédés (utilisé par BASF) l'acide formique est éliminé de l'eau par l'intermédiaire de extraction liquide avec une base organique.
Dans le laboratoire de l'acide formique peut être obtenu par chauffage l'acide oxalique anhydre dans glycérol et l'extraction par distillation à la vapeur. Une autre préparation (qui doit être effectuée sous une hotte) est l'acide hydrolyse de isonitrile éthyle en utilisant du HCl solution.
- C 2 H 5 NF + 2 H 2 O → C 2 H 5 NH 2 + HCOOH
L'isonitrile étant obtenu en faisant réagir amine d'éthyle avec chloroforme (noter que la hotte est nécessaire en raison de l'odeur désagréable de la irrésistiblement isonitrile).
Utilisations
La principale utilisation de l'acide formique est comme un conservateur et antibactérien agent dans l'alimentation du bétail. Lorsqu'ils sont pulvérisés sur des produits frais foin ou autre ensilage, il arrête certains processus de décomposition et provoque l'alimentation de conserver sa valeur nutritive plus, et il est largement utilisé pour conserver l'alimentation hivernale pour le bétail . Dans la volaille industrie, il est parfois ajouté à nourrir de tuer la bactérie salmonella. Autres utilisations:
- Il est utilisé pour traiter le latex organique (SAP) dans brute caoutchouc .
- Les apiculteurs utilisent l'acide formique comme acaricide contre le trachéale ( Acarapis woodi) acariens et de la Acarien Varroa.
- Il est d'une importance mineure dans le textile l'industrie et pour la tannage de cuir.
- Certains formate esters sont des arômes artificiels ou des parfums.
- Ce est l'ingrédient actif dans certaines marques de ménages détartrant.
- Il est utilisé dans les laboratoires comme modificateur de solvant Séparations HPLC de protéines et de peptides, en particulier lorsque l'échantillon est en cours de préparation pour la spectrométrie de masse analyse.
- Il est utilisé par les laboratoires de pathologie clinique pour désinfecter prion activité dans des échantillons de cerveau
En chimie organique de synthèse, de l'acide formique est souvent utilisé comme une source de ion hydrure. Le Réaction d'Eschweiler-Clarke et le Réaction de Leuckart-Wallach sont des exemples de cette application. Il est également utilisé comme source d'hydrogène en transférer hydrogénation.
Dans le laboratoire de l'acide formique est également utilisé comme source de monoxyde de carbone , qui est libéré par addition d' acide sulfurique . L'acide formique est aussi une source de un groupe formyle par exemple dans le formylation de N-méthylaniline à méthylformanilide dans le toluène .
Les piles à combustible qui utilisent modifiés acide formique sont prometteurs.
Histoire
Dès le 15ème siècle, certains alchimistes et naturalistes étaient conscients que fourmilières dégageaient une vapeur acide. La première personne qui décrivent l'isolement de cette substance (par distillation d'un grand nombre de fourmis) était le anglais naturaliste John Ray, en 1671. Les fourmis sécrètent l'acide formique à des fins d'attaque et de défense. L'acide formique a été synthétisé à partir d' acide cyanhydrique par le Français chimiste Joseph Gay-Lussac. En 1855, un autre chimiste français, Marcellin Berthelot, a développé une synthèse de monoxyde de carbone qui est similaire à celui utilisé aujourd'hui.
Dans l'industrie chimique, l'acide formique a longtemps été considéré comme un composé chimique d'intérêt industriel que mineur. À la fin des années 1960, cependant, d'importantes quantités de ce est devenu disponible en tant que sous-produit de l'acide acétique production. Il se trouve maintenant utilisation croissante comme conservateur et antibactérien dans l'alimentation du bétail.
Sécurité
Le principal danger de l'acide formique est de contact avec la peau ou les yeux avec de l'acide formique liquide ou avec les vapeurs concentrées. Chacune de ces voies d'exposition peut causer de graves brûlures chimiques, et l'exposition des yeux peut entraîner des dommages permanents aux yeux. Vapeurs inhalées peuvent de même provoquer des irritations ou des brûlures dans les voies respiratoires. Étant donné que le monoxyde de carbone peut également être présent dans les vapeurs de l'acide formique, il faut prendre soin où de grandes quantités de fumées d'acide formique sont présents. Les É.U OSHA exposition admissible Niveau ( PEL) de la vapeur d'acide formique dans le milieu de travail est de 5 parties par million de parties d'air ( ppm).
L'acide formique est rapidement métabolisé et éliminé par le corps. Néanmoins, certains effets chroniques ont été documentés. Quelques expériences sur les animaux ont démontré que ce était un mutagène, et l'exposition chronique peuvent endommager le foie ou les reins. Une autre possibilité à une exposition chronique est le développement d'une peau allergie qui se manifeste à la ré-exposition au produit chimique.
Les risques de solutions d'acide formique dépendent de la concentration. Le tableau suivant dresse la liste des Classer les solutions d'acide formique de l'UE:
| Concentration ( pour cent en poids) | Classification | Phrases R |
|---|---|---|
| 2% -10% | Irritant (Xi) | R36 / 38 |
| 10% -90% | Corrosif (C) | R34 |
| > 90% | Corrosif (C) | R35 |
Une dosage de l'acide formique dans des fluides corporels, conçus pour la détermination de formiate après intoxication par le méthanol, est basé sur la réaction de formiate de formiate déshydrogénase bactérienne.
