
Carbone
Renseignements généraux
SOS Enfants, qui se déroule près de 200 sos écoles dans le monde en développement, a organisé cette sélection. Voulez-vous savoir sur le parrainage? Voir www.sponsorachild.org.uk
| Carbone | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
6 C | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||
clair (diamant) et noir (graphite)  Raies spectrales de carbone | |||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||
| Nom, symbole, nombre | carbone, C, 6 | ||||||||||||||||||||||||||||||
| Prononciation | / k ɑr b ən / | ||||||||||||||||||||||||||||||
| Catégorie Metallic | non métalliques | ||||||||||||||||||||||||||||||
| Groupe, période, bloc | 14, 2, p | ||||||||||||||||||||||||||||||
| Poids atomique standard | 12,011 (1) | ||||||||||||||||||||||||||||||
| Configuration électronique | [Il] 2s 2 2p 2 2, 4 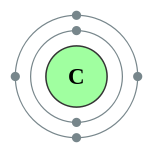 | ||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||
| Découverte | Egyptiens et Sumériens (3750 BC) | ||||||||||||||||||||||||||||||
| Reconnu comme un élément par | Antoine Lavoisier (1789) | ||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||
| Densité (à proximité rt) | amorphe: 1.8 à 2.1 g · cm -3 | ||||||||||||||||||||||||||||||
| Densité (à proximité rt) | diamant: 3,515 g · cm -3 | ||||||||||||||||||||||||||||||
| Densité (à proximité rt) | graphite: 2,267 g · cm -3 | ||||||||||||||||||||||||||||||
| Point de sublimation | 3915 K, 3642 ° C, 6588 ° F | ||||||||||||||||||||||||||||||
| Point triple | 4600 K (4327 ° C), 10 800 kPa | ||||||||||||||||||||||||||||||
| La chaleur de fusion | 117 (graphite) kJ · mol -1 | ||||||||||||||||||||||||||||||
| Capacité thermique molaire | 6.155 (diamant) 8,517 (graphite) J · mol -1 · K -1 | ||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||
| États d'oxydation | 4, 3, 2, 1, 0, -1, -2 , -3 , -4 | ||||||||||||||||||||||||||||||
| Électronégativité | 2,55 (échelle de Pauling) | ||||||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 1086,5 kJ · mol -1 | ||||||||||||||||||||||||||||||
| 2ème: 2352,6 kJ · mol -1 | |||||||||||||||||||||||||||||||
| 3ème: 4620,5 kJ · mol -1 | |||||||||||||||||||||||||||||||
| Rayon covalente | 77 (sp³), 73 (sp²), 69 (sp) h | ||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 170 h | ||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||
| Crystal structure | diamant (Diamant, clair) | ||||||||||||||||||||||||||||||
simples hexagonale  (Graphite, noir) | |||||||||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | ||||||||||||||||||||||||||||||
| Conductivité thermique | 900-2300 (diamant) 119-165 (graphite) W · m -1 · K -1 | ||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 0,8 (diamant) um · m -1 · K -1 | ||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 18 350 (diamant) m · s -1 | ||||||||||||||||||||||||||||||
| Le module d'Young | 1050 (diamant) GPa | ||||||||||||||||||||||||||||||
| Module de cisaillement | 478 (diamant) GPa | ||||||||||||||||||||||||||||||
| Module Bulk | 442 (diamant) GPa | ||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,1 (diamant) | ||||||||||||||||||||||||||||||
| Dureté Mohs | 10 (diamant) 2.1 (graphite) | ||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-44-0 | ||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||
| Article détaillé: Isotopes du carbone | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Carbon (à partir latine : carbo «charbon») est l' élément chimique avec le symbole C et de numéro atomique six. En tant que membre de groupe 14 sur le tableau périodique , il est non métallique et tétravalent fabrication quatre électrons disponibles pour former des liaisons chimiques covalentes. Il ya trois naturels isotopes , avec C 12 et 13 C étant stable, tandis que 14 C est radioactifs, avec une décomposition de demi-vie d'environ 5730 années. Le carbone est l'un des quelques éléments connus depuis l'antiquité.
Il y a plusieurs allotropes de carbone dont les plus connus sont graphite, le diamant , et carbone amorphe. Le propriétés physiques de carbone varient considérablement avec la forme allotropique. Par exemple, le diamant est très transparent, alors que le graphite est opaque et noir. Diamond est parmi les matériaux les plus durs connus, tandis que le graphite est suffisamment souple pour former une série sur papier (d'où son nom, du mot grec "écrire"). Diamant a une très faible conductivité électrique, tandis que le graphite est un très bon conducteur. Dans des conditions normales, le diamant, nanotube de carbone et graphène ont le plus haut les conductivités thermiques du tous les matériaux connus.
Tous allotropes de carbone sont des solides dans des conditions normales avec le graphite étant le plus forme thermodynamiquement stable. Ils sont résistants chimiquement et nécessitent une température élevée à réagir, même avec de l'oxygène. La plus courante état d'oxydation du carbone dans les composés inorganiques est 4, alors que deux se trouve dans le monoxyde de carbone et d'autres métaux de transition des complexes de carbonyle. Les plus importantes sources de carbone inorganique sont calcaires, dolomies et dioxyde de carbone , mais des quantités importantes se produisent dans des dépôts organiques de charbon , la tourbe, l'huile et clathrates de méthane. Carbone forme plus composés que de tout autre élément, avec près de dix millions de purs composés organiques décrites à ce jour, qui à leur tour sont une infime fraction de ces composés qui sont théoriquement possible dans des conditions normales.
Le carbone est le 15 élément le plus abondant dans la croûte de la Terre, et de la quatrième élément le plus abondant dans l'univers en masse après l'hydrogène , l'hélium et l'oxygène . Elle est présente dans toutes les formes de vie connues, et le carbone du corps humain est le deuxième élément le plus abondant de la masse (environ 18,5%) après l'oxygène. Cette abondance, ainsi que la diversité unique de composés organiques et leur capacité de formation du polymère inhabituelle aux températures couramment rencontrées sur Terre , faire de cet élément de la base chimique de toute la vie connue.
Caractéristiques
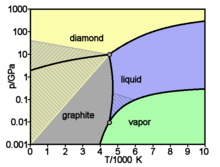
Les différentes formes ou allotropes de carbone (voir ci-dessous) comprennent la substance naturelle la plus dure, le diamant , et aussi l'un des plus doux substances connues, graphite. En outre, il a une affinité pour la liaison avec d'autres petits atomes , y compris d'autres atomes de carbone, et est capable de former multiple stable des liaisons covalentes avec ces atomes. Par conséquent, le carbone est connu de former près de dix millions de composés différents; la grande majorité de tous les composés chimiques . Carbon a également le plus haut point de tous les éléments de sublimation. À la pression atmosphérique, il n'a pas de point de fusion comme son point triple est à 10,8 ± 0,2 MPa et 4600 ± 300 K (~ 4330 ° C ou 7820 ° F), il se sublime à environ 3900 K.
se sublime de carbone dans un arc de carbone qui a une température d'environ 5800 K (5530 ° C; 9980 ° F). Ainsi, quelle que soit sa forme allotropique, le carbone reste solide à des températures plus élevées que les plus hauts des métaux à point de fusion tels que le tungstène ou le rhénium . Bien que thermodynamiquement sensibles à l'oxydation, résiste à l'oxydation du carbone de façon plus efficace que des éléments tels que le fer et le cuivre qui sont des agents réducteurs les plus faibles à la température ambiante.
Les composés de carbone constituent la base de toute vie connue sur la Terre , et de la le cycle carbone-azote fournit une partie de l'énergie produite par le soleil et les autres étoiles. Bien qu'il constitue une extraordinaire variété de composés, la plupart des formes de carbone sont relativement non réactif dans les conditions normales. A température et pression normales, mais il résiste à toutes les oxydants forts. Il ne réagit pas avec l'acide sulfurique , l'acide chlorhydrique , du chlore ou d'alcalis. A des températures élevées carbone réagit avec l'oxygène pour former des oxydes de carbone, et réduire les oxydes métalliques tels que l'oxyde de fer au métal. Cette réaction exothermique est utilisée dans l'industrie du fer et de l'acier pour contrôler la teneur en carbone de l'acier:
- Fe 3 O 4 + 4 C (s) → 3 Fe (s) + 4 CO (g)
avec le soufre pour former le disulfure de carbone et de vapeur d'eau dans la réaction charbon-gaz:
- C (s) + H 2 O (g) → CO (g) + H2 (g).
Carbone se combine avec certains métaux à des températures élevées pour former des carbures métalliques tels que le carbure de fer cémentite en acier, et le carbure de tungstène, largement utilisé en tant que abrasif et pour faire des conseils durs pour outils de coupe.
En 2009, graphène semble être le matériau le plus résistant jamais testé. Cependant, le processus de séparation à partir de graphite, il faudra un certain développement technologique avant qu'il ne soit suffisamment économique pour être utilisé dans les procédés industriels.
Le système de allotropes de carbone se étend sur une plage des extrêmes:
| Synthétique nanocrystalline diamant est le matériau le plus dur connu. | Le graphite est l'une des matières les plus douces connues. |
| Le diamant est le nec plus ultra abrasif. | Le graphite est un très bon lubrifiant, figurent superlubricity. |
| Diamond est un excellent électrique isolateur. | Le graphite est un conducteur de l'électricité. |
| Le diamant est le plus connu d'origine naturelle conducteur thermique | Certaines formes de graphite sont utilisés pour isolation thermique (c.-à-pare-feu et des boucliers thermiques) |
| Le diamant est hautement transparent. | Le graphite est opaque. |
| Diamant cristallise dans le système cubique. | Graphite cristallise dans le système hexagonal. |
| Carbone amorphe est offert isotrope. | Les nanotubes de carbone sont parmi les plus matériaux anisotropes jamais produit. |
Allotropes
Carbone atomique est une espèce très courte durée de vie et, par conséquent, le carbone est stabilisé dans diverses structures multi-atomiques avec différentes configurations moléculaires appelés allotropes . Les trois allotropes relativement bien connus de carbone sont carbone amorphe, graphite et le diamant . Autrefois considéré comme exotique, fullerènes sont aujourd'hui couramment synthétisés et utilisés dans la recherche; ils comprennent buckyballs, Les nanotubes de carbone, nanobuds de carbone et nanofibres. Plusieurs autres formes allotropiques exotiques ont également été découvert, tel que lonsdaléite, le carbone vitreux, nanomousse de carbone et carbone acétylénique linéaire (carbyne).
Le forme amorphe est un assortiment d'atomes de carbone dans un non-cristallin, irrégulière, état vitreux, qui est essentiellement graphite et non maintenu dans une macrostructure cristalline. Elle est présente sous forme de poudre, et est le principal constituant de substances telles que charbon de bois, noir de fumée ( suie) et charbon actif. À des pressions normales carbone prend la forme de graphite, dans laquelle chaque atome est lié à trois autres trigone dans un plan composé d'fusionnés hexagonaux anneaux, tout comme dans celles des hydrocarbures aromatiques. Le réseau résultant est deux dimensions, et les feuilles plates résultantes sont empilées et vaguement lié par la faiblesse de van der Waals . Cela donne graphite sa douceur et sa propriétés de clivage (les feuilles glissent facilement devant l'autre). En raison de la délocalisation de l'un des électrons externes de chaque atome pour former un π-Cloud, le graphite conduit l'électricité , mais seulement dans le plan de chaque lié de façon covalente feuille. Il en résulte un encombrement plus faible conductivité électrique pour le carbone que pour la plupart des métaux . La délocalisation représente aussi pour la stabilité énergétique de graphite sur le diamant à la température ambiante.
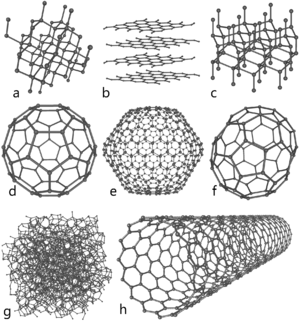
À des pressions très élevées carbone forme la plus compacte allotrope diamant , ayant près de deux fois la densité de graphite. Ici, chaque atome est lié en tétraèdre à quatre autres, permettant ainsi un réseau à 3 dimensions de plissées cycles à six chaînons d'atomes. Le diamant a la même de structure cubique comme le silicium et le germanium et en raison de la force de la liaison carbone-carbone liaisons , ce est la substance naturelle la plus dure en termes de résistance à la rayure . Contrairement à la croyance populaire que " les diamants sont éternels ", ils sont en fait thermodynamiquement instable dans des conditions normales et se transforment en graphite. Toutefois, en raison d'une barrière d'énergie d'activation élevée, la transition en graphite est ainsi extrêmement lente à la température ambiante pour être imperceptible. Dans certaines conditions, le carbone cristallise en tant que lonsdaléite. Cette forme a une hexagonale cristal réseau où tous les atomes sont liés de manière covalente. Par conséquent, toutes les propriétés d'lonsdaléite sont proches de celles du diamant.
Les fullerènes ont une structure de type graphite, mais au lieu de purement emballage hexagonale, ils contiennent également des pentagones (ou même heptagones) d'atomes de carbone, qui plient la feuille dans des sphères, des ellipses ou des cylindres. Les propriétés des fullerènes (divisé en buckyballs, buckytubes et nanobuds) ne ont pas encore été entièrement analysé et représenter un champ intense de recherche dans nanomatériaux. Les noms "fullerène» et «buckyball" sont donnés après Richard Buckminster Fuller, vulgarisateur de dômes géodésiques, qui ressemblent à la structure des fullerènes. Les buckyballs sont assez grandes molécules formées entièrement en carbone lié trigone, formant sphéroïdes (la plus connue et la plus simple est la forme soccerball-C 60 buckminsterfullerene). Les nanotubes de carbone sont structurellement similaires aux fullerènes, sauf que chaque atome est lié trigone dans une feuille incurvée qui forme un creux cylindre. Nanobuds ont été rapportées en 2007 et sont des matériaux hybrides Bucky tubes / buckyball (buckyballs sont liés de manière covalente à la paroi extérieure d'un nanotube) qui combinent les propriétés à la fois dans une structure unique.
Parmi les autres allotropes découverts, nanomousse de carbone est un allotrope ferromagnétique découvert en 1997. Il se compose d'une faible densité cluster assemblage d'atomes de carbone se enchaînent dans une toile tridimensionnelle lâche, dans lequel les atomes sont liés trigone dans les anneaux de six et sept chaînons. Il est parmi les plus légers solides connus, avec une densité d'environ 2 kg / m 3. De même, carbone vitreux contient une forte proportion de fermeture porosité, mais contrairement à graphite normale, les couches de graphite ne sont pas empilés comme les pages d'un livre, mais un arrangement plus aléatoire. Linear carbone acétylénique a la structure chimique - (C ::: C) n -. Carbone dans cette modification est linéaire avec sp hybridation orbital, et est un polymère avec alternance des liaisons simples et triples. Ce type de carbyne est d'un intérêt considérable pour la nanotechnologie comme son Le module de Young est quarante fois supérieur à celui de la matière la plus dure connue - diamant.
Occurrence


Le carbone est le quatrième élément chimique le plus abondant dans l'univers en masse après l'hydrogène, l'hélium et oxygène. Le carbone est abondant dans les Sun , étoiles , comètes , et dans le atmosphères de la plupart des planètes . Certains météorites contiennent des diamants microscopiques qui ont été formées lorsque le système solaire était encore un disque protoplanétaire. Diamants microscopiques peuvent également être formées par la pression intense et haute température sur les sites des impacts de météorites.
En combinaison avec de l'oxygène en dioxyde de carbone , le carbone se trouve dans l'atmosphère de la terre (environ 810 gigatonnes de carbone) et dissous dans tous les plans d'eau (environ 36 000 gigatonnes de carbone). Environ 1 900 gigatonnes de carbone sont présents dans la biosphère . Hydrocarbures (tels que le charbon , le pétrole et le gaz naturel ) contiennent du carbone que bien charbon «réserves» (et non «Ressources») se élèvent à environ 900 gigatonnes, et réserves de pétrole autour de 150 gigatonnes. Sources prouvées de gaz naturel sont environ 175 10 12 mètres cubes (représentant environ 105 gigatonnes de carbone), mais on estime qu'il ya aussi environ 900 10 12 mètres cubes de gaz «non conventionnelles» telles que gaz de schiste, ce qui représente environ 540 gigatonnes de carbone. (Dans le passé, les quantités d'hydrocarbures étaient plus. Dans la période de 1751 à 2008 environ 347 gigatonnes de carbone ont été libérés que le dioxyde de carbone dans l'atmosphère provenant de la combustion de combustibles fossiles.) Carbone est également enfermé comme le méthane et hydrates de méthane dans les régions polaires. On estime qu'au moins 1400 Gt de carbone est sous cette forme juste (et sous) le sous-marin pergélisol de la Plateau sibérien.
Le carbone est un élément majeur dans de très grandes masses de carbonate de roche ( calcaire, dolomite, marbre et ainsi de suite). charbon est la principale source commerciale de carbone minéral, ce qui représente 4 000 gigatonnes ou 80% de carburant de carbone fossile. Il est également riche en carbone - par exemple, anthracite contient 92 à 98%.
Quant aux formes allotropiques de carbone individuels, du graphite se trouve en grande quantité dans le États-Unis (principalement en New York et Texas), la Russie , le Mexique , le Groenland et l'Inde . Les diamants naturels se produisent dans la roche kimberlite, a trouvé dans les anciens volcaniques "cou", ou "tuyaux". La plupart des gisements de diamants sont en Afrique , notamment en Afrique du Sud , la Namibie , le Botswana , la République du Congo et la Sierra Leone . Il ya aussi des dépôts dans Arkansas, le Canada , la Russie de l'Arctique , le Brésil et dans le Nord et de l'Ouest Australie . Les diamants sont désormais également récupérés à partir du fond de l'océan au large de la Cap de Bonne Espérance. Toutefois, si les diamants sont naturellement présents, environ 30% de tous les diamants industriels utilisés aux États-Unis sont maintenant fait synthétiquement.
Le carbone 14 est formé dans les couches supérieures de la troposphère et la stratosphère, à une altitude de 9-15 km, par une réaction qui est précipité par les rayons cosmiques. Les neutrons thermiques sont produits qui entrent en collision avec les noyaux d'azote-14, formant le carbone-14 et un proton.
Isotopes
Les isotopes de carbone sont des noyaux atomiques qui contiennent six protons plus un certain nombre de neutrons (variant de 2 à 16). Le carbone a deux, naturellement stables isotopes . L'isotope carbone 12 (12 C) constitue 98,93% du carbone sur la Terre, tandis que carbone-13 (13C) forme le 1,07% restant. La concentration de 12 C est encore accrue dans les matières biologiques parce que les réactions biochimiques discrimination contre 13 C. En 1961, le Union internationale de chimie pure et appliquée (UICPA) a adopté l'isotope comme base de carbone-12 poids atomiques. Identification de carbone dans Expériences de RMN se fait avec l'isotope 13 C.
Le carbone 14 (14 C) est un phénomène naturel radio-isotope qui se produit dans l'état de traces sur la Terre jusqu'à une partie par trillion (0,0000000001%), la plupart du temps confinés dans les dépôts atmosphériques et superficielles, en particulier des la tourbe et d'autres matières organiques. Cet isotope se désintègre par 0,158 MeV β - émissions. En raison de sa relativement courte demi-vie de 5730 ans 14 C est pratiquement absente dans les roches anciennes, mais est créé dans le la haute atmosphère (inférieure stratosphère et supérieure troposphère) par interaction de l'azote avec les rayons cosmiques. L'abondance de 14 C dans le atmosphère et dans les organismes vivants est presque constant, mais diminue prévisible dans leur corps après la mort. Ce principe est utilisé dans datation au radiocarbone, inventé en 1949, qui a été largement utilisé pour déterminer l'âge des matières carbonées avec des âges allant jusqu'à environ 40000 années.
Il ya 15 isotopes connus de carbone et la plus courte durée de ceux-ci est 8 C qui se désintègre par protons et émissions désintégration alpha et a une demi-vie de 1.98739x10 -21 s. L'exotique 19 C présente une halogéno nucléaire, ce qui signifie que son rayon est sensiblement plus grande que celle qui serait attendue si le noyau se agissait d'un domaine constant de densité .
Formation dans les étoiles
La formation du noyau de l'atome de carbone nécessite une triple collision presque simultanée de les particules alpha ( hélium noyaux) dans le noyau d'une géant ou étoiles supergéante qui est connu sous le nom processus triple alpha, que les produits de d'autres réactions de fusion nucléaire de l'hélium avec de l'hydrogène ou d'un autre produit de l'hélium noyau lithium-5 et béryllium 8, respectivement, les deux qui sont très instables et se désintègrent presque instantanément de retour en petits noyaux. Cela se produit dans des conditions de températures plus de 100 megakelvin concentration et d'hélium que l'expansion rapide et le refroidissement de l'univers début interdites, et donc pas de carbone significative n'a été créés au cours de la Big Bang . Au lieu de cela, l'intérieur des étoiles dans le branche horizontale transformée de trois noyaux d'hélium en carbone au moyen de ce triple processus-alpha. Afin d'être disponible pour la formation de la vie comme nous le savons, ce carbone doit ensuite plus tard être dispersé dans l'espace sous forme de poussière, en supernovae explosions, dans le cadre de la matière qui se forme plus tard seconde, les systèmes d'étoiles de troisième génération qui ont planètes désactualisées partir cette poussière. Le système solaire est une telle troisième génération de système d'étoiles. Un autre des étoiles mécanismes de fusion de Propulsion est le Cycle CNO, dans lequel les actes de carbone comme catalyseur pour permettre à la réaction de se dérouler.
Les transitions de rotation des différentes formes isotopiques de monoxyde de carbone (par exemple, 12 CO, CO 13 et C 18 O) sont détectables dans le submillimétrique gamme de longueurs d'onde, et sont utilisés dans l'étude de nouvellement formé étoiles dans nuages moléculaires.
le cycle du carbone
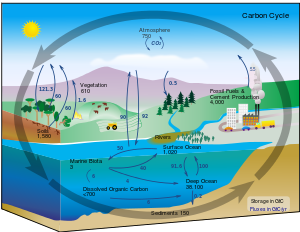
Dans des conditions terrestres, la conversion d'un élément à un autre est très rare. Par conséquent, la quantité de carbone sur Terre est effectivement constante. Ainsi, les processus qui utilisent le carbone doivent obtenir quelque part et disposer ailleurs. Les chemins qui suit carbone dans l'environnement constituent la cycle du carbone. Par exemple, les plantes puisent dioxyde de carbone sur leur environnement et l'utiliser pour construire la biomasse, comme dans respiration de carbone ou le Cycle de Calvin, un processus de la fixation du carbone. Une partie de cette biomasse est consommée par des animaux, alors que peu de carbone exhalé par les animaux est le dioxyde de carbone. Le cycle du carbone est beaucoup plus complexe que cette boucle courte; par exemple, une partie du dioxyde de carbone est dissous dans l'océan; végétaux morts ou de matières animales peuvent devenir pétrole ou le charbon , qui peut brûler avec la libération du carbone, devraient bactéries pas consommer.
Composés
Composés organiques
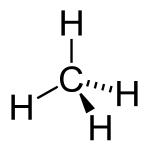
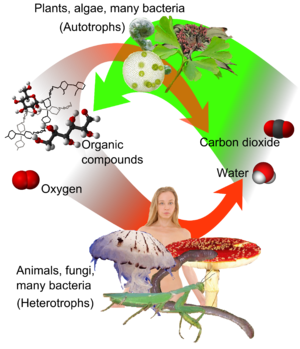
Le carbone a la capacité de former de très longues chaînes de l'interconnexion des liaisons CC. Cette propriété est appelée concaténation. Liaisons carbone-carbone sont solides et stables. Cette propriété permet carbone pour former un nombre presque infini de composés; en fait, il ya des composés contenant du carbone plus connu que tous les composés des autres éléments chimiques combinés l'exception de ceux de l'hydrogène (parce que presque tous les composés organiques contiennent de l'hydrogène trop).
La forme la plus simple d'une molécule organique est le hydrocarbonée une grande famille de molécules organiques qui sont composés d' hydrogène liés à des atomes d'une chaîne d'atomes de carbone. Longueur de la chaîne, des chaînes latérales et groupes fonctionnels affectent tous les propriétés des molécules organiques. Par La définition de l'UICPA, tous les autres composés organiques sont des composés fonctionnalisés d'hydrocarbures.
Carbone se produit dans tous connus la vie organique et constitue la base de la chimie organique . Lorsque uni à l'hydrogène , il forme différents hydrocarbures qui sont importantes pour l'industrie que réfrigérants, des lubrifiants, des solvants , comme intermédiaires de synthèse chimique pour la fabrication de matières plastiques et pétrochimie et que les combustibles fossiles .
Lorsqu'il est combiné avec de l'oxygène et de l'hydrogène, le carbone peut former de nombreux groupes de composés biologiques importants, notamment les sucres , lignanes, chitines, des alcools , graisses et aromatique des esters, caroténoïdes et terpènes. Avec de l'azote , il se forme des alcaloïdes, et avec l'addition de soufre il forme également des antibiotiques , des acides aminés et caoutchouc produits. Avec l'addition de phosphore de ces autres éléments, il se forme de l'ADN et ARN, les transporteurs de produits chimiques code de la vie, et l'adénosine triphosphate (ATP), molécule énergétique de transfert le plus important dans toutes les cellules vivantes.
Composés inorganiques
Généralement les composés qui sont associés à des minéraux ou qui ne contiennent pas un atome d'hydrogène ou un atome de fluor contenant du carbone, sont traités séparément de classiques des composés organiques ; Mais la définition ne est pas rigide (voir les articles de référence ci-dessus). Parmi ceux-ci sont les oxydes de carbone simples. L'oxyde le plus important est le dioxyde de carbone (CO 2). Ce était autrefois le principal constituant de la paleoatmosphere, mais est une composante mineure de l' atmosphère de la Terre aujourd'hui. Dissous dans l' eau , il forme l'acide carbonique (H 2 CO 3), mais comme la plupart des composés ayant de multiples atomes d'oxygène lié à simple sur un seul carbone, il est instable. Par cet intermédiaire, cependant, stabilisé par résonance carbonate ions sont produits. Certains minéraux importants sont les carbonates, notamment calcite . Le disulfure de carbone (CS 2) est similaire.
L'autre oxyde commun est le monoxyde de carbone (CO). Il est formé par une combustion incomplète, et est un gaz incolore et inodore. Les molécules contiennent chacun une triple liaison et sont assez polaire, d'où une tendance à se lier de manière permanente à des molécules d'hémoglobine, déplaçant l'oxygène, qui a une affinité de liaison inférieure. Cyanide (CN -), a une structure similaire, mais se comporte comme un ion halogénure ( pseudo). Par exemple, il peut se former du nitrure molécule de cyanogène ((CN 2)), similaire à halogénures diatomiques. D'autres oxydes sont rares sous-oxyde de carbone (C 3 O 2), le instable Monoxyde de dicarbone (C 2 O), trioxyde de carbone (CO 3), Cyclopentanepentone (C 5 O 5) Cyclohexanehexone (C 6 O 6), et anhydride mellitique (C 12 O 9).
Avec réactives des métaux tels que tungstène , de formes de carbone, soit carbures (C 4), ou acétylures (C 2-
2) pour former des alliages ayant des points de fusion élevés. Ces anions sont également associés à du méthane et d'acétylène , à la fois très faibles acides . Avec une électronégativité de 2,5, le carbone pour former préfère des liaisons covalentes. Quelques carbures sont des réseaux covalentes, comme carborundum (SiC), qui ressemble à diamant .
Composés organométalliques
Les composés organométalliques, par définition, contiennent au moins une liaison carbone-métal. Une large gamme de tels composés existent; les principales catégories comprennent des composés alkyl-métalliques simples (par exemple, plomb tétraéthyle), des composés η 2 alcène (par exemple, De composés η 3 -allyl de sel de Zeise), et (par exemple, allylpalladium chlorure dimère); métallocènes contenant des ligands cyclopentadiényle (par exemple, ferrocene); et transition des complexes de carbène de métal. Beaucoup métaux carbonyles existent (par exemple, tetracarbonylnickel); certains travailleurs considèrent le monoxyde de carbone ligand soit purement inorganique, et non organométallique.
Bien que le carbone est entendu pour former quatre liaisons exclusivement, un composé contenant un intéressant octaédrique hexacoordinés atome de carbone n'a été rapporté. Le cation du composé est le [(Ph 3 Pau) 6 C] 2+. Ce phénomène a été attribué au aurophilicity des ligands d'or.
Histoire et étymologie

L' Anglais nom vient du carbone latine carbo pour le charbon et le charbon de bois, d'où vient aussi le français charbon, ce qui signifie charbon. En allemand , néerlandais et Danois, les noms pour le carbone sont Kohlenstoff, koolstof et kulstof respectivement, tous signifiant littéralement charbon , substance.
Carbon a été découvert dans la préhistoire et était connu dans les formes de suie et charbon de bois pour les premiers humains civilisations . Des diamants ont été connus probablement dès 2500 BCE en Chine, tandis que le carbone sous forme de charbon a été faite autour de l'époque romaine par la même chimie telle qu'elle est aujourd'hui, par chauffage bois dans une pyramide recouvert d' argile pour exclure l'air.

En 1722, René Antoine Ferchault de Réaumur démontré que le fer a été transformé en acier par l'absorption d'une substance, maintenant connu pour être carbone. En 1772, Antoine Lavoisier a montré que les diamants sont une forme de carbone; quand il a brûlé échantillons de charbon de bois et de diamants et a constaté que ni produit de l'eau et que les deux publié la même quantité de dioxyde de carbone par g. En 1779, Carl Wilhelm Scheele a montré que le graphite, qui avait été considéré comme une forme de plomb , était à la place identique à charbon, mais avec un petit mélange de fer, et qu'il a donné "acide aérien" (son nom pour le dioxyde de carbone) lorsque oxydé avec nitrique acide. En 1786, les scientifiques français Claude Louis Berthollet, Gaspard Monge et Vandermonde CA confirmé que le graphite est principalement du carbone par oxydation en oxygène de la même manière Lavoisier avait fait avec le diamant. Certains fer a été de nouveau à gauche, où les scientifiques français pensaient était nécessaire à la structure de graphite. Cependant, dans leur publication ils ont proposé le nom carbone (de carbonum latine) pour l'élément dans le graphite qui a été émis comme un gaz à graphite brûlant. Antoine Lavoisier a ensuite énuméré carbone comme élément dans son manuel de 1789.
Une nouvelle allotrope du carbone, fullerène, qui a été découvert en 1985 comprend formes nanostructurées telles que buckyballs et nanotubes. Leurs découvreurs - Robert Curl, Harold Kroto et Richard Smalley - a reçu le Prix Nobel de chimie en 1996. Le regain d'intérêt pour de nouvelles formes résultant conduit à la découverte d'autres allotropes exotiques, y compris carbone vitreux, et la réalisation que " carbone amorphe "ne est pas strictement amorphe.
Production
Graphite
Commercialement viables gisements naturels de graphite se produisent dans de nombreuses régions du monde, mais les sources les plus importantes sont économiquement en Chine , l'Inde , le Brésil et la Corée du Nord . dépôts de graphite sont des métamorphique origine, a trouvé en association avec le quartz , mica et feldspaths dans les schistes, gneiss et métamorphosé grès et comme calcaire lentilles ou veines, parfois d'un mètre ou plus d'épaisseur. Gisements de graphite dans Borrowdale, Cumberland, Angleterre furent d'abord de la taille et de la pureté suffisante pour que, jusqu'au 19ème siècle, crayons ont été faites tout simplement par sciage des blocs de graphite naturel en bandes avant enfermant les bandes en bois. Aujourd'hui, les petits gisements de graphite sont obtenus par broyage de la roche mère et flottant graphite briquet sur l'eau.
Il existe trois types de graphite amorphe naturelle, de paillettes ou de paillettes cristallin, et la veine ou forfaitaire. Graphite amorphe est la plus faible qualité et le plus abondant. Contrairement à la science, de l'industrie "amorphe" se réfère à très faible taille des cristaux plutôt que l'absence totale de structure cristalline. Amorphe est utilisé pour les produits de graphite de faible valeur et est le graphite prix le plus bas. De grands gisements de graphite amorphes se trouvent en Chine, en Europe, au Mexique et aux États-Unis. Graphite lamellaire est moins fréquente et de meilleure qualité que amorphe; elle se produit sous forme de plaques distinctes qui se sont cristallisées dans la roche métamorphique. Graphite lamellaire peut être quatre fois le prix de amorphe. Bonnes flocons de qualité peuvent être transformés en graphite expansible pour de nombreuses utilisations, telles que les retardateurs de flamme. Les plus grands gisements se trouvent en Autriche, Brésil, Canada, Chine, Allemagne et Madagascar. Veine ou forfaitaire graphite est la plus rare le plus précieux et le plus élevé de type, de la qualité de graphite naturel. Il se produit dans les veines le long de contacts intrusifs en morceaux solides, et il est exploité commercialement seulement au Sri Lanka.
Selon le USGS, la production mondiale de graphite naturel était de 1,1 millions de tonnes en 2010, à laquelle la Chine a contribué 800,00 t, l'Inde 130 000 t, 76 000 t le Brésil, la Corée du Nord de 30 000 t et 25 000 t au Canada. Pas de graphite naturel extrait a été signalé aux États-Unis, mais 118 000 t de graphite synthétique avec une valeur estimée à $ 998 000 000 a été produite en 2009.
Diamant
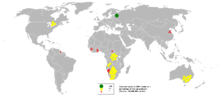
La chaîne d'approvisionnement en diamants est contrôlé par un nombre limité d'entreprises puissantes, et est également fortement concentrée dans un petit nombre d'endroits dans le monde (voir figure).
Seule une très petite fraction du minerai de diamant est constituée de diamants réels. Le minerai est broyé, pendant laquelle les soins doit être pris afin d'éviter de gros diamants d'être détruits dans ce processus et par la suite les particules sont triées par densité. Aujourd'hui, les diamants se trouvent dans la fraction de densité riche en diamants à l'aide de Fluorescence de rayons X, après quoi les étapes finales de tri sont effectuées à la main. Avant l'utilisation de Les rayons X sont devenus monnaie courante, la séparation a été fait avec les ceintures de graisse; diamants ont une plus forte tendance à coller à la graisse que les autres minéraux dans le minerai.
Historiquement diamants ont été connus pour être trouvé seulement dans les dépôts alluviaux dans sud de l'Inde. L'Inde a mené le monde dans la production de diamants à partir du moment de leur découverte approximativement au 9ème siècle avant notre ère à la moitié du 18ème siècle, mais le potentiel commercial de ces sources avait été épuisé par la fin du 18e siècle et à l'époque de l'Inde a été éclipsé par Brésil où les premiers diamants non-indiens ont été trouvés en 1725.
La production de diamants des gisements primaires (kimberlites et lamproïtes) n'a commencé dans les années 1870 après la découverte des champs de diamants en Afrique du Sud. La production a augmenté au fil du temps et maintenant un total cumulé de 4,5 milliards de carats ont été extraites depuis cette date. Environ 20% de ce montant a été exploité dans les 5 dernières années seulement, et au cours des dix dernières années 9 nouvelles mines ont commencé la production tandis que 4 autres sont en attente d'être ouvert bientôt. La plupart de ces mines sont situées au Canada, au Zimbabwe, en Angola et un en Russie.
Aux États-Unis, les diamants ont été trouvées dans Arkansas, Colorado et Montana. En 2004, une découverte surprenante d'un diamant microscopique aux Etats-Unis a conduit à l'échantillonnage en vrac de Janvier 2008 cheminées de kimberlite dans une partie reculée de Montana.
Aujourd'hui, les gisements de diamants les plus commercialement viables sont la Russie , le Botswana , l'Australie et la République démocratique du Congo . En 2005, la Russie a produit près d'un cinquième de la production mondiale de diamants, rapporte le British Geological Survey. L'Australie a le plus riche tuyau diamantifère avec une production atteignant des niveaux de pointe de 42 tonnes (41 tonnes longues; 46 tonnes courtes) par an dans les années 1990. Il ya aussi des dépôts commerciaux étant minées activement à la Territoires du Nord-Ouest de Canada , Sibérie (surtout dans Yakoutie territoire; par exemple, Tuyau Mir et Udachnaya pipe), au Brésil et dans le Nord et de l'Ouest Australie .
Applications






Le carbone est essentielle à tous les systèmes vivants connus, et sans elle la vie comme nous la connaissons ne pourrait exister (voir biochimie de remplacement). L'utilisation économique majeur autre que la nourriture et le bois carbone est sous forme d'hydrocarbures, notamment le combustible fossile le méthane gaz et le pétrole brut (pétrole). Le pétrole brut est utilisé par l' industrie pétrochimique pour produire, entre autres choses, l'essence et le kérosène, par une distillation processus, dans les raffineries. La cellulose est un polymère naturel, contenant du carbone produit par les plantes sous forme de coton , lin et chanvre. Cellulose est principalement utilisé pour maintenir la structure dans les plantes. Commercialement polymères de carbone valeur d'origine animale comprennent la laine , le cachemire et la soie. plastiques sont fabriqués à partir de polymères synthétiques de carbone, souvent avec des atomes d'oxygène et d'azote inclus à intervalles réguliers dans la chaîne polymère principale. Les matières premières pour bon nombre de ces substances synthétiques proviennent de pétrole brut.
Les utilisations de carbone et de ses composés sont extrêmement variées. On peut former des alliages avec du fer , dont la plus courante est l'acier au carbone. Le graphite est combiné avec des argiles pour former le "chef de file" utilisé dans les crayons utilisés pour l'écriture et dessin . Il est également utilisé en tant que lubrifiant et un pigment , en tant que matériau de moulage en verre fabrication, en électrodes pour sèches batteries et dans la galvanoplastie et la galvanoplastie, de brosses pour moteurs électriques et comme modérateur de neutrons dans les réacteurs nucléaires.
Charbon de bois est utilisé comme matériau de dessin dans artwork , pour griller, et dans de nombreux autres usages, y compris la fusion du fer. Bois, charbon et le pétrole sont utilisées comme combustible pour la production d'énergie et le chauffage. Gem qualité de diamant est utilisé dans les bijoux et les diamants industriels sont utilisés dans le forage, outils de coupe et de polissage pour l'usinage des métaux et de la pierre. Les matières plastiques sont fabriqués à partir des hydrocarbures fossiles, et la fibre de carbone, par pyrolyse de synthèse de polyester de fibres est utilisé pour renforcer des matières plastiques pour former des légers avancés matériaux composites. La fibre de carbone est réalisée par pyrolyse de extrudée et étirée filaments de polyacrylonitrile (PAN) et d'autres organique substances. La structure et les propriétés mécaniques de la fibre cristallographiques dépendent du type de matière de départ, et le traitement ultérieur. Les fibres de carbone à base de PAN ont une structure ressemblant à filaments étroits de graphite, mais le traitement thermique peuvent réorganiser la structure en tôle laminée continue. Le résultat est plus élevé avec des fibres de rupture spécifique que l'acier.
Le noir de carbone est utilisé comme noir pigment dans l'impression de l'encre, peinture à l'huile et de l'eau aux couleurs de l'artiste, du papier carbone, finitions automobiles, l'Inde encre et une imprimante laser toner. Le noir de carbone est également utilisé comme une charge dans le caoutchouc des produits tels que les pneus et plastiques composés . Le charbon actif est utilisé comme absorbant et adsorbant en matériau filtrant dans des applications aussi diverses que des masques à gaz, la purification de l'eau et des cuisine hottes aspirantes et en médecine pour absorber les toxines, les poisons, ou de gaz à partir du système digestif. Le carbone est utilisé dans la réduction chimique à haute température. Le coke est utilisé pour réduire le minerai de fer en fonte. durcissement de cas de l'acier est obtenu par chauffage terminé composants en acier dans la poudre de carbone. Carbure de silicium, le tungstène, le bore et le titane, sont parmi les plus durement connue des matériaux, et sont utilisés comme abrasifs dans les outils de coupe et de meulage. Les composés de carbone constituent la plupart des matériaux utilisés dans les vêtements, comme naturels et synthétiques textiles et cuir, et presque toutes les surfaces intérieures de l' environnement bâti autre que le verre, la pierre et le métal.
Diamonds
Le diamant industrie peut être largement séparé en deux catégories fondamentalement distinctes: l'une traitant de diamants de qualité gemme et un autre pour les diamants de qualité industrielle. Même si un grand commerce dans les deux types de diamants existe, les deux marchés agissent radicalement différentes façons.
Un grand commerce desdiamants de qualité gemme existe. Contrairement à métaux précieux tels quel'oroule platine, diamants de joaillerie ne se négocient pas comme unemarchandise: il ya une majoration substantielle de la vente de diamants, et il n'y a pas un marché très actif pour la revente de diamants.
Le marché des diamants de qualité industrielle fonctionne un peu différemment de son homologue de qualité gemme. Les diamants industriels sont évalués principalement pour leur dureté et la conductivité de la chaleur, ce qui rend la plupart des caractéristiques de gemmologie de diamant, y compris la clarté et la couleur, la plupart du temps hors de propos. Cela contribue à expliquer pourquoi 80% des diamants extraits (équivalant à environ 100 millions de carats ou 20 tonnes par an), impropres à l'utilisation que les pierres précieuses et connus comme bort , sont destinés à un usage industriel. En plus de diamants extraits, les diamants synthétiques ont trouvé des applications industrielles presque immédiatement après leur invention dans les années 1950; 3 milliards de carats (600 tonnes) de diamant synthétique sont produites chaque année pour un usage industriel. L'utilisation industrielle dominante du diamant est en coupe, le perçage, le meulage et le polissage. La plupart des utilisations de diamants dans ces technologies ne nécessitent pas de gros diamants; en fait, la plupart des diamants qui sont de qualité gemme, sauf pour leur petite taille, peuvent trouver une utilisation industrielle. Les diamants sont intégrés dans des conseils de forage ou des lames de scie, ou broyé en une poudre pour une utilisation dans le meulage et le polissage. Applications spécialisées comprennent l'utilisation dans les laboratoires comme confinement pour les expériences à haute pression (voir la cellule d'enclume de diamant), de haute performance , des roulements et de l'utilisation limitée dans spécialisées fenêtres. Avec les progrès constants réalisés dans la production de diamants synthétiques, les applications futures commencent à devenir possible. Ayant récolté beaucoup d'excitation est l'utilisation possible du diamant comme un semi-conducteurs adaptés pour construire des puces à partir de, ou l'utilisation du diamant comme un dissipateur de chaleur dans l'électronique .
Précautions

Carbone pur a extrêmement faible toxicité pour l'homme et peut être manipulé et même ingéré en toute sécurité sous la forme de graphite ou de charbon de bois. Il est résistant à la dissolution ou l'attaque chimique, même dans le contenu acide du tractus digestif, par exemple. Par conséquent une fois qu'il pénètre dans les tissus de l'organisme, il est probable d'y rester indéfiniment. Le noir de carbone est probablement l'un des premiers pigments à être utilisé pour le tatouage, et Ötzi a été trouvé pour avoir des tatouages de carbone qui ont survécu au cours de sa vie et pour 5200 années après sa mort. Cependant, l'inhalation de la poussière de charbon ou de la suie ( noir de carbone) en grandes quantités peut être dangereux, irritant les tissus pulmonaires et provoquant l'congestive maladie pulmonaire Anthracose. De même, la poussière de diamant utilisé comme abrasif peut faire mal si ingéré ou inhalé. Microparticules de carbone sont produites dans les gaz d'échappement des moteurs diesel, et peuvent s'accumuler dans les poumons. Dans ces exemples, les effets néfastes peuvent résulter de la contamination des particules de carbone, avec des produits chimiques organiques ou des métaux lourds par exemple, plutôt que de l'atome de carbone lui-même.
Carbon a généralement une faible toxicité pour presque tous la vie sur Terre ; Toutefois, pour certaines créatures il peut encore être toxique - par exemple, des nanoparticules de carbone sont un des toxines mortelles à la drosophile .
Le carbone peut également brûler vigoureusement et vives en présence d'air à des températures élevées, comme dans le feu de Windscale, qui a été causée par la libération soudaine de stocké l'énergie Wigner dans le noyau de graphite. D'importantes accumulations de charbon, qui sont restés inertes pour des centaines de millions d'années, en l'absence d'oxygène, peuvent brûler spontanément lorsqu'il est exposé à l'air, par exemple dans les conseils de déchets des mines de charbon.
La grande variété de composés de carbone comprennent ces poisons mortels que la tétrodotoxine, la lectine ricine à partir des graines de la plante de l'huile de ricin Ricinus communis , le cyanure (CN - ) et le monoxyde de carbone; et ces éléments essentiels à la vie comme le glucose et protéines .
Collage au carbone
| CH | Il | ||||||||||||||||
| CLi | CBe | CB | CC | CN | CO | FC | Ne | ||||||||||
| CNa | CMG | LACl | CSi | CP | CS | CCl | CAr | ||||||||||
| CK | CCa | CSc | CTi | CV | CCr | CMn | CFe | CCo | CNi | CCu | Czn | CGa | CGe | CA | CSe | CBr | KrT |
| CRb | CSr | CY | CzR | CNB | CMo | CTc | CRu | CRH | CPd | CAg | CCd | CDans | CSn | CSb | CTe | CI | CXE |
| CC | CBa | Chf | CTa | CW | CRe | OC | CIr | CPt | Cau | CHG | CTL | CPb | CBi | CPO | CAt | Rn | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |
| ↓ | |||||||||||||||||
| CLa | CCe | CPr | CND | Pm | CSm | Céu | CGD | CTb | CDY | CHo | CEr | CTm | CYb | Clu | |||
| Un C | CTh | CPa | CU | CNp | CPU | CAm | CCm | CBK | Cf | EC | Fm | Md | Aucun | Lr | |||
| La chimie organique de base | De nombreuses utilisations en chimie |
| La recherche académique, mais aucune utilisation généralisée | Bond inconnue |
