
Boro
Sabías ...
Los artículos de esta selección escuelas se han organizado por tema currículo gracias a voluntarios SOS. Haga clic aquí para obtener información sobre el apadrinamiento de niños.
| Boro | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
5 B | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||
negro-marrón  | |||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||
| Nombre, símbolo, número | boro, B, 5 | ||||||||||||||||||||||||
| Pronunciación | / b ɔər ɒ n / | ||||||||||||||||||||||||
| Categoría metálico | metaloide | ||||||||||||||||||||||||
| Grupo, período, bloque | 13, 2, p | ||||||||||||||||||||||||
| Peso atómico estándar | 10,81 (1) | ||||||||||||||||||||||||
| Configuración electrónica | [Él] 2s 2 2p 1 2, 3  | ||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||
| Descubrimiento | Joseph Louis Gay-Lussac y Louis Jacques Thénard (30 de junio 1808) | ||||||||||||||||||||||||
| Primer aislamiento | Humphry Davy (9 de julio 1808) | ||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||
| Líquido densidad en mp | 2,08 g · cm -3 | ||||||||||||||||||||||||
| Punto de fusion | 2349 K , 2076 ° C, 3769 ° F | ||||||||||||||||||||||||
| Punto de ebullicion | 4200 K, 3927 ° C, 7101 ° F | ||||||||||||||||||||||||
| Calor de fusión | 50.2 kJ · mol -1 | ||||||||||||||||||||||||
| El calor de vaporización | 480 kJ · mol -1 | ||||||||||||||||||||||||
| Capacidad calorífica molar | 11.087 J · mol -1 · K -1 | ||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||
| Estados de oxidación | 3, 2, 1 (Levemente ácida óxido) | ||||||||||||||||||||||||
| Electronegatividad | 2,04 (escala de Pauling) | ||||||||||||||||||||||||
| Energías de ionización ( más) | Primero: 800.6 kJ · mol -1 | ||||||||||||||||||||||||
| Segundo: 2427,1 kJ · mol -1 | |||||||||||||||||||||||||
| Tercero: 3659,7 kJ · mol -1 | |||||||||||||||||||||||||
| Radio atómico | 90 pm | ||||||||||||||||||||||||
| Radio covalente | 84 ± 15:00 | ||||||||||||||||||||||||
| Van der Waals radio | 192 pm | ||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||
| Estructura cristalina | rhombohedral  | ||||||||||||||||||||||||
| Ordenamiento magnético | diamagnético | ||||||||||||||||||||||||
| La resistividad eléctrica | (20 ° C) ~ 10 6 Ω · m | ||||||||||||||||||||||||
| Conductividad térmica | 27.4 W · m -1 · K -1 | ||||||||||||||||||||||||
| Expansión térmica | (25 ° C) (forma β) 07.05 m · m -1 · K -1 | ||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 16 200 m · s -1 | ||||||||||||||||||||||||
| Dureza de Mohs | ~ 9.5 | ||||||||||||||||||||||||
| Número de registro del CAS | 7440-42-8 | ||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||
| Artículo principal: Los isótopos de boro | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
El boro es un elemento químico con el símbolo químico B y número atómico 5. Debido a que el boro es producida enteramente por espalación de rayos cósmicos y no por nucleosíntesis estelar, que es un elemento de baja abundancia, tanto en el sistema solar y la corteza de la Tierra. El boro se concentra en la Tierra por la solubilidad en agua de sus compuestos que ocurren naturalmente más comunes, la minerales de borato. Estos se extraen industrialmente como evaporitas, como bórax y kernite.
Químicamente boro no combinada, que se clasifica como un metaloide, no se encuentra naturalmente en la Tierra. Industrialmente, boro muy puro se produce con dificultad, como el boro tiende a formar materiales refractarios que contienen pequeñas cantidades de carbono u otros elementos. Varios alótropos existen de boro: de boro amorfo es un polvo marrón y boro cristalino es negro, extremadamente duro (alrededor de 9,5 en la escala de Mohs ), y un mal conductor a temperatura ambiente. El boro elemental se utiliza como una dopante en el industria de los semiconductores.
Los principales usos a escala industrial de compuestos de boro están en blanqueadores de perborato de sodio, y el componente de bórax de aislamiento de fibra de vidrio. Polímeros de boro y cerámicas desempeñan funciones especializadas como materiales estructurales y refractarios ligeros de alta resistencia. Los compuestos de boro se utilizan en vidrios y cerámicas a base de sílice para darles resistencia a choque termal. Boro-contener reactivos se utilizan para como intermedios en la síntesis de productos químicos finos orgánicos. Se utilizan Unos farmacéuticos orgánicos que contienen boro, o están en estudio. Boro natural se compone de dos isótopos estables, uno de los cuales ( de boro-10) tiene una serie de usos como un agente de captura de neutrones.
En biología, boratos tienen baja toxicidad en mamíferos (similares a la sal de mesa), pero son más tóxicos para los artrópodos y se utilizan como insecticidas. El ácido bórico es ligeramente antimicrobiano, y un antibiótico orgánica que contiene boro natural se conoce. El boro es esencial para la vida. Pequeñas cantidades de compuestos de boro juegan un papel refuerzo en las paredes celulares de todas las plantas, lo que hace necesario de boro en los suelos. Los experimentos indican un papel para el boro como una elemento ultratrazas en animales, pero su papel en la fisiología animal es desconocida.
Historia y etimología
El nombre de boro se origina del árabe palabra بورق buraq o la Palabra persa بوره Burah; que son nombres para el mineral bórax.

Los compuestos de boro se conocían hace miles de años. El bórax se conocía desde los desiertos del oeste del Tíbet, donde recibió el nombre de tincal, derivado del sánscrito . Esmaltes bórax se utilizaron en China desde AD300, y algunos incluso llegaron a tincal Occidente, donde el alquimista persa Ibn Hayyān parece mencionar que en el año 700. Marco Polo trajo algunos esmaltes de vuelta a Italia en el siglo 13. Agricola, alrededor de 1600, reporta el uso de bórax como fundente en la metalurgia . En 1777, ácido bórico fue reconocido en las aguas termales ( soffioni) cerca Florencia, Italia, y fue conocido como sedativum sal, con usos principalmente médicos. El mineral raro se llama sassolite, que se encuentra en Sasso, Italia. Sasso fue la principal fuente de bórax Europea 1827-1872, fecha en la cual fuentes estadounidenses reemplazaron. Los compuestos de boro fueron relativamente rara vez se utilizan productos químicos hasta finales de 1800 cuando Francis Marion Smith Costa del Pacífico de Borax Company primero popularizó estos compuestos y los hizo en el volumen y por lo tanto barato.
El boro no fue reconocido como un elemento hasta que fue aislado por Sir Humphry Davy y por Joseph Louis Gay-Lussac y Louis Jacques Thénard. En 1808 Davy observó que la corriente eléctrica enviada a través de una solución de boratos produjo un precipitado marrón en uno de los electrodos. En sus experimentos posteriores utilizó potasio para reducir el ácido bórico en lugar de la electrólisis . Produjo suficiente boro para confirmar un nuevo elemento y el nombre del elemento boracium. Gay-Lussac y Thénard utilizan hierro para reducir el ácido bórico a altas temperaturas. Ellos mostraron por oxidación de boro con el aire que el ácido bórico es un producto de oxidación de boro. Jöns Jakob Berzelius identificó boro como un elemento en 1824. El boro puro fue discutiblemente primero producido por el químico estadounidense Ezequiel Weintraub en 1909.
Características
Alótropos

El boro es similar a la de carbono en su capacidad para formar estable unido covalentemente redes moleculares. Incluso nominalmente desordenada ( amorfo) boro contiene boro regulares icosahedra que, sin embargo, unida al azar entre sí sin orden de largo alcance. Boro cristalino es un material muy duro negro con un punto de fusión alto de por encima de 2000 ° C. Existe en cuatro grandes polimorfos: α, β, γ y T. Considerando α, β y T fases se basan en B 12 icosaedros, la fase γ pueden ser descritos como un rocksalt disposición de tipo de la icosahedra y B 2 pares atómicas. Puede ser producido mediante la compresión de otras fases de boro a 12-20 GPa y calentando a 1500-1800 ° C; se mantiene estable después de soltar la temperatura y la presión. La fase T se produce a presiones similares, pero más altas temperaturas de 1800-2200 ° C. En cuanto a las fases α y β, podrían coexistir tanto en condiciones ambientales con la fase β ser más estable. La compresión de boro por encima de 160 GPa produce una fase de boro con una estructura aún desconocido, y esta fase es un superconductor a temperaturas de 6-12 K.
| Fase de boro | α | β | γ | T |
|---|---|---|---|---|
| Simetría | Romboedro | Romboedro | Ortorrómbico | Tetragonal |
| Los átomos / célula unitaria | 12 | ~ 105 | 28 | |
| Densidad (g / cm 3) | 2.46 | 2.35 | 2.52 | 2.36 |
| Dureza Vickers (GPa) | 42 | 45 | 50-58 | |
| Módulo de volumen (GPa) | 185 | 224 | 227 | |
| Bandgap (eV) | 2 | 1.6 | 2.1 |
Química del elemento
El boro elemental es rara y poco estudiada porque el material es extremadamente difícil de preparar. La mayoría de los estudios sobre "boro" implican muestras que contienen pequeñas cantidades de carbono. Químicamente, el boro se comporta más de manera similar a silicio que a aluminio . Boro cristalino es químicamente inerte y resistente al ataque por ebullición fluorhídrico o ácido clorhídrico . Cuando finamente dividido, es atacado lentamente por caliente concentrada de peróxido de hidrógeno , caliente concentrado ácido nítrico , caliente de ácido sulfúrico o de la mezcla caliente de sulfúrico y ácidos crómico.
La velocidad de oxidación de boro depende de la cristalinidad, tamaño de partícula, la pureza y la temperatura. El boro no reacciona con el aire a temperatura ambiente, pero a temperaturas más altas que se quema para formar Óxido de boro:
- 4 B + 3 O 2 → 2 B 2 O 3
El boro se somete a halogenación para dar trihaluros, por ejemplo,
- 2 B + 3 Br 2 → 2 BBr3
El tricloruro en la práctica se hace generalmente de óxido.
Los compuestos químicos

En sus compuestos más familiares, boro tiene el estado de oxidación formal III. Estos incluyen óxidos, sulfuros, nitruros y haluros.
Los trihaluros adoptan una estructura trigonal planar. Estos compuestos son Ácidos de Lewis en que se forman fácilmente aductos con pares de electrones donantes, que se llaman Bases de Lewis. Por ejemplo, fluoruro (F -) y trifluoruro de boro (BF3) se combinaron para dar el aniones tetrafluoroborato, BF 4 -. El trifluoruro de boro se utiliza en la industria petroquímica como catalizador. Los haluros reaccionan con agua para formar ácido bórico.
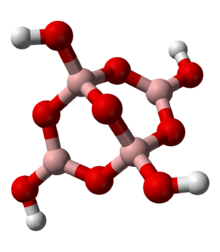
El boro se encuentra en la naturaleza en la Tierra en su totalidad como varios óxidos de B (III), a menudo asociados con otros elementos. El más de cien boratos todo boro característica en estado de oxidación +3. Estos minerales se asemejan silicatos en algún aspecto, aunque de boro se encuentra a menudo no sólo en una coordinación tetraédrica con oxígeno, sino también en una configuración plana trigonal. A diferencia de los silicatos, los minerales de boro nunca cuentan con boro con número de coordinación superior a cuatro. Un motivo típico se ejemplifica por los aniones tetraborato del mineral común bórax, muestra a la izquierda. La carga negativa formal de los centros de borato tetraédricos está equilibrada por cationes metálicos en los minerales, como el sodio (Na +) en bórax.
La nitruros de boro son notables por la variedad de estructuras que adopten. Adoptan estructuras análogas a varios alótropos de carbono , incluyendo grafito, diamante, y nanotubos. En el nitruro de boro cúbico tipo diamante estructura llamada (nombre comercial Borazon), existe átomos de boro en la estructura tetraédrica de átomos de carbono en diamante, pero uno de cada cuatro BN bonos puede ser visto como una enlace covalente coordinado, en el que dos electrones son donados por el átomo de nitrógeno que actúa como el Base de Lewis a un enlace a la Boro ácida centro de Lewis (III). Nitruro de boro cúbico, entre otras aplicaciones, se usa como abrasivo, ya que tiene una dureza comparable con el diamante (las dos sustancias son capaces de producir arañazos en la otra). En el análogo compuesto BN de grafito, nitruro de boro hexagonal (h-BN), el boro cargado positivamente y átomos de nitrógeno cargados negativamente en cada plano se encuentran adyacentes al átomo de carga opuesta en el próximo avión. En consecuencia grafito y h-BN tienen propiedades muy diferentes, aunque ambos son lubricantes, ya que estos planos se deslizan una sobre otra con facilidad. Sin embargo, h-BN es una relativamente pobre conductor eléctrico y térmico en las direcciones planas.
Compuesto de organoboro
Un gran número de compuestos de organoboro son conocidas y muchas son útiles en síntesis orgánica. Organoboro (III) compuestos son por lo general planar tetraédrica o trigonal, por ejemplo, tetrafenilborato (B (C 6 H 5) 4 -) vs trifenilborano (B (C 6 H 5) 3). Muchos se producen a partir hidroboración, que emplea diborano (B 2 H 6).
Los compuestos de B (I) y B (II)
Aunque estos no se encuentran de forma natural en la Tierra, el boro forma una variedad de compuestos estables con el estado de oxidación formal de menos de tres. Como para muchos compuestos covalentes, estados de oxidación formales suelen ser de poco significado en hidruros de boro y boruros metálicos. Los haluros también forman derivados de B (I) y B (II). BF, isoelectrónico con N 2, no es aislable en forma condensada, pero B 2 F 4 y B 4 Cl 4 están bien caracterizados.

Los compuestos binarios de metal-boro, los boruros metálicos, característica de boro en estado de oxidación inferior a III. Ilustrativo es diboruro de magnesio (MGB 2). Cada átomo de boro tiene una carga -1 formal y magnesio se le asigna un cargo formal de 2+. En este material, los centros de boro son plana trigonal, con un doble enlace adicional para cada uno de boro, con los átomos de boro formando hojas similar a la de carbono en grafito. Sin embargo, a diferencia del caso con nitruro de boro hexagonal que por comparación carece de electrones en el plano de los átomos covalentes, los electrones deslocalizados en el plano de diboruro de magnesio permiten que conduce la electricidad similar al grafito isoelectrónico. Además, en 2001 se encontró que este material es una alta temperatura superconductor .
Algunos otros boruros metálicos encontrar aplicaciones especializadas como materiales duros para herramientas de corte.
Desde el punto de vista estructural, los compuestos químicos más distintivos de boro son los hidruros. Se incluyen en esta serie son los compuestos de racimo dodecaborate (B 12 H 12 2-), decaborano (B 10 H 14), y el carboranos como C 2 B 10 H 12. Característicamente tales compuestos incluyen boro con números de coordinación superior a cuatro.
Isótopos
El boro tiene dos de origen natural y estables isótopos , 11 B (80,1%) y 10 B (19,9%). Los resultados diferencia de masa en una amplia gama de valores de δ 11 B, que se definen como una diferencia fraccional entre el 11 B y 10 B y tradicionalmente expresan en partes por mil, en aguas naturales que van desde -16 hasta 59. Hay 13 isótopos conocidos de boro, el isótopo de vida más corta es de 7 B, que se descompone a través emisión de protón y desintegración alfa. Tiene una vida media de 3,5 × 10 -22 s. Fraccionamiento isotópico de boro se controla por las reacciones de intercambio de la especie de boro B ( O H ) y 3 [B (OH) 4] -. Isótopos de boro también se fraccionan durante la cristalización mineral, durante el H 2 O los cambios de fase en sistemas hidrotermales, y durante la alteración hidrotermal de rocas . Los resultados de los efectos últimos en la eliminación preferencial de la 10 B (OH) 4 ion en arcillas. Es el resultado de soluciones enriquecidas en 11 B (OH) 3 y por lo tanto puede ser responsable de la gran enriquecimiento 11 B en el agua de mar en relación tanto oceánica y corteza continental corteza; esta diferencia puede actuar como una firma isotópica. El exótico 17 B exhibe una de halo nuclear, es decir, su radio es apreciablemente mayor que el predicho por el modelo de la gota líquida.
El isótopo 10 B es bueno en la captura neutrones térmicos. Natural de boro es de aproximadamente 20% 10 B y 80% 11 B. La industria nuclear enriquece boro natural para casi puro 10 B. El menos valioso subproducto, boro agotado, es casi puro 11 B.
Enriquecimiento isotópico Comercial
Debido a su sección transversal de neutrones, se utiliza a menudo de boro-10 para controlar la fisión en los reactores nucleares como una sustancia de captura de neutrones. Varios procesos de enriquecimiento a escala industrial se han desarrollado, sin embargo, sólo la destilación a vacío fraccionado de la dimetil éter de aducto se están utilizando trifluoruro de boro (DME-BF 3) y cromatografía en columna de boratos.
Boro enriquecido (boro-10)

De boro enriquecido o 10 B se utiliza tanto en blindaje contra la radiación y es el nucleido primario utilizado en terapia por captura de neutrones de cáncer. En este último ("terapia por captura neutrónica de boro" o BNCT), un compuesto que contiene 10 B se incorpora en un producto farmacéutico que se toma selectivamente por un tumor maligno y los tejidos cerca de él. El paciente se trata entonces con un haz de neutrones térmicos, ya sea, o bien neutrones de baja energía, a una dosis relativamente baja de radiación de neutrones. Los neutrones, sin embargo, provocan energético y de corto alcance secundaria partícula alfa y 7 de litio-radiación de iones pesados que son productos del boro + neutrones reacción nuclear, y esta radiación de iones bombardea adicionalmente el tumor, especialmente desde el interior de las células tumorales.
En los reactores nucleares, 10 B se utiliza para el control de la reactividad y, en sistemas de parada de emergencia. Puede servir cualquiera de las funciones en la forma de borosilicato barras de control o como ácido bórico. En reactores de agua a presión, se añade ácido bórico para el refrigerante del reactor cuando la planta se cierra para repostar. A continuación, se filtra lentamente a lo largo de muchos meses como material fisible se ha agotado y el combustible se vuelve menos reactiva.
En el futuro naves interplanetarias tripuladas, 10 B tiene un papel teórico como material estructural (como fibras de boro o BN material de nanotubo), que también serviría un papel especial en la pantalla de radiación. Una de las dificultades en el trato con los rayos cósmicos, que son en su mayoría protones de alta energía, es que parte de la radiación secundaria de la interacción de los rayos cósmicos y los materiales de la nave es de alta energía neutrones de espalación. Tales neutrones pueden ser moderadas por los materiales con alto contenido de elementos ligeros como polietileno, pero los neutrones moderados continúan siendo un peligro de radiación absorbida a menos activamente en el blindaje. Entre los elementos de luz que absorben neutrones térmicos, 6 Li y 10 B aparecen materiales de naves espaciales estructural como potenciales que sirven tanto para refuerzo mecánico y la protección radiológica.
Boro Empobrecido (boro-11)
La radiación cósmica producirá neutrones secundarios si golpea estructuras de naves espaciales. Estos neutrones se capturan en 10 B, si está presente en de la nave espacial semiconductores , produciendo una gamma ray, un partícula alfa, y una de litio ion. Estos productos de desintegración resultantes pueden luego irradiar estructuras cercanas semiconductores 'chips', causando la pérdida de datos (de volteo de bits, o solo evento molesto). En radiación endureció diseños de semiconductores, una contramedida es utilizar boro agotado que se enriquece en gran medida en 11 B y casi no contiene 10 B. 11 B es en gran medida inmune a los daños por radiación. Boro empobrecido es un subproducto de la industria nuclear .
11 B también es un candidato como combustible para Fusión aneutrónica. Cuando es golpeado por un protón de energía de aproximadamente 500 k eV, produce tres partículas alfa y 8,7 MeV de energía. La mayoría de las otras reacciones de fusión que implican hidrógeno y helio producen radiación penetrante de neutrones, lo que debilita las estructuras del reactor e induce radiactividad largo plazo poniendo en peligro el personal operativo. Considerando que, el partículas alfa de 11 B fusión se pueden convertir directamente en energía eléctrica, y toda la radiación se detiene tan pronto como el reactor está apagado.
Espectroscopía de RMN
Tanto 10 B y 11 B poseen spin nuclear. El spin nuclear de 10 B es 3 y la de 11 B es 3/2. Estos isótopos son, por lo tanto, de uso en espectroscopia de resonancia magnética nuclear; y espectrómetros especialmente adaptados a la detección de los núcleos de boro-11 están comercialmente disponibles. Los 10 B y 11 B núcleos también causan división en el resonancias de los núcleos unidos.
Aparición


El boro es un elemento relativamente raro en la corteza terrestre, que representa sólo el 0,001%. Los depósitos de borato comerciales en todo el mundo se estiman en 10 millones de toneladas. Turquía y el Reino Unidos son los mayores productores mundiales de boro. Turquía tiene 63% de las reservas de boro del mundo. El boro no aparece en la Tierra en forma elemental, pero se encuentra combinado en bórax, ácido bórico, colemanita, kernite, ulexita y boratos. El ácido bórico se encuentra a veces en volcánicas aguas de manantial.
La ulexita es uno de los más de cien minerales de borato; es un cristal fibroso donde las fibras individuales pueden guiar la luz como fibras ópticas .
Económicamente fuentes importantes de boro son rasorite ( kernite) y tincal (mineral bórax). Ambos se encuentran en el Desierto de Mojave de California donde el Río Tinto Borax Mine (también conocido como el bórax Boron Mina EE.UU.) 35 ° 2'34.447 "N 117 ° 40'45.412" W cerca Boron, CA es California la mayor mina a cielo abierto 's y el mayor mina de bórax en el mundo, produciendo casi la mitad del mundo boratos de este sitio único. Sin embargo, los mayores yacimientos de bórax conocidos, muchos aún sin explotar, están en el centro y oeste de Turquía que incluye las provincias de Eskisehir, Kütahya y Balikesir.
Producción
La producción de compuestos de boro no implica formación de boro elemental, pero explota la disponibilidad conveniente de boratos.
Las primeras rutas a boro elemental involucrados reducción de óxido bórico con metales tales como magnesio o aluminio . Sin embargo, el producto es casi siempre contaminado con metales boruros. El boro puro se puede preparar mediante la reducción de haluros de boro volátiles con hidrógeno a altas temperaturas. Ultrapura boro, para el uso en la industria de los semiconductores, se produce por la descomposición de diborano a altas temperaturas y a continuación se purificó adicionalmente con la fusión por zonas o Procesos Czochralski.
Tendencia del mercado
Consumo mundial estimado de boro se elevó a un récord de 1,8 millones de toneladas de B 2 O 3 en 2005, tras un período de fuerte crecimiento de la demanda de Asia, Europa y América del Norte. Capacidades de minería y refinación de boro se consideran adecuados para satisfacer los niveles esperados de crecimiento a través de la próxima década.
La forma en que se consume el boro ha cambiado en los últimos años. El uso de minerales como colemanita ha disminuido como consecuencia de la preocupación por el arsénico contenido. Los consumidores se han desplazado hacia el uso de boratos refinados y ácido bórico que tienen un contenido de contaminantes inferior. El costo promedio de boro cristalino es de $ 5 / g.
La creciente demanda de ácido bórico ha llevado a varios productores a invertir en capacidad adicional. Eti Mine Company de Turquía abrió una nueva planta de ácido bórico con la capacidad de producción de 100.000 toneladas por año en Emet en 2003. Río Tinto Group aumentó la capacidad de su planta de boro de 260 mil toneladas por año en 2003 a 310.000 toneladas por año en mayo de 2005, con planes para crecer esto a 366.000 toneladas por año en 2006. Los productores de boro chinos no han podido satisfacer la creciente demanda de los boratos de alta calidad. Esto ha llevado a las importaciones de tetraborato de sodio ( bórax) que crecen por el ciento entre 2000 y 2005, y las importaciones de ácido bórico aumentar en un 28% anual durante el mismo período.
El aumento de la demanda mundial se ha visto impulsado por las altas tasas de crecimiento en fibra de vidrio y producción de borosilicato. Un rápido aumento en la fabricación de fibra de vidrio de refuerzo de grado en Asia, con el consiguiente aumento de la demanda de boratos ha compensado el desarrollo de la fibra de vidrio de refuerzo grado libres de boro en Europa y los EE.UU.. Los recientes aumentos en los precios de la energía pueden conducir a un mayor uso de la fibra de vidrio de aislamiento de grado, con el consiguiente aumento del consumo de boro. Roskill Consulting Group prevé que la demanda mundial de boro crecerá un 3,4% por año hasta alcanzar 21 millones de toneladas para el año 2010. Se espera que el mayor crecimiento de la demanda para estar en Asia, donde la demanda podría aumentar en un promedio de 5,7% por año.
Aplicaciones
Casi todo el mineral de boro se extrae de la Tierra está destinada para el refinamiento en ácido bórico y tetraborato de sodio pentahidratado. En los Estados Unidos, el 70% de la de boro se utiliza para la producción de vidrio y cerámica.
Vidrio y cerámica

Vidrio borosilicato, que suele ser de 12-15% de B 2 O 3, el 80% de SiO2, y 2% de Al 2 O 3, tiene un bajo coeficiente de expansión térmica que le da una buena resistencia al choque térmico. Duran y Pyrex son dos grandes marcas de este vaso, que se utiliza tanto en vidrio de laboratorio y en los consumidores Batería de cocina, principalmente de esta resistencia.
Filamentos de boro son de alta resistencia, materiales ligeros que se utilizan principalmente para avanzados estructuras aeroespaciales como un componente de materiales compuestos, así como bienes de consumo limitadas producción y deportivas como palos de golf y cañas de pescar. Las fibras pueden ser producidas por deposición de vapor químico de boro en un tungsteno filamento.
Fibras de boro y manantiales de boro cristalino de tamaño submilimétricas son producidos por láser -assisted deposición de vapor químico. Traducción del rayo láser enfocado permite producir estructuras helicoidales incluso complejas. Estas estructuras muestran buenas propiedades mecánicas ( módulo elástico 450 GPa, tensión de fractura 3,7%, tensión de fractura 17 GPa) y puede ser aplicado como refuerzo de la cerámica o en sistemas de micromecánica.
Formulaciones de detergentes y agentes de blanqueo
El bórax se utiliza en diversos productos domésticos para ropa y limpieza, incluyendo el bien conocido " 20 Mule Team Bórax "refuerzo de lavandería y" Boraxo "jabón de manos en polvo. También está presente en algunos fórmulas de blanqueamiento dental.
El perborato de sodio sirve como una fuente de oxígeno activo en muchas detergentes, detergentes para la ropa, productos de limpieza y de lavandería blanqueadores. Sin embargo, a pesar de su nombre, "Borateem" blanqueador de ropa ya no contiene compuestos de boro, utilizando El percarbonato de sodio en lugar como agente de blanqueo.
Insecticidas
El ácido bórico se usa como un insecticida, en particular contra las hormigas, pulgas y cucarachas.
Semiconductores
El boro es un útil dopante para semiconductores tales como silicio , germanio , y carburo de silicio. Tener uno menos electrones de valencia que el átomo de acogida, que dona un agujero resultante en tipo p conductividad. Método tradicional de la introducción de boro en semiconductores es a través de su difusión atómica a altas temperaturas. Este proceso utiliza ya sea sólido (B 2 O 3), líquido (BBr 3), o de fuentes de boro gaseosos (B 2 H 6 o BF 3). Sin embargo, después de 1970, fue reemplazado en su mayoría por implantación de iones, que se basa principalmente en BF 3 como fuente de boro. Gas tricloruro de boro es también un producto químico importante en la industria de los semiconductores, sin embargo no para el dopaje, sino más bien para grabado por plasma de metales y sus óxidos. Trietilborano también se inyecta en reactores de deposición de vapor como fuente de boro. Ejemplos de ello son la deposición de plasma de películas de carbono duro que contiene boro, las películas de nitruro de silicio nitruro de boro, y para dopaje de diamante película con boro.
Imanes
El boro es un componente de imanes de neodimio (Nd 2 Fe 14 B), que son el tipo más fuerte de imán permanente. Se encuentran en una variedad de dispositivos electromecánicos y electrónicos domésticos y profesionales, como imágenes por resonancia magnética (MRI), diversos motores y actuadores, HDDs de ordenador, reproductores de CD y DVD, teléfonos móviles, interruptores con temporizador, altavoces, y así sucesivamente.
De alta dureza y compuestos abrasivos

Varios compuestos de boro son conocidos por su extrema dureza y tenacidad.
El carburo de boro y nitruro de boro cúbico polvos son ampliamente utilizados como abrasivos. Metal boruros se utilizan para herramientas de recubrimiento a través deposición de vapor químico o deposición física de vapor. Implantación de boro iones en metales y aleaciones, a través implantación de iones o deposición de haz de iones, se traduce en un aumento espectacular de la resistencia superficial y microdureza. Aleación con láser también se ha utilizado con éxito para el mismo propósito. Estos boruros son una alternativa a las herramientas revestidas de diamante, y sus superficies (tratadas) tienen propiedades similares a las de la boruro mayor.
El carburo de boro
El carburo de boro es un material cerámico que se obtiene por descomposición de B 2 O 3 con el carbono en el horno eléctrico:
- 2 B 2 O 3 + 7 C → B 4 C + 6 CO
La estructura de carburo de boro es sólo aproximadamente B 4 C, y muestra un agotamiento clara de carbono de esta sugirió relación estequiométrica. Esto es debido a su estructura muy compleja. La sustancia se puede ver con empírica fórmula B 12 C 3 (es decir, con B 12 dodecaedros ser un motivo), pero con menos carbono como las sugeridas C 3 unidades se sustituyen por cadenas BC, y hay menor (B 6) octaedros presentes también. (Vea el artículo para el análisis estructural).
El polímero más semicristalino estructura repetitiva de carburo de boro le confiere una gran resistencia estructural por peso. Se utiliza en blindaje de los tanques, chalecos antibalas, y muchas otras aplicaciones estructurales.
La capacidad de carburo de boro para absorber los neutrones sin formar de larga vida radionucleidos (especialmente cuando dopado con boro-10 extra) hace que el material atractivo como un absorbente para la radiación de neutrones que surja en las centrales nucleares. Las aplicaciones nucleares de carburo de boro incluyen blindaje, las barras de control y pellets de parada. Dentro de las barras de control, carburo de boro es a menudo en forma de polvo, para aumentar su área de superficie.
| Material | Diamante | cúbico-BC 2 N | cúbico-BC 5 | cúbico-BN | B 4 C | ReB 2 |
|---|---|---|---|---|---|---|
| Dureza Vickers (GPa) | 115 | 76 | 71 | 62 | 38 | 22 |
| Resistencia a la fractura (MPa m 1/2) | 5.3 | 4.5 | 9.5 | 6.8 | 3.5 |
Otros compuestos de boro superduro
- Heterodiamond (también llamado BCN);
- Nitruro de boro. Este material es isoelectrónico de carbono . Similar al carbono, que tiene tanto hexagonal (c-BN duros, tipo diamante) formas (suaves y grafito como h-BN) y cúbico. h-BN se utiliza como un componente de alta temperatura y lubricante. c-BN, también conocido bajo el nombre comercial borazon, es un abrasivo superior. Su dureza es sólo ligeramente más pequeño, pero la estabilidad química es superior a la del diamante.
- Diboruro de renio puede ser producido a presiones ambientales, pero es bastante caro a causa de renio. La dureza de ReB 2 exhibe considerable anisotropía debido a su estructura en capas hexagonal. Su valor es comparable a la de carburo de tungsteno, carburo de silicio, diboruro de titanio o diboruro de circonio.
- AlMgB 14 + 2 TiB compuestos poseen alta dureza y resistencia al desgaste y se utilizan ya sea en forma a granel o como recubrimientos para los componentes expuestos a altas temperaturas y al desgaste cargas.
Blindaje en los reactores nucleares
Boron blindaje se utiliza como un control para reactores nucleares, tomando ventaja de su sección transversal para la captura de neutrones de alta.
Otros usos no médicos
- Debido a su distintivo llama verde, boro amorfo se utiliza en bengalas pirotécnicas.
- El almidón y adhesivos a base de caseína contienen tetraborato decahidrato sodio (Na 2 B 4 O 7 • 10 H 2 O)
- Algunos sistemas anticorrosivos contienen bórax.
- Boratos de sodio se utilizan como una fundente para soldadura de plata y oro y con cloruro de amonio para la soldadura de metales ferrosos. También son pirorretardantes aditivos para plástico y manufacturas de caucho.
- El ácido bórico (también conocido como ácido ortobórico) H 3 BO 3 se utiliza en la producción de fibra de vidrio y textiles pantallas planas y en muchos PVAc y PVOH basado adhesivos.
- Trietilborano es una sustancia que enciende la JP-7 de combustible de la Pratt & Whitney J58 turborreactores / los motores que impulsan el ramjet Lockheed SR-71 Blackbird . También se utiliza para encender el F-1 Motores en el Saturno V Rocket utilizado por la NASA 's Apolo y Programas Skylab desde 1967 hasta 1973. Trietilborano es adecuado para este debido a su propiedades pirofóricas, especialmente el hecho de que se quema con una temperatura muy alta. Trietilborano es un industrial iniciador en reacciones de radicales, donde es eficaz incluso a bajas temperaturas.
Farmacéutica y aplicaciones biológicas
El ácido bórico tiene propiedades antisépticas, antimicóticas y antivirales y por estas razones se aplica como un clarificador de agua en el tratamiento del agua de piscinas. Soluciones leves de ácido bórico se han utilizado como antisépticos oculares.
El bortezomib (Velcade). El boro se presenta como un elemento activo en su primer aprobado pharamaceutical orgánica en la novela bortezomib farmacéutica, una nueva clase de fármacos llamados los inhibidores del proteasoma, que son activos en el mieloma y una forma de linfoma (está en la actualidad en ensayos experimentales contra otros tipos de linfoma). El átomo de boro en el bortezomib se une al sitio catalítico de la Proteasoma 26S con alta afinidad y especificidad.
- Un número de productos farmacéuticos potenciales borados utilizando boro-10, han sido preparados para su uso en terapia por captura neutrónica de boro (BNCT).
- Algunos compuestos de boro son prometedores en el tratamiento de artritis, aunque ninguno ha sido aún aprobado generalmente para el propósito.
Líneas de investigación
Diboruro de magnesio es un importante material superconductor con la temperatura de transición de 39 K. MGB 2 cables se producen con la polvo en tubo de proceso y aplicado en imanes superconductores.
De boro amorfo se utiliza como depresor del punto de fusión en aleaciones de soldadura de níquel-cromo.
Hexagonal boro formas de nitruro de atómicamente capas delgadas, que han sido utilizados para mejorar la movilidad de los electrones en dispositivos de grafeno. También forma estructuras nanotubulares ( BNNTs), que tienen con alta resistencia, alta estabilidad química y alta conductividad térmica, entre su lista de propiedades deseables.
Papel biológico Natural
No es un producto natural que contiene boro antibiótico , boromycin, aislado de Streptomyces. El boro es un vegetal esencial de nutrientes , es necesario principalmente para mantener la integridad de las paredes celulares. A la inversa, las concentraciones altas de suelo de> 1,0 ppm puede causar necrosis marginal y la punta en las hojas, así como los malos resultados de crecimiento global. Niveles tan bajos como 0.8 ppm pueden causar los mismos síntomas que aparecen en plantas especialmente sensibles al boro en el suelo. Casi todas las plantas, incluso aquellos un poco tolerante con boro en el suelo, se muestran al menos algunos síntomas de toxicidad de boro cuando el contenido de boro en el suelo es superior a 1,8 ppm. Cuando este contenido excede 2.0 ppm, algunas plantas se realizarán bien y algunos pueden no sobrevivir. Cuando los niveles de boro en el tejido vegetal superen 200 ppm síntomas de toxicidad de boro es probable que aparezcan.
Como elemento de ultratrazas, boro es necesario para la salud óptima de ratas, aunque es necesaria en cantidades tan pequeñas que ultrapurificada alimentos y filtración de polvo de aire es necesario para inducir la deficiencia de boro, que se manifiestan como pobres capa o pelo de la calidad. Presumiblemente, el boro es necesario para otros mamíferos. No síndrome de deficiencia en los seres humanos se ha descrito. Pequeñas cantidades de boro se producen ampliamente en la dieta, y las cantidades necesarias en la dieta serían, por analogía con los estudios con roedores, ser muy pequeño. El papel fisiológico exacto de boro en el reino animal es poco conocida.
El boro se produce en todos los alimentos producidos a partir de plantas. Desde 1989 su valor nutricional ha argumentado. Se piensa que el boro desempeña varias funciones bioquímicas en animales, incluyendo seres humanos. El Departamento de Agricultura de Estados Unidos llevó a cabo un experimento en el que las mujeres posmenopáusicas tomaron 3 mg de boro al día. Los resultados mostraron que el boro suplementario reduce la excreción de calcio en un 44%, y activan el estrógeno y la vitamina D , lo que sugiere un posible papel en la supresión de la osteoporosis. Sin embargo, si estos efectos eran convencionalmente nutricional o medicinal, no se pudo determinar. Los EE.UU. Institutos Nacionales de Salud afirma que "la ingesta total diaria de boro en normales dietas humanas oscila desde 2,1 hasta 4,3 mg de boro / día. "
Congénita distrofia endotelial tipo 2, una forma rara dedistrofia corneal, está vinculado a mutaciones enel gen SLC4A11 que codifica un transportador de informes, la regulación de la concentración intracelular de boro.
Cuantificación analítica
Para la determinación del contenido de boro en los alimentos o materiales de la curcumina se utiliza el método colorimétrico. El boro tiene que ser transferido a ácido bórico o boratos y en reacción con la curcumina en la solución ácida, un color rojo boro complejo de quelato, rosocyanine, está formada.
Las cuestiones de salud y toxicidad
El boro elemental, óxido de boro, ácido bórico, boratos, y muchos compuestos de organoboro no son tóxicos para los seres humanos y los animales (aproximadamente similar a la sal de mesa). La LD 50 (dosis a la que hay mortalidad 50%) para los animales es de aproximadamente 6 g por kg de peso corporal. Las sustancias con LD 50 por encima de 2 g se consideran no tóxicos. La dosis letal mínima para los seres humanos no se ha establecido. Una ingesta de 4 g / día de ácido bórico se reportó sin incidentes, pero más que esto se considera tóxico durante más de unas cuantas dosis. El consumo de más de 0,5 gramos por día durante 50 días causan digestivos menores y otros problemas sugerente de toxicidad. Las dosis médicas individuales de 20 g de ácido bórico para la terapia de captura de neutrones han sido utilizados sin toxicidad indebida. Fish han sobrevivido durante 30 min en una solución saturada de ácido bórico y pueden sobrevivir más tiempo en fuertes soluciones de bórax. El ácido bórico es más tóxico para los insectos que a los mamíferos, y se utiliza rutinariamente como un insecticida.
La boranos (compuestos de hidrógeno de boro) y compuestos gaseosos similares son muy venenosas. Como es habitual, no es un elemento que es intrínsecamente venenosa, pero la toxicidad depende de la estructura.
Los boranos son tóxicos y altamente inflamables y requieren un cuidado especial al manejar. Borohidruro de sodio presenta un peligro de incendio debido a su naturaleza reductora, y la liberación de hidrógeno en contacto con el ácido. Haluros de boro son corrosivos.
