
Radón
Acerca de este escuelas selección Wikipedia
SOS Children ha intentado que el contenido de Wikipedia más accesible por esta selección escuelas. Infantil SOS es la mayor donación de caridad del mundo niños huérfanos y abandonados de la oportunidad de la vida familiar.
| Radón | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
86 Rn | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Apariencia | ||||||||||||||||||||||||||||||||||
gas incoloro  | ||||||||||||||||||||||||||||||||||
| Propiedades generales | ||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | radón, Rn, 86 | |||||||||||||||||||||||||||||||||
| Pronunciación | / r eɪ d ɒ n / RAY -don | |||||||||||||||||||||||||||||||||
| Categoría Elemento | gases nobles | |||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 18 (gases nobles) , 6, p | |||||||||||||||||||||||||||||||||
| Peso atómico estándar | (222) | |||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Xe ] 4f 14 5d 10 6s 2 6p 6 2, 8, 18, 32, 18, 8  | |||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||
| Descubrimiento | Friedrich Ernst Dorn (1898) | |||||||||||||||||||||||||||||||||
| Primer aislamiento | William Ramsay y Robert Whytlaw-Gray (1910) | |||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||
| Fase | gas | |||||||||||||||||||||||||||||||||
| Densidad | (0 ° C, 101,325 kPa) 9,73 g / L | |||||||||||||||||||||||||||||||||
| Líquido densidad en pb | 4,4 g · cm -3 | |||||||||||||||||||||||||||||||||
| Punto de fusion | 202,0 K , -71.15 ° C, -96.07 ° F | |||||||||||||||||||||||||||||||||
| Punto de ebullicion | 211.3 K, -61.85 ° C, -79,1 ° F | |||||||||||||||||||||||||||||||||
| Punto crítico | 377 K, 6,28 MPa | |||||||||||||||||||||||||||||||||
| Calor de fusión | 3,247 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| El calor de vaporización | 18,10 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 5 R / 2 = 20.786 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||
| Presión del vapor | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||
| Estados de oxidación | 6, 2, 0 | |||||||||||||||||||||||||||||||||
| Electronegatividad | 2,2 (escala de Pauling) | |||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 1.037 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Radio covalente | 150 pm | |||||||||||||||||||||||||||||||||
| Van der Waals radio | 220 pm | |||||||||||||||||||||||||||||||||
| Miscelánea | ||||||||||||||||||||||||||||||||||
| Estructura cristalina | cara cúbica centrada  | |||||||||||||||||||||||||||||||||
| Ordenamiento magnético | no magnético | |||||||||||||||||||||||||||||||||
| Conductividad térmica | 3,61 m W · m -1 · K -1 | |||||||||||||||||||||||||||||||||
| Número de registro del CAS | 10043-92-2 | |||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | ||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de radón | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
El radón es un elemento químico con el símbolo de Rn y número atómico 86. Es un radiactivo, incoloro, inodoro, insípido gas noble , de origen natural como un producto de la desintegración indirecta de uranio o torio . Su más estable de isótopos , 222 Rn, tiene una vida media de 3,8 días. El radón es una de las sustancias más densas que sigue siendo un gas en condiciones normales. También es el único gas en condiciones normales que sólo tiene isótopos radiactivos, y se considera un peligro para la salud debido a su radiactividad. Radiactividad intensa también ha obstaculizado los estudios químicos de radón y sólo unos pocos compuestos son conocidos.
El radón se forma como un paso intermedio en la radiactivo normales cadenas de desintegración, a través del cual el torio y el uranio se descomponen lentamente en plomo . Torio y el uranio son los dos elementos radiactivos más comunes en la tierra; que han existido desde que se formó la tierra. Sus isótopos naturales tienen muy larga vida media, del orden de miles de millones de años. Torio y uranio, su producto de desintegración del radio , y su producto de desintegración del radón, serán, por tanto, seguir ocurriendo por decenas de millones de años en casi la misma concentración como lo hacen ahora. Como el radón se desintegra en sí, produce nuevos elementos radioactivos denominados descendientes del radón o productos de desintegración. A diferencia de la propia radón gaseoso, descendientes del radón son sólidos y se adhieren a las superficies, como las partículas de polvo en el aire. Si se inhala como polvo contaminado, estas partículas se pueden adherir a las vías respiratorias de los pulmones y aumentar el riesgo de desarrollar cáncer de pulmón.
A diferencia de todos los demás elementos intermedios en las cadenas de desintegración anteriores, el radón es gaseoso y tan fácilmente inhalado. Por lo tanto, incluso en esta era de los reactores nucleares, el radón de origen natural es responsable de la mayoría de la exposición del público a radiación ionizante. A menudo es el mayor contribuyente a un individuo de dosis de radiación de fondo, y es el más variable a partir de un lugar a otro. A pesar de su corta vida, algo de gas radón de fuentes naturales puede acumularse hasta mucho más alto que las concentraciones normales en los edificios, especialmente en locales cerrados como los áticos y sótanos. También se puede encontrar en algunos aguas de manantial y aguas termales.
Estudios epidemiológicos han demostrado una clara relación entre respirar altas concentraciones de radón y la incidencia de cáncer de pulmón . Por lo tanto, el radón se considera un contaminante significativo que afecta calidad del aire interior en todo el mundo. De acuerdo con la Agencia de Protección Ambiental de los Estados Unidos, el radón es la segunda causa más frecuente de cáncer de pulmón, después de fumar cigarrillos, causando 21.000 muertes por cáncer de pulmón por año en los Estados Unidos . Sobre 2.900 de estas muertes ocurren en personas que nunca han fumado. Mientras que el radón es la segunda causa más frecuente de cáncer de pulmón, es la causa número uno entre los no fumadores, según estimaciones de la EPA.
Características
Propiedades físicas
El radón es un gas incoloro e inodoro, y por lo tanto no detectables por los sentidos humanos por sí solos. En temperatura y presión estándar, el radón forma una gas monoatómico con una densidad de 9,73 kg / m 3, aproximadamente 8 veces la densidad de la atmósfera de la Tierra a nivel del mar, 1.217 kg / m3. El radón es uno de los gases más densos a temperatura ambiente y es el más denso de los gases nobles. Aunque incoloro a temperatura y presión estándar, cuando se enfría por debajo de su punto de congelación de 202 K (-71 ° C; -96 ° F), el radón emite un brillante radioluminiscencia que cambie de color amarillo a naranja-rojo como las temperatura baja. A condensación, el radón brilla debido a la intensa radiación que produce.
Propiedades químicas
Al ser un gas noble, el radón no es químicamente muy reactivo. Sin embargo, la vida media de 3,8 días de radón-222 hace que sea útil en las ciencias físicas como naturales trazador.
El radón es un miembro de las cero- valencia elementos que son llamados gases nobles. Es inerte a las reacciones químicas más comunes, tales como la combustión, debido a que el exterior valencia cáscara contiene ocho electrones. Esto produce una configuración estable de energía, mínimo en el que los electrones externos están estrechamente vinculados. Se requiere 1037 kJ / mol para extraer un electrón de sus conchas (también conocidos como la primera energía de ionización). Sin embargo, de acuerdo con las tendencias periódicas , el radón tiene una menor electronegatividad que el periodo de elemento antes de que, xenón , y por lo tanto es más reactivo. Radon es escasamente soluble en agua, pero más soluble que los gases nobles más ligeros. El radón es sensiblemente más soluble en líquidos orgánicos que en agua. Los primeros estudios concluyeron que la estabilidad de radón hidrato debe ser del mismo orden que la de los hidratos de cloro (Cl 2) o dióxido de azufre (SO 2), y significativamente mayor que la estabilidad del hidrato de sulfuro de hidrógeno (H 2 S).
Debido a su coste y la radiactividad, la investigación química experimental rara vez se realiza con el radón, y como resultado hay muy pocos informó compuestos de radón, ya sea todo fluoruros o óxidos. El radón puede ser oxidado por unos pocos agentes oxidantes poderosos tales como flúor , formando de esta manera difluoride radón. Se descompone de nuevo a los elementos a una temperatura de por encima de 250 ° C. Tiene un bajo Se pensaba volatilidad y ser RNF 2. Pero debido a la corta vida media del radón y la radioactividad de sus compuestos, no ha sido posible estudiar el compuesto en detalle. Los estudios teóricos sobre esta molécula predecir que debería tener un Rn-F distancia de enlace de 2,08 Å, y que el compuesto es termodinámicamente más estable y menos volátil más ligero que su contraparte XeF2. La molécula octaédrica RNF 6 se prevé que tenga una aún menor entalpía de formación que el difluoruro. Los fluoruros superiores RNF 4 y RNF 6 han sido reclamados a existir, pero es dudoso que en realidad se han sintetizado. El [RNA] + ion se cree que forma por la reacción:
- Rn (g) + 2 [O 2] + [SbF6] - (s) → [RNF] + [Sb 2 F 11] - (s) + 2 O 2 (g)
Óxidos de radón son de los pocos otra reportado compuestos de radón; sólo el trióxido ha sido confirmada. Radón carbonilo RNCO se ha predicho que ser estable y tener una geometría molecular lineal. Se encontró que las moléculas de Rn 2 y RnXe ser estabilizado significativamente por acoplamiento spin-órbita. El radón enjaulado dentro de un fulereno se ha propuesto como un fármaco para tumores.
Isótopos

El radón no tiene isótopos estables . Sin embargo, 36 isótopos radiactivos se han caracterizado, con su masas atómicas que van desde 193 a 228. El isótopo más estable es 222 Rn, que es una producto de la desintegración de 226 Ra, un producto de la desintegración de 238 U. Entre las hijas de 222 Rn es también el isótopo altamente inestable 218 Rn.
Hay otras tres isótopos de radón que tienen una vida media de más de una hora: 211 RN, RN y 210 224 Rn. El isótopo 220 Rn es un producto de descomposición natural de los más estables torio isótopo (232 Th), y se conoce comúnmente como torón. Tiene una vida media de 55,6 segundos y también emite radiación alfa. Del mismo modo, 219 Rn se deriva de la isótopo más estable de actinio (Ac 227) -llamada "actinon", y es un emisor alfa con una vida media de 3,96 segundos. No hay isótopos de radón se producen de forma significativa en el neptunio (237 Np) series de desintegración.
Progenie
222 Rn pertenece a la radio y el uranio-238 cadena de desintegración, y tiene una vida media de 3,8235 días. Sus cuatro primeros productos (excluyendo esquemas de desintegración marginales) son de muy corta duración, lo que significa que las desintegraciones correspondientes son indicativos de la distribución inicial de radón. Su decadencia pasa por la siguiente secuencia:
- 222 Rn, 3,8 días, alfa en descomposición para ...
- 218 Po , 3,10 minutos, alfa en descomposición para ...
- 214 Pb , 26,8 minutos, beta en descomposición para ...
- 214 Bi , 19,9 minutos, beta descomposición a ...
- 214 Po, 0,1643 ms, alfa en descomposición para ...
- 210 Pb, que tiene una vida media de 22,3 años mucho más tiempo, beta descomposición a ...
- 210 Bi, 5,013 días, beta descomposición a ...
- 210 Po, 138,376 días, alfa en descomposición para ...
- 206 Pb, estable.
El factor de equilibrio de radón es la relación entre la actividad de todos progenie de radón de periodo corto (que son responsables de la mayoría de los efectos biológicos de radón), y la actividad que sería en el equilibrio con el progenitor radón.
Si un volumen cerrado se suministra constantemente con el radón, la concentración de isótopos de vida corta aumentará hasta que se alcance un equilibrio en el que la tasa de descomposición de cada producto de la desintegración será igual a la del propio radón. El factor de equilibrio es 1 cuando ambas actividades son iguales, lo que significa que los productos de desintegración han permanecido cerca de los padres radón el tiempo suficiente para el equilibrio a alcanzar, dentro de un par de horas. En estas condiciones cada PCI adicionales / L de radón aumentará la exposición, por 0,01 WL (ver explicación de WL abajo). Estas condiciones no siempre se cumplen: en muchos hogares, la fracción de equilibrio es típicamente 40%; es decir, habrá 0.004 WL de la progenie para cada pCi / L de radón en el aire. 210 Pb lleva mucho más tiempo (décadas) entren en equilibrio con el radón, pero, si el entorno permite la acumulación de polvo durante periodos de tiempo prolongados, 210 Pb y sus productos de desintegración pueden contribuir a los niveles globales de radiación también.
Debido a su carga electrostática, progenie de radón se adhieren a las superficies o partículas de polvo, mientras que el radón gaseoso no lo hace. Adjunto los elimina del aire, causando por lo general el factor de equilibrio en la atmósfera a ser menor que uno. El factor de equilibrio se reduce también por dispositivos de circulación de aire o de filtración de aire, y se aumenta por partículas de polvo suspendidas en el aire, incluyendo el humo del cigarrillo. En altas concentraciones, los isótopos de radón en el aire contribuyen significativamente al riesgo para la salud humana. El factor de equilibrio que se encuentra en los estudios epidemiológicos es de 0,4.
Historia y etimología

El radón es el quinto elemento radiactivo que se descubrió, en 1900 por Friedrich Ernst Dorn, después de uranio, torio, radio y el polonio. En 1900 Dorn informó algunos experimentos en los que se percató de que los compuestos de radio emanan un gas radiactivo que llamó Radium Emanación (Ra Em). Antes de eso, en 1899, Pierre y Marie Curie observaron que el "gas" emitida por el radio seguía siendo radiactivo durante un mes. Más tarde ese año, Robert B. Owens y Ernest Rutherford , en Universidad de McGill en Montreal , se dio cuenta de las variaciones cuando se trata de medir la radiación de óxido de torio. Rutherford se dio cuenta de que los compuestos de torio emiten continuamente un gas radiactivo que conserva los poderes radiactivos durante varios minutos, y llamó a esta emanación de gas (de "emanare" América -para transcurrir y -expiration "emanatio"), y más tarde torio Emanación (Th Em ). En 1901, demostró que las emanaciones son radiactivos, pero atribuye los Curie para el descubrimiento del elemento. En 1903, emanaciones similares se observaron desde el actinio por André-Louis Debierne y fueron llamados actinio Emanación (Ac Em).
Varios nombres fueron sugeridos para estos tres gases: exradio, exthorio y exactinio en 1904; el radón, torón, y AKTON en 1918; radeon, thoreon y actineon en 1919, y, finalmente, el radón, torón, y actinon en 1920. La semejanza de los espectros de estos tres gases con los de argón, criptón y xenón, y su inercia química observado llevó Sir William Ramsay a sugerir en 1904 que las "emanaciones" podrían contener un elemento nuevo de la familia de los gases nobles.
En 1910, Sir William Ramsay y Robert Whytlaw-Gray aislado radón, determinó su densidad, y determinó que era el gas más pesado conocido. Ellos escribieron que "L'expresión de l'émanation du radio est fortaleza incommode", (la expresión de emanación de radio es muy torpe) y sugirió que el nuevo nombre niton (Nt) (de los "nitens" latina que significa "brillante") para enfatizar la propiedad radioluminiscencia, y en 1912 fue aceptado por la Comisión Internacional para Pesos Atómicos. En 1923, el Comité Internacional de elementos químicos y Unión Internacional de Química Pura y Aplicada (IUPAC) eligió entre los nombres de radón (Rn), torón (Tn), y actinon (An). Más tarde, cuando los isótopos fueron contados en lugar de su nombre, el elemento tomó el nombre del isótopo más estable, el radón, mientras Tn fue rebautizado 220 Rn y An pasó a llamarse 219 Rn. Todavía en la década de 1960, el elemento también se refiere simplemente como emanación. El primer compuesto sintetizado de radón, fluoruro de radón, se obtuvo en 1,962.
El peligro de la alta exposición al radón en las minas, donde las exposiciones que llegan a 1.000.000 Bq / m 3 se puede encontrar, conocido desde hace tiempo. En 1530, Paracelso describió una enfermedad degenerativa de los mineros, el metallorum mala, y Georg Agricola recomienda la ventilación en las minas para evitar este mal de montaña (Bergsucht). En 1879, esta condición fue identificado como el cáncer de pulmón por Herting y Hesse en su investigación de los mineros de Schneeberg, Alemania. Los primeros estudios importantes con el radón y la salud se produjo en el contexto de la minería del uranio en el Región de Joachimsthal Bohemia. En los EE.UU., los estudios y la mitigación sólo siguieron décadas de efectos sobre la salud de los mineros de uranio de la Suroeste de los Estados Unidos empleó durante la primera Guerra Fría ; las normas no se aplicaron hasta 1971.
La presencia de radón en el aire interior fue documentada ya en el año 1950. A partir de la década de 1970 se inició la investigación para hacer frente a las fuentes de radón en el interior, los factores determinantes de la concentración, efectos sobre la salud, y se acerca a la mitigación. En los Estados Unidos, el problema de radón en el interior recibió amplia difusión y se intensificó la investigación después de un incidente ampliamente publicitado en 1984. Durante el monitoreo de rutina en una planta de energía nuclear de Pennsylvania, un trabajador fue encontrado estar contaminados con radiactividad. Una alta contaminación de radón en su casa fue identificado posteriormente como responsable de la contaminación.
Aparición
Unidades de concentración
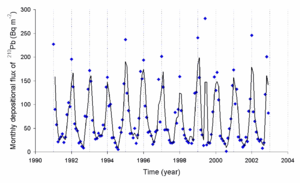
Todas las discusiones de las concentraciones de radón en el medio ambiente se refieren a 222 Rn. Mientras que la tasa media de producción de 220 Rn (de la serie de desintegración torio) es aproximadamente el mismo que 222 Rn, la cantidad de 220 Rn en el medio ambiente es mucho menor que la de 222 Rn debido a la corta vida media de 220 Rn (1 minuto frente a 4 días).
Concentración de radón se mide generalmente en la atmósfera, en becquerel por metro cúbico (Bq / m 3), la Unidad SI derivada. Exposiciones nacionales típicas son alrededor de 100 Bq / m 3 en el interior, y 10 a 20 Bq / m 3 al aire libre.
A menudo se mide en picocuries por litro (pCi / L) en los EE.UU., con 1 pCi / L = 37 Bq / m 3.
En la industria minera, la exposición se mide tradicionalmente en nivel (WL) de trabajo, y la exposición acumulada en trabajar meses nivel (WLM): 1 WL igual a cualquier combinación de efímera 222 Rn progenie (218 Po, 214 Pb, 214 Bi y 214 Po) en 1 litro de aire que libera 1,3 × 10 5 MeV de energía alfa potencial; uno WL es equivalente a 2,08 × 10 -5 julios por metro cúbico de aire (J / m 3). La unidad SI de la exposición acumulada se expresa en julios-hora por metro cúbico (J · h / m 3). Una WLM es equivalente a 3,6 × 10 -3 J · h / m 3. Una exposición a 1 WL durante 1 mes de trabajo (170 horas) es igual a 1 WLM exposición acumulativa.
Una exposición acumulativa de 1 WLM es aproximadamente equivalente a un año de vivir una atmósfera con una concentración de radón de 230 Bq / m 3.
El radón (Rn 222), cuando se libera en el aire, se descompone en 210 Pb y otros radioisótopos, los niveles de 210 Pb se pueden medir. La tasa de deposición de este radioisótopo es dependiente del tiempo.
Las concentraciones de radón que se encuentran en ambientes naturales son demasiado baja para ser detectada por medios químicos. A / m 3 (relativamente alta) concentración 1.000 Bq corresponde a 0,17 picogramos por metro cúbico. La concentración promedio de radón en la atmósfera es de aproximadamente 6 × 10 -20 átomos de radón para cada molécula en el aire, o alrededor de 150 átomos en cada ml de aire. La actividad de radón de la atmósfera de la Tierra origina a partir de algunas decenas de gramos de radón, sustituido constantemente por la descomposición de grandes cantidades de radio y el uranio.
Natural
El radón se produce por la desintegración radiactiva de radio 226, que se encuentra en los minerales de uranio; roca de fosfato; pizarras; rocas ígneas y metamórficas como el granito, gneis y esquistos; y, en menor grado, en las rocas comunes, tales como piedra caliza. Cada kilómetro cuadrado de la superficie del suelo, a una profundidad de 6 pulgadas (2,6 km2 a una profundidad de 15 cm), contiene aproximadamente 1 gramo de radio, que libera radón en pequeñas cantidades a la atmósfera A escala mundial, se estima que 2.400 millones curies (90 TBq) de radón son liberados de suelo al año.
Concentración de radón varía mucho de un lugar a otro. En el aire abierto, que varía de 1 a 100 Bq / m 3, incluso menos (0,1 Bq / m 3) por encima del océano. En cuevas o minas gaseosas, o casas aireados malos, su concentración se eleva a 20-2,000 Bq / m 3. Concentración de radón puede ser mucho mayor en contextos de minería. Reglamentos de ventilación instruyen para mantener la concentración de radón en las minas de uranio bajo el "nivel de trabajo", con niveles percentiles 95o van hasta casi 3 SV (546 pCi 222 Rn por litro de aire; 20,2 kBq / m 3, medida 1976-1985). La concentración en el aire en el (sin ventilación) Gastein Healing Galería promedios 43 kBq / m 3 (1,2 nCi / L) con valor máximo de 160 kBq / m3 (4,3 nCi / L).
El radón aparece sobre todo con la cadena de desintegración del radio y el uranio serie (222 Rn), y marginalmente con la serie del torio (220 Rn). El elemento emana naturalmente de la tierra, y algunos materiales de construcción, en todo el mundo, donde los rastros de uranio o torio se pueden encontrar, y sobre todo en regiones con suelos que contienen granito o esquisto, que tienen una mayor concentración de uranio. Sin embargo, no todas las regiones graníticas son propensos a las altas emisiones de radón. Al ser un gas raro, por lo general migra libremente a través de las fallas y los suelos fragmentados, y puede acumularse en cuevas o agua. Debido a su vida media muy corta (cuatro días para 222 Rn), concentración de radón disminuye muy rápidamente cuando la distancia desde la zona de producción aumenta. Concentración de radón varía mucho con la temporada y las condiciones atmosféricas. Por ejemplo, se ha demostrado que se acumulan en el aire si hay una inversión meteorológica y poco viento.
Las altas concentraciones de radón se pueden encontrar en algunas aguas de manantial y aguas termales. Las ciudades de Boulder, Montana; Misasa; Bad Kreuznach, Alemania ; y el país de Japón tiene resortes de radio ricos que emiten radón. Para ser clasificado como un agua mineral radón, concentración de radón debe estar por encima de un mínimo de 2 nCi / L (74 kBq / m 3). La actividad de agua mineral radón alcanza 2.000 Bq / m 3 en Merano y 4000 Bq / m 3 en Lurisia (Italia).
Las concentraciones de radón naturales en la atmósfera de la Tierra son tan bajos que el agua de radón-rica en contacto con la atmósfera perderá continuamente radón por volatilización. Por lo tanto, agua subterránea tiene una mayor concentración de 222 Rn de El agua superficial, porque el radón se produce continuamente por la desintegración radiactiva de 226 Ra presente en las rocas. Asimismo, el zona saturada de un suelo con frecuencia tiene un contenido de radón superior a la zona no saturada debido las pérdidas de difusión a la atmósfera.
En 1971, Apolo 15 pasó 110 kilometros (68 millas) por encima de la meseta de Aristarco en la Luna , y se detectó un aumento significativo partículas alfa cree que es causada por la desintegración de 222 Rn. La presencia de 222 Rn se ha inferido a partir de datos obtenidos después de la Lunar Prospector espectrómetro de partículas alfa.
El radón se encuentra en alguna de petróleo . Debido a que el radón tiene una presión similar y curva de temperatura de propano , y las refinerías de petróleo petroquímica por separado en función de sus puntos de ebullición, la tubería de transporte de gas propano recién separado en refinerías de petróleo puede llegar a ser radiactivo debido a descomposición del radón y sus productos.
Los residuos de petróleo y gas natural de la industria a menudo contienen el radio y sus hijas. La escala de sulfato a partir de una pozo de petróleo puede ser el radio rico, mientras que el agua, el aceite y gas de un pozo a menudo contiene radón. El radón se desintegra para formar radioisótopos sólidos que se forman revestimientos en el interior de las tuberías.
La acumulación en casas

El fenómeno de la contaminación radón elevado en los hogares fue descubierto por casualidad en 1985, después de las pruebas de radiación rigurosa realizada en una entrada de la planta de energía nuclear de manifiesto que Stanley Watras, ingeniero entra en la planta, estaba contaminada por sustancias radiactivas. Exposiciones nacionales típicos son de aproximadamente 100 Bq / m 3 en el interior. Dependiendo de cómo se construyen y ventilados casas, el radón se puede acumular en los sótanos y viviendas. El radón también puede filtrarse en un ambiente de interior a través de grietas en los pisos sólidos, juntas de construcción, grietas en las paredes, huecos en forjados, huecos alrededor de tuberías de servicio, cavidades en el interior paredes, y el suministro de agua. Concentraciones de radón en la misma ubicación pueden diferir por un factor de dos durante un período de 1 hora. Además, la concentración en una habitación de un edificio puede ser significativamente diferente de la concentración en una habitación contigua.
La distribución de las concentraciones de radón tiende a ser asimétrica alrededor de la media: las concentraciones más grandes tienen un peso desproporcionado mayor. Concentración de radón en interiores suele suponer que seguir un distribución logarítmica normal en un territorio determinado. Por lo tanto, la media geométrica se utiliza generalmente para la estimación de la "media" la concentración de radón en un área. La concentración media oscila entre menos de 10 Bq / m 3 a más de 100 Bq / m 3 en algunos países europeos. Típico desviaciones estándar geométricas encontrados en estudios oscilan entre 2 y 3, el significado (dada la 68-95-99.7 regla) que se espera que la concentración de radón para ser más de cien veces la concentración media de 2 a 3% de los casos.
Las concentraciones de radón promedio más altos en los Estados Unidos se encuentran en Iowa y en el Áreas Montes Apalaches en el sureste de Pensilvania. Algunas de las lecturas más altas jamás se han registrado en la ciudad irlandesa de Mallow, County Cork, lo que hace temer locales con respecto al cáncer de pulmón. Iowa tiene las concentraciones de radón promedio más altos en los Estados Unidos debido a la significativa glaciación que muele las rocas graníticas de la Escudo Canadiense y se deposita como suelos que componen la tierra fértil Iowa. Muchas ciudades dentro del estado, tales como Iowa City, han pasado los requisitos para la construcción resistente al radón en las viviendas nuevas. En algunos lugares, colas de uranio se han utilizado durante vertederos y posteriormente fueron construidas sobre, lo que resulta en un posible aumento de la exposición al radón.
Producción industrial
El radón se obtiene como un subproducto de uranífera procesamiento de minerales después de la transferencia en soluciones al 1% de clorhídrico o bromhídrico. La mezcla de gas extraído de las soluciones contiene H 2, O 2, Él, Rn, CO 2, H 2 O y hidrocarburos. La mezcla se purificó haciéndolo pasar a través de cobre a 720 ° C para eliminar el H 2 y el O 2, y luego KOH y P 2 O 5 se utilizan para eliminar los ácidos y humedad por sorción. El radón se condensa con nitrógeno líquido y se purificó a partir de gases de residuos por sublimación.
Comercialización radón está regulada, pero está disponible en pequeñas cantidades para la calibración de sistemas de medición de 222 Rn, a un precio de casi $ 6,000 por mililitro de solución de radio (que sólo contiene aproximadamente 15 picogramos de radón real en un momento dado). El radón se produce por una solución de radio 226 (vida media de 1600 años). Radium-226 decae por la emisión de partículas alfa, la producción de radón que se acumula sobre muestras de radio 226 a una tasa de alrededor de 1 mm 3 / día por gramo de radio; El equilibrio se alcanza rápidamente y se produce radón en un flujo constante, con una actividad igual a la del radio (50 Bq). Gaseoso 222 Rn (media de vida de alrededor de cuatro días) se escapa de la cápsula a través de la difusión.
Escala de concentración
| Bq / m 3 | pCi / L | Ejemplo Ocurrencia |
|---|---|---|
| 1 | ~ 0.03 | Concentración de radón en las orillas de los grandes océanos es típicamente de 1 Bq / m 3. Concentración rastro radón por encima de los océanos o en la Antártida puede ser inferior a 0,1 Bq / m 3. |
| 10 | 0.27 | La media de concentración continental al aire libre: 10 a 30 Bq / m 3. Sobre la base de una serie de encuestas, la concentración de radón en interiores media global se estima en 39 Bq / m 3. |
| 100 | 2.7 | Exposición doméstica interior típico. La mayoría de los países han adoptado una concentración de radón de 200 a 400 Bq / m 3 de aire interior como una acción o nivel de referencia. Si las pruebas muestran niveles de menos de 4 picocuries de radón por litro de aire (150 Bq / m 3), entonces no se requiere acción. Una exposición acumulada de 230 Bq / m3 de concentración de gas radón durante un periodo de 1 año corresponde a 1 WLM. |
| 1000 | 27 | Las concentraciones de radón muy altas (> 1.000 Bq / m 3) se han encontrado en las casas construidas en suelos con un alto contenido de uranio y / o alta permeabilidad del suelo. Si los niveles son 20 picocuries de radón por litro de aire (800 Bq / m 3) o más alta, el dueño de casa debe tener en cuenta algún tipo de procedimiento para disminuir los niveles de radón en el interior. |
| 10000 | 270 | El "de trabajo" en las minas de uranio corresponde a un 7.000 Bq / m3 de concentración. La concentración en el aire en las (sin ventilación) Gastein Healing Galería promedios 43 kBq / m 3 (aproximadamente 1,2 nCi / L) con valor máximo de 160 kBq / m 3 (aproximadamente 4,3 nCi / L). |
| 100000 | ~ 2700 | Acerca de 100.000 Bq / m 3 (2,7 nCi / L) se midió en Sótano de Stanley Watras. |
| 1000000 | 27000 | Las concentraciones que alcanzan 1.000.000 Bq / m 3 se pueden encontrar en las minas de uranio sin ventilación. |
Aplicaciones
Médico
Una forma de principios del siglo 20 charlatanería fue el tratamiento de enfermedades en un radiotorium. Era una habitación pequeña y sellada para los pacientes a estar expuesto al radón por sus "efectos medicinales". La naturaleza carcinógena del radón debido a su radiación ionizante se hizo evidente más adelante. Molécula de dañar la radiactividad de Radon se ha utilizado para matar las células cancerosas. No obstante, aumentar la salud de las células sanas. De hecho, la radiación ionizante provoca la formación de los radicales libres, lo que resulta en daño celular genética y otra, lo que resulta en un aumento de las tasas de enfermedades, incluyendo el cáncer .

La exposición al radón, un proceso conocido como hormesis de radiación, se ha sugerido para mitigar enfermedades autoinmunes tales como artritis. Como resultado, a finales del siglo 20 y principios del siglo 21, "las minas de salud" establecidos en Cuenca, Montana atrajo personas que buscan alivio de los problemas de salud tales como la artritis a través de una exposición limitada al agua de la mina radiactivo y el radón. Sin embargo, la práctica se recomienda debido a los efectos nocivos bien documentados de altas dosis de radiación en el cuerpo.
Baños de agua radiactiva se han aplicado desde 1906 en Jáchymov, República Checa , pero incluso antes del descubrimiento de radón que se utilizaron en Bad Gastein, Austria . Muelles de radio-ricos también se utilizan en el tradicional japonesa onsen en Misasa, Prefectura de Tottori. Terapia potable se aplica en Bad Brambach, Alemania . La terapia de inhalación se lleva a cabo en Gasteiner-Heilstollen, Austria, en Świeradów-Zdrój, Czerniawa-Zdrój, Kowary, Lądek Zdrój, Polonia, en Harghita Bai, Rumanía y, en Boulder, Estados Unidos. En los Estados Unidos y Europa hay varios radón " spas ", donde la gente se sienta durante minutos u horas en un ambiente de alto radón en la creencia de que las dosis bajas de radiación dinamizarán o energizarlos.
El radón se ha producido comercialmente para uso en terapia de radiación, pero en su mayor parte ha sido reemplazado por radionucleidos realizadas en aceleradores y reactores nucleares. El radón se ha utilizado en las semillas implantables, hecho de oro o de vidrio, principalmente utilizado para tratar los cánceres. Las semillas de oro fueron producidos por llenado de un tubo largo con el radón bombeado desde una fuente de radio, el tubo está entonces dividida en secciones cortas por engaste y corte. La capa de oro mantiene al radón en el interior, y filtra las radiaciones alfa y beta, mientras que permite la rayos gamma para escapar (que matan el tejido enfermo). Las actividades pueden variar de 0,05 a 5 milicurios por semilla (2 a 200 MBq). Los rayos gamma se producen por el radón y los primeros elementos de corta vida de su cadena de desintegración (218 Po, 214 Pb, Bi 214, 214 Po).
El radón y sus productos de desintegración primero ser muy efímero, la semilla se deja en su lugar. Después de 12 vidas medias (43 días), la radiactividad del radón está en 1/2000 de su nivel original. En esta etapa, la actividad residual predominante se origina en el producto de la desintegración del radón 210 Pb, cuya vida media (22,3 años) es 2000 veces mayor que la de radón (y cuya actividad es por lo tanto 1/2000 de radón de), y sus descendientes y 210 Bi 210 Po, totalizando 0,03% de la actividad inicial de la semilla.
En la primera parte del siglo 20 en los EE.UU., el oro contaminado con 210 Pb entró en la industria de la joyería. Esto fue a partir de semillas de oro que habían celebrado 222 Rn que se habían fundido después del radón había decaído.
Científico
El radón emanación del suelo varía con el tipo de suelo y con contenido de uranio de la superficie, por lo que las concentraciones de radón al aire libre se puede utilizar para realizar un seguimiento de las masas de aire en un grado limitado. Este hecho ha sido puesto en uso por algunos científicos atmosféricos. Debido a la rápida pérdida de radón al aire y la descomposición relativamente rápida, el radón se utiliza en hidrológico de investigación que estudia la interacción entre aguas subterráneas y arroyos. Cualquier concentración significativa de radón en una secuencia es un buen indicador de que hay insumos locales de agua subterránea. El radón también se utiliza en la datación de suelos que contienen aceite porque el radón tiene una alta afinidad para las sustancias de petróleo similares.
Radon-concentración en el suelo se ha utilizado de forma experimental al mapa enterrado cerca del subsuelo geológico fallas porque las concentraciones son generalmente más altos en los fallos. Del mismo modo, se ha encontrado un uso limitado en la prospección de gradientes geotérmicos.
Algunos investigadores han estudiado los cambios en las concentraciones de radón aguas subterráneas para la predicción de terremotos. El radón tiene una vida media de aproximadamente 3,8 días, lo que significa que se puede encontrar sólo poco después de que se ha producido en la cadena de desintegración radiactiva. Por esta razón, se ha planteado la hipótesis de que los incrementos en la concentración de radón es debido a la generación de nuevas grietas subterráneas, lo que permitiría una mayor circulación de agua subterránea, el lavado de radón. La generación de nuevas grietas no puede irrazonablemente suponerse que preceder a grandes terremotos. En los años 1970 y 1980, las mediciones científicas de las emisiones de radón cerca de fallas encontraron que los terremotos ocurrieron a menudo sin señal de radón, y el radón se detectan a menudo con ningún terremoto de seguir. Entonces fue despedido por muchos como un indicador poco fiable. Sin embargo, a partir de 2009, que está siendo investigado como un posible precursor de la NASA.
El radón es un contaminante conocido emite desde centrales eléctricas geotérmicas, aunque dispersa rápidamente y sin riesgo radiológico se ha demostrado en diversas investigaciones. La tendencia en las plantas geotérmicas es reinyectar todas las emisiones mediante el bombeo a gran profundidad, y esto parece probable que disminuya en última instancia, esos peligros del radón más.
En la década de 1950, el radón se ha utilizado en industrial la radiografía.
Riesgos para la salud - radón en el aire
El radón en las minas
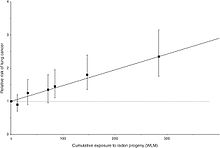
El radón-222 (progenie realidad radón) ha sido clasificado por la Agencia Internacional para la Investigación sobre el Cáncer como carcinógeno para los seres humanos, y como un gas que puede ser inhalado, el cáncer de pulmón es una preocupación particular para las personas expuestas a altos niveles de radón durante períodos prolongados de tiempo. Durante los años 1940 y 50, cuando no se implementan ampliamente los estándares de seguridad que requieren ventilación caros en las minas, la exposición al radón fue relacionado con el cáncer de pulmón entre los mineros de no fumadores de uranio y otros materiales de roca dura en lo que hoy es la República Checa , y más tarde entre los mineros desde el suroeste de los Estados Unidos.
Desde entonces, la ventilación y otras medidas se han utilizado para reducir los niveles de radón en las minas más afectados que siguen operando. En los últimos años, la exposición media anual de los mineros de uranio ha caído a niveles similares a las concentraciones inhaladas en algunos hogares. Esto ha reducido el riesgo de cáncer de origen profesional del radón, aunque los problemas de salud pueden persistir por los que están empleados actualmente en las minas afectadas y para los que se han empleado en ellos en el pasado. A medida que el riesgo relativo para los mineros ha disminuido, por lo tanto tiene la capacidad de detectar el exceso de riesgos entre esa población.
Muchos investigadores han puesto de relieve una teórica posible aumento del riesgo deleucemia de radón, pero el apoyo empírico para esto no ha surgido.
La exposición a nivel nacional
La exposición al radón (en realidad descendientes del radón) se ha relacionado con el cáncer de pulmón en numerosos estudios de casos y controles realizados en los Estados Unidos, Europa y China. Hay aproximadamente 21.000 muertes por año en los EE.UU. debido a cáncer de pulmón inducido por radón.
Uno de los estudios más completos realizados radón en los Estados Unidos por el Dr. R. William Field y sus colegas encontraron un mayor riesgo de cáncer de pulmón 50% incluso en las exposiciones prolongadas a nivel de la acción de la EPA de 4 pCi / L. América del Norte y Europa Canasta de análisis apoyan aún más estos resultados.
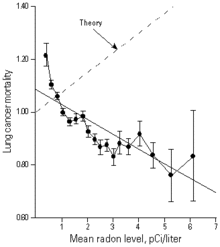
La mayoría de los modelos de la exposición al radón residencial se basan en estudios de mineros, y las estimaciones directas de los riesgos para los propietarios de viviendas que sería más deseable. No obstante, debido a las dificultades de medir el riesgo de radón en relación con otros colaboradores, a saber fumadores-modelos de su efecto a menudo han hecho uso de ellos.
El radón se ha considerado la segunda causa principal de cáncer de pulmón y causa ambiental de la mortalidad por cáncer por los Agencia de Protección Ambiental de los Estados Unidos. que otros han llegado a conclusiones similares para el Reino Unido y Francia. La exposición al radón en los hogares y oficinas puede surgir de ciertas formaciones rocosas del subsuelo, y también de ciertos materiales de construcción (por ejemplo, algunos granitos). El mayor riesgo de exposición al radón surge en edificios que son herméticos, suficientemente ventilado, y tienen fugas de cimentación que permiten que el aire de la tierra en los sótanos y habitaciones de vivienda.
El radón y el tabaquismo
Los resultados de estudios epidemiológicos indican que el riesgo de cáncer de pulmón aumenta con la exposición al radón residencial. Sin embargo, siempre hay grandes incertidumbres en estos estudios. Un ejemplo clásico y bien conocido de fuente de error es el tabaquismo. Además, el tabaquismo es el factor de riesgo más importante para el cáncer de pulmón. En Occidente, se estima que el humo del tabaco que causa aproximadamente el 90% de todos los cánceres de pulmón. Hay una tendencia a que otros riesgos de cáncer de pulmón hipotéticos se ahoguen en el riesgo de fumar. Los resultados de estudios epidemiológicos siempre deben ser interpretados con cautela.
Según la EPA, el riesgo de cáncer de pulmón para los fumadores es significativo debido a los efectos sinérgicos de radón y el tabaquismo. Para esta población de 62 personas en un total de 1.000 morirán a causa de cáncer de pulmón en comparación con 7 personas en un total de 1.000 para las personas que nunca han fumado. No puede sin embargo excluirse que el riesgo de los no fumadores debe ser explicado principalmente por un efecto combinado de radón y el tabaquismo pasivo (véase más adelante).
El radón, al igual que otros factores de riesgo externos conocidos o sospechosos para el cáncer de pulmón, es una amenaza para los fumadores y ex fumadores. Esto quedó claramente demostrado por el estudio de la agrupación europea. Un comentario al estudio agrupación declaró: "no es apropiado hablar simplemente de un riesgo de radón en los hogares, el riesgo es de fumar, agravada por un efecto sinérgico de radón para los fumadores sin fumar, el efecto parece ser tan pequeño.. como para ser insignificante ".
Un estudio de la radiación de puesto mastectomía la radioterapia muestra que los modelos simples utilizados previamente para evaluar los riesgos combinados y separados de la radiación y el tabaquismo deben ser desarrollados. Esto también es apoyado por una nueva discusión sobre el método de cálculo, LNT, que habitualmente se ha utilizado.
El radón y el tabaquismo pasivo
Una pregunta importante es si también el tabaquismo pasivo puede causar un efecto de sinergia similar con el radón residencial. Esto ha sido estudiado suficientemente. Los datos básicos para el estudio de la agrupación europea hace que sea imposible excluir que tal efecto de sinergia es una explicación para el aumento (muy limitada) en el riesgo de radón que se declaró para los no fumadores.
Un estudio de 2001, que incluyó 436 casos (nunca fumadores con cáncer de pulmón), y un grupo de control (1649 nunca han fumado) mostraron que la exposición al radón aumenta el riesgo de cáncer de pulmón en los no fumadores. Sin embargo, el grupo que había sido expuesto al tabaquismo pasivo en el hogar parecía tener todo el aumento del riesgo, mientras que los que no fueron expuestos al tabaquismo pasivo no mostraron ningún aumento en el riesgo con el aumento del nivel de radón.
Este resultado debe ser confirmada por estudios adicionales. A pesar de los resultados sorprendentes de 2001, los nuevos estudios no parecen haber sido implementado.
Riesgos para la salud - radón en el agua potable
Los efectos de radón si se ingiere son igualmente desconocido, aunque los estudios han encontrado que su vida media biológica oscila desde 30 hasta 70 minutos, con 90 por ciento de eliminación en 100 minutos. En 1999 el Consejo Nacional de Investigación investigó el tema de radón en el agua potable. Los riesgos asociados con la ingestión fue considerado casi insignificante.
Además de ser ingerido a través del agua potable, el radón también se libera de agua cuando se aumenta la temperatura, se disminuye la presión y cuando se airea el agua. Las condiciones óptimas para la liberación de radón y la exposición se producen durante la ducha. Agua con una concentración de radón de 10 4 pCi / L puede aumentar la concentración de radón en el aire interior por 1 pCi / L en condiciones normales de uso del agua.
Las concentraciones de radón en el aire pueden ser altos en las plantas con grandes piscinas de agua subterránea, tales como plantas de tratamiento de agua potable.
Pruebas y mitigación

De acuerdo con la "Guía para el Ciudadano sobre Radón" de la EPA, el método para reducir el radón "... usado sobre todo es un sistema de tubo de ventilación y el ventilador, que tira de radón de debajo de la casa y ventila hacia el exterior", que también se llama despresurización bajo losa, activa despresurización del suelo, o succión del suelo. Generalmente radón en interiores puede ser mitigado por despresurización bajo losa y agotar tales aire radón cargada hacia el exterior, lejos de las ventanas y otras aberturas del edificio. "La EPA recomienda generalmente métodos que impiden la entrada de radón. De succión del suelo, por ejemplo, impide que el radón entren a su casa dibujando el radón de debajo de la casa y de ventilación a través de un tubo o tubos, al aire por encima de la casa, donde se se diluye rápidamente "y" La EPA no recomienda el uso de sellado solo para reducir el radón, ya que, por sí mismo, el sellado no se ha demostrado para reducir los niveles de radón de manera significativa o consistente ", según la EPA" Guía del Consumidor de radón de reducción: Cómo arreglar tu hogar ".
Sistemas de ventilación de presión positiva-se pueden combinar con un intercambiador de calor para recuperar la energía en el proceso de intercambio de aire con el exterior, y simplemente expulsar el aire sótano hasta el exterior no es necesariamente una solución viable como en realidad esto puede dibujar gas radón en una vivienda. Las casas construidas en un espacio de rastreo se pueden beneficiar de un coleccionista de radón instalado bajo una "barrera de radón" (una hoja de plástico que cubre el espacio del arrastre). Para espacios de acceso, la EPA establece "Un método efectivo para reducir los niveles de radón en los hogares crawlspace consiste en cubrir el suelo de tierra con una lámina de plástico de alta densidad. Un tubo de ventilación y el ventilador se utilizan para dibujar el radón de debajo de la hoja y de ventilación a la al aire libre. Esta forma de succión del suelo se llama aspiración submembrane, y cuando se aplica correctamente, es la manera más efectiva de reducir los niveles de radón en los hogares Crawlspace ".
