
Erbio
Sabías ...
SOS Children, que corre cerca de 200 sos escuelas en el mundo en desarrollo, organizó esta selección. El patrocinio de los niños ayuda a los niños en el mundo en desarrollo para aprender también.
| Erbio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
68 Er | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
blanco plateado  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades generales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | erbio, Er, 68 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pronunciación | / ɜr b yo ə m / UR--bee əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoría metálico | lantánidos | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | n / a, 6, F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atómico estándar | 167.259 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [ Xe ] 4f 12 6s 2 2, 8, 18, 30, 8, 2 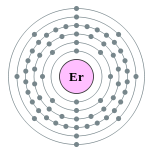 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Descubrimiento | Carl Gustaf Mosander (1842) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad (cerca rt) | 9,066 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líquido densidad en mp | 8,86 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusion | 1802 K , 1529 ° C, 2784 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullicion | 3141 K, 2868 ° C, 5194 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor de fusión | 19.90 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El calor de vaporización | 280 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacidad calorífica molar | 28.12 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión del vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estados de oxidación | 3, 2, 1 ( óxido básico) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 1,24 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energías de ionización | Primero: 589.3 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Segundo: 1150 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tercero: 2194 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico | 176 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 189 ± 18:00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscelánea | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal compacta | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenamiento magnético | paramagnético a 300 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La resistividad eléctrica | ( rt) (poli) 0,860 μΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 14.5 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Expansión térmica | ( rt) (poli) 12,2 m / (m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido (varilla delgada) | (20 ° C) 2830 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| El módulo de Young | 69.9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de corte | 28.3 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Módulo de volumen | 44.4 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relación de Poisson | 0,237 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Vickers | 589 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureza Brinell | 814 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número de registro del CAS | 7440-52-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La mayoría de los isótopos estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Los isótopos de erbio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Erbio es un elemento químico en el lantánido serie, con el símbolo de Er y número atómico 68. Un metal sólido de color blanco plateado cuando aísla artificialmente, erbio natural se encuentra siempre en combinación química con otros elementos de la Tierra. Como tal, es una elemento de tierras raras que se asocia con varios otros elementos raros en el mineral gadolinita de Ytterby en Suecia .
Usos principales de erbio implican sus iones de color rosa Er 3+, que tienen propiedades fluorescentes ópticas particularmente útiles en ciertas aplicaciones del láser. Anteojos o lentes de cristales dopados con erbio se pueden utilizar como medios de amplificación óptica, donde los iones de erbio (III) son bombeados ópticamente en alrededor de 980 nm o 1480 nm y luego irradiar luz en 1530 nm en emisión estimulada. Este proceso resulta en una inusual forma mecánica sencilla láser amplificador óptico para señales transmitidas por fibra óptica. La nm de longitud de onda 1550 es especialmente importante para comunicaciones ópticas porque monomodo estándar fibras ópticas tienen una pérdida mínima en esta longitud de onda particular. Además de láseres de fibra óptica, una gran variedad de aplicaciones médicas (es decir, dermatología, odontología) utilizar 2940 nm de emisión del ion de erbio (ver Er: YAG), el cual es altamente absorbida en agua en los tejidos, por lo que su efecto muy superficial. Tal deposición de tejido superficial de la energía láser es útil en la cirugía con láser, y para la producción eficiente del vapor para la ablación con láser de esmalte en ciertos tipos de odontología láser.
Características
Propiedades físicas

Un trivalente elemento, erbio pura del metal es maleable (o fácilmente en forma), suave pero estable en el aire, y no lo hace oxidar tan rápidamente como alguna otra metales de las tierras raras. Su sales son de color rosa, y el elemento tiene característica fuerte bandas del espectro de absorción de la luz visible , ultravioleta , y cerca infrarrojos. De lo contrario, se parece mucho a las otras tierras raras. Su sesquióxido se llama erbia. Propiedades de erbio son en un grado dictado por el tipo y la cantidad de impurezas presentes. Erbium no juega ningún papel biológico conocido, pero se cree que es capaz de estimular metabolismo.
Erbio es ferromagnético por debajo de 19 K, antiferromagnético entre 19 y 80 K y paramagnético por encima de 80 K.
Erbio puede formar clústeres atómicos en forma de hélice Er 3 N, donde la distancia entre los átomos de erbio es 0,35 nm. Esos grupos pueden aislarse mediante encapsulación de los mismos en moléculas de fullereno, como lo confirma microscopía electrónica de transmisión.
Propiedades químicas
Erbium de metal empaña lentamente en el aire y se quema fácilmente para formar erbio (III) óxido de:
- 4 Er + 3 O 2 → 2 Er 2 O 3
Erbio es muy electropositivo y reacciona lentamente con el agua fría y bastante rápidamente con agua caliente para formar hidróxido de erbio:
- 2 Er (s) + 6 H2O (l) → 2 Er (OH) 3 (ac) + 3 H 2 (g)
Erbium de metal reacciona con todos los halógenos:
- 2 Er (s) + 3 F 2 (g) → 2 ErF 3 (s) [rosa]
- 2 Er (s) + 3 Cl 2 (g) → 2 ERCL 3 (s) [violeta]
- 2 Er (s) + 3 Br 2 (g) → 2 ErBr 3 (s) [violeta]
- 2 Er (s) + 3 I 2 (g) → 2 ErI 3 (s) [violeta]
Erbio se disuelve fácilmente en diluida de ácido sulfúrico para formar soluciones que contienen Er (III) iones hidratados, que existen como el amarillo [Er (OH 2) 9] 3+ complejos de hidratación:
- 2 Er (s) + 3 H 2 SO 4 (ac) → 2 Er 3+ (ac) + 3 SO 2-
4 (aq) + 3 H 2 (g)
Isótopos
Naturalmente erbio ocurre se compone de 6 estables isótopos , 162 Er, 164 Er, 166 Er, 167 Er, 168 Er, y 170 con 166 Er Er siendo el más abundante (33,503% abundancia natural). 29 radioisótopos se han caracterizado, con ser el más estable Er 169 con una vida media de 9,4 d, Er 172 con una vida media de 49,3 h, 160 Er, con una vida media de 28,58 h, 165 Er, con una vida media de 10,36 h, y 171 Er, con una vida media de 7.516 h. Todos los restantes isótopos radiactivos tienen vidas medias que son menos que 3,5 h, y la mayoría de ellos tienen vidas medias que son menos de 4 minutos. Este elemento también tiene 13 estados de la meta, con la más estable Er ser 167m con una vida media de 2.269 s.
Los isótopos de gama erbio en peso atómico de 142.9663 u (143 Er) a 176.9541 u (177 Er). El primario modo de decaimiento antes del isótopo estable más abundante, 166 Er, es captura de electrones, y el modo primario después de que se desintegración beta. El primario productos de desintegración antes 166 Er son elemento 67 ( holmio ) isótopos, y los productos primarios después de son elemento 69 ( tulio ) isótopos.
Historia
Erbio (por Ytterby, una aldea en Suecia ) fue descubierto por Carl Gustaf Mosander en 1843. Mosander separado "itrio" del mineral gadolinita en tres fracciones que denominó itrio, erbia, y terbia. Él nombró el nuevo elemento después del pueblo de Ytterby, donde se encuentran grandes concentraciones de itrio y erbio. Erbia y terbia, sin embargo, estaban confundidos en este momento. Después de 1860, pasó a llamarse terbia erbia y después de 1877 lo que se había conocido como erbia fue rebautizado terbia. Bastante pura Er 2 O 3 se aisló de forma independiente en 1905 por Georges Urbain y Charles James. Razonablemente metal puro no se produjo hasta 1934, cuando Klemm y Bommer redujeron el anhidro cloruro con potasio vapor. No fue sino hasta la década de 1990 que el precio para el óxido de erbio derivada de China se convirtió en lo suficientemente bajo como para erbio para ser considerado para el uso como colorante en el vidrio del arte.
Aparición

La concentración de erbio en la corteza terrestre es de aproximadamente 2,8 mg / kg y en el agua de mar 0,9 ng / L. Esta concentración es suficiente para hacer erbio sobre 45 en abundancia elemental en la corteza terrestre.
Como otras tierras raras, este elemento no se encuentra como elemento libre en la naturaleza, pero se encuentra unido en minerales de arena monacita. Ha sido históricamente muy difícil y costoso para separar las tierras raras de la otra en sus minerales pero las técnicas de producción de intercambio iónico desarrollado en el siglo 20 han traído gran medida reducir el costo de producción de todos los metales de las tierras raras y sus compuestos químicos .
Las principales fuentes comerciales de erbio son de los minerales xenotima y euxenite, y, más recientemente, las arcillas de adsorción de iones del sur de China; en consecuencia, China se ha convertido en el principal proveedor mundial de este elemento. En las versiones de alto itrio de estos concentrados de mineral, itrio es de aproximadamente dos tercios del total en peso, y erbia es de aproximadamente 4-5%. Cuando se disuelve el concentrado en ácido, el erbia libera suficiente de iones de erbio para impartir un color rosa distinta y característica para la solución. Este comportamiento del color es similar a lo Mosander y los demás trabajadores de la primera en los lantánidos habrían visto en sus extractos de los minerales gadolinita de Ytterby.
Producción
Minerales triturados son atacados por clorhídrico o ácido sulfúrico que transforma los óxidos insolubles de tierras raras en cloruros o sulfatos solubles. Los filtrados ácidos se neutralizan parcialmente con sosa cáustica (hidróxido de sodio) a pH 3-4. El torio precipita de la solución como hidróxido y se retira. Después de que la solución se trata con oxalato de amonio para convertir tierras raras en su insoluble oxalatos. Los oxalatos se convierten en óxidos mediante recocido. Los óxidos se disuelven en ácido nítrico que excluye a uno de los componentes principales, de cerio , óxido de cuya es insoluble en HNO 3. La solución se trata con nitrato de magnesio para producir una mezcla de cristalizado sales dobles de metales de las tierras raras. Las sales se separan por intercambio iónico. En este proceso, los iones de tierras raras son absorbidos en la resina de intercambio iónico adecuada por intercambio con hidrógeno, amonio o iones cúpricos presentes en la resina. Los iones de tierras raras se lavan a continuación selectivamente a cabo por el agente complejante adecuado. Erbio metálico se obtiene de su óxido o sales calentando con calcio a 1450 ° C en atmósfera de argón.
Aplicaciones

Usos cotidianos de erbio son variadas. Es comúnmente usado como un filtro fotográfico, y debido a su capacidad de resistencia es útil como un aditivo metalúrgico. Otros usos:
- Utilizado en nuclear tecnología en absorbente de neutrones barras de control.
- Cuando se añade a vanadio como una aleación, erbio baja dureza y mejora la trabajabilidad.
- Óxido de erbio tiene un color rosa, y se utiliza a veces como un colorante para vidrio , circonio cúbico y porcelana. El vidrio continuación, se utiliza a menudo en gafas de sol y barato de la joyería .
- Dopada con erbio fibras ópticas de sílice de vidrio son el elemento activo en amplificadores de fibra dopada con erbio (EDFAs), que son ampliamente utilizados en comunicaciones ópticas. Las mismas fibras pueden ser utilizados para crear la fibra láser . Co-dopaje de la fibra óptica con Er e Yb se utiliza en alta potencia Er / Yb láseres de fibra, que sustituyen gradualmente láseres de CO2 para la soldadura de metal y aplicaciones de corte. Erbium también se puede utilizar en amplificadores de guía de onda dopada con erbio.
- Un erbium- níquel aleación de Ni Er 3 tiene una inusualmente alta capacidad de calor específico a temperaturas de helio líquido y se utiliza en Sistemas de refrigeración criogénicos; una mezcla de 65% Er 3 Co y 35% Er 0,9 Yb 0,1 Ni en volumen mejora la capacidad de calor específico aún más.
- Una gran variedad de aplicaciones médicas (por ejemplo, dermatología, odontología) utilizan 2.940 nm de emisión de iones de erbio (ver Er: YAG), el cual es altamente absorbida en agua ( coeficiente de absorción sobre 12.000 / cm). Tal deposición de tejido superficial de la energía del láser es necesario para la cirugía con láser, y la producción eficiente de vapor para la ablación de esmalte láser en odontología.
Papel biológico
Erbium no tiene una función biológica, pero las sales de erbio puede estimular metabolismo. Los seres humanos consumen 1 miligramo de erbio al año en promedio. La mayor concentración de erbio es el ser humano es el de la huesos, pero también hay erbio en los humanos riñones y hígado.
Toxicidad
Erbio es ligeramente tóxico si se ingiere, pero los compuestos de erbio no son tóxicos. Erbio metálico en forma de polvo presenta un peligro de incendio y explosión.
Cultura popular
En la novela de Carl Sagan "Contacto", una máquina está construido a partir de un modelo recibida a través de una transmisión de radio extraterrestre. Un componente importante (e inexplicable) de la máquina se construye tacos de erbio.
