
Valence (química)
Sabías ...
Esta selección wikipedia ha sido elegido por los voluntarios que ayudan Infantil SOS de Wikipedia para esta Selección Wikipedia para las escuelas. SOS Children es la caridad más grande del mundo dando huérfanos y abandonados los niños la oportunidad de la vida familiar.
En la química , de valencia, también conocido como valencia o número de valencia, es una medida del número de enlaces formados por un átomo de un elemento dado. "Valence" se puede definir como el número de valencia une un átomo dado se ha formado, o puede formar, con uno o más de otros átomos. Para la mayoría de los elementos del número de enlaces puede variar. La Definición IUPAC limita valencia al número máximo de átomos de univalentes que pueden combinar con el átomo, que es el número máximo de enlaces de valencia que es posible para el elemento dado.
La valencia de un elemento depende del número de electrones de valencia que pueden estar implicados en la formación de enlaces de valencia. Un univalente (monovalente) átomo, ion o grupo tiene una valencia de uno y por lo tanto pueden formar uno enlace covalente. La bivalente entidad molecular tiene una valencia de dos y puede formar dos enlaces sigma o uno enlace sigma más uno enlace pi. Los grupos alquilo y iones hidroxilo son ejemplos univalentes; ligandos oxo son divalentes.
Durante el último siglo, el concepto de valencia se convirtió en una serie de enfoques para describir el enlace químico, incluyendo Estructuras de Lewis (1916), teoría del enlace de valencia (1927), orbitales moleculares (1928), valencia de electrones shell teoría repulsión de los pares (1958) y todos los métodos avanzados de química cuántica .
 | En ciclohexanona oxima (imagen de la izquierda), el nitrógeno átomo tiene tres enlaces de valencia y por la primera definición que tiene una valencia de tres. El nitrógeno tiene cinco electrones de valencia y, por definición IUPAC que tiene una valencia de cinco, porque puede formar cinco enlaces de valencia máxima, como en óxido de N-metil-1-phenylmethanimine . En cyclohexanonoxime, nitrógeno tiene el estado de oxidación -1 y oxígeno -2. |
Historia
La etimología de la palabra "valencia" se remonta a 1425, lo que significa "extraer, preparación," de América valentia "fuerza, capacidad," y el significado químico se refiere a la "capacidad de combinación de un elemento" se registra a partir de 1884, del alemán Valenz .
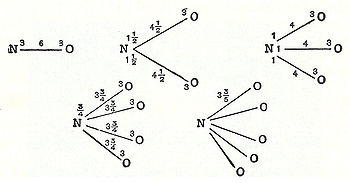
En 1789, William Higgins publicó puntos de vista sobre lo que llamó combinaciones de partículas "últimas", que prefiguraban el concepto de enlaces de valencia. Si, por ejemplo, de acuerdo a Higgins, la fuerza entre la partícula final de oxígeno y la partícula final de nitrógeno eran 6, entonces la intensidad de la fuerza se dividiría en consecuencia, y de manera similar para las otras combinaciones de partículas últimas (véase la ilustración) .
El inicio exacto, sin embargo, de la teoría de valencias químicas se puede remontar a un documento de 1852 por Edward Frankland, en la que combina las teorías anteriores de los radicales libres y la "teoría de tipo" con pensamientos sobre afinidad química para demostrar que ciertos elementos tienen la tendencia a combinarse con otros elementos para formar compuestos que contienen 3, es decir, en los tres grupos de átomos (por ejemplo, NO 3, NH 3, NI 3, etc.) o 5, es decir, en los cinco grupos de átomos (por ejemplo, NO 5, NH 4 O, PO 5, etc.), equivalentes de los elementos conectados. Es de esta manera, de acuerdo con Frankland, que sus afinidades son las mejores satisfecho. Siguiendo estos ejemplos y postulados, Frankland declara lo obvio que es que:
| " | Una tendencia o la ley prevalece (en este caso), y que, no importa lo que los personajes de los átomos unificadores pueden ser, el poder de la combinación del elemento de atracción, si se me permite el término, siempre es satisfecha por el mismo número de estos átomos . | " |
Este "poder de combinación" se llamó después quantivalence o valencia (valencia y por los químicos estadounidenses).
Covalence
El concepto de covalencia se desarrolló en la mitad del siglo XIX, en un intento de racionalizar las fórmulas de diferentes compuestos químicos . En 1919, Irving Langmuir, tomó prestado el término para explicar Gilbert N. Lewis modelo del átomo cúbico al afirmar que "el número de pares de electrones que Any Given átomo comparte con los átomos adyacentes se llama la covalencia de ese átomo. " El prefijo co- significa "juntos", de modo que un enlace covalente significa que los átomos de compartir valencia. Por lo tanto, si un átomo, por ejemplo, tenía una valencia 1, lo que significa que tiene un electrón de valencia más allá de la carcasa completa, y otro un -1 de valencia, lo que significa que requiere un electrón para completar su capa externa (falta un electrón), entonces un vínculo entre estos dos átomos resultaría porque estarían complementando o compartir su equilibrio de tendencias de valencia. Posteriormente, ahora es más común hablar de enlaces covalentes en lugar de "valencia", lo que ha quedado fuera de uso en el trabajo de nivel superior con los avances en la teoría del enlace químico, pero sigue siendo ampliamente utilizados en los estudios elementales en las que proporciona una introducción heurístico para el sujeto.
Valencias comunes
Para los elementos de la principales grupos de la tabla periódica , la valencia puede variar entre uno a siete, pero por lo general estos elementos forman una serie de enlaces de valencia entre uno y cuatro. El número de enlaces formados por un elemento dado se pensó originalmente para ser una propiedad química fija. De hecho, en la mayoría de los casos esto no es cierto. Por ejemplo, el fósforo a menudo tiene una valencia de tres, pero también puede tener otras valencias.
Sin embargo, muchos elementos tienen una valencia común relacionado con su posición en la tabla periódica, siguiendo el regla del octeto. Los elementos de los grupos principales 1 (metales alcalinos) y 17 (halógenos) suelen tener una valencia de 1; elementos de los grupos 2 (metales alcalinotérreos) y (16) calcógenos de valencia 2; elementos en 13 grupos (grupo de boro) y 15 (grupo de nitrógeno) de valencia 3; elementos en grupo 14 (grupo de carbono) valencia 4.
Valence frente a estado de oxidación
Debido a la ambigüedad del término de valencia, en la actualidad otras anotaciones se utilizan en la práctica. Además de el sistema de números de oxidación tal como se utiliza en Stock nomenclatura para compuestos de coordinación, y la notación lambda, tal como se utiliza en el Nomenclatura química de los compuestos inorgánicos, " estado de oxidación "es una indicación más clara de la situación electrónica de los átomos en una molécula.
El " estado de oxidación "de un átomo en una molécula da el número de electrones de valencia que ha ganado o perdido. En contraste con el número de valencia, el estado de oxidación puede ser positiva (por un átomo electropositivo) o negativo (para una átomo electronegativo).
Los elementos de un alto estado de oxidación pueden tener una valencia mayor que cuatro. Por ejemplo, en percloratos, cloro tiene siete enlaces de valencia y rutenio , en el estado de oxidación en 8 rutenio (VIII) tetróxido, tiene incluso ocho enlaces de valencia.
"Número máximo de bonos" definición
La Unión Internacional de Química Pura y Aplicada (IUPAC) ha hecho varios intentos para llegar a una definición inequívoca de valencia. La versión actual, adoptada en 1994 ,:
- El número máximo de átomos univalentes (originalmente átomos de hidrógeno o cloro) que pueden combinar con un átomo del elemento de que se trate, o con un fragmento, o para los que un átomo de este elemento puede ser sustituido.
El hidrógeno y el cloro se utilizaron originalmente como ejemplos de átomos univalentes, debido a su naturaleza para formar un único enlace sencillo. El hidrógeno tiene un solo electrón de valencia y puede formar solamente un enlace con un átomo que tiene una incompleta cáscara externa. Cloro tiene siete electrones de valencia y puede formar solamente un enlace con un átomo que dona un electrón de valencia para completar la cáscara externa del cloro. Sin embargo, cloro también puede tener estados de oxidación 1-7 y puede formar más de un enlace con la donación de electrones de valencia.
Aunque el hidrógeno tiene un solo electrón de valencia, se puede formar enlaces con más de un átomo en bonos hipervalentes. En el ion bifluoruro ([HF 2] -), por ejemplo, forma una de tres centros de bonos de cuatro electrones con dos átomos de flúor: ![[\ F \ frac {\ quad} {\ quad H} \ {} ^ - \ F \ quad \ Longleftrightarrow \ quad F ^ -! \ {} \ H \ frac {\ quad} {\ quad F} \]](../../images/1118/111899.png)
Otro ejemplo es el Enlace de tres centros y dos electrones en diborano (B 2 H 6).
Ejemplos
(Valencias de acuerdo con el número de enlaces de valencia definición y se ajustan estados de oxidación)
| COMPUESTO | FORMULA | VALENCE | Estado de oxidación |
|---|---|---|---|
| El cloruro de hidrógeno | HCl | H = 1 Cl = 1 | H = + 1 Cl = -1 |
| Cloro | Cl 2 | Cl = 1 Cl = 1 | Cl = + 1 Cl = -1 |
| El perclorato * | HClO4 | H = 1 Cl = 7 O = 2 | H = + 1 = Cl + 7 O = -2 |
| Hidruro de sodio | NaH | Na = 1 H = 1 | Na = + 1 H = -1 |
| Óxido ferroso ** | FeO | Fe = 2 O = 2 | Fe = + 2 O = -2 |
| El óxido férrico ** | Fe 2 O 3 | Fe = 3 O = 2 | Fe = + 3 O = -2 |
* El ion perclorato univalente (ClO 4 -) tiene valencia 1.
** El óxido de hierro aparece en un estructura de cristal, por lo que ninguna molécula típica puede ser identificado.
En óxido ferroso, Fe tiene número de oxidación II, en óxido férrico, número de oxidación III.
Valencias de los elementos
Valencias máximos para la mayoría de los elementos se basan en el fluoruro o fluoroanion más alto conocido. Tenga en cuenta que valencia de hidrógeno y flúor son dos. El astato se predice que tienen valencia de siete, pero no se sabe que tiene compuestos con una valencia por encima de uno.
Valencias máximas de los elementos | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupo → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| ↓ Período | ||||||||||||||||||||
| 1 | 1 H | 2 Él | ||||||||||||||||||
| 2 | 3 Li | 4 Ser | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Nebraska | ||||||||||||
| 3 | 11 N / A | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Arkansas | ||||||||||||
| 4 | 19 K | 20 California | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Minnesota | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Georgia | 32 Ge | 33 Como | 34 Se | 35 Br | 36 Kr | ||
| 5 | 37 Rb | 38 Sr | 39 Y |
40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 CD | 49 En | 50 Sn | 51 Sb | 52 Te | 53 YO | 54 Xe | ||
| 6 | 55 Cs | 56 Ba | * | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg |
81 Tl | 82 Pb | 83 Bi | 84 Correos | 85 En | 86 Rn | ||
| 7 | 87 Fr | 88 Ra | ** | 104 Rf | 105 Db | 106 Mx | 107 Bh | 108 Hs | 109 Montana | 110 Ds | 111 Rg | 112 Cn | 113 Uut | 114 Florida | 115 Uup | 116 Lv | 117 Uus | 118 Uuo | ||
| * lantánidos | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Ue | 64 Di-s | 65 Tuberculosis | 66 Dy | 67 Ho |
68 Er | 69 Tm | 70 Yb | 71 Lu | |||||
| ** actínidos | 89 Corriente alterna | 90 Th | 91 Papá | 92 U | 93 Np | 94 Pu | 95 Soy | 96 Cm |
97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Maryland | 102 No | 103 Lr | |||||
| Valencias máximas se basan en el Lista de los estados de oxidación de los elementos | ||||||||||||||||||||
Valencias máximas de los elementos químicos | |||||||||||||
|
| ||||||||||||
