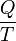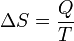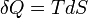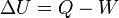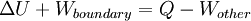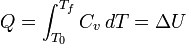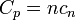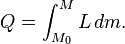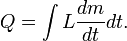Chaleur
Saviez-vous ...
Enfants SOS bénévoles ont aidé à choisir des articles et faites autre matériel de programme de parrainage d'enfants aide les enfants du monde en développement à apprendre aussi.
Dans la physique , de la chaleur, symbolisé par Q, est l'énergie transférée d'un organisme ou système à l'autre en raison d'une différence de température . En thermodynamique , une quantité de TDS est utilisé comme une mesure représentative de la chaleur, qui est la température absolue d'un objet multiplié par la quantité différentielle d'un système de l'entropie mesurée à la limite de l'objet. La chaleur peut se écouler spontanément à partir d'un objet avec une température élevée pour un objet avec une température inférieure. Le transfert de chaleur d'un objet à un autre objet à une température égale ou supérieure peut se produire uniquement à l'aide d'un pompe à chaleur. Organismes de température élevée, qui aboutissent souvent à des taux élevés de transfert de chaleur, peut être créé par des réactions chimiques (tels que brûlure), réactions nucléaires (tels que la fusion qui a lieu à l'intérieur du Soleil ), électromagnétique dissipation (comme dans cuisinières électriques), ou dissipation mécanique (tels que frottement). La chaleur peut être transférée entre des objets par rayonnement, conduction et convection. Température est utilisée comme une mesure de l'énergie interne ou enthalpie , ce est le niveau de mouvement primaire donnant lieu à un transfert de chaleur. La chaleur ne peut être transféré entre les objets, ou des zones dans un objet, avec des températures différentes (comme indiqué par le Principe zéro de la thermodynamique), puis, en l'absence de travaux, uniquement dans la direction du corps froid (selon la seconde loi de la thermodynamique ). La température et la phase d'une substance soumise à un transfert de chaleur sont déterminés par chaleur latente et la capacité calorifique. Un terme connexe est l'énergie thermique, vaguement défini comme l'énergie d'un corps qui augmente avec sa température .

Vue d'ensemble
La première loi de la thermodynamique affirme que l'énergie d'un système fermé est conservé. Par conséquent, pour modifier l'énergie d'un système, de l'énergie doit être transférée vers ou depuis le système. La chaleur et le travail sont les deux seuls mécanismes par lesquels l'énergie peut être transférée vers ou à partir d'une masse de commande. La chaleur est le transfert d'énergie provoquée par la différence de température. L'unité de la quantité d'énergie transférée par la chaleur en Système international d'unités SI est le joule (J), si le British Thermal Unit et de la calories sont encore parfois utilisé aux États-Unis. L'unité de la vitesse de transfert de chaleur est la watt (W = J / s).
Le transfert de chaleur est un fonction de trajet ( quantité de processus), par opposition à un fonction de point ( grandeur d'état). Le flux de chaleur entre les systèmes qui ne sont pas en équilibre thermique avec l'autre; il coule spontanément des zones de haute température dans des zones de basse température. Lorsque deux corps de température différente entrent en contact thermique, ils vont échanger de l'énergie interne jusqu'à ce que leurs températures sont égalisées; ce est, jusqu'à ce qu'ils atteignent équilibre thermique. L'adjectif chaud est utilisé comme un terme relatif pour comparer la température de l'objet à celle de l'environnement (ou celui de la personne utilisant le terme). La chaleur à long terme est utilisé pour décrire le flux d'énergie. En l'absence d'interactions de travail, la chaleur qui est transférée à un objet finit par se stockées dans l'objet sous la forme d'énergie interne.

La chaleur spécifique est définie comme la quantité d'énergie qui doit être transféré vers ou depuis une unité de masse ou en moles d'une substance pour changer sa température par une degré. La chaleur spécifique est une propriété, ce qui signifie que cela dépend de la substance à l'étude et son état comme spécifié par ses propriétés. Combustibles, lorsqu'il est brûlé, libèrent une grande partie de l'énergie dans les liaisons chimiques de leurs molécules. Lors du passage d'une phase à l'autre, une substance rejets purs ou absorbe la chaleur sans son changement de température. La quantité de transfert de chaleur pendant un changement de phase est appelée chaleur latente et dépend principalement de la substance et de son état.
Energie Thermique
L'énergie thermique est un terme souvent confondu avec celui de la chaleur. Grosso modo, quand la chaleur est ajoutée à une système thermodynamique ses augmentations d'énergie thermique et lorsque la chaleur est retirée de ses baisses d'énergie thermique. Dans ce point de vue, les objets qui sont chauds sont désignées comme étant en possession d'une grande quantité d'énergie thermique, tandis que les objets froids possèdent peu d'énergie thermique. L'énergie thermique est alors souvent à tort défini comme étant synonyme du mot chaleur. Ceci, cependant, ne est pas le cas: un objet ne peut pas posséder la chaleur, mais seulement de l'énergie. L'énergie thermique terme lorsqu'il est utilisé dans la conversation ne est pas souvent utilisé dans un sens tout à fait correct, mais est plus susceptible d'être utilisé comme un mot descriptif. En physique et de la thermodynamique, les mots "chaleur", " énergie "," travail "," enthalpie "(teneur en chaleur),« entropie »,« externes forces ", etc., qui peut être définie exactement, ce est à dire sans avoir recours à des motions et des vibrations atomiques internes, ont tendance à être préféré et utilisé plus souvent que l'énergie thermique à long terme, ce qui est difficile à définir.
Histoire
Dans l' histoire de la science , l'histoire de la chaleur retrace ses origines de la première hominidés de faire feu et de spéculer sur son fonctionnement et un sens à jour modernes physiciens des particules qui étudient la nature sub-atomique de la chaleur. En bref, le phénomène de la chaleur et sa définition a évolué à partir des théories mythologiques de feu , à la chaleur, à pinguis cuite, phlogistique, à air de feu, calorique, de la théorie de la chaleur, de la équivalent mécanique de la chaleur, à la thermo-dynamique (parfois appelé énergétique) à la thermodynamique . L'histoire de la chaleur, alors, est un précurseur de l'évolution et les théories de la l'histoire de la thermodynamique.
Notation
Le montant total de l'énergie transférée par transfert de chaleur est classiquement abrégé Q. La convention de signe conventionnel est que quand un corps libère de la chaleur dans son environnement, Q <0 (-); . quand un corps absorbe la chaleur de son environnement, Q> 0 (de +) Taux de transfert de chaleur, ou flux de chaleur par unité de temps, est désigné par:
 .
.
Elle est mesurée en watts. flux de chaleur est définie comme le taux de transfert de chaleur par unité de surface de section transversale, et est noté q, résultant en unités de watts par mètre carré, bien que légèrement différentes conventions de notation peuvent être utilisés.
Entropy
En 1854, le physicien allemand Rudolf Clausius défini le deuxième théorème fondamental (la seconde loi de la thermodynamique ) dans la mécanique théorie de la chaleur ( thermodynamique ): "si deux transformations qui, sans nécessiter aucun autre changement permanent, peut remplacer mutuellement les uns les autres, être appelés équivalent, les générations de la quantité de chaleur Q du travail à la température T, a l'équivalence un valeur: "
En 1865, il est venu de définir ce rapport que l'entropie symbolisée par S, de telle sorte que, pour un système fixe fermé:
et ainsi, par réduction, les quantités de chaleur AQ (e différentielle inexacte) sont définis comme quantités de TDS (un différentielle exacte):
En d'autres termes, la fonction d'entropie S facilite la quantification et la mesure des flux de chaleur à travers un limite thermodynamique.
Définitions
En termes modernes, la chaleur est définie comme l'énergie de manière concise en transit. Physicien écossais James Clerk Maxwell , dans son 1871 Théorie classique de chaleur, a été l'un des premiers à énoncer une définition moderne de la "chaleur". En bref, Maxwell a présenté quatre stipulations sur la définition de la chaleur. Premièrement, il est «quelque chose qui peut être transféré d'un corps à un autre", selon la seconde loi de la thermodynamique . Deux, il peut parler comme un «quantité mesurable», et ce traité mathématiquement comme les autres quantités mesurables. Troisièmement, il "ne peut pas être considérée comme une substance"; car il peut être transformé en quelque chose qui ne est pas une substance, p.ex. travail mécanique . Enfin, il est "l'une des formes de l'énergie ". Similaires tels moderne, définitions succinctes de chaleur sont les suivantes:
- Dans un sens thermodynamique, la chaleur ne est jamais considéré comme étant stocké dans un corps. Comme le travail, elle ne existe que sous forme d'énergie en transit d'un corps à un autre; dans la terminologie thermodynamique, entre un système et de ses environs. Lorsque l'énergie sous forme de chaleur est ajouté à un système, il est stocké sous forme de chaleur, mais pas sous forme d'énergie cinétique et potentielle des atomes et des molécules qui constituent le système.
- La chaleur de nom ne est défini que pendant le processus de transfert d'énergie par conduction ou rayonnement.
- La chaleur est défini comme tout écoulement spontané de l'énergie d'un objet à un autre, provoquée par une différence de température entre deux objets.
- La chaleur peut être définie comme l'énergie en transit d'un objet à haute température à un objet de température inférieure.
- La chaleur est une interaction entre deux systèmes fermés sans échange de travail est une interaction thermique pur quand les deux systèmes, d'abord isolés et dans un équilibre stable, sont mises en contact. L'énergie échangée entre les deux systèmes est ensuite appelée chaleur.
- La chaleur est une forme d'énergie que possède une substance en vertu du mouvement de vibration, ce est à dire l'énergie cinétique, des molécules ou des atomes.
- La chaleur est le transfert d'énergie entre les substances à des températures différentes.
Thermodynamique
L'énergie interne
De la chaleur est liée à la énergie interne  et le système de travail
et le système de travail 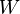 effectuée par le système par la première loi de la thermodynamique :
effectuée par le système par la première loi de la thermodynamique :
ce qui signifie que l'énergie du système peut modifier le travail ou soit par l'intermédiaire des flux de chaleur à travers la limite de la système thermodynamique. De manière plus détaillée, L'énergie est la somme de toutes les formes microscopiques d'énergie d'un système. Elle est liée à la structure moléculaire et le degré d'activité moléculaire et peut être considérée comme la somme des énergies cinétiques et potentielles des molécules; il comprend les types d'énergies suivantes:
| Type | Composition de L'énergie interne (U) |
|---|---|
| Énergie sensible | la partie de la énergie interne d'un système associé avec des énergies cinétiques (traduction moléculaire, la rotation et les vibrations, la traduction électronique et de spin et spin nucléaire) des molécules. |
| Énergie latente | l'énergie associée à l' étape d'un système. |
| L'énergie chimique | l'énergie interne associé aux liaisons atomiques dans une molécule. |
| Énergie nucléaire | l'énorme quantité d'énergie associée à la de fortes liaisons dans le noyau de l'atome lui-même. |
| interactions énergétiques | ces types d'énergies ne sont pas stockées dans le système (par exemple, transfert de chaleur, transfert de masse, et travaux), mais qui sont comptabilisés à la limites du système comme ils le traversent, qui représentent les gains ou les pertes par un système au cours du processus. |
| Energie Thermique | la somme des formes sensibles et latentes de l'énergie interne. |
Le transfert de la chaleur à un gaz parfait à pression constante augmente l'énergie interne et effectue des travaux de délimitation (c. permet un volume de contrôle de gaz à devenir plus ou moins), à condition que le volume ne est pas contraint. Revenant à la première loi équation et la séparation de la période de travail en deux types, "travail de frontière» et «autres» (par exemple travail de l'arbre réalisée par un ventilateur de compresseur), donne le résultat suivant:
Cette quantité combinée  est l'enthalpie ,
est l'enthalpie ,  , L'un des potentiels thermodynamiques. Les deux enthalpie,
, L'un des potentiels thermodynamiques. Les deux enthalpie,  , Et de l'énergie interne,
, Et de l'énergie interne,  sont fonctions de l'État. fonctions étatiques reviennent à leur valeur initiale à la fin de chaque cycle dans des processus cycliques, tels que celui d'une moteur thermique. En revanche, ni
sont fonctions de l'État. fonctions étatiques reviennent à leur valeur initiale à la fin de chaque cycle dans des processus cycliques, tels que celui d'une moteur thermique. En revanche, ni  ni
ni 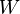 sont des propriétés d'un système et ne sont pas nécessairement somme soit égale à zéro au cours des étapes d'un cycle. L'expression infinitésimale de chaleur,
sont des propriétés d'un système et ne sont pas nécessairement somme soit égale à zéro au cours des étapes d'un cycle. L'expression infinitésimale de chaleur,  , Forme un différentielle inexacte pour les processus impliquant un travail. Cependant, pour des procédés impliquant pas de changement de volume, le champ magnétique appliqué, ou d'autres paramètres extérieurs,
, Forme un différentielle inexacte pour les processus impliquant un travail. Cependant, pour des procédés impliquant pas de changement de volume, le champ magnétique appliqué, ou d'autres paramètres extérieurs,  , Forme un différentielle exacte. De même, pour les processus adiabatique (pas de transfert de chaleur), l'expression pour le travail fait différentielle exacte, mais pour les processus impliquant le transfert de chaleur qu'il fait différentielle inexacte.
, Forme un différentielle exacte. De même, pour les processus adiabatique (pas de transfert de chaleur), l'expression pour le travail fait différentielle exacte, mais pour les processus impliquant le transfert de chaleur qu'il fait différentielle inexacte.
Capacité calorifique
Pour un système compressible simple comme un gaz parfait à l'intérieur un piston, les variations de l'enthalpie et l'énergie interne peut être liée à la la capacité thermique à pression constante et le volume, respectivement. contraint à avoir un volume constant, la chaleur,  , Nécessaire pour changer sa température à partir d'une température initiale T 0, à une température finale, T f est donnée par:
, Nécessaire pour changer sa température à partir d'une température initiale T 0, à une température finale, T f est donnée par:
Retrait de la contrainte de volume et permettant au système de dilater ou se contracter à pression constante:
Pour les substances incompressibles, comme solides et liquides , la distinction entre les deux types de capacité de chaleur disparaît comme aucun travail ne est effectué. la capacité de chaleur est un vaste quantité et en tant que telle est dépendante du nombre de molécules dans le système. Il peut être représenté comme le produit de la masse,  Et la capacité thermique spécifique,
Et la capacité thermique spécifique, 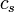 selon:
selon:
ou est dépendante du nombre de moles et la capacité thermique molaire, 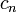 selon:
selon:
Les capacités calorifiques molaires et spécifiques dépendent des degrés de liberté internes du système et non sur les propriétés externes tels que le volume et le nombre de molécules.
Les chaleurs spécifiques des gaz monoatomiques (par exemple, hélium) sont à peu près constante avec la température. Gaz diatomiques telles que l'affichage d'hydrogène certaine dépendance de température, et les gaz triatomiques (par exemple, dioxyde de carbone) plus encore.
Dans les liquides à des températures suffisamment basses, les effets quantiques deviennent significatifs. Un exemple est le comportement de bosons tels que l'hélium-4. Pour de telles substances, le comportement de la capacité calorifique de la température est discontinue au Bose-Einstein point de condensation.
Le comportement quantique des solides est suffisamment caractérisé par le Modèle Debye. A des températures bien inférieures à la température de Debye caractéristique d'un réseau solide, sa chaleur spécifique est proportionnelle au cube de la température absolue. Pour les métaux à basse température, un deuxième terme est nécessaire pour tenir compte du comportement des électrons de conduction, un exemple de Statistique de Fermi-Dirac.
Changements de phase
Le point d'ébullition de l'eau , au niveau de la mer et de la pression atmosphérique normale et la température, seront toujours à près de 100 ° C, peu importe combien de chaleur est ajouté. La chaleur supplémentaire modifie la phase de l'eau de l'état liquide dans la vapeur d'eau . La chaleur ajoutée pour modifier la phase d'une substance de cette façon est dite "cachée", et par conséquent il est appelé chaleur latente (du latin sens latere "mentir caché»). La chaleur latente est la chaleur par unité de masse nécessaire de changer l'état d'une substance donnée, ou:
et
Notez que lorsque la pression augmente, la L augmente légèrement. Ici,  est la quantité de masse d'abord dans la nouvelle phase, et M est la quantité de masse qui finit dans la nouvelle phase. De plus, en général L ne dépend pas de la quantité de masse qui change de phase, de sorte que l'équation peut être écrite normalement:
est la quantité de masse d'abord dans la nouvelle phase, et M est la quantité de masse qui finit dans la nouvelle phase. De plus, en général L ne dépend pas de la quantité de masse qui change de phase, de sorte que l'équation peut être écrite normalement:
Parfois, L peut être dépendant du temps si la pression et le volume sont en train de changer avec le temps, de sorte que l'intégrale peut être écrite comme:
des mécanismes de transfert de chaleur
La chaleur tend à se déplacer à partir d'une région de haute température à une région de basse température. Ce transfert de chaleur peut se produire par les mécanismes de conduction et rayonnement. Dans l'ingénierie , le terme transfert de chaleur par convection est utilisé pour décrire les effets combinés de conduction et l'écoulement de fluide et est considérée comme un troisième mécanisme de transfert de chaleur.
Conduction
La conduction est le moyen le plus importantes de transfert de chaleur dans un solide. Sur une échelle microscopique, la conduction se produit aussi chaud, se déplaçant rapidement ou vibration des atomes et des molécules d'interagir avec des atomes et des molécules voisines, transférer une partie de leur énergie (chaleur) à ces atomes voisins. En Isolateurs le flux de chaleur est réalisé presque entièrement par vibrations des phonons.
Le "fluide d'électrons» d'un métalliques conductrice conduites solides quasi-totalité des flux de chaleur à travers le solide. Phonon flux est toujours présent, mais comporte moins de 1% de l'énergie. Électrons effectuent également un courant électrique à travers les solides conductrices, et la thermique et conductivités électriques de la plupart des métaux ont à peu près le même rapport. Un bon conducteur électrique, tels que le cuivre , conduit généralement aussi bien la chaleur. Le Effet Peltier-Seebeck présente la propension des électrons à conduire la chaleur à travers un solide conducteur électriquement. Thermoelectricity est causée par la relation entre les électrons, les flux de chaleur et des courants électriques.
Convection
La convection est généralement la forme dominante de transfert de chaleur dans les liquides et les gaz. Ce est un terme utilisé pour caractériser les effets combinés de la conduction et l'écoulement du fluide. En convection, enthalpie transfert se produit par le mouvement des parties chaudes ou froides du fluide en même temps que le transfert de chaleur par conduction. Par exemple, lorsque l'eau est chauffée dans un four, l'eau chaude à partir du fond de la cuvette augmente, le chauffage de l'eau dans la partie supérieure de la cuve. Deux types de convection, on distingue généralement, convection libre, dans lequel les forces de gravité et de flottabilité en voiture le mouvement fluide et convection forcée, où un ventilateur, d'un agitateur, ou d'autres moyens sont utilisés pour déplacer le fluide. Le dynamisme convection est en raison des effets de la gravité, et donc ne se produit pas dans conditions de microgravité.
Radiation
Le rayonnement est la seule forme de transfert de chaleur qui peut se produire en l'absence de toute forme de support; il est donc le seul moyen de transfert de chaleur à travers un vide. Le rayonnement thermique est une conséquence directe des mouvements des atomes et des molécules dans un matériau. Étant donné que ces atomes et molécules sont composées de particules chargées ( protons et électrons ), leurs déplacements se traduisent par l'émission d' un rayonnement électromagnétique , qui transporte de l'énergie loin de la surface. Dans le même temps, la surface est constamment bombardé par un rayonnement provenant de l'environnement, ce qui entraîne le transfert d'énergie à la surface. Depuis le montant des augmentations de rayonnement émis lorsque la température augmente, un transfert net d'énergie à partir des températures plus élevées à des résultats plus faibles températures
La puissance que corps noir émet à différentes fréquences est décrit par La loi de Planck. Il existe une fréquence f max à laquelle la puissance émise est maximale. La loi de déplacement de Wien, et le fait que la fréquence de la lumière est inversement proportionnelle à sa longueur d'onde dans le vide, signifient que la fréquence maximale f max est proportionnelle à la température absolue T du corps noir. La photosphère du Soleil, à une température d'environ 6000 K, émet un rayonnement principalement dans la partie visible du spectre. L'atmosphère de la terre est partiellement transparent à la lumière visible, et la lumière qui atteint la surface de la terre est absorbée ou réfléchie. La surface de la terre émet le rayonnement absorbé, approchant le comportement d'un corps noir à 300 K avec un pic spectrale à f max. A ces basses fréquences, l'atmosphère est en grande partie opaque et le rayonnement de la surface de la terre est absorbé ou diffusé par l'atmosphère. Bien que certains rayonnement échappe dans l'espace, il est absorbé puis réémis par les gaz atmosphériques. Ce est cette sélectivité spectrale de l'atmosphère qui est responsable de l'planétaire effet de serre
Le ménage commun ampoule a un spectre de corps noir chevauchant le spectre du soleil et de la terre. Une partie des photons émis par un filament de l'ampoule de lumière tungstène à 3000K sont dans le spectre visible. Cependant, la plupart de l'énergie est associé à des photons de longueurs d'onde; ceux-ci ne seront pas aider une personne à voir, mais seront toujours transférer la chaleur à l'environnement, comme on peut le déduire empiriquement en observant une ampoule à incandescence de ménage. Chaque fois que le rayonnement électromagnétique émise puis absorbée, la chaleur est transférée. Ce principe est utilisé dans fours à micro-ondes, découpage au laser, et Épilation RF.
D'autres mécanismes de transfert de chaleur
- Chaleur latente: transfert de chaleur à travers un changement physique dans le milieu comme l'eau à la glace ou de l'eau-vapeur implique beaucoup d'énergie et est exploitée dans de nombreuses façons: machine à vapeur , réfrigérateur, etc. (voir chaleur latente de fusion)
- Les caloducs: utilisant la chaleur latente et l'action capillaire pour déplacer la chaleur, des caloducs peuvent transporter plusieurs fois autant de chaleur que une tige de cuivre de taille similaire. Inventé à l'origine pour une utilisation dans satellites, ils commencent à avoir des applications dans les ordinateurs personnels .
La dissipation de chaleur
Dans les climats froids, maisons avec leurs systèmes de chauffage forment des systèmes dissipatives. En dépit des efforts pour isoler ces maisons pour réduire les pertes de chaleur à leurs extérieurs, une forte chaleur est perdue ou dissipée, de leur part, ce qui peut rendre leurs intérieurs inconfortablement frais ou froid. Pour le confort de ses habitants, à l'intérieur d'une maison doit être maintenu hors d'équilibre thermique avec son environnement externe. En effet, les résidences domestiques sont des oasis de chaleur dans une mer de froid et le gradient thermique entre l'intérieur et l'extérieur est souvent assez raide. Cela peut conduire à des problèmes tels que condensation et de désagréables courants (de projets) qui, si rien ne est, peut causer des dommages structurels à la propriété. Ce est pourquoi des techniques d'isolation modernes sont nécessaires pour réduire la perte de chaleur.
Dans une telle maison, un thermostat est un dispositif apte à démarrer le système de chauffage lorsque l'intérieur de la maison est inférieure à une température de consigne, et d'arrêter cette même lorsqu'un autre système (supérieur) température de consigne a été atteinte. Ainsi, le thermostat contrôle le flux d'énergie dans la maison, que l'énergie d'être finalement dissipée à l'extérieur.