
Anticorps
Saviez-vous ...
Cette sélection de wikipedia a été choisi par des bénévoles aidant les enfants SOS de Wikipedia pour cette sélection Wikipedia pour les écoles. SOS Enfants a regardé des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
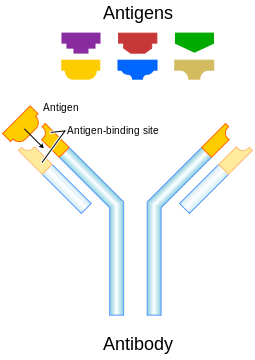
Anticorps (également appelés immunoglobulines) sont gamma-globuline protéines que l'on trouve dans le sang ou autre les fluides corporels de vertébrés , et sont utilisés par le système immunitaire pour identifier et neutraliser des corps étrangers, tels que les bactéries et les virus . Ils sont typiquement constitués de motifs structuraux de base - chacun avec deux grandes chaînes lourdes et deux petites - chaînes légères pour former, par exemple, monomères à une unité, dimères avec deux unités ou pentamères avec cinq unités. Les anticorps sont produits par une espèce de globule blanc appelé Cellule hôte. Il existe plusieurs types de chaînes lourdes d'anticorps, et de plusieurs types différents d'anticorps, qui sont regroupées en différentes isotypes sur la base duquel la chaîne lourde qu'ils possèdent. Cinq isotypes d'anticorps différents sont connus chez les mammifères, qui effectuent des rôles différents, et une aide directe de la réponse immunitaire appropriée pour chaque type d'objet étrangère différente qu'ils rencontrent.
Bien que la structure générale de tous les anticorps est très similaire, une petite région à l'extrémité de la protéine est extrêmement variable, permettant à des millions d'anticorps avec peu différentes structures à pointes d'exister. Cette région est appelée la région hypervariable. Chacune de ces variantes peuvent se lier à une cible différente, connue en tant que antigène. Cette grande diversité d'anticorps permet au système immunitaire à reconnaître une aussi grande diversité d'antigènes. La partie unique de l'antigène reconnu par un anticorps est appelée epitope. Ces epitopes se lient avec leurs anticorps à une interaction hautement spécifique, appelée ajustement induit, qui permet d'identifier des anticorps et ne lient que leur antigène unique dans le milieu des millions de molécules différentes qui composent un organisme . La reconnaissance d'un antigène par un anticorps étiquettes pour elle attaque par d'autres parties du système immunitaire. Les anticorps peuvent également neutraliser des objectifs directement, par exemple, une liaison à une partie d'un agent pathogène dont il a besoin pour provoquer une infection.
La population importante et diversifiée d'anticorps est généré par des combinaisons aléatoires d'un ensemble de des segments de gènes qui codent pour l'antigène de liaison différents sites (ou paratopes), suivis par hasard des mutations dans cette région du gène d'anticorps, ce qui crée en outre la diversité. Les gènes d'anticorps également réorganiser dans un processus appelé la commutation de classe qui change la base de la chaîne lourde de l'autre, créant ainsi un autre isotype de l'anticorps qui conserve la région variable spécifique de l'antigène. Cela permet à un seul anticorps pour être utilisé par plusieurs parties différentes du système immunitaire. La production d'anticorps est la fonction principale de la système immunitaire humoral.
Formes d'anticorps
Les cellules B activées différencier en cellules soit produisant des anticorps appelés les cellules plasmatiques qui sécrètent des anticorps soluble, ou en cellules de mémoire qui survivent dans le corps pendant des années pour permettre au système immunitaire de se rappeler un antigène et répondre plus rapidement sur les expositions futures. Les anticorps sont, par conséquent, un produit essentiel de la le système immunitaire adaptatif qui apprend et se souvient des réponses à des agents pathogènes envahisseurs. Anticorps se produisent sous deux formes: une soluble forme sécrétée dans le sang et d'autres fluides dans le corps, et un forme liée à la membrane qui est fixée à la surface d'un Cellule hôte.
Anticorps solubles qui sont sécrétées à partir d'une cellule B activée (dans sa forme des cellules plasmatiques) de liaison à des substances étrangères et le signal pour leur destruction par le reste du système immunitaire. Ils peuvent aussi être appelés anticorps libres (jusqu'à ce qu'ils lient un antigène et deviennent partie intégrante d'un complexe immun) ou des anticorps sécrétés.
La forme d'un anticorps lié à la membrane peut être appelé une immunoglobuline de surface (Sig) ou une immunoglobuline de membrane (MIG). Elle fait partie du récepteur de cellule B (BCR), ce qui permet à une cellule B pour détecter le moment où un antigène spécifique est présent dans le corps et déclenche l'activation des cellules B. La BCR est composé de IgD ou IgM de surface lié et associé Ig-α et β-Ig hétérodimères, qui sont capables de la transduction de signal. Une cellule B humaine typique aura 50 000 à 100 000 anticorps liés à sa surface. Lors de la liaison antigène, ils se regroupent dans de grandes parcelles, qui peuvent dépasser 1 micromètre de diamètre, sur des radeaux lipidiques qui isolent les RCO de la plupart des autres récepteurs de signalisation cellulaire. Ces correctifs peuvent améliorer l'efficacité de la réponse immunitaire cellulaire. Chez l'homme, la surface de la cellule est à nu autour des récepteurs des cellules B pour plusieurs milliers d'Angströms, ce qui réduit encore les BCR isole des influences contradictoires.
Isotypes
| Nom | Types | Description | Anticorps Complexes |
| IgA | 2 | Trouvé dans les zones de la muqueuse, tels que la Gut, les voies respiratoires et urogénitale voies, et empêche la colonisation par agents pathogènes. On trouve également dans la salive, les larmes, et le lait maternel. |  |
| IgD | 1 | Fonctions principalement comme un récepteur de l'antigène sur les cellules B qui ne ont pas été exposées à des antigènes. Sa fonction est moins défini que les autres isotypes. | |
| IgE | 1 | Se lie à allergènes et les déclencheurs la libération d'histamine les mastocytes et basophiles, et est impliqué dans l'allergie . Protège également contre des vers parasites. | |
| IgG | 4 | Dans ses quatre formes, fournit la majorité de l'immunité à base d'anticorps contre les agents pathogènes envahisseurs. Le seul anticorps capable de traverser le placenta pour obtenir une immunité passive au foetus. | |
| IgM | 1 | Exprimée à la surface des cellules B et sous une forme sécrétée avec une très grande avidité. Élimine les agents pathogènes dans les premiers stades de la cellule B médiation (humorale) l'immunité avant qu'il y ait suffisamment de IgG. |
Les anticorps peuvent venir de différentes variétés connues comme isotypes ou des classes. En les mammifères placentaires, il existe cinq isotypes d'anticorps connus comme IgA, IgD, IgE, IgG et IgM. Ils sont chacun nommés avec un préfixe "Ig" qui signifie immunoglobuline, un autre nom pour l'anticorps, et diffèrent dans leurs propriétés biologiques, les lieux fonctionnels et capacité à traiter avec différents antigènes, comme illustré dans le tableau.
L'isotype de l'anticorps d'une cellule B cellule change au cours développement et activation. Cellules B immatures, qui ne ont jamais été exposés à un antigène, sont connus comme des cellules B naïves et ne expriment que l'isotype IgM sous une forme liée à la surface cellulaire. cellules B commencent à exprimer à la fois IgM et IgD quand ils atteignent la maturité - la co-expression de ces deux isotypes d'immunoglobulines rend la cellule B «mature» et prêt à répondre à l'antigène. l'activation des cellules B se ensuit engagement de la molécule d'anticorps de cellules lié à un antigène, ce qui provoque la cellule de se diviser et différencier en une cellule productrice d'anticorps appelé plasmocytaire. Dans cette forme activée, la cellule B commence à produire des anticorps dans un sécrétée forme plutôt qu'une forme liée à la membrane. Certains cellules filles des cellules B activées subissent commutation isotypique, un mécanisme qui provoque la production d'anticorps pour passer de IgM ou IgD aux autres isotypes d'anticorps IgE, IgA ou IgG, qui ont défini les rôles dans le système immunitaire.
Structure
Les anticorps sont lourds (~ 150k Da) globulaire protéines plasmatiques qui sont également connus comme les immunoglobulines. Ils ont des chaînes ajoutés à certains de leurs de sucre d'acides aminés des résidus. En d'autres termes, les anticorps sont glycoprotéines. L'unité fonctionnelle de base de chaque anticorps est une immunoglobuline (Ig) monomère (contenant une seule unité Ig); anticorps sécrétés peuvent également être dimère avec deux unités Ig comme avec IgA, tétramère avec quatre unités de Ig tels que poissons téléostéens IgM, ou pentamère avec cinq unités d'Ig, comme des IgM chez les mammifères.

domaines d'immunoglobuline
Le monomère Ig est une "Y" en forme de molécule qui se compose de quatre chaînes polypeptide; deux chaînes lourdes identiques et deux chaînes légères identiques reliés par des liaisons disulfure. Chaque chaîne se compose de domaines structuraux appelés domaines Ig. Ces domaines contiennent environ 70 à 110 acides aminés et sont classés en différentes catégories (par exemple, une variable ou IgV et constante ou CIG) en fonction de leur taille et de la fonction. Ils ont une caractéristique immunoglobuline pli dans lequel deux feuillets bêta créer une forme «sandwich», tenue ensemble par des interactions entre conservé cystéines et d'autres acides aminés chargés.
Chaîne lourde
Il existe cinq types de mammifères Ig chaîne lourde désignés par les lettres grecques : α, δ, ε, γ et μ. Le type de chaîne lourde présente définit la classe d'anticorps; ces chaînes se trouvent dans les IgA, IgD, IgE, IgG et IgM, respectivement. Chaînes lourdes distinctes diffèrent par la taille et la composition; α et γ contenir environ 450 acides aminés, tandis que μ et ε ont environ 550 acides aminés .

2. Région Fc
3. Avec une chaîne lourde variable (VH) suivi d'un domaine domaine constant (CH1), une région charnière, et deux plus constante (C H 2 et C H 3) domaines.
4. Chaîne légère avec une variable (V L) et une constante (C L) domaine
Site de liaison 5. antigène (paratope)
6. régions de charnière.
Chaque chaîne lourde possède deux régions, la région constante et la région variable. La région constante est identique dans tous les anticorps du même isotype, mais en diffère par les anticorps de différents isotypes. Les chaînes lourdes γ, α et δ avoir une région constante composé de trois tandem (en ligne) Ig domaines et une région charnière pour plus de flexibilité; Les chaînes lourdes μ et ε ont une région constante composée de quatre domaines de type immunoglobuline. La région variable de la chaîne lourde est différente dans différents anticorps produits par les cellules B, mais est le même pour tous les anticorps produits par une seule cellule B ou B clone cellulaire. La région variable de chaque chaîne lourde est d'environ 110 acides aminés de longueur et est composée d'un seul domaine de type Ig.
Chaîne légère
Chez les mammifères, il existe deux types de chaîne légère, qui sont appelés lambda (λ) et kappa (κ). Une chaîne légère possède deux domaines successifs: un domaine constant et un domaine variable. La longueur approximative d'une chaîne légère est de 211 à 217 acides aminés. Chaque anticorps contenant deux chaînes légères qui sont toujours identiques; un seul type de chaîne légère, κ ou λ, est présent par anticorps chez des mammifères. D'autres types de chaînes légères, telles que la chaîne iota (ι), se trouvent dans inférieurs vertébrés comme Chondrichthyes et Teleostei.
Régions Fab et Fc
Certaines parties d'un anticorps ont des fonctions uniques. Les extrémités de l'Y, par exemple, contiennent le site qui lie l'antigène et, par conséquent, de reconnaître des objets étrangers spécifiques. Cette région de l'anticorps est appelé le Fab (fragment, liaison à l'antigène) région. Il est composé d'une constante et une de chaque domaine variable de chaîne lourde et légère de l'anticorps. Le paratope est conformée à la l'extrémité terminale amino de l'anticorps monomère par les domaines variables des chaînes lourdes et légères.
La base du Y joue un rôle dans la modulation de l'activité des cellules immunitaires. Cette région est appelée la Fc (fragment cristallisable) région, et se compose de deux chaînes lourdes qui contribuent deux ou trois domaines constants en fonction de la classe de l'anticorps. En se liant à des protéines spécifiques de la région Fc se assure que chaque anticorps produit une réponse immunitaire appropriée pour un antigène donné. La région Fc se lie également à divers cellule récepteurs, tels que Les récepteurs Fc, et d'autres molécules immunes, telles que protéines du complément. En faisant cela, il médie différent y compris les effets physiologiques opsonisation, cellule lyse, et de dégranulation mastocytes, basophiles et éosinophiles.
Fonction
Depuis anticorps existent librement dans le sang, ils sont considérés comme faisant partie de la système immunitaire humoral. Les anticorps circulants sont produits par les cellules B clonales qui répondent spécifiquement à un seul antigène, un virus fragment de protéine de coque, par exemple. Anticorps contribuent à l'immunité de trois façons principales: ils peuvent empêcher les agents pathogènes de pénétrer ou d'endommager les cellules en se liant à eux; ils peuvent stimuler l'élimination d'un agent pathogène par macrophages et d'autres cellules par l'agent pathogène revêtement; et ils peuvent déclencher la destruction des agents pathogènes directe en stimulant d'autres réponses immunitaires comme le voie complément.
L'activation du complément
Les anticorps qui se lient à des antigènes de surface, par exemple une bactérie, d'attirer le premier composant de la compléter cascade avec leur région Fc et initier l'activation du système du complément "classique". Il en résulte la destruction des bactéries de deux façons. Tout d'abord, la liaison de l'anticorps et le complément molécules marque le microbe pour l'ingestion par les phagocytes dans un processus appelé opsonisation; ces phagocytes sont attirés par certaines molécules du complément générés dans la cascade du complément. D'autre part, certains composants du système du complément forment un complexe d'attaque membranaire pour aider les anticorps à tuer la bactérie directement.
L'activation des cellules effectrices
Pour combattre les pathogènes qui répliquent l'extérieur des cellules, anticorps se lient à des agents pathogènes pour les relier entre eux, les obligeant à agglutinent. Depuis un anticorps comporte au moins deux paratopes il peut se lier plus d'un antigène par liaison à des epitopes identiques effectuées sur les surfaces de ces antigènes. En revêtant l'agent pathogène, les anticorps stimulent les fonctions effectrices contre l'agent pathogène dans des cellules qui reconnaissent leur région Fc.
Ces cellules qui reconnaissent les pathogènes enrobés ont des récepteurs Fc qui, comme son nom l'indique, interagit avec le Région Fc d'anticorps IgA, IgG, IgE et. L'engagement d'un anticorps particulier avec le récepteur Fc sur une cellule particulière déclenche une fonction effectrice de la cellule; phagocytes sera phagocytose, les mastocytes et neutrophiles sera dégranulent, cellules tueuses naturelles libéreront cytokines et molécules cytotoxiques; qui finira par entraîner la destruction du microbe envahissant. Les récepteurs Fc sont spécifiques d'un isotype, ce qui donne une plus grande souplesse au système immunitaire, en invoquant que les mécanismes immunitaires appropriées pour les agents pathogènes distincts.
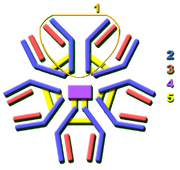
diversité d'immunoglobulines
Pratiquement tous les microbes peuvent déclencher une réponse d'anticorps. La reconnaissance réussie et l'éradication de nombreux types de microbes nécessite la diversité parmi les anticorps; leur composition en acides aminés varie en leur permettant d'interagir avec de nombreux antigènes différents. Il a été estimé que les humains produisent environ 10 milliards anticorps différents, chacun étant capable de se lier à un epitope d'un antigène distinct. Bien qu'un vaste répertoire d'anticorps différents est généré en une seule personne, le nombre de gènes disponibles pour rendre ces protéines est limitée. Plusieurs mécanismes génétiques complexes ont évolué qui permettent aux cellules de vertébrés B afin de générer un ensemble diversifié d'anticorps à partir d'un nombre relativement faible de gènes d'anticorps.
La variabilité de domaine

La région (locus) d'un chromosome qui code pour un anticorps est grande et contient plusieurs gènes distincts pour chaque domaine de l'anticorps - du locus contenant des gènes de chaîne lourde ( IGH @) se trouve sur chromosome 14, et le locus contenant des gènes de chaîne légère kappa et lambda ( IGL @ et IGK @) se trouvent sur les chromosomes 22 et 2 chez l'homme. Un de ces domaines est appelé le domaine variable, qui est présent dans chaque chaîne lourde et légère de chaque anticorps, mais peut varier selon les anticorps générés à partir de cellules B distinctes. Les différences entre les domaines variables, sont situés sur trois boucles appelées régions hypervariables (HV-1, HV-2 et HT-3) ou les régions déterminant la complémentarité (CDR1, CDR2 et CDR3). CDR sont pris en charge dans les domaines variables par régions cadres conservés. Le locus de chaîne lourde contient environ 65 gènes différents de domaine variable que tous se distinguent par leur CDR. La combinaison de ces gènes avec un ensemble de gènes pour d'autres domaines de l'anticorps génère une grande cavaliers d'anticorps avec un degré élevé de variabilité. Cette combinaison est appelée V (D) J recombinaison discuté ci-dessous.
V (D) J recombinaison
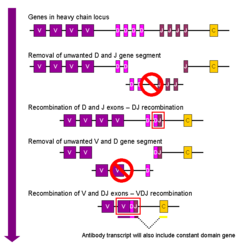
Recombinaison somatique des immunoglobulines, aussi connu comme V (D) J recombinaison implique la génération d'une région variable d'immunoglobuline unique. La région variable de chaque chaîne lourde ou légère d'immunoglobuline est codé en plusieurs morceaux - connu sous le nom de segments de gènes. Ces segments sont appelés variable (V), diversité (D) et de jonction (J) segments. V, D et J sont présents dans des segments Ig chaînes lourdes, mais seulement les segments V et J sont présents dans Chaînes légères Ig. Des copies multiples du V, D et J segments de gènes existent, et sont disposés en tandem dans le génomes de mammifères . Dans la moelle osseuse, le développement de chaque cellule B assembler une région variable d'immunoglobuline en sélectionnant et en combinant de façon aléatoire une V, une D et un segment J du gène (ou une V et un segment J de la chaîne légère). Comme il existe de multiples copies de chaque type de segment de gène, et différentes combinaisons de segments de gènes peuvent être utilisées pour générer chaque région variable d'immunoglobuline, ce procédé génère un grand nombre d'anticorps, chacun avec différents paratopes, et donc différentes spécificités antigéniques.
Après une cellule B produit un gène d'immunoglobuline fonctionnel au cours de V (D) J recombinaison, elle ne peut exprimer ne importe quelle autre région variable (un processus connu sous le nom allélique exclusion) ainsi chaque cellule B peut produire des anticorps contenant un seul type de chaîne variable.
Hypermutation somatique et la maturation d'affinité
Un autre mécanisme qui génère une diversité d'anticorps se produit dans la cellule B mature. Après l'activation avec l'antigène, les lymphocytes B commencent à proliférer rapidement. Dans ces cellules à division rapide, les gènes codant pour les domaines variables des chaînes lourdes et légères sont soumis à un taux élevé de mutation ponctuelle, par un appelé hypermutation somatique de processus (SHM). SHM résultats dans environ un changement de nucleotide par le gène variable, par la division cellulaire. Par conséquent, toute cellule fille B vont acquérir légères acides aminés différences dans les domaines variables de leurs chaînes d'anticorps.
Hypermutation somatique sert à augmenter la diversité de la piscine d'anticorps et les effets de l'anticorps de liaison à l'antigène affinité. Certaines mutations ponctuelles se traduira par la production d'anticorps qui ont une interaction faible (faible affinité) avec leur antigène de l'anticorps d'origine, et certaines mutations vont générer des anticorps ayant une interaction plus forte (haute affinité). les cellules B qui expriment des anticorps de haute affinité sur leur surface recevront un signal de survie forte lors des interactions avec d'autres cellules, tandis que ceux avec des anticorps de faible affinité sera pas, et mourront par apoptose. Ainsi, les cellules B exprimant des anticorps avec une affinité plus élevée pour l'antigène seront supplanter ceux avec des affinités plus faibles pour la fonction et la survie. Le processus de générer des anticorps ayant des affinités de liaison accrue est appelé maturation d'affinité. La maturation d'affinité se produit dans les cellules B matures après V (D) J recombinaison, et dépend de l'aide de cellules T auxiliaires.

commutation de classe
La commutation isotypique ou classe est une processus biologique se produisant après l'activation de la cellule hôte, ce qui permet à la cellule de produire différentes classes d'anticorps (IgA, IgE, IgG) ou. Les différentes classes d'anticorps, et donc des fonctions effectrices, sont définies par les régions (C) de la chaîne lourde d'immunoglobuline constant. Initialement, les cellules B naïves expriment seulement IgM de surface cellulaire et IgD avec les régions de liaison d'antigène identiques. Chaque isotype est adapté à une fonction distincte, par conséquent, après activation, un anticorps ayant une fonction effectrice IgG, IgA, IgE ou peut être nécessaire pour éliminer efficacement un antigène. la commutation de classe permet différentes cellules filles à partir de la même cellule B activée pour produire des anticorps de différents isotypes. Seule la région constante des changements anticorps de chaîne lourde pendant la commutation de classe; les régions variables, et donc la spécificité d'antigènes, restent inchangés. Ainsi, la descendance d'une seule cellule B peut produire des anticorps spécifiques, tous pour le même antigène, mais avec la capacité de produire la fonction d'effecteur approprié pour chaque défi antigénique. commutation de classe est déclenché par les cytokines; l'isotype générée dépend de cytokines qui sont présents dans l'environnement des cellules B.
la commutation de classe se produit dans le gène de chaîne lourde locus par une recombinaison de commutation de classe de mécanisme appelé (RSE). Ce mécanisme repose sur conservée motifs nucléotidiques, appelé commutateur (S) régions, trouvé dans l'ADN en amont de chaque gène de la région constante (sauf dans le δ-chaîne). Le brin d'ADN est cassé par l'activité d'une série de enzymes à deux S-régions sélectionnées. Le domaine variable exon est rejoint par un processus appelé extrémité de jonction (NHEJ) à la région constante souhaitée non homologue (γ, α ou ε). Ce processus aboutit à un gène d'immunoglobuline qui code pour un anticorps de l'isotype d'un autre.
Applications médicales
le diagnostic des maladies
Détection des anticorps particuliers est une forme très courante de médecine diagnostic et des applications telles que sérologie dépendent de ces méthodes. Par exemple, dans des dosages biochimiques pour le diagnostic de la maladie, une titre d'anticorps dirigé contre Le virus d'Epstein-Barr ou la maladie de Lyme est estimé à partir du sang. Si ces anticorps ne sont pas présents, soit la personne ne est pas infectée, ou l'infection a eu lieu il ya très longtemps, et les cellules B générant ces anticorps spécifiques ont naturellement décomposé. En immunologie clinique, les niveaux de cours individuels d'immunoglobulines sont mesurés par néphélométrie (ou turbidimétrie) pour caractériser le profil d'anticorps de patient. Des élévations de différentes classes d'immunoglobulines sont parfois utiles pour déterminer la cause de dommages au foie chez les patients dont le diagnostic ne est pas clair. Par exemple, IgA élevée indique alcoolique cirrhose, IgM élevée indique l'hépatite virale et la cirrhose biliaire primaire, tandis que l'IgG est élevée dans hépatite virale, l'hépatite auto-immune et la cirrhose. Maladies auto-immunes peuvent souvent être attribués à des anticorps qui se lient le corps propre épitopes; nombre peut être détectée par des analyses de sang. Anticorps dirigés contre globules rouges antigènes de surface cellulaire à médiation immunitaire l'anémie hémolytique sont détectés avec le Test de Coombs. Le test de Coombs est également utilisé pour le dépistage d'anticorps dans la préparation de la transfusion sanguine et aussi pour le dépistage d'anticorps dans femmes en consultations prénatales. En pratique, plusieurs méthodes immunodiagnostiques basées sur la détection de complexes antigène-anticorps sont utilisés pour diagnostiquer des maladies infectieuses, par exemple ELISA, immunofluorescence, Western blot, immunodiffusion, et immunoélectrophorèse.
la thérapie de maladies
"Ciblée" traitement anticorps monoclonal est utilisé pour traiter des maladies telles que la polyarthrite rhumatoïde, la sclérose en plaques , le psoriasis, et de nombreuses formes de cancer , y compris le lymphome non hodgkinien, cancer colorectal, la tête et du cou et cancer du sein. Certaines déficiences immunitaires, telles que agammaglobulinémie liée à l'X et hypogammaglobulinémie, entraîner un manque partiel ou total d'anticorps. Ces maladies sont souvent traitées en induisant une forme à court terme de l'immunité appelé immunité passive. L'immunité passive est assurée par le transfert d'anticorps prêts à l'emploi sous la forme d'humain ou animal sérum, mis en commun immunoglobuline ou anticorps monoclonaux, en la personne concernée.
Thérapie prénatale
Anticorps Rho (D) Immunoglobuline sont spécifiques pour Rhésus D (RhD) antigène humain, également connu comme Le facteur rhésus. Ces anticorps anti-RhD sont connus sous plusieurs noms de marque, y compris RhoGAM, BayRHo-D, Gamulin Rh, HypRho-D, et WinRho SDF. Facteur rhésus est un antigène trouvé sur les globules rouges; les individus qui sont Rhésus positif (Rh +) ont cet antigène sur leurs globules rouges et les individus qui sont Rhésus négatif (Rh) ne font pas. Pendant normale l'accouchement, la livraison traumatisme ou complications pendant la grossesse, le sang d'un fœtus peut entrer dans le système de la mère. Dans le cas d'une mère Rh-incompatible et de l'enfant, consécutifs mélange de sang peut sensibiliser une mère Rh à l'antigène Rh sur les cellules de sang de l'enfant Rh +, mettre le reste de la grossesse , et tous les grossesses ultérieures, au risque de la maladie hémolytique du nouveau-né. Les anticorps anti-RhD sont administrés dans le cadre d'un prénatale régime de traitement pour prévenir la sensibilisation qui peut se produire quand une mère rhésus négatif a un foetus Rhésus positif. Traitement d'une mère avec des anticorps anti-RhD avant et immédiatement après le traumatisme et la livraison détruit antigène Rh dans le système du fœtus de la mère. Surtout, cela se produit avant que l'antigène peut stimuler les cellules B maternels à "rappeler" antigène Rh en générant cellules B mémoire. Par conséquent, son système immunitaire humoral ne fera pas d'anticorps anti-Rh, et ne sera pas attaquer les antigènes Rhésus du bébé cours ou la suivante. Rho (D) le traitement immunoglobuline prévient la sensibilisation qui peut conduire à Rh maladie, mais ne pas prévenir ou traiter la maladie sous-jacente elle-même.
applications de recherche
Les anticorps spécifiques sont produits par injection d'un antigène dans un mammifère , tel qu'une souris , rat ou lapin pour de petites quantités d'anticorps, ou de chèvre , de mouton ou de cheval pour de grandes quantités d'anticorps. Le sang isolé à partir de ces animaux contient - des anticorps polyclonaux plusieurs anticorps qui se lient au même antigène - dans le sérum, qui peut maintenant être appelée antisérum. Antigènes sont également injectés dans des poulets pour la production d'anticorps polyclonaux en le jaune d'oeuf. Pour obtenir un anticorps qui est spécifique d'un seul epitope d'un antigène, d'un anticorps sécrétant Les lymphocytes sont isolés à partir de l'animal et immortalisées en les fusionnant avec une lignée cellulaire de cancer. Les cellules fusionnées sont appelés hybridomes, et sera constamment croître et sécréter des anticorps dans la culture. Des cellules d'hybridomes individuelles sont isolées par clonage par dilution pour générer clones de cellules qui produisent tous le même anticorps; ces anticorps sont appelés des anticorps monoclonaux. Des anticorps polyclonaux et monoclonaux générés sont purifiés en utilisant souvent La protéine A / G ou Chromatographie d'affinité d'antigène.
Utilisation
Dans la recherche, des anticorps purifiés sont utilisés dans de nombreuses applications. Ils sont le plus souvent utilisés pour identifier et localiser intracellulaire et des protéines extracellulaires. Les anticorps sont utilisés dans cytométrie en flux pour différencier les types cellulaires par les protéines qu'ils expriment; différents types de cellules expriment différentes combinaisons de amas de molécules de différenciation sur leur surface, et de produire intracellulaire différente et protéines sécrétées. Ils sont également utilisés dans immunoprécipitation de protéines distinctes et tout liés à eux (co-immunoprécipitation) d'autres molécules dans un lysat cellulaire, en Western blot analyse pour identifier les protéines séparées par électrophorèse, et immunohistochimie ou immunofluorescence pour examiner l'expression des protéines dans des coupes de tissus ou de localiser des protéines au sein des cellules avec l'aide d'un microscope . Les protéines peuvent également être détectés et quantifiés par des anticorps, en utilisant ELISA et Techniques ELISPOT.
Histoire
L'étude d'anticorps a commencé en 1890 lorsque Emil von Behring et Shibasaburo Kitasato décrit l'activité des anticorps contre diphtérie et toxines de tétanos. Behring et Kitasato mis en avant la théorie de l'immunité humorale, proposant un médiateur dans le sérum pourrait réagir avec un antigène étranger. Leur idée a incité Paul Ehrlich de proposer la théorie de la chaîne latérale de l'anticorps et de l'interaction de l'antigène en 1897, lorsqu'il a émis l'hypothèse que les récepteurs (décrits comme des «chaînes latérales») sur la surface des cellules peuvent se lier spécifiquement à toxines - dans une interaction "lock-et-clé" - et que cette réaction de liaison a été le déclencheur pour la production d'anticorps. D'autres chercheurs croient que les anticorps existaient librement dans le sang et, en 1904, Almroth Wright a suggéré que les anticorps solubles revêtus bactéries de les étiqueter pour phagocytose et la destruction; un processus qu'il a appelé opsoninization.
Dans les années 1920, Michael Heidelberger et Oswald Avery observé que les antigènes peuvent être précipités par des anticorps et a continué à montrer que les anticorps ont été faites de protéines. Les propriétés biochimiques des interactions de liaison antigène-anticorps ont été examinés plus en détail à la fin des années 1930 par John Marrack. La prochaine avancée majeure était dans les années 1940, lorsque Linus Pauling a confirmé la théorie de la serrure et clef proposé par Ehrlich en montrant que les interactions entre les anticorps et les antigènes dépendait plus de leur forme que leur composition chimique. En 1948, Astrid Fagreaus découvert que les cellules B, sous la forme de plasmocytes, étaient responsables de la production d'anticorps.
D'autres travaux concentrée sur la caractérisation des structures des protéines d'anticorps. Une avancée majeure dans ces études structurales était la découverte au début des années 1960 par Gerald Edelman et Joseph Gally de l'anticorps la chaîne légère, et leur réalisation que cette protéine est la même que la Protéine de Bence-Jones a décrit en 1845 par Henry Bence Jones. Edelman a continué de découvrir que les anticorps sont composées de liaison disulfure lié-chaînes lourdes et légères. A la même époque, la queue de liaison d'anticorps (Fab) et l'anticorps (Fc) régions d'IgG ont été caractérisés par Rodney Porter. Ensemble, ces scientifiques déduisent la structure et complète acide aminé séquence d'IgG, un exploit pour lequel elles ont été attribuées conjointement le 1972 Prix Nobel de Physiologie ou médecine . Alors que la plupart de ces premières études ont porté sur IgM et IgG, d'autres isotypes d'immunoglobulines ont été identifiés dans les années 1960: Thomas Tomasi découvert anticorps sécrétoire ( IgA) et David Rowe et John Fahey identifié IgD, et IgE a été identifié par Kikishige Ishizaka et Teruki Ishizaka en tant que classe d'anticorps impliqués dans des réactions allergiques.
Des études génétiques ont révélé la base de la grande diversité de ces protéines d'anticorps lors de la recombinaison somatique des gènes d'immunoglobuline a été identifié par Susumu Tonegawa en 1976.
