Or (III) chlorure
Saviez-vous ...
Cette sélection écoles a été choisi par SOS Enfants pour les écoles dans le monde en développement ne ont pas accès à Internet. Il est disponible en téléchargement intranet. Parrainer un enfant de faire une réelle différence.
| Or (III) chlorure | |
|---|---|
 | |
 | |
 | |
Or (III) chlorure | |
Autres noms Chlorure Auric | |
| Identificateurs | |
| Numéro CAS | 13453-07-1 |
| PubChem | 26030 |
| ChemSpider | 8036939 |
| UNII | 15443PR153 |
| ChEBI | CHEBI: 30076 |
| Numéro RTECS | MD5420000 |
| images de Jmol-3D | Image 1 |
SMILES
| |
InChI
| |
| Propriétés | |
| Formule moléculaire | AuCl 3 (Existe comme Au 2 Cl 6) |
| Masse molaire | 303,325 g / mol |
| Apparence | Cristaux rouges (anhydres); , cristaux jaunes d'or (monohydraté) |
| Densité | 4,7 g / cm 3 |
| Point de fusion | 254 ° C (527 K) |
| Solubilité dans l'eau | 68 g / 100 ml (à froid) |
| Solubilité | soluble dans l'éther , légèrement soluble dans le liquide de l'ammoniac |
| Structure | |
| Crystal structure | monoclinique |
| Coordination géométrie | Plan carré |
| Risques | |
| FS | MSDS externe |
| Phrases-R | R36 / 37/38 |
| Phrases S | S26 S36 |
| Principal dangers | Irritant |
| Des composés apparentés | |
| D'autres anions | Or (III) fluorure Or (III) le bromure de |
| D'autres cations | Or (I) de chlorure Argent (I) de chlorure Platine (II) chlorure Le mercure (II) chlorure |
| Page de données supplémentaire | |
| Structure et propriétés | n, ε r, etc. |
| Thermodynamique données | comportement de phase Solide, liquide, gaz |
| Les données spectrales | UV, IR, RMN , MS |
Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
Or (III) chlorure, traditionnellement appelé chlorure aurique, est un produit chimique composé de l'or et du chlore . Avec la formule moléculaire Au 2 Cl 6, le trichlorure d'or nom est une simplification, en se référant à la formule empirique. Les chiffres romains dans le nom indique que l'or a un état d'oxydation de +3, ce qui est courant pour les composés d'or. Il ya aussi un autre chlorure connexe de l'or, or (I) chlorure (AuCl). Acide chloraurique, HAuCl 4, le produit formé quand l'or se dissout dans l'eau régale, est parfois dénommé "chlorure d'or", "trichlorure d'or acide» ou même «or (III) chlorure trihydrate." Or (III) chlorure est très hygroscopique et très soluble dans l'eau ainsi que l'éthanol . Il décompose au-dessus de 160 ° C ou à la lumière.
Structure
AuCl 3 existe sous forme d'un chlorure ponté dimère fois sous forme solide et sous forme de vapeur, du moins aux basses températures. Or (III) du bromure comporte de manière analogue. La structure est similaire à celle de iode (III) chlorure.
En or (III), de chaque centre d'or est plan carré, ce qui est typique d'un complexe métallique avec l'annonce 8 count électronique. Le collage en AuCl 3 est considéré comme peu covalente.
Préparation
Or (III) chlorure est le plus souvent préparé en faisant passer du chlore gazeux au-dessus de la poudre d'or à 180 ° C:
- 2 Au + 3 Cl 2 → 2 AuCl 3
Un autre procédé de préparation, est la réaction d'addition, où l'or (3+) est mis à réagir avec du chlorure de produire tetrachloridoaurate (1-); après quoi, la tetrachloridoaurate d'hydrogène (1) est chauffé pour éliminer les gaz de chlorane. Or (3+) est produit par oxydation avec de l'acide nitrique présent dans l'eau régale:
- Au (s) + 3 NO -
3 (aq) + 6 H + (aq) Au 3+ (aq) + 3 NO 2 (g) + 3 H 2 O (l)
Au 3+ (aq) + 3 NO 2 (g) + 3 H 2 O (l) - Au 3+ (aq) + 3 NOCl (g) + 3 NO -
3 (aq) → AuCl 3 (aq) + 6 N 2 (g) - AuCl 3 (aq) + Cl - (aq)
 AuCl -
AuCl -
4 (aq) - 2 HAuCl 4 (s) 2 Cl Au → 6 (s) + 2 HCl (g)
Réactions
Le contact avec l'eau, AuCl trois formes une série d'espèces, parfois décrit comme AuCl 3 · H 2 O et sa base conjuguée [AuCl 3 (OH)] -. La réaction avec des agents réducteurs tels que le peroxyde d'hydrogène ou Fe 2+ provoque or élémentaire est précipité dans la solution.
Anhydre AuCl 3 commence à se décomposer à AuCl à environ 160 ° C; cependant, ceci à son tour subit dismutation à des températures élevées pour donner métallique or et AuCl 3.
- AuCl 3 → Cl 2 + AuCl (> 160 ° C)
- 3 AuCl → AuCl 3 + 2 Au (> 420 ° C)
AuCl 3 est Formes acides de Lewis et facilement complexes. Par exemple, il réagit avec l'acide chlorhydrique pour former l'acide chloroaurique (HAuCl 4):
- HCl + AuCl 3 (aq) → H + + [AuCl 4] -
D'autres sources de chlorure, tels que KCl, également convertir AuCl 3 dans AuCl -
4. Les solutions aqueuses de AuCl 3 réagissent avec une base aqueuse telle que l'hydroxyde de sodium pour former un précipité de Au (OH) 3, qui se dissout dans un excès de NaOH afin de former l'aurate de sodium (NaAuO 2). Si chauffé doucement, Au (OH) 3 se décompose en or (III) de l'oxyde, Au 2 O 3, puis à l'or métallique.
Or (III) chlorure est le point de départ pour la synthèse de nombreux autres composés d'or. Par exemple, la réaction avec le cyanure de potassium produit soluble dans l'eau complexe, K [Au (CN) 4]:
- AuCl 3 + 4 KCN → K [Au (CN) 4] + 3 KCl
Applications en synthèse organique
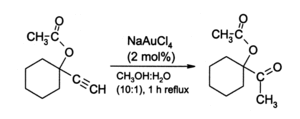
AuCl 3 a suscité l'intérêt des chimistes organiques comme un catalyseur acide doux pour une variété de réactions, même si aucun transformations ont été commercialisés. Or (III) sels, en particulier Na [AuCl 4] (préparé à partir AuCl 3 + NaCl ), fournissent une alternative à mercure de sels (II) en tant que catalyseurs pour des réactions impliquant alcynes. Une réaction illustratif est l'hydratation des alcynes terminaux pour produire méthyle cétones :
Certains subissent alcynes amination en présence de catalyseurs d'or (III). Or catalyse la alkylation de certaines et des cycles aromatiques à une conversion de furannes phénols . Par exemple, dans solution d'acétonitrile, or (III) catalyse l'alkylation le chlorure de 2-méthylfurane (sylvestre) par vinyl cétone de méthyle à la position 5:
L'efficacité de ce OrganoGold réaction est remarquable parce que le furane et la cétone sont sensibles à des réactions secondaires telles que la polymérisation dans des conditions acides. Dans certains cas où alcynes sont présents, phénols forment parfois:
Cette réaction implique un réarrangement qui donne un nouveau cycle aromatique.