
état d'oxydation
Saviez-vous ...
Les articles de cette sélection écoles ont été organisés par sujet du programme d'études grâce aux bénévoles d'enfants SOS. Voir http://www.soschildren.org/sponsor-a-child pour connaître le parrainage d'enfants.
L'état d'oxydation est un indicateur du degré de oxydation d'un atome en un composé chimique . L'état d'oxydation formel est l'hypothétique responsable qu'un atome aurait si tous les liaisons à des atomes de différents éléments étaient de 100% ionique. États d'oxydation sont généralement représentés par des nombres entiers , qui peut être positif, négatif, ou zéro. Dans certains cas, l'état d'oxydation moyen d'un élément est une fraction, par exemple 8/3 de fer dans la magnétite (Fe 3 O 4). L'état d'oxydation plus connu est 8 dans les tétroxydes de ruthénium, xénon, osmium, iridium , et hassium , et certains complexes impliquant du plutonium , tandis que l'état d'oxydation le plus bas connu est -4 pour certains éléments de la groupe de carbone.
L'augmentation de l'état d'un atome d'oxydation par une réaction chimique est connue comme une oxydation; une diminution de l'état d'oxydation est connu en tant que réduction. Ces réactions impliquent le transfert formel des électrons, un gain net en électrons étant une réduction et une perte nette d'électrons étant une oxydation. Pour les éléments purs, l'état d'oxydation est zéro.
La définition de l'état d'oxydation répertoriés par IUPAC est la suivante:
état d'oxydation: une mesure du degré d'oxydation d'un atome dans une substance. Il est défini comme la charge d'un atome peut être imaginé d'avoir quand les électrons sont comptés selon un ensemble convenu de règles:Par exemple, les états d'oxydation de soufre dans H 2 S, S 8 (de soufre élémentaire), SO 2, SO 3, et H 2 SO 4 sont, respectivement: -2, 0, 4, 6 et 6. Plus le degré d'oxydation d'un atome donné la plus grande de son degré d'oxydation; plus le degré d'oxydation plus son degré de réduction.
- (1) l'état d'un d'oxydation élément libre (élément non combinée) est égal à zéro
- (2) pour une simple (monoatomique) ion, l'état d'oxydation est égale à la charge nette sur l'ion
- (3) un atome d'hydrogène a un état d'oxydation de 1 'oxygène et a un état d'oxydation de -2 quand ils sont présents dans la plupart des composés. (Des exceptions à cette règle sont que l'hydrogène a un état d'oxydation de -1 dans des hydrures de métaux actifs, par exemple, LiH , et de l'oxygène a un état d'oxydation de -1 à les peroxydes, par exemple H 2 O 2
- (4) la somme algébrique des états d'oxydation de tous les atomes dans une molécule neutre doit être zéro, tandis que dans ions la somme algébrique des états d'oxydation des atomes constitutifs doit être égale à la charge de l'ion.
Quelques règles générales pour déterminer les états d'oxydation sans l'utilisation de structures de Lewis
Voici les règles générales pour les composés simples, sans formules structurelles:
- Tout élément pur (même se il forme des molécules diatomiques comme le chlore, Cl 2) a la tate d'une o xidation (OS) de zéro. Des exemples en sont le Cu ou O 2.
- Pour ions monoatomiques, le système d'exploitation est la même que la charge de l'ion. Par exemple, S 2- a un OS de -2, tandis que Li + a un système d'exploitation de 1.
- La somme des systèmes d'exploitation de tous les atomes dans une molécule ou un ion polyatomique est égale à la charge de la molécule ou d'un ion, de sorte que le système d'exploitation d'un élément peut être calculé à partir du système d'exploitation des autres éléments. Par exemple, dans SO 2-
3 ( ions sulfite), la charge totale de l'ion est de -2, et chacun l'oxygène est supposé avoir son état d'oxydation habituelle de -2. La somme des systèmes d'exploitation est alors OS (S) + 3 (-2) = OS (S) - 6 = -2, de sorte que OS (S) = 4.
Pour résumer: la somme algébrique des états d'oxydation de tous les atomes dans un neutre molécule doit être à zéro, tandis que dans polyatomique ions la somme algébrique des états d'oxydation des atomes constitutifs doit être égale à la charge de l'ion. Ce fait, combiné avec le fait que certains éléments ont presque toujours certains états d'oxydation (en raison de leur très haute électropositivité ou électronégativité), permet de calculer les états d'oxydation des atomes restants (tels que les métaux de transition) en composés simples.
Les règles suivantes qui sont utilisées pour attribuer initialement états d'oxydation pour certains éléments, en composés simples:
- Le fluor a un état d'oxydation de -1 lorsqu'il est lié à ne importe quel autre élément, car il a le plus haut électronégativité de tous les éléments réactifs.
- Les halogènes autres que le fluor ont un état d'oxydation de -1 sauf quand ils sont liés à l'oxygène, l'azote ou un autre (plus électronégatif) halogène. Par exemple, l'état d'oxydation du chlore dans monofluorure de chlore (CLF) est une. Toutefois, dans le bromure de chlore (ou de chlorure de brome) (BrCl) l'état d'oxydation de Cl est -1.
- L'hydrogène a une l'état d'oxydation de +1, sauf lorsqu'ils sont liés à des éléments plus électropositifs tels que le sodium , l'aluminium et le bore , en tant que NaH, NaBH 4, LiAlH 4 , où chaque M a un état d'oxydation de -1.
- Dans les composés, l'oxygène a généralement un état d'oxydation de -2, mais il ya des exceptions qui sont répertoriés ci-dessous . Un exemple est les peroxydes (par exemple peroxyde d'hydrogène H 2 O 2) quand il a un système d'exploitation de -1.
- Les métaux alcalins ont un état d'oxydation de 1 dans pratiquement tous leurs composés (à l'exception, voir alkalide).
- Métaux alcalino-terreux ont un état d'oxydation de +2 dans la quasi-totalité de leurs composés.
Exemple pour un sel complexe: Dans Cr (OH) 3, l'oxygène a un état d'oxydation de -2 (pas de liaisons de fluor ou O-O présents), et de l'hydrogène a un état de 1 (lié à l'oxygène). Donc, chacune des trois hydroxyde groupes a un état de -2 + 1 = -1 oxydation. Comme le composé est neutre, Cr a un état d'oxydation de +3.
Pour des molécules avec des atomes non équivalents d'un même élément, le procédé de somme algébrique donne seulement un état d'oxydation moyen. Nous allons examiner ci-dessous comment trouver l'état de chaque atome d'oxydation à l'aide d'une structure de Lewis.
état d'oxydation et de charge formelle
L'état d'un atome d'oxydation est souvent différente de la accusation formelle souvent inclus dans les structures de Lewis (quand il est non nul). L'état d'oxydation est calculée en supposant que chaque liaison chimique (sauf entre les atomes identiques) est ionique de sorte que les deux électrons sont affectés à l'atome lié plus électronégatif. En revanche, la charge formelle est calculé en supposant que chaque obligations est covalente de telle sorte que un électron est attribué à chaque atome lié. Par exemple, dans l'ion ammonium (NH 4 +) de l'état d'oxydation de l'azote est -3, comme tous les huit électrons de valence sont affectés à l'atome d'azote qui est plus électronégatif que l'hydrogène. Cependant la charge formelle est une, calculée en affectant seulement quatre électrons de valence (une par obligation) à l'azote. A titre de comparaison, l'azote dans l'ammoniac (NH 3) a un état d'oxydation -3 également, mais une accusation formelle de zéro. Sur protonation d'ammoniac de l'accusation formelle sur les changements d'azote, mais son état d'oxydation ne est pas.
Calcul des états d'oxydation formels avec une structure de Lewis
Il ya deux façons communes de calcul de l'état d'un atome d'oxydation dans un composé. Le premier est la technique de la somme algébrique simple ci-dessus, utilisés dans les composés qui ne nécessitent pas un Structure de Lewis. La seconde est utilisé pour les molécules quand on a un Structure de Lewis.
Il convient de rappeler que l'état d'un atome d'oxydation ne représente pas la charge "réelle" sur cet atome: Cela est particulièrement vrai des États d'oxydation élevés, où la énergie d'ionisation nécessaire pour produire un ion positif de multiplication sont beaucoup plus grandes que les énergies disponibles dans des réactions chimiques. L'affectation des électrons entre les atomes dans le calcul un état d'oxydation est purement un formalisme, mais est un utile pour la compréhension de nombreuses réactions chimiques.
Pour plus sur les questions de calcul charges atomiques, voir charge partielle.
La structure de Lewis
Lorsqu'un La structure d'une molécule de Lewis est disponible, les états d'oxydation peuvent être affectés par le calcul de la différence entre le nombre de les électrons de valence qu'un atome neutre de cet élément auraient et le nombre d'électrons qui "appartiennent" à elle dans la structure de Lewis. Aux fins du calcul des états d'oxydation, des électrons dans une liaison entre les atomes de différents éléments appartiennent à la plus atome électronégatif; électrons dans une liaison entre les atomes d'un même élément sont divisés de manière égale et les électrons dans un seule paire appartient seulement à l'atome avec la paire solitaire.
Par exemple, considérons l'acide acétique :
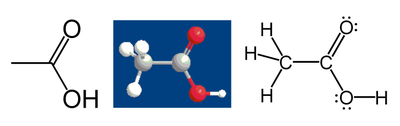
Le méthyle atome de carbone du groupe a six électrons de valence à ses liaisons à des atomes d'hydrogène parce que le carbone est plus électronégatif que l'hydrogène. En outre, une électrons est obtenue à partir de sa liaison avec l'autre atome de carbone parce que la paire d'électrons dans la Liaison C-C est réparti à parts égales, soit un total de 7 électrons. Un atome de carbone neutre aurait quatre électrons de valence, car le carbone est en groupe 14 du tableau périodique. La différence, 4-7 = -3, est l'état de cet atome de carbone d'oxydation. Autrement dit, si l'on suppose que toutes les liaisons ont été de 100% ionique (qui en fait, ils ne sont pas), le carbone serait décrit comme C 3.
Suivant les mêmes règles, l' acide carboxylique atome de carbone a un état d'oxydation de +3 (il obtient un seul électron de valence de la liaison C-C; les atomes d'oxygène obtenir tous les autres électrons parce que l'oxygène est plus électronégatif que le carbone). Les deux atomes d'oxygène ont un état d'oxydation de -2; ils obtiennent 8 électrons chacune (4 à partir des paires seules et 4 des obligations), tandis qu'un atome neutre d'oxygène aurait 6. Les atomes d'hydrogène ont tous état d'oxydation +1, parce qu'ils se rendent leur électrons aux atomes plus électronégatifs à laquelle ils sont liés.
Inéquivalentes atomes d'un élément

Un exemple d'une molécule non équivalents des atomes d'un même élément est le ion thiosulfate (S 2 O 3 2-), pour lequel la règle de somme algébrique donne la valeur moyenne des deux pour le soufre, où les deux électrons ionisants sont affectés à l'atome de soufre terminal. Cependant, l'utilisation d'une structure électronique et Lewis comptage montre que les deux atomes de soufre sont différents. Le soufre central est affecté un seul électron de valence de la liaison SS et pas d'électrons de valence des liaisons SO, comparativement à six électrons de valence d'un atome de soufre libre, de sorte que l'état de la centrale d'oxydation du soufre est 5. L'atome de soufre terminal est assigné l'autre électron de la liaison SS et trois paires libres pour un total de sept électrons de valence, de sorte que son état d'oxydation est de -1.
Les réactions d'oxydoréduction
les états d'oxydation peut être utile pour équilibrer les équations chimiques pour oxydoréduction (ou redox) réactions, parce que les changements dans les atomes oxydés doivent être pondérées par les changements dans les atomes réduits. Par exemple, dans la réaction de l'acétaldéhyde avec le Réaction de Tollens de l'acide acétique (ci-dessous), l'atome de carbone du carbonyle change son état d'oxydation de 1 à 3 (oxydation). Cette oxydation est compensée par la réduction de deux équivalents d' argent Ag de Ag + à 0.
Dans de tels schémas structurels de la chimie organique, des états d'oxydation sont représentés par des chiffres romains pour les distinguer accusations formelles (calculé avec toutes liaisons covalentes).
Éléments avec de multiples états d'oxydation
La plupart des éléments ont plus d'un état d'oxydation possible. Le carbone a neuf états d'oxydation entière, et il existe également des molécules dans lesquelles le degré d'oxydation moyen de plusieurs atomes de carbone est fractionnée.
États d'oxydation entiers de carbone avec des exemples
- -4: CH 4
- -3: C 2 H 6
- -2: CH 3 Cl
- -1: C 2 H 2
- 0: CH 2 Cl 2
- 1: CHCl 2 - CHCl 2
- 2: CHCl 3
- 3: C 2 Cl 6
- 4: CCl 4
Des exemples d'états d'oxydation fractionnaires pour le carbone
- - (5.6): C 5 H 5 -
- - (6/7): C 7 H 7 +
- - (4.5): C 8 H 8 2-
L'oxygène a 8 états d'oxydation différents
- -2 À des oxydes, par exemple, ZnO, CO 2 , H 2 O
- -1 À les peroxydes, par exemple H 2 O 2
- - (1/2) dans superoxydes, par exemple KO 2
- - (03/01) dans inorganique ozonides, par exemple RBO 3
- 0 en O 2
- + (1/2) dans dioxygényle, par exemple dioxygényle hexafluoroarsénate O 2 + [AsF 6] -
- Dans une F 2 O 2
- 2 dans DE 2
On notera que, étant donné que le fluor est plus électronégatif que l'oxygène, O 2 F 2 et D 2 sont considérés comme les fluorures, au lieu de, respectivement, un peroxyde et un oxyde.
États d'oxydation fractionnaires
États d'oxydation fractionnaires sont souvent utilisés pour représenter les états d'oxydation moyens de plusieurs atomes dans une structure. Par exemple, dans KO 2, le ion superoxyde a une charge de -1 divisé entre deux atomes équivalents, de sorte que chaque oxygène est affecté d'un état d'oxydation de -½, Cet ion est décrit comme un hybride de résonance des deux structures de Lewis, et chaque oxygène a l'état d'oxydation 0 à une structure et -1 dans l'autre.
Pour le ion cyclopentadiényle C 5 H 5 -, C de l'état d'oxydation est (-1) + (-1/5) = -6/5. Le -1 se produit parce que chaque C est lié à une moins H électronégatif, et -1/5 parce que la charge ionique totale est répartie entre cinq équivalent C.
Si la moyenne se réfère à des atomes qui ne sont pas équivalentes, l'état d'oxydation moyen peut ne pas être représentative de chacun des atomes. Cela est vrai dans magnétite Fe 3 O 4, dont la formule conduit à un état d'oxydation moyen de +8/3. En fait, les deux tiers des ions de fer sont Fe 3+, et un tiers de Fe 2+.
De même, la ozonide ions O 3 - a un état d'oxydation moyenne de -1/3. Ce est avec un ion central d'oxygène, ce qui ne est pas équivalent aux deux autres et ne peuvent pas être supposés avoir le même état d'oxydation en forme de V.
Nombre d'oxydation
L'état termes d'oxydation et d'oxydation sont souvent utilisés indifféremment. Cependant, nombre d'oxydation est utilisé dans chimie de coordination avec une signification légèrement différente. Dans la chimie de coordination, les règles utilisées pour compter les électrons sont différents: Chaque électron dans une liaison métal-ligand appartient à la ligand, quel que soit électronégativité. En outre, nombre d'oxydation sont classiquement représentés par des chiffres romains, tandis que les États d'oxydation utilisent chiffres indo-arabes.
Histoire
Le concept actuel de "l'état d'oxydation" a été introduit par WM Latimer en 1938. L'oxydation se était d'abord étudié par Antoine Lavoisier , qui croyait que l'oxydation était toujours le résultat de réactions avec l'oxygène , d'où le nom. Bien que l'idée de Lavoisier a été montré pour être incorrect, le nom qu'il a proposé est encore utilisé, mais plus généralement.
États d'oxydation ont été l'un des intellectuels «tremplins» Mendeleïev utilisées pour obtenir le tableau périodique moderne.
États formelles d'oxydation inhabituelles
Des états d'oxydation formels inhabituelles de métaux sont importants dans les processus biochimiques, les notables étant ceux Fe (IV) et Fe (V) en Cytochrome P450 systèmes contenant.

