
Vanadium
Contexte des écoles Wikipédia
Arrangeant une sélection Wikipedia pour les écoles dans le monde en développement sans internet a été une initiative de SOS Enfants. Parrainer un enfant de faire une réelle différence.
| Vanadium | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
23 V | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||
bleu-gris argent métal  | ||||||||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | vanadium, V, 23 | |||||||||||||||||||||||||||||||||
| Prononciation | / v ə n eɪ ré Je ə m / və- NAY -dee-əm | |||||||||||||||||||||||||||||||||
| Catégorie Metallic | métal de transition | |||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 5, 4, ré | |||||||||||||||||||||||||||||||||
| Poids atomique standard | 50,9415 (1) | |||||||||||||||||||||||||||||||||
| Configuration électronique | [ Ar ] 3d 3 4s 2 2, 8, 11, 2 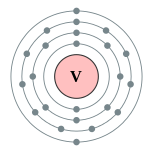 | |||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||
| Découverte | Andrés Manuel del Río (1801) | |||||||||||||||||||||||||||||||||
| Premier isolement | Nils Gabriel Sefström (1830) | |||||||||||||||||||||||||||||||||
| Nommé par | Nils Gabriel Sefström (1830) | |||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 6,0 g · cm -3 | |||||||||||||||||||||||||||||||||
| Liquid densité au mp | 5,5 g · cm -3 | |||||||||||||||||||||||||||||||||
| Point de fusion | 2183 K , 1910 ° C, 3470 ° F | |||||||||||||||||||||||||||||||||
| Point d'ébullition | 3680 K, 3407 ° C, 6165 ° F | |||||||||||||||||||||||||||||||||
| La chaleur de fusion | 21,5 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 459 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 24,89 J · mol -1 .K -1 | |||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||
| États d'oxydation | 5, 4, 3, 2, 1, -1 ( l'oxyde amphotère) | |||||||||||||||||||||||||||||||||
| Électronégativité | 1,63 (échelle de Pauling) | |||||||||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1e: 650,9 kJ · mol -1 | |||||||||||||||||||||||||||||||||
| 2ème: 1414 kJ · mol -1 | ||||||||||||||||||||||||||||||||||
| 3ème: 2830 kJ · mol -1 | ||||||||||||||||||||||||||||||||||
| Rayon atomique | 134 h | |||||||||||||||||||||||||||||||||
| Rayon covalente | 153 ± 20 heures | |||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||
| Crystal structure | cubique centré  | |||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | |||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 197 nΩ · m | |||||||||||||||||||||||||||||||||
| Conductivité thermique | 30,7 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) de 8,4 um · m -1 · K -1 | |||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 4,560 m · s -1 | |||||||||||||||||||||||||||||||||
| Le module d'Young | 128 GPa | |||||||||||||||||||||||||||||||||
| Module de cisaillement | 47 GPa | |||||||||||||||||||||||||||||||||
| Module Bulk | 160 GPa | |||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,37 | |||||||||||||||||||||||||||||||||
| Dureté Mohs | 6,7 | |||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-62-2 | |||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de vanadium | ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
Le vanadium est un élément chimique avec le symbole V et le numéro atomique 23. Ce est un dur, gris argenté, et ductile malléable métal de transition . L'élément ne se trouve que sous forme combinée chimiquement dans la nature, mais une fois isolé artificiellement, la formation d'une couche d'oxyde stabilise le métal libre un peu contre l'oxydation. Andrés Manuel del Río découvert composés de vanadium en 1801 par l'analyse d'un nouveau minéral du plomb qu'il a appelé "fil brun," et présumé ses qualités étaient dus à la présence d'un nouvel élément, qu'il nomma Erythronium (grec pour «rouge») puisque, lors du chauffage, la plupart de ses sels revenaient de leur couleur initiale au rouge. Quatre ans plus tard, cependant, il a été convaincu par d'autres scientifiques que Erythronium était identique au chrome. Chlorures de vanadium ont été générés en 1830 par Nils Gabriel Sefström qui de ce fait se est avéré qu'un nouvel élément a été impliqué, qu'il nomma "vanadium" après la Déesse germanique de la beauté et de la fertilité, VANADIS ( Freyja). Les deux noms ont été attribués à la large gamme de couleurs trouvées dans les composés de vanadium. Minérale plomb de Del Rio a été rebaptisée plus tard Vanadinite pour sa teneur en vanadium. Bien que Berzelius a prétendu avoir isolé première vanadium dans les années 1830, en 1867 Henry Enfield Roscoe a montré qu'il ne avait obtenu que l'oxyde, et enfin en 1869 Roscoe démontré une méthode pour obtenir l'élément pur.
Vanadium se produit naturellement dans environ 65 différents minéraux et combustibles fossiles dépôts. Elle est produite en Chine et la Russie de fonderie d'acier laitier; autres pays produisent ce soit à partir de la poussière de fumée de l'huile lourde, ou en tant que sous-produit de l'extraction d'uranium. Il est principalement utilisé pour produire de l'acier de spécialité alliages tels que aciers à outils à haute vitesse. Le composé de vanadium industriel le plus important, le pentoxyde de vanadium est utilisé en tant que catalyseur pour la production d' acide sulfurique .
De grandes quantités d'ions vanadium se trouvent dans quelques organismes, peut-être comme une toxine. L'oxyde et quelques autres sels de vanadium ont une toxicité modérée. En particulier, dans l'océan, le vanadium est utilisé par certaines formes de vie comme un centre actif d'enzymes, tels que la vanadium bromoperoxydase de certaines algues de l'océan. Le vanadium est probablement une micronutriments chez les mammifères, y compris les humains, mais son rôle précis à cet égard est inconnue.
Histoire
Le vanadium est à l'origine découverte par Andrés Manuel del Río, minéralogiste mexicain d'origine espagnole, en 1801. Del Río extrait l'élément à partir d'un échantillon de minerai mexicaine "de fil brun", nommé plus tard vanadinite. Il a constaté que ses sels présentent une grande variété de couleurs, et en conséquence il a nommé l'panchromium élément (en grec: παγχρώμιο "toutes les couleurs"). Plus tard, Del Río rebaptisé Erythronium élément (en grec: ερυθρός "rouge") comme la plupart de ses sels viré au rouge lors du chauffage. En 1805, le chimiste français Hippolyte Victor Collet-Descotils, soutenu par l'ami de Baron del Río Alexander von Humboldt, à tort déclaré que nouvel élément de del Río ne était qu'un échantillon impur de chrome . Del Río accepté la déclaration de Collet-Descotils et rétracté sa demande.
En 1831, le chimiste suédois Nils Gabriel Sefström redécouvert l'élément dans une nouvelle oxyde il a trouvé tout en travaillant avec minerais de fer. Plus tard cette même année, Friedrich Wöhler a confirmé les travaux antérieurs de del Río. Sefström choisi un nom commençant par V, qui ne avait pas encore été attribuée à ne importe quel élément. Il a appelé l'élément vanadium après Vieux norrois VANADIS (autre nom pour le Norse Vanr déesse Freyja, dont les facettes inclure des connexions à la beauté et de la fertilité), en raison des nombreux magnifiquement colorés composés chimiques qu'elle produit. En 1831, le géologue George William Featherstonhaugh suggéré que le vanadium devrait être rebaptisé "rionium" après del Río, mais cette suggestion n'a pas été suivie.

L'isolement du vanadium métallique se est avéré difficile. En 1831, Berzelius a rapporté la production du métal, mais Henry Enfield Roscoe montré que Berzelius avait en effet produit le nitrure, nitrure de vanadium (VN). Roscoe finalement produit le métal en 1867 par la réduction des vanadium (II) chlorure, VCl 2, avec hydrogène . En 1927, le vanadium pur a été produite par la réduction du pentoxyde de vanadium avec le calcium . La première utilisation industrielle à grande échelle de vanadium dans les aciers a été trouvée dans le châssis de la Ford Model T, inspirée par les voitures de course français. Vanadium a permis de réduire le poids tout en augmentant simultanément résistance à la traction.
Caractéristiques

Le vanadium est un dur, ductile, gris argenté métallique. Certaines sources décrivent vanadium comme "soft", peut-être parce que ce est ductile, malléable et pas fragile. Le vanadium est plus difficile que la plupart des métaux et aciers (voir Duretés des éléments (page de données) et fer ). Il a une bonne résistance à la corrosion et il est stable par rapport à alcalis, sulfurique et chlorhydrique acides. C'est oxydé dans l'air à environ 933 K (660 ° C, 1220 ° F), bien que se forme une couche d'oxyde, même à température ambiante.
Isotopes
Naturellement vanadium survenant est composé d'un stable isotope 51 V et une isotope radioactif 50 V. Ce dernier a une demi-vie de 1,5 × 10 17 années et une abondance naturelle 0,25%. 51 V a une 2.7 de spin nucléaire qui est utile pour la spectroscopie RMN . 24 artificielle des radio-isotopes ont été caractérisés, allant dans un nombre de masse de 40 à 65. La plupart de ces isotopes stables sont 49 V avec une demi-vie de 330 jours, et 48 V avec une demi-vie de 16,0 jours. Tout le reste isotopes radioactifs ont une demi-vie plus courte d'une heure, dont la plupart sont en dessous de 10 secondes. Au moins quatre isotopes ont états excités métastables. capture d'électrons est le principal mode de désintégration des isotopes plus léger que le 51 V. Pour les plus lourds, le mode le plus commun est désintégration bêta. Les réactions de capture d'électrons conduisent à la formation de l'élément 22 ( titane ) isotopes, tandis que pour la désintégration bêta, il conduit à 24 éléments ( chrome ) isotopes.
Chimie et composés

La chimie du vanadium est remarquable pour l'accessibilité des quatre adjacentes états d'oxydation 2-5. En solution aqueuse les couleurs sont V lilas 2+ (aq), vert V 3+ (aq), VO bleu 2+ (aq) et, à un pH élevé, VO jaune 4 2-. Vanadium (II) composés sont des agents réducteurs, et le vanadium (V) composés sont des agents oxydants. Vanadium (IV) composés existe souvent que dérivés de vanadyle qui contiennent le centre de la VO.
vanadate d'ammonium (V) (NH 4 VO 3) peut être successivement réduit avec élémentaire zinc pour obtenir les différentes couleurs du vanadium dans ces quatre états d'oxydation. États d'oxydation inférieurs se produisent dans des composés tels que V (CO) 6, [V (CO) 6] - et les dérivés substitués.
Le Batterie redox vanadium utilise tous les quatre états d'oxydation; une électrode utilise le + 5 / + 4 couple et l'autre utilise le couple + 3 / + 2. La conversion de ces états d'oxydation est illustrée par la réduction d'une solution fortement acide d'un composé de vanadium (V) avec de la poussière de zinc ou d'amalgame. La caractéristique de couleur jaune initiale de l'ion pervanadyl [VO 2 (H 2 O) 4] + est remplacé par la couleur bleue de [VO (H 2 O) 5] 2+, suivie par la couleur verte de [V (H 2 O) 6] 3+, puis la couleur violette cause de [V (H 2 O) 6] 2+.
Le composé le plus important dans le commerce est le pentoxyde de vanadium, qui est utilisé en tant que catalyseur pour la production d'acide sulfurique. Ce composé se oxyde le dioxyde de soufre (SO 2) à la trioxyde (SO 3). Dans ce réaction d'oxydoréduction, le soufre est oxydé 4-6, et le vanadium est réduit de 5 à 3:
- V 2 O 5 + 2 SO 2 → V 2 O 3 + 2 SO 3
Le catalyseur est régénéré par oxydation avec de l'air:
- V 2 O 3 + O 2 → V 2 O 5
Oxy-anions et cations

La chimie de l'oxyanion de vanadium (V) est complexe: le diagramme de prédominance pour vanadates en solution aqueuse montre au moins 11 espèces à être prédominant dans des conditions spécifiées de pH et de la concentration. L'ion vanadate tétraédrique, VO 3-
4, est les principales espèces présentes à pH 12-14. Lors de l'acidification, le monomère [HVO 4] 2- et dimère [V 2 O 7] - sont formées, avec le monomère prédominant à une concentration de vanadium de moins de ca. 10 -2 M (pV> 2; pv est égal au moins le logarithme de la concentration totale de vanadium / M). La formation de l'ion divanadate est analogue à la formation de la ions dichromate. Lorsque le pH est réduit, et en outre polymérisation de protonation polyvanadates se produisent: à pH 4-6 [H 2 VO 4] - est prédominant au pV supérieure à ca. 4, tout en concentrations plus élevées trimères et tétramères sont formés. Entre pH 2-4 decavanadates prédominent. Dans decavanadates il ya un octaèdre déformé d'atomes d'oxygène autour de chaque atome de vanadium. Acide vanadique, H 3 VO 4 a une concentration très faible en raison protonation des espèces tétraédriques [H 2 VO 4] - conduit à la formation préférentielle de l'octaédrique [VO 2 (H 2 O) 4] + espèces. Dans les solutions fortement acides, de pH <2. [VO 2 (H 2 O) 4] + est l'espèce prédominante, tandis que l'oxyde de V 2 O 5 précipite de la solution à des concentrations élevées. L'oxyde est formellement le anhydride inorganique de l'acide vanadique. Les structures de plusieurs de ceux-ci et d'autres ions vanadate ont été déterminées par cristallographie aux rayons X de composés cristallins.
Les constantes de dissociation acide de la série de vanadium et de phosphore sont remarquablement similaire. Chaînes, anneaux et clusters impliquant vanadium tétraédrique, analogues à la polyphosphates, sont connus. La correspondance entre la chimie et le vanadate de phosphate peut être attribuée à la similitude de taille et de charge de phosphore (V) et le vanadium (V). Orthovanadate V O 3-
4 est utilisé dans cristallographie des protéines pour étudier la biochimie de phosphate.
Le Diagramme de Pourbaix de vanadium dans l'eau, ce qui montre la potentiels redox entre diverses espèces de vanadium dans différents états d'oxydation est également complexe.
Vanadium (V) forme également des complexes peroxo différents. L'espèce VO (O) 2 (H 2 O) 4 + est présent dans les solutions acides. Dans alcalines espèces solutions avec 2, 3 et 4 groupes peroxyde sont présents; les formes derniers cristaux violets M 3 V (O 2) 4 nH 2 O (M = Li, Na, K, NH 4 +), dans lequel le vanadium a une structure de coordonnées 8 dodécaédrique.
composés chalcogénures et halogénures
Vanadium forme une très grande variété de composés binaires du soufre, du sélénium et du tellure, avec souvent des structures complexes. Le tétraédrique sulfamides-anion [VS 4] 3-, analogue à l'ion orthovanadate, est bien connu, mais il n'y a pas thio-analogues des oxo-vanadates polymères.
Tous les quatre halogénures sont connus pour des états d'oxydation 2 et 3, mais l'iodure est pas connu pour V (IV) et VF 5 est le seul halogénures connu pour état d'oxydation 5. VCl 4 peut être utilisé comme catalyseur pour la polymérisation de diènes.
Des exemples de oxyhalogénures comprennent.
- vanadium (V): VOF 3, VOX 3 et VO 2 X (X = F, Cl)
- vanadium (IV): VOX 2 (X = F, Cl, Br)
- vanadium (III): VOX, (X = Cl, Br)
composés de coordination
La position de début de vanadium dans le métal de transition conduit à trois séries caractéristiques plutôt inhabituelles de la chimie de coordination de vanadium. Tout d'abord, le vanadium métallique a la configuration électronique [Ar] 3d 3 4s 2, donc composés de vanadium sont relativement pauvre en électrons. Par conséquent, la plupart des composés binaires sont Acides de Lewis (paire accepteurs d'électrons); exemples sont tous les halogénures formant adduits octaédriques avec la formule VX n L 6- n (X = halogénure; L = autre ligand). Deuxièmement, l'ion vanadium est plutôt grand et peut atteindre un nombre de coordination supérieur à 6, comme ce est le cas en [V (CN) 7] 4-. En troisième lieu, la Vanadyle, VO 2+, est en vedette dans de nombreux complexes de vanadium (IV) tels que l'acétylacétonate de vanadyle (V (= O) 5 (C 5 H 7) 2). Dans ce complexe, le vanadium est de 5 coordonnée, pyramidale carrée, ce qui signifie que sixième ligand, tel que la pyridine, peut être fixé, si le constante d'association de ce procédé est faible. Beaucoup 5 coordonner complexes de vanadyle ont une géométrie trigonale bypyramidal, comme VOCl 2 (NMe 3) 2.
Composés organométalliques
La chimie organométallique de vanadium est bien développé, mais les composés organométalliques sont d'une importance commerciale mineure. Le dichlorure de vanadocène est un réactif de départ polyvalent et trouve des applications même mineures dans la chimie organique. Vanadium carbonyle, V (CO) 6, est un exemple rare d'un carbonyle métallique contenant un électron non apparié, mais qui existe sans dimérisation. L'addition d'un rendement d'électrons V (CO) -
6 ( isoélectronique avec Cr (CO) 6), qui peut être encore réduit avec du sodium dans l'ammoniac liquide pour donner V (CO) 3-
6 (isoélectronique avec Fe (CO) 5).
Occurrence
Vanadium métallique ne est pas trouvé dans la nature, mais on sait qu'il existe dans environ 65 différents minéraux . Exemples économiquement significatifs comprennent patronite (VS 4), vanadinite (Pb 5 (VO 4) 3 Cl), et carnotite (K 2 (UO 2) 2 (VO 4) 2 · 3H 2 O). Une grande partie de la production de vanadium du monde provient de vanadium-roulement magnétite trouvé dans ultramafique organismes de gabbro. Le vanadium est extrait principalement en Afrique du Sud , au nord-ouest de la Chine , et l'est de la Russie . En 2010, ces trois pays minés plus de 98% de la 56000 tonnes de vanadium produite.
Le vanadium est également présent dans bauxite et en combustibles fossiles des dépôts tels que le pétrole brut , le charbon , l'huile de schiste et sables bitumineux. Dans le pétrole brut, des concentrations allant jusqu'à 1 200 ppm ont été rapportés. Lorsque ces produits pétroliers sont brûlés, les traces de vanadium peuvent initier la corrosion dans les moteurs et les chaudières. On estime à 110 000 tonnes par an de vanadium sont libérés dans l'atmosphère par la combustion de combustibles fossiles. Vanadium a également été détectée par spectroscopie à la lumière de la Sun et quelques autres étoiles .
Production
Les plus vanadium est utilisé comme un alliage appelé ferrovanadium comme additif pour améliorer les aciers . Ferrovanadium est produit directement par réduction d'un mélange d'oxyde de vanadium, les oxydes de fer et de fer dans un four électrique. Vanadium-roulement le minerai de magnétite de fer est la principale source pour la production de vanadium. Le vanadium se retrouve dans la fonte brute produite à partir de vanadium magnétite palier. Pendant la production d'acier, de l'oxygène est soufflé dans la fonte, l'oxydation du carbone et la plupart des autres impuretés, formant scories. Selon le minerai utilisé, le laitier contient jusqu'à 25% de vanadium.
Vanadium métallique est obtenu par un procédé en plusieurs étapes qui commence avec le grillage de minerai broyé avec NaCl ou Na 2 CO 3 à environ 850 ° C pour donner métavanadate de sodium (NaVO 3). Un extrait aqueux de ce solide est acidifié pour donner "gâteau rouge", un sel polyvanadate, qui est réduite avec du calcium métallique. Comme une alternative pour la production à petite échelle, le pentoxyde de vanadium est réduit avec de l'hydrogène ou de magnésium . De nombreux autres procédés sont également en cours d'utilisation, dans laquelle l'ensemble de vanadium est produit en tant que sous-produit d'autres processus. La purification du vanadium est possible par la processus de barre de cristal développé par Eduard van Arkel et Jan Hendrik de Boer en 1925. Il se agit de la formation de l'iodure métallique, dans cet exemple vanadium (III) de l'iodure, et la décomposition ultérieure pour donner métal pur.
- 2 + V 3 I 2
 2 VI 3
2 VI 3
Applications
Alliages
Environ 85% de vanadium est utilisé comme produit ferrovanadium ou en acier additif. L'augmentation considérable de la résistance dans l'acier contenant de petites quantités de vanadium a été découvert au début du 20ème siècle. Vanadium forme de nitrures et de carbures stables, entraînant une augmentation significative de la résistance de l'acier. Depuis ce temps vanadium a été utilisé pour des applications dans cadres essieux, vélo, vilebrequins, engrenages et autres composants critiques. Il existe deux groupes de vanadium contenant des groupes d'alliages d'acier. Vanadium à haute carbone alliages d'acier contiennent 0,15% à 0,25% de vanadium et aciers à outils à haute vitesse (HSS) ont une teneur en vanadium de 1% à 5%. Pour les aciers à outils à grande vitesse, une dureté au-dessus HRC 60 peut être obtenue. HSS acier est utilisé dans et les instruments chirurgicaux outils.
Le vanadium stabilise la forme bêta de titane et augmente la stabilité de la résistance et de la température de titane. Mélangé avec l'aluminium en titane alliages il est utilisé dans les moteurs à réaction , cellules à grande vitesse et implants dentaires. Un des alliages courants est 6Al-4V titane, un alliage de titane avec 6% d'aluminium et 4% de vanadium.
D'autres utilisations
Le vanadium est compatible avec le fer et le titane, le vanadium donc feuille est utilisée dans revêtement de titane à l'acier. Le modérée capture de neutrons thermiques la section transversale et la courte demi-vie des isotopes produits par capture de neutrons vanadium fait un matériau adapté à la structure intérieure d'un réacteur de fusion. Plusieurs alliages de vanadium présentent un comportement supraconducteur. La première A15 supraconducteur de phase est un composé de vanadium, V 3 Si, qui a été découvert en 1952. Bande-vanadium de gallium est utilisé dans supraconducteurs aimants (17,5 teslas ou 175000 gauss). La structure de l'étape A15 supraconducteur de V 3 Ga est similaire à celle de la plus fréquente Nb 3 Sn et Nb 3 Ti.
L'oxyde le plus commun de vanadium, vanadium V 2 O 5 pentoxyde, est utilisé comme catalyseur dans la fabrication d'acide sulfurique par le processus de contact et comme comburant dans la production de l'anhydride maléique. Le pentoxyde de vanadium est également utilisé dans la fabrication céramiques. Un autre oxyde de vanadium, dioxyde de vanadium VO 2, est utilisé dans la production de revêtements de verre, qui bloque rayonnement infrarouge (et la lumière non visible) à une température spécifique. L'oxyde de vanadium peut être utilisé pour induire des centres de couleur en corindon pour créer des simulée bijoux alexandrite, bien alexandrite dans la nature est un chrysobéryl. La possibilité d'utiliser des couples redox de vanadium dans les deux demi-cellules, ce qui élimine le problème de contamination croisée par diffusion des ions à travers la membrane est l'avantage de vanadium redox piles rechargeables. Vanadate peut être utilisé pour protéger l'acier contre la rouille et la corrosion par électrochimique revêtement de conversion. Oxyde de lithium et de vanadium a été proposé pour une utilisation comme anode à haute densité d'énergie pour les batteries lithium-ion, à 745 Wh / L quand il est associé avec un oxyde de lithium cobalt cathode. Il a été proposé par certains chercheurs qu'une petite quantité, de 40 à 270 ppm, de vanadium dans Wootz et acier de Damas , améliore significativement la résistance du matériau, mais il est difficile que soit la source du vanadium était.
Rôle biologique
Vanadium joue un rôle très limité dans la biologie , et est plus important dans les environnements océaniques que sur terre.
Bromoperoxydases dans les algues
Composés organo-bromés dans un certain nombre d'espèces de marine algues sont générées par l'action d'un vanadium dépendante bromoperoxydase. C'est un haloperoxydase dans les algues qui exige bromure et est une enzyme absolument vanadium-dépendante. La plupart des composés organobromés dans la mer en fin de compte se présentent sous l'action de cette vanadium bromoperoxydase.
Accumulation vanadium dans tuniciers et ascidies
Chimiste allemand Martin Henze découvert vanadium dans le cellules sanguines (ou cœlomiques cellules) de Ascidiacea (des ascidies) en 1911. Il est essentiel de ascidies et tuniciers, où il est stocké dans le très acidifié vacuoles de certains types de cellules sanguines, vanadocytes désignés. Vanabins (Les protéines de liaison de vanadium) ont été identifiés dans le cytoplasme de ces cellules. La concentration de vanadium dans le sang est de 10 millions de fois supérieure à la concentration de vanadium dans l'eau de mer qui les entoure. La fonction de ce système de concentration de vanadium, et ces protéines contenant du vanadium, est encore inconnue.
Fixation de l'azote
Un nitrogénase vanadium est utilisé par certains fixateurs d'azote micro-organismes, tels que Azotobacter. Dans ce rôle de vanadium remplace plus fréquente de molybdène ou de fer , et donne le nitrogénase des propriétés légèrement différentes.
Champignons
Plusieurs espèces de champignons supérieurs, à savoir Amanita muscaria et les espèces apparentées, accumulent vanadium (jusqu'à 500 mg / kg en poids sec). Le vanadium est présent dans le complexe de coordination, amavadin, dans les fruits-organismes fongiques. Cependant, l'importance biologique du processus d'accumulation est inconnue. fonctions de toxines ou peroxydase fonctions enzymatiques ont été proposés.
Mammifères et oiseaux
Les rats et les poulets sont également connus pour nécessiter vanadium en très petites quantités et les irrégularités conduisent à une croissance réduite et altérée reproduction. Le vanadium est relativement controversée complément alimentaire, principalement pour augmenter l'insuline sensibilité et body-building. Que cela fonctionne pour le dernier objectif n'a pas été prouvée, et il existe des preuves que les athlètes qui le prennent sont simplement connaissent une effet placebo. Sulfate Vanadyl peut améliorer le contrôle glycémique chez les personnes atteintes le diabète de type 2. En outre, décavanadate et oxovanadates sont des espèces qui ont potentiellement de nombreuses activités biologiques et qui ont été utilisées avec succès comme outils dans la compréhension de plusieurs processus biochimiques.
Sécurité
Tous les composés du vanadium doivent être considérés comme toxiques. Tétravalent VOSO 4 a été signalé comme étant plus de cinq fois plus toxique que trivalent V 2 O 3. Le Sécurité et administration de la santé au travail (OSHA) a fixé une limite d'exposition de 0,05 mg / m 3 pour la poussière de pentoxyde de vanadium et de 0,1 mg / m 3 pour les fumées de pentoxyde de vanadium dans l'air en milieu de travail pour une journée de travail de 8 heures, 40 heures semaines de travail. Le Institut national de sécurité et santé au travail (NIOSH) a recommandé que 35 mg / m 3 de vanadium être considéré comme un danger immédiat pour la vie et la santé. Ce est le niveau d'un produit chimique qui est susceptible de causer des problèmes de santé permanents ou la mort exposition.
Les composés de vanadium sont mal absorbés par le système gastro-intestinal. expositions par inhalation au vanadium et des composés de vanadium résultent principalement des effets néfastes sur le système respiratoire. Les données quantitatives sont, cependant, insuffisante pour calculer une dose de référence de l'inhalation subchronique ou chronique. D'autres effets ont été rapportés après exposition par voie orale ou par inhalation sur les paramètres sanguins, sur le foie, sur le développement neurologique chez les rats et d'autres organes.
Il ya peu de preuves que les composés de vanadium ou de vanadium sont toxiques pour la reproduction ou tératogènes. Le pentoxyde de vanadium a été cité comme cancérogène chez les rats mâles et les souris mâles et femelles par inhalation dans une étude NTP, bien que l'interprétation des résultats a récemment été contesté. Vanadium n'a pas été classé comme cancérigène par le Environmental Protection Agency des États-Unis.
Vanadium traces dans carburants diesel présentent un risque de corrosion; ce est la composante principale de carburant influencer corrosion à haute température. Lors de la combustion, il se oxyde et réagit avec le sodium et le soufre, ce qui donne des composés de vanadate avec des points de fusion bas pour 530 ° C, qui attaquent le couche de passivation sur l'acier, les rendant sensibles à la corrosion. Les composés solides du vanadium provoquent également l'abrasion des composants du moteur.











