
L'acide phosphorique
Saviez-vous ...
SOS Enfants, qui se déroule près de 200 sos écoles dans le monde en développement, a organisé cette sélection. Voulez-vous savoir sur le parrainage? Voir www.sponsorachild.org.uk
| L'acide phosphorique | |
|---|---|
 | |
 | |
Autres noms L'acide orthophosphorique | |
| Identificateurs | |
| Numéro CAS | 7664-38-2 |
| Propriétés | |
| Formule moléculaire | H 3 PO 4 |
| Masse molaire | 98,0 g / mol |
| Apparence | solide blanc ou liquide incolore, visqueux (> 42 ° C) |
| Densité | 1,685 g / ml (liquides) |
| Point de fusion | 42,35 ° C, 316 K, 108 ° F |
| Point d'ébullition | 158 ° C, 431 K, 316 ° F (déc.) |
| Acidité (p K a) | 2,12, 7,21, 12,67 |
| Viscosité | 85% de solution aqueuse ? cP |
| Risques | |
| Classification UE | Corrosif (C) |
| Phrases-R | R34 |
| Phrases S | (S1 / 2), S26, S45 |
| Des composés apparentés | |
| D'autres anions | Acide nitrique L'acide Arsenic |
| D'autres cations | phosphate d'ammonium Le phosphate trisodique |
| L'acide de phosphore liés | L'acide hypophosphoreux L'acide de phosphore L'acide pyrophosphorique L'acide tripolyphosphorique L'acide hypophosphorique L'acide perphosphorique L'acide Permonophosphoric |
| Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
L'acide phosphorique, également connu comme l'acide orthophosphorique ou phosphorique (V) de l'acide, est un acide minéral (inorganique) ayant la formule chimique H 3 P O 4. En revanche, orthophosphorique acides peuvent se combiner avec les molécules elles-mêmes pour former une variété de composés désignés comme des acides phosphoriques d'une manière plus générale. L'acide phosphorique terme peut également faire référence à un chimique ou réactif constitué par les acides phosphoriques, l'acide orthophosphorique habituellement principalement.
La chimie de l'acide orthophosphorique
Pur acide phosphorique anhydre est un solide blanc qui fond à 42,35 ° C pour former un liquide incolore, visqueux.
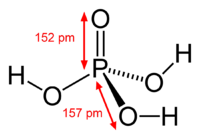
La plupart des gens et même les chimistes se réfèrent à l'acide orthophosphorique que l'acide phosphorique, qui est le nom IUPAC pour ce composé. L'ortho préfixe est utilisé pour distinguer l'acide à partir d'autres acides phosphoriques, les acides polyphosphoriques appelées. L'acide orthophosphorique est un non , toxique inorganique , plutôt faible triprotique acide qui, lorsqu'il est pur, est un solide à la chambre température et pression. Le structure chimique de l'acide orthophosphorique est représentée ci-dessus dans le tableau de données. Acide phosphorique est un très polaire molécule ; par conséquent, il est très soluble dans l'eau. L' état d'oxydation du phosphore (P) dans les acides phosphoriques ortho et autres est 5; l'état de tous les d'oxydation de l'oxygène atomes (O) est de -2 et de tous les hydrogènes des atomes (H) est une. Triprotique signifie qu'une molécule d'acide orthophosphorique peut dissocier jusqu'à trois fois, ce qui donne un H + jusqu'à chaque fois, qui combine généralement avec une molécule d'eau , H 2 O, comme montré dans ces réactions :
- H 3 PO 4 (s) + H 2 O (l) ⇌ H 3 O + (aq) + H 2 PO 4 - (aq) K a1 = 7,5 x 10 -3
- H 2 PO 4 - (aq) + H 2 O (l) ⇌ H 3 O + (aq) + HPO 4 2- (aq) K a2 = 6,2 × 10 -8
- HPO 4 2- (aq) + H 2 O (l) ⇌ H 3 O + (aq) + PO 4 3- (aq) K a3 = 2,14 × 10 -13
L' anion après la première dissociation, H 2 PO 4 -, est l'anion de phosphate monopotassique. L'anion secondes après la dissociation, HPO 4 2-, est l'anion de phosphate d'hydrogène. L'anion après la troisième dissociation, PO 4 3-, est le phosphate ou un anion orthophosphate. Pour chacune des réactions de dissociation indiquées ci-dessus, il est séparé constante de dissociation acide, appelé K a1, a2 K, et K A3 donnés à 25 ° C. Associé à ces trois constantes de dissociation sont p K a1 = 2,12, p = 7,21 K a2, a3 K et p = 12,67 valeurs à 25 ° C correspondant. Bien que tous les trois l'hydrogène (H) atomes sont équivalentes sur une molécule d'acide orthophosphorique, l'successive K a les valeurs diffèrent, car il est énergétiquement moins favorable à perdre de l'autre H + si une (ou plusieurs) a déjà été perdu et la molécule / ion est plus chargé négativement.
Étant donné que la dissociation de l'acide orthophosphorique triprotique, le fait que son bases conjuguées (les phosphates mentionnés ci-dessus) couvrent un large plage de pH, et, parce que l'acide phosphorique / phosphate solutions sont, en général, non toxique, des mélanges de ces types de phosphates sont souvent utilisés comme des agents tampons ou de faire des solutions de tampon, où le pH souhaité dépend des proportions des phosphates dans les mélanges. De même, le non-toxique, anion sels de triprotique organique acide citrique sont également souvent utilisé pour faire des tampons. Les phosphates se trouvent omniprésente en biologie, notamment dans les composés dérivés phosphorylés à partir de sucres , tels que l'ADN , ARN et de l'adénosine triphosphate (ATP). Il ya un article distinct sur phosphate sous forme d'anion ou de ses sels.
Lors du chauffage de l'acide orthophosphorique, de la condensation des unités phosphorique peut être induite en chassant l'eau formée par la condensation. Quand une molécule d'eau a été supprimé car chaque fois deux molécules de l'acide phosphorique, le résultat est l'acide pyrophosphorique (H 4 P 2 O 7). Quand une moyenne d'une molécule d'eau par unité phosphorique a été chassé, la substance résultante est un solide ayant une formule empirique vitreux de HPO 3 et est appelé acide métaphosphorique. L'acide métaphosphorique est une version de l'acide anhydre seul orthophosphoic et est parfois utilisé en tant que réactif à l'eau ou absorbant l'humidité. Plus déshydratant est très difficile, et peut être accomplie que par un très fort déshydratant (et non par chauffage seul). Il produit l'anhydride phosphorique, ce qui a une formule empirique P 2 O 5, même si une molécule réelle a une formule chimique de P 4 O 10. Anhydride phosphorique est un solide qui est très fortement l'humidité aborbing et est utilisé comme un dessiccatif.
p H et la composition d'une solution d'acide phosphorique
Pour une concentration en acide totale donnée [A] = [H 3 PO 4] + [H 2 PO 4 -] + [HPO 4 2-] + [PO 4 3-] ([A] est le nombre total de moles de pur H 3 PO 4 qui ont été utilisés pour préparer 1 litre de solution), la composition d'une solution aqueuse d'acide phosphorique peut être calculé en utilisant les équations d'équilibre associées aux trois réactions décrites ci-dessus conjointement avec le [H +] [OH -] = 10 -14 relation et l'équation de neutralité électrique. Le système peut être réduit à une équation de degré cinquième pour [H +] qui peut être résolu numériquement, ce qui donne:
| [A] (mol / L) | p H | [H 3 PO 4] / [A] (%) | [H 2 PO 4 -] / [A] (%) | [HPO 4 2-] / [A] (%) | [PO 3- 4] / [A] (%) |
| 1 | 1,08 | 91,7 | 8,29 | 6,20 × 10 -6 | 1,60 × 10 -17 |
| 10 -1 | 1,62 | 76,1 | 23,9 | 6,20 x 10 -5 | 5,55 × 10 -16 |
| 10 -2 | 2,25 | 43,1 | 56,9 | 6,20 × 10 -4 | 2,33 × 10 -14 |
| 10 -3 | 3,05 | 10,6 | 89,3 | 6,20 × 10 -3 | 1,48 × 10 -12 |
| 10 -4 | 4.01 | 1,30 | 98,6 | 6,19 × 10 -2 | 1,34 × 10 -10 |
| 10 -5 | 5,00 | 0,133 | 99,3 | 0,612 | 1,30 × 10 -8 |
| 10 -6 | 5,97 | 1,34 × 10 -2 | 94,5 | 5,50 | 1,11 × 10 -6 |
| 10 -7 | 6,74 | 1,80 × 10 -3 | 74,5 | 25,5 | 3,02 x 10 -5 |
| 10 -10 | 7,00 | 8,24 × 10 -4 | 61,7 | 38,3 | 8,18 x 10 -5 |
Pour de grandes concentrations d'acide, la solution est essentiellement composée de H 3 PO 4. Pour [A] = 10 -2, le p H est fermé à p K a1, ce qui donne un mélange équimolaire de H 3 PO 4 et H 2 PO 4 -. Pour [A] ci-dessous 10 -3, la solution se compose principalement de H 2 PO 4 - à [HPO 4 2-] devenir non négligeable de solution très diluée. [PO 4 3-] est toujours négligeable.
L'acide phosphorique en tant que réactif chimique
Pure de 75 à 85% aqueuses solutions (le plus commun) sont claires, incolore, inodore, non volatiles, plutôt visqueux, sirupeux liquides , mais encore coulante. L'acide phosphorique est très couramment utilisé comme un solution aqueuse de 85% d'acide phosphorique ou H 3 PO 4. Parce que ce est un concentré acide, une solution à 85% peut être corrosif, non toxique, bien que lorsqu'elle est diluée. En raison du pourcentage élevé d'acide phosphorique dans ce réactif, au moins une partie de l'acide orthophosphorique est condensée en acides polyphosphoriques en fonction de la température d'équilibre , mais, pour des raisons de simplicité et d'étiquetage, les 85% représente H 3 PO 4 en tant que si ce était tout l'acide phosphorique. Autres pourcentages sont également possibles, même au-dessus de 100%, où les acides phosphoriques et l'eau seraient dans un équilibre non précisée, mais le général élémentaire taupe contenu serait considéré comme spécifié. Lorsque des solutions aqueuses d'acide phosphorique et / ou de phosphate sont diluée, ils sont ou seront atteindre un équilibre après un moment où les unités phosphate pratiquement tout le phosphoriques / sont sous la forme ortho.
Préparation d'halogénures d'hydrogène
L'acide phosphorique réagit avec les halogénures pour former le gaz d'halogénure d'hydrogène correspondant (embuées fumées sont observées sur le réchauffement du mélange réactionnel). Ce est une pratique courante pour la préparation d'halogénures d'hydrogène de laboratoire.
- 3NaCl (s) + H 3 PO 4 (l) → NaH 2 PO 4 (s) + HCl (g)
- 3NaBr (s) + H 3 PO 4 (l) → NaH 2 PO 4 (s) + HBr (g)
- 3NaI (s) + H 3 PO 4 (l) → NaH 2 PO 4 (s) + HI (g)
enlèvement de Rust
L'acide phosphorique peut être utilisé par l'application directe de fer rouillé, outils en acier, ou des surfaces de convertir fer (III) oxyde ( rouille) à un soluble dans l'eau- composé phosphate. Il est généralement disponible sous forme de liquide verdâtre, propice au trempage (bain d'acide), mais est plus généralement utilisé comme composant dans un gel, communément appelé gelée navale. Comme un gel épais, il peut être appliqué sur des surfaces verticales, inclinées, voire généraux. Des précautions doivent être prises pour éviter les brûlures de l'acide de la peau et en particulier les yeux, mais le résidu est dilué avec de l'eau facilement. Lorsque suffisamment dilué, il peut même être nutritifs à la vie végétale, contenant les nutriments essentiels phosphore et fer. Il est parfois vendu sous d'autres noms, tels que "antirouille" ou "la rouille tueur." Il ne devrait pas être introduit directement dans l'eau de surface comme les ruisseaux ou dans les égouts, cependant. Après le traitement, l'oxyde de fer brun-rouge sera converti en un noir fer revêtement composé de phosphate qui peut être nettoyée off. Plusieurs applications de l'acide phosphorique peuvent être nécessaires pour éliminer toute trace de rouille. Le composé noire résultante peut fournir plus de résistance à la corrosion (telle protection est fourni par le peu superficiellement similaires Parkerizing et procédés de revêtement de conversion électrochimiques bleuies.) Après application et le retrait de la rouille en utilisant des composés d'acide phosphorique, le métal doivent être huilés (si être utilisé nu, comme dans un outil) ou peint appropriée, en utilisant un procédé de revêtement multiple de primaire, intermédiaire, et terminer manteaux.
L'utilisation des aliments transformés
L'acide phosphorique de qualité alimentaire est utilisé pour acidifier des aliments et des boissons telles que diverses colas, mais non sans controverse concernant ses effets sur la santé. Il offre un goût acidulé, et, étant un produit chimique de production de masse, est disponible à moindre coût et en grandes quantités. Le faible coût et la disponibilité en vrac est la différence assaisonnements naturels les plus chers qui donnent saveurs comparables, tels que gingembre tangyness, ou de l'acide citrique pour l'acidité, obtenu à partir de citrons et limes. (Acide citrique Cependant la plupart dans l'industrie alimentaire ne est pas extrait à partir d'agrumes, mais fermenté par Aspergillus de la moisissure à partir de déchets mélasse, les déchets amidon les hydrolysats et l'acide phosphorique). Il est étiqueté comme Numéro E E338.
Les effets biologiques sur le calcium des os et la santé des reins
L'acide phosphorique, utilisé dans de nombreuses boissons gazeuses (principalement cola), a été liée à abaisser la densité osseuse dans des études épidémiologiques. Par exemple, une étude utilisant la bi-énergie absorptiométrie à rayons X plutôt que d'un questionnaire sur la rupture, fournit une preuve raisonnable de soutenir la théorie que la consommation de cola résultats de la densité osseuse inférieure. Cette étude a été publiée dans l'American Journal of Clinical Nutrition. Un total de 1 672 femmes et 1 148 hommes ont été étudiés entre 1996 et 2001. L'information alimentaire ont été recueillies sur un questionnaire de fréquence alimentaire qui avait des questions précises sur le nombre de portions de cola et autres boissons gazeuses et a également fait une distinction entre régulière, caféine boissons sans et l'alimentation. Le document cite des preuves statistiquement significative de montrer que les femmes qui consomment de cola ont quotidienne densité osseuse inférieure. La consommation totale de phosphore ne était pas significativement plus élevé chez les consommateurs de cola par jour que chez non-consommateurs; cependant, les rapports calcium-phosphore étaient plus bas. L'étude suggère également que des recherches supplémentaires sont nécessaires pour confirmer les résultats.
D'autre part, une étude financée par Pepsi suggère qu'un faible apport de phosphore entraîne une baisse de la densité osseuse. L'étude ne examine pas l'effet de l'acide phosphorique, qui se lie avec le magnésium et le calcium dans le tractus digestif pour former des sels qui ne sont pas absorbés, mais, plutôt, il étudie la consommation générale de phosphore.
Cependant, une étude clinique bien contrôlée par Heaney et Rafferty en utilisant des méthodes de calcium bilan n'a trouvé aucun impact de boissons gazeuses contenant de l'acide phoshporic sur l'excrétion de calcium. L'étude a comparé l'impact de l'eau, le lait et diverses boissons gazeuses (deux avec de la caféine et deux sans; deux avec de l'acide phosphorique et deux avec de l'acide citrique) sur l'équilibre de calcium de 20 à 40 ans, les femmes qui habituellement consommé ~ 3 ou plusieurs tasses (680 ml) d'une boisson gazeuse non alcoolisée par jour. Ils ont constaté que, par rapport à l'eau, seul le lait et les deux boissons gazeuses contenant de la caféine augmente la calciurie, et que la perte de calcium associé à la consommation de boissons gazeuses contenant de la caféine était à peu près égale à celle précédemment trouvé pour la caféine seule. L'acide phosphorique sans caféine n'a eu aucune incidence sur la calciurie, ni ne augmentent la perte de calcium urinaire liés à la caféine. Parce que les études ont montré que l'effet de la caféine est compensée par les pertes de calcium réduit tard dans la journée, Heaney et Rafferty ont conclu que l'effet net de boissons gazeuses - y compris ceux avec de la caféine et l'acide phosphorique - est négligeable, et que les effets sur le squelette de gazéifiée consommation de boissons gazeuses sont probablement due principalement au lait déplacement.
Autres produits chimiques tels que la caféine (également une composante importante de boissons au cola commune populaire) ont également été suspectés en tant que contributeurs possibles à faible densité osseuse, en raison de l'effet connu de la caféine sur calciurie. Une autre étude, composé de 30 femmes au cours d'une semaine, suggère que l'acide phosphorique dans les colas n'a pas cet effet, et postule que la caféine n'a qu'un effet temporaire, qui est ensuite inversée. Les auteurs de cette étude concluent que les effets sur le squelette de la consommation de boissons gazeuses sont probablement dues principalement au déplacement de lait. (Un autre possible confondre facteur peut être une association entre une consommation élevée de boissons gazeuses et de mode de vie sédentaire.)
La consommation Cola a également été liée à des pierres de la maladie rénale et rénales chroniques grâce à la recherche médicale. Cette étude distinction entre les effets de cola (contient généralement de l'acide phosphorique), non-cola boissons gazeuses (acide citrique substitut) et le café (contrôle pour la caféine), et a constaté que la consommation de deux ou plusieurs colas par jour a plus que doublé l'incidence des reins maladie.
L'usage médical
L'acide phosphorique est utilisé dans dentisterie et orthodontie comme une solution de gravure, à nettoyer et poncer les surfaces des dents où des appareils dentaires ou plombages seront placés. L'acide phosphorique est également un ingrédient dans plus de-the-counter médicaments anti-nauséeux qui contiennent également des niveaux élevés de sucre ( glucose et fructose). Il ne devrait pas être utilisé par les diabétiques sans consultation avec un médecin. Cet acide est également utilisé dans de blanchiment des dents pour éliminer toute plaque qui peut être sur vos dents.
Préparation de l'acide phosphorique
L'acide phosphorique peut être préparé par deux voies - le traitement thermique et le procédé humide.
L'acide phosphorique thermique: Cet acide phosphorique très pure est obtenue par la combustion élémentaire de phosphore pour produire le pentoxyde de phosphore et en dissolvant le produit dans de l'acide phosphorique dilué. On obtient un acide phosphorique très pur, étant donné que la plupart des impuretés présentes dans la roche ont été supprimées lors de l'extraction du phosphore de la roche dans un four. Le résultat final est de qualité alimentaire, l'acide phosphorique thermique; Cependant, pour les applications critiques, un traitement supplémentaire pour éliminer les composés de l'arsenic peut être nécessaire.
L'acide phosphorique par voie humide: Wet acide phosphorique de procédé est préparé en ajoutant de l'acide sulfurique à phosphate de calcium roche.
La réaction est simplifié:
- 3 H 2 SO 4 + Ca 3 (PO 4) 2 + 6 H 2 O ↔ 2 H 3 PO 4 + 3 CaSO 4, 2H 2 O
L'acide par voie humide peut être purifié par élimination du fluor pour produire des animaux de qualité de l'acide phosphorique, ou par extraction au solvant et élimination de l'arsenic à produire de l'acide phosphorique de qualité alimentaire.
D'autres applications
L'acide phosphorique est utilisé comme le électrolyte dans les piles à combustible à l'acide phosphorique. Il est également utilisé comme étalon externe de phosphore -31 résonance magnétique nucléaire (RMN).
L'acide phosphorique est utilisé comme agent de nettoyage par métiers de la construction pour enlever les dépôts minéraux, des frottis de ciment, et les taches d'eau dure. Il est également utilisé comme ingrédient dans certains produits de nettoyage domestiques visant à des tâches de nettoyage similaires.
L'acide phosphorique chaud est utilisé dans microfabrication pour graver le nitrure de silicium (Si 3 N 4). Il est hautement sélectif pour la gravure du Si 3 N 4 à la place du SiO 2, du dioxyde de silicium .
L'acide phosphorique est utilisé comme flux par des amateurs (tels que les modélistes ferroviaires) comme une aide à la souder.
L'acide phosphorique est également utilisé dans la culture hydroponique de pH des solutions pour abaisser le pH de la solution nutritive. Alors que d'autres types d'acides peuvent être utilisés, le phosphore est un élément nutritif utilisé par les plantes, en particulier au cours de la floraison, ce qui rend l'acide phosphorique particulièrement souhaitable. Solution liquide General Hydroponics pH Down contient de l'acide phosphorique, en plus de l'acide citrique et du bisulfate d'ammonium avec des tampons pour maintenir un pH stable dans le réservoir de nutriment.
L'acide phosphorique est utilisé comme un agent d'ajustement du pH dans les produits cosmétiques et les produits de soins de la peau.
L'acide phosphorique est utilisé comme agent oxydant chimique pour la production de charbon actif.
