
Phosphore
Saviez-vous ...
Les articles de cette sélection écoles ont été organisés par sujet du programme d'études grâce aux bénévoles d'enfants SOS. SOS Children travaille dans 45 pays africains; pouvez-vous aider un enfant en Afrique ?
| Phosphore | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
15 P | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||
incolore, cireux blanc, jaune, écarlate, rouge, violet, noir  blancs cireuse (coupe jaune), rouge (granulés centre gauche, centre de morceau à droite), et le violet de phosphore | |||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||
| Nom, symbole, nombre | phosphore, P, 15 | ||||||||||||||||||||||||
| Prononciation | / fa ɒ s fa ər ə s / FOS--fər əs | ||||||||||||||||||||||||
| Élément Catégorie | non métalliques | ||||||||||||||||||||||||
| Groupe, période, bloc | 15 (pnictogens), 3, p | ||||||||||||||||||||||||
| Poids atomique standard | 30.973762 (2) | ||||||||||||||||||||||||
| Configuration électronique | [ Ne ] 3s 2 3p 3 2, 8, 5  | ||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||
| Découverte | Hennig Brand (1669) | ||||||||||||||||||||||||
| Reconnu comme un élément par | Antoine Lavoisier (1777) | ||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||
| Densité (à proximité rt) | (Blanc) 1,823, (rouge) ≈ 2,2 à 2,34, (violet) 2,36, (noir) 2,69 g · cm -3 | ||||||||||||||||||||||||
| Point de fusion | (Blanc) 44,2 ° C, (noir) 610 ° C | ||||||||||||||||||||||||
| Point de sublimation | (Rouge) ≈ 416 à 590 ° C, (violet) 620 ° C | ||||||||||||||||||||||||
| Point d'ébullition | (Blanc) 280,5 ° C | ||||||||||||||||||||||||
| La chaleur de fusion | (Blanc) 0,66 kJ · mol -1 | ||||||||||||||||||||||||
| Chaleur de vaporisation | (Blanc) 12,4 kJ · mol -1 | ||||||||||||||||||||||||
| Capacité thermique molaire | (Blanc) 23,824 J · mol -1 · K -1 | ||||||||||||||||||||||||
| Pression de vapeur (blanc) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Pression de vapeur (rouge, pb. 431 ° C) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||
| États d'oxydation | 5, 4, 3, 2, 1, -1, -2, -3 (Légèrement acide oxyde) | ||||||||||||||||||||||||
| Électronégativité | 2,19 (échelle de Pauling) | ||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 1011,8 kJ · mol -1 | ||||||||||||||||||||||||
| 2ème: 1907 kJ · mol -1 | |||||||||||||||||||||||||
| 3ème: 2914,1 kJ · mol -1 | |||||||||||||||||||||||||
| Rayon covalente | 107 ± 15 heures | ||||||||||||||||||||||||
| Rayon de Van der Waals | 180 h | ||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||
| Crystal structure | triclinique  | ||||||||||||||||||||||||
| Ordre magnétique | (Blanc, rouge, violet, noir) diamagnétique | ||||||||||||||||||||||||
| Conductivité thermique | (Blanc) 0,236, (noir) 12,1 W · m -1 K -1 | ||||||||||||||||||||||||
| Module Bulk | (Blanc) 5, (rouge) 11 GPa | ||||||||||||||||||||||||
| Numéro de registre CAS | 7723-14-0 | ||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||
| Article détaillé: Isotopes du phosphore | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Le phosphore est un élément chimique avec le symbole P et le numéro atomique 15. Un multivalent du non-métal groupe de l'azote, du phosphore comme un minéral est presque toujours présente dans son état oxydé au maximum, comme inorganique roches de phosphate. Le phosphore élémentaire existe sous deux formes majeure le phosphore blanc et phosphore rouge, mais en raison de sa forte réactivité, le phosphore ne est jamais trouvé comme un élément libre sur Terre.
La première forme de phosphore élémentaire à produire (phosphore blanc, en 1669) émet une faible lueur à l'exposition à l'oxygène - d'où son nom donné à la mythologie grecque, Φωσφόρος signifie «porteur de lumière» (latine Lucifer), se référant à la " Morning Star ", la planète Vénus . Le terme " phosphorescence ", ce qui signifie lueur après l'illumination, tire originaire de cette propriété de phosphore, bien que ce mot a depuis été utilisé pour un processus physique différent qui produit une lueur. La lueur de phosphore se est originaire de l'oxydation du blanc (mais pas rouge) phosphore - un processus appelé maintenant la chimioluminescence.
La grande majorité des composés du phosphore sont consommés comme engrais . D'autres applications comprennent le rôle des composés organophosphorés dans des détergents, pesticides et des agents neurotoxiques, et matchs.
Le phosphore est essentiel à la vie. Comme phosphate, il est un composant d' ADN , L'ARN, l'ATP , ainsi que la phospholipides qui forment toutes les membranes cellulaires. Démontrer le lien entre le phosphore et la vie, le phosphore élémentaire a été historiquement d'abord isolé de l'urine humaine, et de cendres d'os était une importante source de phosphate tôt. Minéraux phosphatés sont des fossiles. Faible taux de phosphate sont une limite importante à la croissance dans certains systèmes aquatiques. L'utilisation commerciale chef de composés du phosphore pour la production d'engrais est due à la nécessité de remplacer le phosphore qui les plantes absorbent du sol.
Caractéristiques
Physique

Le phosphore ne existe que plusieurs formes ( allotropes ) qui présentent des propriétés radicalement différentes. Les deux allotropes les plus courants sont le phosphore blanc et le phosphore rouge. Une autre forme, le phosphore écarlate, est obtenu en laissant une solution de phosphore blanc dans le disulfure de carbone de se évaporer au soleil. Phosphore noir est obtenu par chauffage phosphore blanc sous des pressions élevées (environ 12 000 atmosphères standard ou 1,2 gigapascals). En apparence, propriétés, et de la structure, il ressemble graphite, être noir et squameuse, un conducteur d'électricité, et a plissé des feuilles d'atomes liés. Un autre est allotrope diphosphore; il contient un phosphore dimère en tant que motif structural et est très réactif.

La forme la plus importante de phosphore élémentaire dans la perspective des applications et de la littérature chimique est le phosphore blanc. Il se compose de molécules tétraédriques P 4, dans laquelle chaque atome est lié à trois autres atomes par une liaison simple. Cette tétraèdre P 4 est également présent dans le phosphore liquide et gazeux à la température de 800 ° C quand il commence à décomposer les molécules P 2. Solide blanc existe sous deux formes. À basses températures, la forme β est stable. Au-températures élevées de la forme α est prédominante. Ces formes diffèrent en termes des orientations relatives du constituant P quatre tétraèdres.
Le phosphore blanc est le moins stable, le plus réactif, le plus volatil, le moins dense et la plus toxique des allotropes. Le phosphore blanc se transforme progressivement en phosphore rouge. Cette transformation est accélérée par la lumière et la chaleur, et des échantillons de phosphore blanc contiennent presque toujours une partie du phosphore rouge et par conséquent apparaissent jaune. Pour cette raison elle est aussi appelée phosphore jaune. Il brille dans le noir (lorsqu'il est exposé à l'oxygène) avec une très légère teinte de vert et de bleu, est très inflammable et pyrophore (auto-inflammation) au contact de l'air et est toxiques (provoquant de graves dommages au foie en cas d'ingestion). En raison de sa pyrophoricité, le phosphore blanc est utilisé en tant qu'additif dans napalm. L'odeur de la combustion de cette forme a une odeur d'ail caractéristique, et les échantillons sont généralement revêtue de blanc "(di) le pentoxyde de phosphore ", qui se compose de P 4 O 10 tétraèdres d'oxygène inséré entre les atomes de phosphore et au niveau de leurs sommets. Le phosphore blanc est insoluble dans l'eau mais soluble dans le disulfure de carbone.
Thermolyse (craquage) de P 4 à 1100 kelvin) donne diphosphore P 2. Cette espèce est pas stable sous forme solide ou liquide. L'unité dimère contient une triple liaison et est analogue au N 2. Il peut également être généré en tant que solution intermédiaire transitoire par thermolyse dans des réactifs précurseurs organo-phosphorés. À des températures encore plus élevées, P 2 se dissocie en atomique P.
Bien que le terme phosphorescence est dérivé du phosphore, la réaction qui donne son éclat phosphore est correctement appelé chimiluminescence (incandescent due à une réaction chimique à froid), pas la phosphorescence (la lumière qui, auparavant, est tombé sur une substance et excité, il ré-émettant).


Phosphore rouge
Le phosphore rouge est polymère dans la structure. Il peut être considéré comme un dérivé de P 4 dans lequel une liaison est rompue PP, et une liaison supplémentaire est formé avec le tétraèdre voisine résultant en une structure en forme de chaîne. Phosphore rouge peuvent être formées par chauffage de phosphore blanc à 250 ° C (482 ° F) ou par exposition à la lumière solaire phosphore blanc. Phosphore après ce traitement est amorphe. Après un chauffage supplémentaire, ce matériau se cristallise. En ce sens, le phosphore rouge est pas une forme allotropique, mais plutôt une phase intermédiaire entre le phosphore blanc et le violet, et la plupart de ses propriétés ont une plage de valeurs. Par exemple, fraîchement préparée, le phosphore rouge vif est très réactif et se enflamme à environ 300 ° C, mais il est encore plus stable que le phosphore blanc, qui se enflamme à environ 30 ° C. Après chauffage ou un stockage prolongé, les assombrit de couleur (voir images infobox); le produit résultant est plus stable et ne se enflamme pas spontanément à l'air.
phosphore Violet
Violet phosphore est une forme de phosphore qui peut être produite par une journée de phosphore rouge recuit supérieure à 550 ° C. En 1865, Hittorf découvert que lorsque le phosphore a été recristallisé à partir de fusion du plomb , une forme rouge / violette obtenue. Par conséquent, cette forme est parfois connu comme "les phosphore de Hittorf" (ou violette ou α-métallique phosphore).

Phosphore noir
Phosphore noir est la allotrope moins réactive et la forme thermodynamiquement stable en dessous de 550 ° C. Il est également connu sous le β-métallique phosphore et a une structure quelque peu semblable à celle de graphite. Les hautes pressions sont habituellement nécessaires pour produire le phosphore noir, mais il peut aussi être produits dans les conditions ambiantes utilisant des sels métalliques comme catalyseurs.
| Forme | blanc (α) | blanc (β) | violet | noir |
|---|---|---|---|---|
| Symétrie | Cubique centré | Triclinique | Monoclinique | Orthorhombique |
| Symbole de Pearson | AP24 | mP84 | OS8 | |
| Groupe d'espace | I 4 3m | P 1 No.2 | P2 / c n ° 13 | CMCA No.64 |
| Densité (g / cm 3) | 1,828 | 1,88 | 2,36 | 2,69 |
| Bandgap (eV) | 2.1 | 1,5 | 0,34 | |
| Indice de réfraction | 1,8244 | 2.6 | 2.4 |
Isotopes
Vingt-trois isotopes de phosphore sont connus, y compris toutes les possibilités de P 24 à 46 p. Seulement 31 P est stable et est donc présent à 100% d'abondance. La demi-entier spin nucléaire et de haute abondance de 31 P marque phosphore-31 NMR Spectroscopy un outil analytique très utile dans les études d'échantillons contenant du phosphore.
Deux isotopes radioactifs du phosphore ont des demi-vies qui les rendent utiles pour des expériences scientifiques. P 32 a une demi-vie de 14,262 jours et 33 P a une demi-vie de 25,34 jours. Les biomolécules peuvent être "étiquetés" avec un radio-isotope pour permettre l'étude d'échantillons très diluées.
Radioactives isotopes de phosphore comprennent
- 32 P, émetteur bêta (1,71 MeV) avec une demi-vie de 14,3 jours, ce qui est utilisé couramment dans les laboratoires de sciences de la vie, principalement pour produire ADN et l'ARN radiomarqué sondes, p.ex. pour utilisation dans Transferts de Northern ou Transferts de Southern. Parce que les particules bêta de haute énergie produites peau et de pénétrer cornées , et parce que tout 32 P ingéré, inhalé ou absorbé est facilement incorporé dans l'os et acides nucléiques, Sécurité et administration de la santé aux États-Unis, et des institutions similaires dans d'autres pays développés exigent que une blouse de laboratoire, des gants jetables et des lunettes de sécurité ou des lunettes être porté lorsque vous travaillez avec 32 P, et que travailler directement sur un récipient ouvert être évités afin pour protéger les yeux. Surveillance, les vêtements et la contamination de surface personnelle est également nécessaire. En outre, en raison de la haute énergie des particules bêta, blindage ce rayonnement avec les matériaux denses normalement utilisés (comme le plomb), donne lieu à l'émission secondaire de Rayons X via Bremsstrahlung (de rayonnement de freinage). Par conséquent blindage doit être réalisée avec des matériaux de faible densité, par exemple en plexiglas (Lucite), d'autres matières plastiques, l'eau, ou (lorsque la transparence ne est pas nécessaire), même le bois.
- 33 P, un émetteur bêta (0,25 MeV) avec une demi-vie de 25,4 jours. Il est utilisé dans les laboratoires de sciences de la vie dans les applications où les émissions de bêta d'énergie inférieures sont avantageuses telles que l'ADN séquençage.
Occurrence
En termes de nucléosynthèse stellaire, des formes stables de phosphore sont produites dans (supérieure à 3 masses solaires) étoiles en fusionnant deux grandes oxygène atomes ensemble. Cela nécessite des températures supérieures à 1000 megakelvins.
Le phosphore ne est pas trouvé libre dans la nature, mais il est largement distribué dans de nombreux minéraux , les phosphates essentiellement. Historiquement-important mais limité de sources commerciales étaient organiques, tels que les cendres des os et (dans ce dernier 19 ème siècle) guano. Inorganique roche phosphatée, qui est partiellement faite de apatite (une tri-phosphate de calcium minéral impur), est aujourd'hui le chef de source commerciale de cet élément. Environ 50 pour cent des réserves mondiales de phosphore sont dans les pays arabes. Les grands dépôts d'apatite sont situés dans la Chine , la Russie , Maroc , Florida , Idaho, Tennessee, Utah, et ailleurs. Albright et Wilson dans le Royaume-Uni et leur Niagara Falls plante, par exemple, étaient utilisant du phosphate de roche dans les années 1890 et 1900 de Tennessee, en Floride, et la Île du Grand Connétable ( sources insulaires du guano de phosphate); en 1950, ils utilisaient la roche phosphatée principalement du Tennessee et de l'Afrique du Nord. Au début des années 1990, les entreprises de l'acide phosphorique par voie humide purifié Albright et Wilson a été affectée négativement par les ventes de phosphate par la Chine et l'entrée de leurs fournisseurs de phosphate marocains de longue date dans l'entreprise purifiée d'acide phosphorique par voie humide.
En 2012, l'USGS estime 71000000000 tonnes de réserves mondiales, où les chiffres des réserves se réfèrent à la quantité supposée recouvrable à prix courants du marché; 0190000000 tonnes ont été extraites en 2011.
Des rapports récents suggèrent que la production de phosphore peut avoir atteint un sommet, menant à la possibilité de pénuries mondiales d'ici 2040. En 2007, au taux de la consommation, l'offre de phosphore a été estimé à manquer dans 345 ans. Cependant, certains scientifiques croient maintenant qu'un " phosphore pointe »se produira dans 30 ans et que« Au rythme actuel, les réserves seront épuisées dans les 50 à 100 prochaines années. "phosphore comprend environ 0,1% en masse de la roche moyenne, et par conséquent l'approvisionnement de la Terre est vaste, bien diluée .
Production
La majorité des composés contenant du phosphore sont fabriqués pour être utilisés comme engrais. A cet effet, les minéraux contenant du phosphate sont convertis en acide phosphorique. Deux itinéraires distincts sont utilisés, le principal étant le traitement des minéraux phosphatés avec de l'acide sulfurique. L'autre procédé utilise le phosphore blanc, qui peuvent être produits par la réaction et la distillation à partir de sources de phosphate de très faible niveau. Le phosphore blanc est alors oxydé en acide phosphorique et neutralisé ensuite avec une base pour donner des sels de phosphate. L'acide phosphorique obtenu par le phosphore blanc est relativement pure et est la principale source de phosphates utilisés dans les détergents et autres applications non-engrais.
Phosphore élémentaire
Actuellement, environ un million (910 000 tonnes courtes t) de phosphore élémentaire est produit annuellement. Le phosphate de calcium (phosphate), principalement exploité en Floride et en Afrique du Nord, peut être chauffé à 1.200-1.500 ° C avec du sable, qui est principalement SiO 2, et le coke (carbone impur) pour produire P vaporisé 4. Le produit est ensuite condensée en une poudre blanche sous l'eau pour éviter l'oxydation par l'air. Même sous l'eau, phosphore blanc est lentement convertis en plus stable phosphore rouge allotrope . L'équation chimique pour ce processus quand on commence avec fluoroapatite, un minéral de phosphate commun, est:
- 4 Ca 5 (PO 4) 3 F 18 + SiO 2 + C → 30 3 P 4 + 30 + 18 CO + 2 CaSiO3 CaF 2
produits secondaires de cette production incluent ferrophosphore, une forme brute de Fe 2 P, résultant des impuretés de fer dans les précurseurs minéraux. Le silicate laitier est un matériau de construction utile. Le fluorure est parfois récupéré pour une utilisation dans fluoration de l'eau. Plus problématique est une «boue» contenant des quantités significatives de phosphore blanc. Production de phosphore blanc est effectuée dans de grandes installations en partie parce qu'il est très énergivore. Le phosphore blanc est transporté sous forme liquide. Certains accidents majeurs ont eu lieu pendant le transport, la formation au déraillements Brownston, le Nebraska et Miamisburg, Ohio a conduit à de grands feux. Le pire incident était ces derniers temps un une environnement en 1968, lorsque la mer a été contaminé en raison de déversements et / ou insuffisamment traitée eaux usées d'une usine de phosphore blanc à Placentia Bay, Terre-Neuve.
Un autre processus par lequel phosphore élémentaire est extrait comprend l'application à haute température (1500 ° C):
- 2 Ca 3 (PO 4) 2 + 6 + SiO 2 10 C → + 10 6CaSiO 3 CO + P 4
Thermphos International est le seul producteur de phosphore élémentaire avec la capacité annuelle de 80 000 t fournies par une usine à Vlissingen, aux Pays-Bas de l'Europe.
Composés
Oxacides de phosphore
Oxoacides phosphore sont vastes, souvent commercialement importantes, et parfois structurellement compliqué. Ils ont tous des protons acides liés à des atomes d'oxygène et certains ont des protons non acides qui sont liés directement au phosphore. Bien que de nombreux oxoacides de phosphore sont formés, seulement neuf sont importants, et trois d'entre eux, l'acide hypophosphoreux, l'acide phosphoreux et l'acide phosphorique, sont ceux particulièrement importants.
| état d'oxydation | Formule | Nom | Protons acides | Composés |
|---|---|---|---|---|
| 1 | HH 2 PO 2 | L'acide hypophosphoreux | 1 | sels d'acides, |
| 3 | H 2 HPO 3 | L'acide de phosphore | 2 | sels d'acides, |
| 3 | HPO 2 | l'acide metaphosphorous | 1 | sels |
| 3 | H 3 PO 3 | (Ortho) l'acide phosphoreux | 3 | sels d'acides, |
| 5 | (HPO 3) n | acides métaphosphoriques | n | sels (n = 3,4,6) |
| 5 | H (HPO 3) n OH | acides polyphosphoriques | n + 2 | les acides, les sels (n = 1-6) |
| 5 | H 5 P 3 O 10 | l'acide tripolyphosphorique | 3 | sels |
| 5 | H 4 P 2 O 7 | l'acide pyrophosphorique | 4 | sels d'acides, |
| 5 | H 3 PO 4 | (Ortho) de l'acide phosphorique | 3 | sels d'acides, |
Phosphore (V) composés
Oxydes
Les composés les plus répandues de phosphore sont des dérivés de phosphate (PO 4 3-), un anion tétraédrique. Le phosphate est la base conjuguée de l'acide phosphorique, qui est produite sur une grande échelle pour une utilisation dans les engrais. Etant triprotique, l'acide phosphorique convertit pas à pas à trois bases conjuguées:
- H 3 PO 4 + H 2 O
 H 3 O + + H 2 PO 4 - K a1 = 7,25 × 10 -3
H 3 O + + H 2 PO 4 - K a1 = 7,25 × 10 -3
- H 2 PO 4 - + H 2 O
 H 3 O + + HPO 4 2- K a2 = 6,31 × 10 -8
H 3 O + + HPO 4 2- K a2 = 6,31 × 10 -8
- HPO 4 2- + H 2 O
 H 3 O + + PO 4 3- K a3 = 3,98 × 10 -13
H 3 O + + PO 4 3- K a3 = 3,98 × 10 -13
Phosphate présente la tendance à former des chaînes et des anneaux avec des liaisons POP. Beaucoup de polyphosphates sont connus, y compris l'ATP . Polyphosphates surviennent par déshydratation de phosphates d'hydrogène tels que HPO 4 2- et H 2 PO 4 -. Par exemple, l'importance industrielle triphosphate trisodique (également connu sous le nom le tripolyphosphate de sodium, le STPP) est produit industriellement sur une échelle mégatonnes via ce réaction de condensation:
- 2 Na 2 [(HO) PO 3] + Na [(HO) 2 PO 2] → Na 5 [O 3 POP (O) 2 -O-PO 3] + 2 H 2 O
Le pentoxyde de phosphore (P 4 O 10) est le anhydride d'acide de l'acide phosphorique, mais plusieurs intermédiaires sont connus entre les deux. Cette cireux solides blancs réagit vigoureusement avec de l'eau.
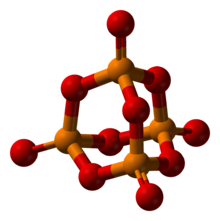
Avec métalliques cations , phosphate forme une variété de sels. Ces solides sont polymères, avec des liaisons POM. Lorsque le cation de métal a une charge de 2+ ou 3+, les sels sont généralement insolubles, d'où ils existent en tant que minéraux communs. De nombreux sels de phosphate sont dérivés de phosphate d'hydrogène (HPO 4 2-).
PCl 5 et PF 5 sont des composés courants. Les deux sont volatiles et pâle ou incolore. Les deux autres halogénures, PBr 5 5 PI PI et 5 sont instables. Le pentachlorure de pentafluorure et adoptent bipyramide trigonale géométrie moléculaire et sont Des acides de Lewis. Avec fluorure, PF 5 forme PF 6 -, un anion qui est isoélectroniques avec SF 6. L'oxyhalogénure plus important est l'oxychlorure de phosphore (POCl 3), qui est tétraédrique.
Avant de nombreux calculs informatiques étaient réalisables, il a été proposé que la liaison en phosphore (V) composés d orbitales impliquées. Il est désormais admis que la liaison peut être mieux expliqué par théorie des orbitales moléculaires et ne implique que s et p orbitales phosphore.
Nitrures
Les composés de formule (2) n PNCL existent principalement comme des anneaux tels que la trimère hexachlorophosphazene. Les phosphazènes surviennent par traitement de pentachlorure de phosphore avec du chlorure d'ammonium: PCl 5 + NH 4 Cl → 1 / n (NPCl 2) n + 4 HCl Les groupes chlorure peut être remplacé par alcoolate (RO -) pour donner naissance à une famille de polymères présentant des propriétés potentiellement utiles.
Sulfures
Le phosphore forme un large éventail de sulfures, où le phosphore peut être P (V), P (III) ou d'autres états d'oxydation. Le plus célèbre est le triple symétrique P 4 S 3 utilisé dans les allumettes. P 4 S 10 et P 4 O 10 ont des structures analogues.
Phosphore composés (III)
La phosphine (PH 3) et ses dérivés organiques (PR 3) sont des analogues structuraux avec de l'ammoniac (NH 3), mais les angles de liaison au niveau du phosphore sont plus proches de 90 ° pour phosphine et ses dérivés organiques. Ce est un mauvais odorat, composé toxique. La phosphine est produit par hydrolyse de le phosphure de calcium, Ca 3 P 2. Contrairement à l'ammoniac, phosphine est oxydé par l'air. Phosphine est également beaucoup moins basique que l'ammoniac.
Tous les quatre trihalogénures symétriques sont bien connus: gazeux PF 3, les liquides jaunâtres, PCl 3 et PBr 3 , et le solide 3 PI. Ces matériaux sont sensibles à l'humidité, hydrolyse pour donner l'acide de phosphore. Le trichlorure de réactif commun, est produit par chloration du phosphore blanc:
- P 4 + 6 Cl 2 → PCl 3 4
Le trifluorure de est produite par le trichlorure par échange halogénure. PF 3 est toxique car il se lie à l'hémoglobine.
Le phosphore (III) de l'oxyde, P 4 O 6 (aussi appelé hexoxyde de tétraphosphore) est l'anhydride de P (OH) 3, le tautomère mineure d'acide phosphoreux. La structure de P 4 O 6 est semblable à celle de P 4 O 10 moins les groupes d'oxyde terminaux.
Oxyhalogénures et oxyhydrides de phosphore (III) mixtes sont presque inconnus.
Les composés organophosphorés
Composés avec des liaisons PC et PS sont souvent classés comme les composés organophosphorés. Ils sont largement utilisés dans le commerce. Le PCl 3 sert de source de P voies à 3+ dans organophosphorés composés (III). Par exemple, il est le précurseur de triphénylphosphine:
- PCl 3 + 6 + Na 3 C 6 H 5 Cl → P (C 6 H 5) 3 + 6 NaCl
Traitement de trihalogénures de phosphore avec des alcools et des phénols , par exemple les phosphites donne triphénylphosphite:
- PCl 3 + 3 C 6 H 5 OH → P (OC 6 H 5) 3 + 3 HCl
Des réactions similaires se produisent pour l'oxychlorure de phosphore , offrant triphénylphosphate:
- OPCL 3 + 3 C 6 H 5 OH → OP (OC 6 H 5) 3 + 3 HCl
Phosphore (I) et de phosphore (II) composés
Ces composés comportent généralement des obligations PP. Les exemples incluent des dérivés de phosphine et organophosphines concaténées. Le gaz hautement inflammable diphosphine (P 2 H 4) est le premier d'une série de dérivés de ce type. Diphosphine est un analogue du hydrazine. Composés contenant P = P doubles liaisons ont également été observés, mais ils sont rares.

Phosphures
L'ion de phosphure est P 3-. Phosphures surviennent par réaction des métaux avec du phosphore rouge. Sels de P 3- ne existent pas en solution et ces dérivés sont réfractaires, reflétant leur haute énergie treillis. Illustré par le comportement phosphure de calcium, de nombreux phosphures métalliques hydrolysent dans l'eau avec libération de phosphine:
- Ca 3 P 2 + 6 H 2 O → 2 PH 3 3 + Ca (OH) 2
Schreibersite est un phosphure naturellement présent dans les météorites. Beaucoup polyphosphures sont connus tels que les dérivés de PCO 2. Ceux-ci peuvent être structurellement complexe allant de Na 3 P 7 et P 26 dérivés de 4-. Souvent, ces espèces adoptent des structures en forme de cage qui ressemblent à des fragments de phosphore violets.
Orthographe et l'étymologie
Le nom du phosphore dans la Grèce antique était le nom de la planète Vénus et est dérivé des grecs mots (φως = lumière, φέρω = carry), qui se traduit à peu près comme porteur de lumière ou de porte-avions léger. (Dans la mythologie grecque et la tradition, Augerinus (Αυγερινός = étoile du matin, en usage jusqu'à aujourd'hui), Hesperus ou Hesperinus (Εσπερος ou Εσπερινός ou Αποσπερίτης étoile du soir =, en usage jusqu'à aujourd'hui) et Eosphorus (Εωσφόρος = dawnbearer, ne est pas utilisé pour la planète après le christianisme) sont proches homologues, et également associé à Phosphore-the-Planet).
Selon le Oxford English Dictionary, l'orthographe correcte de l'élément est le phosphore. Le mot de phosphore est la forme adjectivale du P 3+ valence: oui, tout comme soufre formes soufre composés ic UO et de soufre, phosphore nous forme phosphore composés UO (par exemple, l'acide de phosphore) et Valence phosphore composés de P ic (par exemple, les acides phosphoriques et les phosphates).
Histoire et découverte
Le phosphore était l'élément 13 d'être découvert. Pour cette raison, et aussi en raison de son utilisation dans les explosifs, les poisons et les agents neurotoxiques, il est parfois appelé «élément du Diable". Ce est le premier élément à découvrir qui ne était pas connu depuis l'Antiquité. La découverte de phosphore est crédité à l'alchimiste allemand Hennig Brand en 1669, bien que d'autres chimistes ont découvert pourraient phosphore dans le même temps. Marque expérimenté urine, qui contient des quantités considérables de phosphates dissous provenant du métabolisme normal. Travailler dans Hambourg , Marque tenté de créer le légendaire pierre philosophale par la distillation de certains sels par évaporation de l'urine, et dans le processus produit un matériau blanc qui brillait dans l'obscurité et brûlé avec brio. Il a été nommé mirabilis de phosphore ("porteur de lumière miraculeuse"). Son processus concernait à l'origine laisser reposer pendant urine jours jusqu'à ce qu'il dégageait une odeur épouvantable. Puis il fait bouillir jusqu'à une pâte, chauffé cette pâte à une température élevée, et a conduit les vapeurs à travers l'eau, où il espérait qu'ils se condenser à l'or. Au lieu de cela, il a obtenu, une substance cireuse blanche qui brillait dans l'obscurité. Marque avait découvert le phosphore, le premier élément découvert depuis l'antiquité. Nous savons maintenant que la marque produit de phosphate acide d'ammonium de sodium, (NH 4) NaHPO 4. Bien que les quantités étaient essentiellement correcte (il a fallu environ 1 100 L d'urine pour faire environ 60 g de phosphore), il ne était pas nécessaire pour permettre à l'urine à la pourriture. Plus tard, les scientifiques seraient découvrir que l'urine fraîche a donné la même quantité de phosphore.

Marque d'abord essayé de garder la méthode secrète, mais plus tard vendu la recette de 200 thalers à D Krafft de Dresde, qui pourrait maintenant faire aussi bien, et a visité une grande partie de l'Europe avec elle, y compris l'Angleterre, où il a rencontré Robert Boyle . Le secret qu'elle a été faite à partir d'urine a coulé et le premier Johann Kunckel (1630-1703), en Suède (1678) et plus tard Boyle à Londres (1680) ont également réussi à faire de phosphore. Boyle affirme que Krafft lui a donné aucune information quant à la préparation de phosphore autres que celui qu'il a été dérivé de «peu qui appartenaient au corps de l'homme". Cela a donné un indice précieux Boyle, cependant, de sorte que, lui aussi, a réussi à faire le phosphore, et publié la méthode de sa fabrication. Plus tard, il a amélioré le processus de Marque en utilisant du sable dans la réaction (toujours en utilisant l'urine comme matériau de base),
- 4 NaPO 3 + 2 SiO 2 + 10 C → 2 Na 2 SiO 3 + 10 + CO P 4
Robert Boyle était le premier à utiliser le phosphore pour enflammer attelles en bois soufre pointe, précurseurs de nos matchs modernes, en 1680.
En 1769, Johan Gottlieb et Gahn Carl Wilhelm Scheele a montré que le phosphate de calcium (Ca 3 (PO 4) 2) se trouve dans les os, et ils obtenu phosphore élémentaire à partir de cendres d'os. Antoine Lavoisier reconnu phosphore comme un élément en 1777. cendres osseuse a été la principale source de phosphore jusqu'à la 1840. La méthode commencé par grillage os, alors employé l'utilisation de l'argile cornues enfermé dans un four en briques très chaud pour distiller le produit de phosphore élémentaire hautement toxique. Alternativement, les phosphates précipités pourraient être faites à partir d'os de sol-up qui avait été dégraissés et traités avec des acides forts. phosphore blanc pourrait être alors être fait par chauffage des phosphates précipités, mélangé avec du charbon de terre ou charbon de bois dans un pot de fer, et l'élimination par distillation de la vapeur de phosphore dans un cornue. monoxyde de carbone et d'autres gaz inflammables produits pendant le processus de réduction ont été brûlés dans une torchère.
Dans les années 1840, la production de phosphate du monde se est tourné vers l'exploitation des gisements des îles tropicales formé à partir d'oiseaux et chauve-souris guano (voir aussi Guano Islands Act). Ils sont devenus une source importante de phosphates d'engrais dans la seconde moitié du 19 e siècle.
Le phosphate, un minéral contenant du phosphate de calcium, on a utilisé la première fois en 1850 à faire le phosphore, et après l'introduction du four à arc électrique, en 1890, la production de phosphore élémentaire commuté du chauffage cendre d'os, pour la production d'arc électrique à partir de la roche phosphatée. Après l'épuisement des sources de guano du monde sur le même temps, les phosphates minéraux sont devenus la principale source de production d'engrais phosphatés. La production de phosphate naturel a considérablement augmenté après la Seconde Guerre mondiale, et reste la source primaire mondiale de phosphore et de produits chimiques de phosphore aujourd'hui. Voir l'article sur phosphore pointe pour plus d'informations sur l'histoire et l'état actuel de l'exploitation du phosphate. Phosphate naturel reste une matière première dans l'industrie des engrais, où il est traité avec de l'acide sulfurique pour produire divers " superphosphate "produits d'engrais.
Le phosphore blanc a été fait dans le commerce dans le 19 ème siècle pour le industrie des allumettes. Cette cendre d'os utilisé pour une source de phosphate, tel que décrit ci-dessus. Le processus cendre d'os est devenue obsolète lorsque le arc submergé four pour la production de phosphore a été introduit pour réduire la roche phosphatée. La méthode a permis four électrique pour augmenter la production au point où le phosphore pourraient être utilisées dans des armes de guerre. Dans la Première Guerre mondiale , il a été utilisé dans des engins incendiaires, écrans de fumée et des balles traçantes. Une balle incendiaire spécial a été développé pour tirer sur l'hydrogène -filled Zeppelins plus de la Grande-Bretagne (l'hydrogène est hautement inflammable se il peut être allumé). Pendant la Seconde Guerre mondiale , Cocktails Molotov de benzène et de phosphore ont été distribués en Grande-Bretagne pour les civils spécialement sélectionnés au sein de l'opération de la résistance britannique, pour la défense; et de phosphore des bombes incendiaires ont été utilisés dans la guerre sur une grande échelle. Brûler le phosphore est difficile à éteindre et se il éclabousse la peau humaine, il a des effets horribles.
Les premiers matchs utilisés phosphore blanc dans leur composition, ce qui est dangereux à cause de sa toxicité. Meurtres, les suicides et accidentelles intoxications résultent de son utilisation. (Un conte apocryphe raconte une femme tenté d'assassiner son mari avec du phosphore blanc dans sa nourriture, qui a été détectée par le ragoût de donner de la vapeur lumineuse). En outre, l'exposition aux vapeurs donné travailleurs de match sévère nécrose des os de la mâchoire, l'infâme " phossy mâchoire ". Quand un processus sûr pour la fabrication de phosphore rouge a été découvert, avec son inflammabilité et la toxicité beaucoup plus faible, des lois ont été adoptées, dans le cadre du Convention de Berne (1906), exigeant son adoption comme une alternative sûre pour la fabrication des allumettes. La toxicité du phosphore blanc conduit à l'arrêt de celui-ci utiliser dans les matchs. Dans une coïncidence historique, les Alliés a utilisé du phosphore bombes incendiaires dans la Seconde Guerre mondiale pour détruire Hambourg, l'endroit où le «porteur de lumière miraculeuse" a été découvert.
La lueur, l'explication, et le terme qui en découle
. Il était connu depuis les premiers temps que la lueur verte émanant de phosphore blanc serait persister pendant un temps dans un bocal bouché, mais alors cesser Robert Boyle dans les années 1680 attribuait à «affaiblissement» de l'air; en fait, ce est l'oxygène consommé. Par le 18ème siècle, il était connu que de l'oxygène pur, le phosphore ne se allume pas du tout; il n'y a qu'une gamme de pression partielle à laquelle il le fait. La chaleur peut être appliquée pour amener la réaction à des pressions supérieures.
En 1974, la lueur se explique par RJ van Zee et de l'UA Khan. Une réaction avec de l'oxygène a lieu à la surface du solide (ou liquide) de phosphore, en formant les molécules de courte durée HPO et P 2 O 2 qui émettent de la lumière visible à la fois. La réaction est lente et que très peu des intermédiaires sont nécessaires pour produire la luminescence, d'où le temps prolongé la lueur continue dans un bocal bouché.
Depuis cette époque, phosphores et phosphorescence ont été utilisés pour décrire vaguement substances qui brillent dans le noir sans brûler. Cependant, comme mentionné ci-dessus, même si la phosphorescence terme a été inventé à l'origine comme un terme par analogie avec la lueur de l'oxydation du phosphore élémentaire, est aujourd'hui réservée à un autre procédé fondamentalement différent-re-émission de lumière après l'illumination.
Applications
Fertilisant
L'application de phosphore est dominante dans les engrais, qui fournit phosphate comme nécessaire pour toute vie et est souvent un élément nutritif limitant pour les cultures. Le phosphore, étant un nutriment essentiel pour les plantes, trouve sa principale utilisation comme constituant d' engrais pour l'agriculture et la production agricole sous la forme d'acides phosphoriques concentrés, qui peuvent être constituées de 70% à 75% P 2 O 5. La demande mondiale pour les engrais conduit à forte augmentation phosphate (PO 4 3-) la production dans la seconde moitié du 20e siècle. En raison de la nature essentielle de phosphore pour les organismes vivants, la faible solubilité de composés contenant du phosphore naturelles, et le cycle naturel lente de phosphore, l'industrie agricole est fortement tributaire de l'engrais qui contiennent du phosphate, principalement sous la forme de superphosphate de chaux. Superphosphate de chaux est un mélange de deux sels de phosphate, le dihydrogénophosphate de calcium Ca (H 2 PO 4) 2 et de sulfate de calcium dihydraté CaSO 4 · 2H 2 O produit par la réaction de l'acide sulfurique et de l'eau avec du phosphate de calcium.
| Composés largement utilisés | Utilisation |
|---|---|
| Ca (H 2 PO 4) 2 · H 2 O | Poudre et engrais cuisson |
| CaHPO 4 · 2H 2 O | additif d'aliments pour animaux, poudre dentifrice |
| H 3 PO 4 | Fabrication d'engrais phosphatés |
| PCl3 | Fabrication de POCl3et pesticides |
| POCl3 | plastifiant de fabrication |
| P4S10 | Fabrication d'additifs et pesticides |
| Na5P3O10 | Détergents |
Les composés organophosphorés
Le phosphore blanc est largement utilisé pour fabriquer des composés organophosphorés, par les intermédiaires des chlorures de phosphore et les deux sulfures de phosphore, le pentasulfure de phosphore et de sesquisulfure de phosphore. Les composés organophosphorés ont de nombreuses applications, y compris dans des plastifiants, des retardateurs de flamme, des pesticides, agents d'extraction, et traitement de l'eau. en particulier l'herbicide glyphosate vendus sous le nom de marque Roundup.
Aspects métallurgiques
Le phosphore est également un élément important dans l'acier la production, dans la fabrication de bronze au phosphore, et dans de nombreux autres produits connexes. Le phosphore est ajouté en cuivre métallique au cours de son processus de fusion pour réagir avec l'oxygène présent en tant qu'impureté dans le cuivre et à produire du cuivre (contenant du phosphore ) CuOFP alliages avec une meilleure résistance à la fragilisation par l'hydrogène de cuivre normal.
Allumettes

Matchs phosphore contenus ont été produites la première fois en 1830 et contenaient un mélange de phosphore blanc, un composé libérant de l'oxygène ( le chlorate de potassium, dioxyde de plomb ou un nitrate ) et un liant dans leurs têtes. Ils étaient plutôt sensibles aux conditions de stockage, toxiques et dangereux, car ils pourraient être éclairées par la suppression, sur toute surface rugueuse. Par conséquent, leur production a été progressivement interdit entre 1872 et 1925 dans différents pays. L'international Convention de Berne, adoptée en 1906, interdit l'utilisation de phosphore blanc dans des matchs. En conséquence, les matchs «grève-partout» ont été progressivement remplacés par des «matchs de sécurité» où le phosphore blanc a été remplacé par sesquisulfure de phosphore (P 4 S 3 ), de soufre ou de sulfure d'antimoine. Ces matchs sont difficiles à enflammer sur une surface arbitraire et exigent une bande spéciale. La bande contient du phosphore rouge qui se réchauffe sur frappante, réagit avec le composé libérant de l'oxygène dans la tête et enflamme le matériau inflammable de la tête.
adoucissement de l'eau
Le tripolyphosphate de sodium fabriqué à partir de l'acide phosphorique est utilisé dans les détergents à lessive, dans certains pays, mais interdit pour cet usage dans d'autres. Il est utile pour adoucir l'eau pour améliorer la performance des détergents et de prévenir tuyau / chaudière tube de la corrosion .
applications de niche
- Les phosphates sont utilisés dans la fabrication des particulierslunettesqui sont utilisés pourdes lampes au sodium.
- Cendre d'os,phosphate de calcium, est utilisé dans la production de la porcelaine fine.
- L'acide phosphorique à base de phosphore élémentaire est utilisé dans des applications alimentaires telles que des boissons gazeuses. L'acide est également un point de départ pour faire des phosphates de qualité alimentaire. Ceux-ci comprennent le phosphate de mono-calcium qui est utilisé dans poudre à pâte et le tripolyphosphate de sodium et d'autres phosphates de sodium. Parmi les autres utilisations ceux-ci sont utilisés pour améliorer les caractéristiques de la viande transformée et de fromage. D'autres sont utilisés dans la pâte dentifrice.
- Le phosphore blanc, appelé "WP" (terme d'argot "Willie Peter") est utilisé dans des applications militaires comme des bombes incendiaires, pour fumée dépistage comme pots fumigènes et des bombes fumigènes, et en munitions traçantes. Il est également une partie d'une grenade à main obsolètes phosphore blanc M34 US. Cette grenade polyvalente a été principalement utilisé pour la signalisation, des écrans de fumée et de l'inflammation; il pourrait aussi causer de graves brûlures et a eu un impact psychologique sur l'ennemi. Les utilisations militaires de phosphore blanc sont contraints par le droit international
- Dans l'état de traces, le phosphore est utilisé commedopant poursemi-conducteurs de type n.
- 32P et33P sont utilisés comme traceurs radioactifs dans les laboratoires biochimiques.
- Le phosphate est un fortagent complexant pour le hexavalenturanyle (UO2 2+) des espèces et ceci est la raison pour laquellel'apatite et d'autres phosphates naturels peuvent souvent être très riche enuranium.
- Tributylphosphate est unorganophosphoré soluble dansle kérosène et utilisé pour extraire l'uranium dans leprocédé Purex appliquée dans le retraitement ducombustible nucléaire usé.
Rôle biologique
Phosphore inorganique sous forme de phosphate PO 3-
4 est nécessaire pour toutes les formes connues de la vie , en jouant un rôle majeur dans les molécules biologiques comme l'ADN et l'ARN, où il fait partie de la charpente de ces molécules. Les cellules vivantes utilisent aussi le phosphate de transporter l'énergie cellulaire sous la forme d' adénosine triphosphate (ATP). Presque tous les processus cellulaire qui utilise l'énergie l'obtient sous la forme d'ATP. L'ATP est également important pour la phosphorylation, un événement clé dans la régulation des cellules. Les phospholipides sont les composants structurels principaux de toutes les membranes cellulaires. sels de phosphate de calcium aident à raidir os.
Les cellules vivantes sont définis par une membrane qui le sépare de son environnement. Les membranes biologiques sont fabriqués à partir d'une matrice de protéines et de phospholipides, typiquement sous la forme d'une bicouche. Les phospholipides sont dérivés de glycérol, de telle sorte que deux de l'hydroxyle de la glycérine (OH) protons ont été remplacés par des acides gras comme un ester, et le troisième proton hydroxyle a été remplacé par un autre phosphate lié à l'alcool.
Un patient humain adulte moyen contient environ 0,7 kg de phosphore, environ 85 à 90% de ce qui est présent dans les os et les dents sous la forme d' apatite, et le reste dans les tissus mous et les fluides extracellulaires (~ 1%). La teneur en phosphore augmente d'environ 0,5% en poids dans l'enfance à 0,65 à 1,1% de poids chez les adultes. La concentration moyenne de phosphore dans le sang est d'environ 0,4 g / l, environ 70% de qui est organique et 30% de phosphates inorganiques. Un adulte bien nourri dans le monde industrialisé consomme et excrète environ 1-3 grammes de phosphore par jour, avec une consommation sous la forme de phosphate inorganique et biomolécules contenant du phosphore tels que les acides nucléiques et les phospholipides; et l'excrétion presque exclusivement sous la forme d'ions phosphate tels que H 2 PO -
4 et HPO 2-
4 . Seulement environ 0,1% de phosphate de corps circule dans le sang, et cette quantité reflète la quantité de phosphate disponible pour les cellules des tissus mous.
Os et l'émail des dents
Le composant principal de l'os est de l'hydroxyapatite ainsi que les formes amorphes de phosphate de calcium, y compris éventuellement du carbonate. L'hydroxyapatite est le composant principal de l'émail des dents. fluoration de l'eau améliore la résistance à la pourriture des dents par la conversion partielle de ce minéral pour le matériau encore plus dur appelé fluoroapatite:
- Ca5(PO4)3OH+F-→Ca5(PO4)3F+OH-
La carence en phosphore
En médecine, les syndromes bas-phosphate sont causés par la malnutrition, par l'échec d'absorber le phosphate, et par des syndromes métaboliques qui attirent de phosphate dans le sang (comme la réfection de l'alimentation après la malnutrition) ou passent trop de lui dans l'urine. Elles sont caractérisées par une hypophosphatémie, qui est une condition de faible niveau de taux de phosphate solubles dans le sérum sanguin, et donc à l'intérieur des cellules. Les symptômes de l'hypophosphatémie comprennent musculaire et un dysfonctionnement neurologique, et la perturbation des cellules musculaires et sanguins en raison du manque de l'ATP. Trop de phosphate peut provoquer de la diarrhée et la calcification (durcissement) des organes et des tissus mous, et peut interférer avec la capacité du corps à utiliser le fer, le calcium, le magnésium et le zinc.
Le phosphore est un élément essentiel macromineral pour les plantes, qui est largement étudié dans edaphology afin de comprendre absorption par les plantes à partir du sol systèmes. Dans écologiques termes, le phosphore est souvent un facteur limitant dans de nombreux environnements; à savoir la disponibilité du phosphore régit la vitesse de croissance de nombreux organismes. En écosystèmes un excès de phosphore peut être problématique, notamment dans les systèmes aquatiques, ce qui entraîne l'eutrophisation qui conduisent parfois à la prolifération d'algues.
Précautions
Composés organiques du phosphore forment une grande classe de matériaux, beaucoup sont nécessaires pour la vie, mais certains sont extrêmement toxiques. Fluorophosphate esters sont parmi les plus puissants connus neurotoxines. Une large gamme de composés organophosphorés sont utilisés pour leur toxicité pour certains organismes comme les pesticides ( herbicides, insecticides, fongicides, etc.) et weaponised comme agents neurotoxiques. La plupart des phosphates inorganiques sont des nutriments essentiels et relativement non toxiques.
Le phosphore blanc allotrope présente un danger important, car il brûle dans l'air et produit un résidu d'acide phosphorique. Intoxication au phosphore blanc chronique entraîne une nécrose de la mâchoire appelé « mâchoire de phossy ". L'ingestion de phosphore blanc peut causer une maladie appelée «syndrome Tabouret de fumer".

Lors de l'exposition au phosphore élémentaire, dans le passé, il a été suggéré de laver la zone touchée avec 2% de solution de sulfate de cuivre pour former des composés inoffensifs qui peuvent être emportés. Selon le récent traitement de l'US Navy sur les accidents et les blessures de l'agent chimique conventionnelle chimiques militaire: FM8-285: Partie 2 blessures conventionnel chimiques militaire , "Cupric (cuivre () II) sulfate a été utilisé par le personnel américain dans le passé et est toujours en cours utilisé par certains pays. Cependant, le sulfate de cuivre est toxique et son utilisation sera interrompue. Le sulfate de cuivre peut produire des reins et de la toxicité cérébrale ainsi que l'hémolyse intravasculaire. "
Le manuel suggère plutôt " une solution de bicarbonate pour neutraliser l'acide phosphorique, qui sera ensuite permettre l'enlèvement du phosphore blanc visible. Les particules peuvent souvent être situé par leur émission de fumée lorsque de l'air les frappe, ou par leur phosphorescence dans l'obscurité. Dans un environnement sombre, fragments sont considérés comme des points luminescents. rapidement débrider la brûlure si l'état du patient va permettre l'enlèvement de bits de WP (du phosphore blanc) qui pourrait être absorbée plus tard et éventuellement provoquer un empoisonnement systémique. NE PAS appliquer huileuses à base de pommades avant d'être certain que tous les WP a été retiré. Après l'élimination complète des particules, de traiter les lésions que des brûlures thermiques. " Comme le phosphore blanc se mélange facilement avec des huiles, des substances ou des pommades grasses ne sont pas recommandés jusqu'à ce que la zone est nettoyée à fond et tout le phosphore blanc enlevés.
Liste statut US DEA je
Le phosphore peut réduire élémentaire iode de l'acide iodhydrique, qui est un réactif efficace pour réduire l'éphédrine ou de pseudoéphédrine à la méthamphétamine. Pour cette raison, le phosphore rouge et blanc ont été désignés par les États-Unis Drug Enforcement Administration que la liste I précurseurs chimiques sous 21 CFR 1310,02 vigueur le 17 Novembre, 2001. En conséquence, aux États-Unis, les gestionnaires de phosphore rouges ou blancs sont soumis à de strictes contrôles réglementaires.
