
Ytterbium
Saviez-vous ...
Enfants SOS offrent un chargement complet de la sélection pour les écoles pour une utilisation sur les intranets des écoles. parrainage SOS enfant est cool!
| Ytterbium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
70 Yb | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
blanc argenté  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | ytterbium, Yb, 70 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / ɨ t ɜr b Je ə m / i- TUR -bee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Catégorie Metallic | lanthanides | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 6, fa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 173,054 (5) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 4f 14 6s 2 2, 8, 18, 32, 8, 2 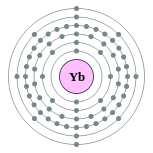 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Jean Charles Galissard de Marignac (1878) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Georges Urbain (1907) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 6,90 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 6,21 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1097 K , 824 ° C, 1515 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 1469 K, 1196 ° C, 2185 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 7,66 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 159 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 26,74 J · mol -1 .K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 3, 2, 1 ( oxyde de base) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | ? 1,1 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 603,4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1174,8 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 2417 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 176 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 187 ± 20 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique à faces centrées  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | ( rt) (β, le poly) 0,250 μΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 38,5 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | ( rt) (β, poly) 26,3 um / (m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 1,590 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | (Sous forme de β) 23,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | (Sous forme de β) 9,9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | (Sous forme de β) 30,5 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | (Sous forme de β) 0,207 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 206 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 343 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-64-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de l'ytterbium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ytterbium est un élément chimique avec le symbole Yb et le numéro atomique 70. Ce est l'élément quatorzième et avant-dernier dans le lanthanide série, ou dernier élément de la f-bloc, qui est la base de la stabilité relative de la 2 état d'oxydation . Cependant, comme les autres lanthanides, état d'oxydation le plus commun est 3, vu dans son oxyde, des halogénures et d'autres composés. En solution aqueuse, comme d'autres composés de lanthanides fin, des composés solubles dans l'ytterbium former des complexes avec neuf molécules d'eau. En raison de sa configuration fermée d'électrons-coquille, ses points de densité et de fusion et d'ébullition diffèrent de celles des autres lanthanides.
En 1878, le chimiste suisse Jean Charles Galissard de Marignac séparé dans la terre "erbia« rare un autre composant indépendant, qu'il a appelé "ytterbium", pour Ytterby, village de Suède près du lieu où il a trouvé la nouvelle composante de l'erbium . Il soupçonne que ytterbia était un composé d'un élément nouveau qu'il a appelé "l'ytterbium" (au total, quatre éléments ont été nommés après le village, les autres étant l'yttrium , le terbium et l'erbium). En 1907, la nouvelle terre "lutecia" a été séparé de ytterbium, à partir de laquelle l'élément "lutécium" (maintenant le lutétium ) a été extrait par Georges Urbain, Carl Auer von Welsbach, et Charles James. Après discussion, le nom "l'ytterbium" de Marignac a été retenu. Un échantillon relativement pur du métal a été obtenue seulement en 1953. À l'heure actuelle, l'ytterbium est principalement utilisé en tant que dopant en acier inoxydable ou support actif laser, et moins souvent en source de rayons gamma.
Ytterbium naturel est un mélange de sept isotopes stables, qui sont tout à fait présent à des concentrations de 3 parties par million. Cet élément est extrait en Chine, aux États-Unis, le Brésil et l'Inde en forme des minéraux monazite, euxenite, et xénotime. La concentration d'ytterbium est faible, parce que l'élément se trouve parmi beaucoup d'autres éléments de terres rares; en outre, il est parmi les moins abondantes. Une fois extrait et préparé, l'ytterbium est un peu dangereux comme un irritant pour les yeux et la peau. Le métal est un risque d'incendie et d'explosion.
Caractéristiques
Propriétés physiques
Ytterbium est un doux, malléable et ductile élément chimique qui affiche un argenté clair lustre lorsqu'il est dans sa forme pure. C'est un élément des terres rares, et il est facilement attaqué et dissous par la forte des acides minéraux. Il réagit lentement avec le froid de l'eau et il oxyde lentement à l'air.
Ytterbium a trois allotropes marqués par les lettres grecques alpha, bêta et gamma; leurs températures de transformation sont -13 ° C et 795 ° C, bien que la température de transformation exacte dépend de la pression et stress. Le allotrope bêta existe à la température ambiante, et il a une cubique à faces centrées la structure cristalline. La forme allotropique gamma à haute température a une corps-centrée structure cristalline cubique. La forme allotropique alpha a une la structure cristalline hexagonale et est stable à basse température. Normalement, le allotrope bêta a une métallique conductivité électrique, mais il devient un semi-conducteur lorsqu'elle est exposée à une pression d'environ 16 000 atmosphères (1,6 GPa). Son électrique résistivité augmente dix fois lors de la compression à 39 000 atmosphères (3,9 GPa), mais tombe à environ 10% de sa résistivité à la température ambiante à environ 40 000 atm (4,0 GPa).
Par contraste avec les autres métaux des terres rares, qui ont habituellement antiferromagnétique et / ou propriétés ferromagnétiques à basses températures , l'ytterbium est paramagnétique à des températures supérieures à 1,0 kelvin . Cependant, la forme allotropique alpha est diamagnétique. Avec un point de fusion de 824 ° C et un point d'ébullition de 1196 ° C, l'ytterbium a la plus petite gamme de liquides de tous les métaux.
Ytterbium a une densité de 6,973 g / cm 3, ce qui est nettement inférieur à celui des voisins les lanthanides, le thulium (9,32 g / cm 3) et le lutétium (9,841 g / cm 3). Les points de fusion et d'ébullition sont également nettement inférieurs à ceux de thulium et le lutétium. Cela est dû à la configuration fermée coquille électronique d'ytterbium ([Xe] 4f 14 6s 2), ce qui entraîne que les deux électrons 6s d'être disponible pour la liaison métallique (à la différence des trois autres lanthanides où des électrons sont disponibles) et de l'ytterbium réduit rayon métallique.
Propriétés chimiques
Métal ytterbium ternit lentement à l'air. Ytterbium finement dispersé oxyde rapidement dans l'air et sous oxygène. Les mélanges de poudre avec de l'ytterbium polytétrafluoroéthylène ou hexachloroéthane brûler avec une flamme de couleur vert émeraude lumineux. Ytterbium réagit avec l'hydrogène pour former divers non-stoechiométrique hydrures. Ytterbium se dissout lentement dans l'eau, mais rapidement dans les acides, libérant de l'hydrogène gazeux.
Ytterbium est assez électropositive, et il réagit lentement avec l'eau froide et assez rapidement avec de l'eau chaude pour former ytterbium (III) hydroxyde:
- Yb 2 (s) + 6 H 2 O (l) → 2 Yb (OH) 3 (aq) + 3 H 2 (g)
Ytterbium réagit avec tous les atomes d'halogène :
- 2 YB (s) + 3 F 2 (g) → 2 YbF 3 (s) [blanc]
- 2 YB (s) + 3 Cl 2 (g) → 2 YbCl 3 (s) [blanc]
- 2 YB (s) + 3 Br 2 (g) → 2 YbBr 3 (s) [blanc]
- 2 YB (s) + 3 I 2 (g) → 2 ybi 3 (s) [blanc]
L'ytterbium (III) ions absorbe la lumière dans la gamme de longueurs d'onde du proche infrarouge, mais pas dans la lumière visible , de sorte que le minéral ytterbium, Yb 2 O 3, est de couleur blanche et les sels de l'ytterbium sont également incolore. Ytterbium dilué dissout facilement dans l'acide sulfurique pour former des solutions qui contiennent les Yb (III) des ions incolores, qui existent comme des complexes nonahydraté:
- 2 YB (s) + 3 H 2 SO 4 (aq) → 2 [YB (H 2 O) 9] 3+ (aq) + 3 SO 2-
4 (aq) + 3 H 2 (g)
YB (II) contre YB (III)
Bien que généralement trivalent, l'ytterbium forme facilement des composés bivalents. Ce comportement est inhabituel pour la plupart des lanthanides , qui forment presque exclusivement composés avec un état d'oxydation de +3. L'état 2 a une valence configuration d'électrons de 4 f f 14, car le -shell entièrement rempli donne une plus grande stabilité. L'ytterbium jaune-vert (II) ion est une très forte agent réducteur et décompose l'eau, libérant l'hydrogène gaz, et donc seulement l'ytterbium incolore (III) ions se produit dans solution aqueuse. samarium et le thulium se comportent de cette façon dans l'état 2, mais l'europium (II) est stable en solution aqueuse. Ytterbium (II) se comporte de manière similaire à l'europium (II) et les métaux alcalino-terreux, en dissolvant dans de l'ammoniac pour former bleue sels electride.
Isotopes
Ytterbium naturel est composé de sept stables isotopes : 168 Yb, 170 Yb, 171 Yb, 172 Yb, 173 Yb, 174 Yb, et 176 Yb, avec 174 Yb étant l'isotope le plus abondant, à 31,8% de la abondance naturelle). 27 des radio-isotopes ont été observées, avec les plus stables étant 169 Yb avec une demi-vie de 32,0 jours, 175 Yb avec une demi-vie de 4,18 jours et 166 Yb avec une demi-vie de 56,7 heures. Tout le reste de ses isotopes radioactifs ont des demi-vies qui sont moins de deux heures et la plupart d'entre eux ont des demi-vies sont à moins de 20 minutes. Ytterbium a également 12 États méta, avec l'être le plus stable 169m YB (t ½ 46 secondes).
Les isotopes de gamme de l'ytterbium dans poids atomique de 147.9674 unité de masse atomique (u) pour 148 Yb à 180,9562 U pour 181 Yb. Le primaire mode d'ytterbium de désintégration des isotopes plus léger que l'isotope stable le plus abondant, 174 Yb, est capture d'électrons, et le mode de désintégration primaire pour ceux plus lourd que 174 Yb est désintégration bêta. Le primaire produits de désintégration des isotopes plus légers que l'ytterbium Yb 174 est thulium isotopes, et les produits de désintégration d'isotopes primaires avec d'ytterbium Yb plus lourd que 174 sont lutétium isotopes.
Occurrence

Ytterbium se trouve avec d'autres éléments de terres rares rares dans plusieurs minéraux . Il est le plus souvent retrouvé dans le commerce auprès le sable monazite (0,03% d'ytterbium). L'élément se trouve aussi dans euxénite et xénotime. Les principales zones minières sont la Chine , le Royaume-Unis , le Brésil , l'Inde , le Sri Lanka et l'Australie ; et les réserves de l'ytterbium sont estimés à un million tonnes. Ytterbium est normalement difficile de séparer d'autres terres rares, mais échange d'ions et techniques d'extraction par solvant développées dans le milieu et la fin du 20e siècle ont simplifié séparation. Connus des composés de l'ytterbium sont rares et ne ont pas encore été bien caractérisés. L'abondance de l'ytterbium dans la croûte de la Terre est d'environ 3 mg / kg.
En tant que lanthanide de numéro pair, conformément à la Oddo règle-Harkins, l'ytterbium est nettement plus abondante que ses voisins immédiats, le thulium et le lutécium , qui se produisent dans la même concentré à des niveaux d'environ 0,5% chacun. La production mondiale de l'ytterbium est seulement d'environ 50 tonnes par an, reflétant le fait que l'ytterbium a quelques applications commerciales. Traces microscopiques d'ytterbium sont utilisés en tant que dopant dans la Yb: YAG, un laser à l'état solide dans lequel l'ytterbium est l'élément qui subit émission stimulée de rayonnement électromagnétique .
Production
Il est quelque peu difficile de l'ytterbium séparé des autres lanthanides raison de ses propriétés similaires. En conséquence, le processus est un peu longue. Premières, des minéraux tels que monazite ou xénotime sont dissous dans divers acides, tels que l'acide sulfurique . Ytterbium peut alors être séparé des autres lanthanides par échange d'ions, comme d'autres lanthanides. La solution est ensuite appliquée à un résine, qui différentes lanthanides liaison à différents en matière. Ce est alors dissous l'aide des agents complexants, et en raison des différents types de liaison présentée par les lanthanides différents, il est possible d'isoler les composés.
Ytterbium est séparé des autres terres rares, soit par l'échange d'ions ou par réduction avec un amalgame de sodium. Dans ce dernier procédé, une solution acide tamponnée de terres rares trivalentes est traitée avec un alliage en fusion sodium-mercure, ce qui réduit dissout et Yb 3+. L'alliage est traité avec de l'acide chlorhydrique. Le métal est extrait de la solution sous forme d'oxalate et converti en oxyde par chauffage. L'oxyde est réduit en métal par chauffage avec le lanthane , l'aluminium , le cérium ou le zirconium dans un vide poussé. Le métal est purifié par sublimation et recueillies sur une plaque condensée.
Composés

Le comportement de l'ytterbium chimique est similaire à celle du reste des lanthanides . La plupart des composés d'ytterbium se trouvent dans l'état d'oxydation +3 et de ses sels dans cet état d'oxydation sont presque incolore. Comme l'europium , le samarium et le thulium , de l'ytterbium les trihalogénures peuvent être réduits par l'hydrogène , zinc de la poussière, ou par l'addition d'ytterbium pour les dihalogénures métalliques. L'état d'oxydation +2 ne se produit que dans des composés solides et réagit à certains égards, est similaire aux métaux alcalino-terreux des composés; par exemple, l'ytterbium (II) oxyde (Ybo) montre la même structure que l'oxyde de calcium (CaO).
Halogénures

les deux formes d'Ytterbium des dihalogénures et des trihalogénures avec les atomes d'halogène fluor , chlore , brome et iode . Les dihalogénures sont sensibles à l'oxydation pour les trihalogénures à la température ambiante et hors de proportion avec les trihalogénures et ytterbium métallique à haute température:
Certains halogénures d'ytterbium sont utilisés comme réactifs dans synthèse organique. Par exemple, ytterbium (III) chlorure (YbCl 3) est un Et un acide de Lewis peut être utilisé en tant que catalyseur dans l' aldol et Réactions de Diels-Alder. Ytterbium (II) d'iodure (YBI 2) peut être utilisé, comme samarium (II) de l'iodure, en tant que agent réducteur pour réactions de couplage. Ytterbium (III) fluorure (YbF 3) est utilisé comme inerte et non toxique le remplissage de la dent, car elle libère en continu ions fluorures, ce qui est bon pour la santé dentaire, et est également un bon Des rayons X de l'agent de contraste.
Oxydes
Ytterbium réagit avec l'oxygène pour former ytterbium (III) oxyde (Yb 2 O 3), qui cristallise dans la structure "de terres rares de type C sesquioxyde» qui est lié à la la structure fluorite avec un quart des anions enlevés, conduisant à des atomes d'ytterbium dans deux six coordonner différents environnements (non-octaédriques). Ytterbium (III) de l'oxyde peut être réduite à ytterbium (II) oxyde (Ybo) avec ytterbium élémentaire, qui cristallise dans la même structure que le chlorure de sodium .
Histoire

Ytterbium était découvert par le chimiste suisse Jean Charles Galissard de Marignac en l'année 1878. Alors que l'examen d'échantillons de gadolinite, Marignac a trouvé un nouveau composant dans la terre alors connu comme erbium, et il l'a nommé ytterbium, pour Ytterby, le Suédois village proche où il a trouvé la nouvelle composante de l'erbium. Marignac soupçonne que ytterbia était un composé d'un élément nouveau qu'il a appelé "l'ytterbium".
En 1907, le chimiste français Georges Urbain séparait la ytterbia de Marignac en deux composantes: neoytterbia et lutecia. Neoytterbia deviendra plus tard connu comme l'élément d'ytterbium, et lutecia serait connu plus tard comme l'élément le lutécium . Le chimiste autrichien Carl Auer von Welsbach indépendamment isolé ces éléments de ytterbia à peu près au même moment, mais il les appelait aldebaranium et cassiopeium; le chimiste américain Charles James a également indépendamment isolé ces éléments à peu près au même moment. Urbain et Welsbach accusent mutuellement de la publication des résultats sur la base de l'autre partie. La Commission sur la masse atomique, composé de Frank Wigglesworth Clarke, Wilhelm Ostwald, et Georges Urbain, qui était alors responsable de l'attribution de nouveaux noms d'éléments, a réglé le différend en 1909 en accordant la priorité à Urbain et l'adoption de ses noms comme ceux officielles, basées sur le fait que la séparation des lutécium de la ytterbium de Marignac était d'abord décrit par Urbain; après les noms de Urbain ont été reconnus, neoytterbium a été revenue à l'ytterbium.
Les propriétés chimiques et physiques de l'ytterbium n'a pu être déterminée avec précision jusqu'en 1953, lorsque le premier ytterbium métal presque pur a été produit à l'aide processus d'échange d'ions. Le prix de l'ytterbium a été relativement stable entre 1953 et 1998 à environ US $ 1,000 / kg.
Applications
Dopage de l'acier inoxydable
Ytterbium peut également être utilisé en tant que dopant pour aider à améliorer l'affinage du grain, de la force, et d'autres propriétés mécaniques des acier inoxydable. Certains ytterbium alliages ont rarement été utilisé dans dentisterie.
Autres
Métal ytterbium augmente sa résistivité électrique lorsqu'il est soumis à de fortes contraintes. Cette propriété est utilisée dans des jauges de contraintes pour surveiller déformations du sol des tremblements de terre et des explosions.
Les ondes lumineuses vibrent plus vite que les micro-ondes, et donc horloges optiques peuvent être plus précis que césium horloges atomiques. Le Physikalisch-Technische Bundesanstalt (PTB) travaille sur plusieurs de ces horloges optiques. Le modèle avec un ion d'ytterbium unique pris dans un piège à ions est très précis. L'horloge optique basé sur il est exact de 17 chiffres après la virgule.
Actuellement, l'ytterbium est à l'étude comme un remplacement possible pour le magnésium en haute densité charges pyrotechniques pour cinématique fusées-leurres infrarouges. Comme ytterbium (III) a un oxyde significativement plus élevés émissivité dans l'infrarouge que l'oxyde de magnésium, une intensité de rayonnement plus élevée est obtenue avec des charges à base d'ytterbium par rapport à ceux qui sont couramment basé sur magnésium / téflon / viton (MTV).
Précautions
Bien ytterbium est assez stable chimiquement, il est stocké dans des récipients étanches à l'air et dans une atmosphère inerte telle qu'une boîte sèche remplie d'azote pour protéger le métal de l'air et de l'humidité. Tous les composés de l'ytterbium sont traités comme hautement toxique, bien que des études initiales semblent indiquer que le danger est minime. composés ytterbium sont, cependant, connus pour provoquer une irritation de la peau humaine et les yeux, et certains pourraient être tératogène. La poussière d'ytterbium métallique peut se enflammer spontanément, et les fumées résultant sont dangereux. feux de Ytterbium ne peuvent pas être éteint avec de l'eau, et seulement un produit chimique sec classe D extincteurs peuvent éteindre les incendies.
