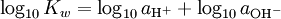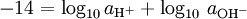pH
Renseignements généraux
SOS Enfants a fait cette sélection Wikipedia aux côtés d'autres écoles des ressources . Avant de vous décider à propos de parrainer un enfant, pourquoi ne pas en apprendre davantage sur différents organismes de parrainage premier ?
| Acides et Bases |
|---|
| Constante de dissociation acide Extraction acide-base Réaction acide-base Titrage acide-base Constante de dissociation fonction d'acidité solutions tampons pH Proton affinité Autoprotolyse Force de l'acide |
| Acide types |
| Brønsted · Lewis · Minéral Organic · Fort Superacides · Faible |
| Les types de base |
| Brønsted · Lewis · Organique Forte · Superbases Non nucléophile · Faible |
Le pH est une mesure de l'acidité ou l'alcalinité d'une solution. Des solutions aqueuses à 25 ° C avec un pH inférieur à sept sont considérés comme acide, tandis que ceux ayant un pH supérieur à sept sont considérés basique (alcalin). Quand un niveau de pH est de 7,0, elle est définie comme "neutre" à 25 ° C, car à ce pH de la concentration H 3 O + est égale à la concentration de OH - dans de l'eau pure. Le pH est formellement dépend de la activité de hydronium ions (H 3 O +), mais pour des solutions très diluées, les molarité de H 3 O + peut être utilisée comme un substitut avec peu de perte de précision. (H + est souvent utilisé comme synonyme de H 3 O +.) Parce que le pH est dépendante de l'activité ionique, une propriété qui ne peut être facilement mesurée ou totalement prédit théoriquement, il est difficile de déterminer une valeur précise pour le pH d'une solution . La lecture de pH d'une solution est généralement obtenue en comparant solutions inconnues à ceux de pH connu, et il ya plusieurs façons de le faire.
Le concept de pH a été introduite par Danois chimiste SPL Sørensen au Carlsberg Laboratoire en 1909 . Le nom pH a été prétendu avoir provenir d'une des plusieurs sources, y compris: pondus hydrogenii, potentia hydrogenii ( latine ), potentiel hydrogène ( français ), et le potentiel de l'hydrogène ( en anglais ).
Définition
pH est défini dans la norme internationale ISO 31-8: opérationnellement comme suit. Pour une solution X, d'abord mesurer la force électromotrice E X de la Pile galvanique
où
- F est la Constante de Faraday;
- R est le constante molaire des gaz;
- T est la température thermodynamique .
Défini de cette façon, le pH est un grandeur sans dimension. Valeurs pH (S) pour une gamme de solutions standard S, avec de plus amples détails sont donnés dans le pertinentes Recommandation IUPAC.
pH n'a pas de signification fondamentale comme un tout; sa définition officielle est d'ordre pratique. Cependant dans la gamme restreinte de diluée des solutions aqueuses ayant une concentration de quantité de substance dissoute, à moins de 0,1 mol / L, et ne étant ni fortement ni alcalin fortement acide (2 <pH <12), la définition est telle que
où [H +] représente la concentration en ion hydrogène H + en quantité de substance et γ 1 désigne la coefficient d'activité d'un typique univalent électrolyte dans la solution.
Explication
En termes plus simples, le nombre résulte d'une mesure de la l'activité de l'hydrogène ions (ou leur équivalent) dans la solution. L'échelle de pH est l'inverse logarithmique représentation de protons d'hydrogène ( H +) concentration. Contrairement à échelles linéaires, qui ont une relation constante entre la pièce à mesurer (concentration en H + dans ce cas) et la valeur rapportée, chaque unité de pH individu est un facteur de 10 différente de la prochaine unité supérieure ou inférieure. Par exemple, un changement de pH entre 2 et 3 représente une diminution de 10 fois de la concentration en H +, et un décalage de 2 à 4 représente une cent (10 x 10) -fois la diminution de concentration en H +. La formule pour calculer le pH est:
Où α H + désigne l'activité d'ions H +, et sans dimension. Dans des solutions contenant d'autres ions, concentration et l'activité ne sera pas généralement les mêmes. L'activité est une mesure de la concentration efficace des ions hydrogène, au lieu de la concentration réelle; il comprend le fait que d'autres ions entourant ions hydrogène seront les protéger et affecter leur capacité à participer à des réactions chimiques. Ces autres ions changent la quantité efficace de la concentration en ions hydrogène dans ne importe quel processus qui comprend H +.
Dans les solutions diluées (tels que eau du robinet), l'activité est approximativement égale à la valeur numérique de la concentration de l'ion H +, noté [H +] (ou plus exactement écrite [ H 3 O +]), mesurée dans moles par litre (également connu sous le nom molarité). Par conséquent, il est souvent commode de définir le pH en tant que:
Pour les deux définitions, log 10 désigne la base 10 logarithme donc définit un pH échelle logarithmique de l'acidité. Par exemple, si l'on fait une limonade avec un H + concentration de 0,0050 moles par litre, son pH serait:
Une solution de pH = 8,2 aura une concentration [H +] de 10 -8,2 mole / L, ou d'environ 6,31 x 10 -9 mol / L. Ainsi, son activité d'hydrogène H + α est d'environ 6,31 × 10 -9. Une solution ayant une concentration [H +] de 4,5 x 10 -4 mol / L aura une valeur de pH de 3,35.
En solution à 25 ° C, un pH de 7 indique la neutralité (ce est à dire le pH de l'eau pure), car l'eau se dissocie naturellement en H + et OH - ions avec des concentrations égales de 1 × 10 -7 mole / L. Une valeur de pH inférieur (par exemple un pH de 3) indique la force croissante de l'acidité, et une valeur de pH plus élevé (par exemple pH 11) indique en augmentant la force de la basicité. Notez, cependant, que l'eau pure, lorsqu'il est exposé à l'atmosphère, aura en dioxyde de carbone , dont certains réagit avec l'eau pour former et l'acide carbonique H +, abaissant ainsi le pH à environ 5,7.
PH neutre à 25 ° C ne est pas exactement 7. pH est une valeur expérimentale, il a donc une erreur associée. Depuis la constante de dissociation de l'eau est (1,011 ± 0,005) × 10 -14, pH de l'eau à 25 ° C serait 6,998 ± 0,001. La valeur est constante, cependant, avec un pH neutre étant 7,00 à deux chiffres significatifs, ce qui est assez près pour la plupart des gens de supposer que ce est exactement 7. Le pH de l'eau devient plus petit avec des températures plus élevées. Par exemple, à 50 ° C, le pH de l'eau est 6,55 ± 0,01. Cela signifie qu'une solution diluée est neutre à 50 ° C lorsque son pH est d'environ 6,55 et un pH qui est de 7,00 de base.
La plupart des substances présentent un pH dans la gamme de 0 à 14, bien que extrêmement acide ou extrêmement substances de base peuvent avoir un pH inférieur à 0 ou supérieur à 14. Un exemple est le ruissellement minier acide, avec un pH = -3,6. A noter que cela ne se traduit pas à une concentration molaire de 3,981 M; ces valeurs de haute activité sont le résultat de la valeur extrêmement élevée du coefficient d'activité alors que les concentrations sont dans une fourchette «raisonnable». Par exemple, un 7,622 molaire H 2 SO 4 solution a un pH = -3,13, l'activité d'hydrogène H + α autour de 1350 et activité coefficient γ H + = 165,4 en utilisant la convention de mise à l'échelle MacInnes Pitzer coefficient d'activité unique d'ions.
Arbitrairement, le pH est ![- \ Log_ {10} {([\ mbox {} ^ H +])}](../../images/122/12253.png) . En conséquence,
. En conséquence,
ou, par substitution,
 .
.
Le "pH" de toute autre matière peut également être trouvée (par exemple, le potentiel des ions argent, ou pAg +) en dérivant une équation similaire en utilisant le même processus. Ces autres équations pour les potentiels ne sont pas les mêmes, cependant, que le nombre de moles d'électrons transférés (n) sera différente pour les différentes réactions.
Calcul du pH pour les acides faibles et forts
Les valeurs de pH acides forts et faibles peuvent être estimés à l'aide de certaines théories et hypothèses.
En vertu de la théorie de Brønsted-Lowry , acides forts ou plus faibles sont un concept relatif. Mais ici, nous définissons un acide fort comme une espèce qui est un acide beaucoup plus forte que l'hydronium (H 3 O +) ionique. Dans ce cas, la réaction de dissociation (strictement HX + H 2 O + O↔H 3 + X -, mais simplifié comme HX↔H + + X -) parvient à son terme, ce est à dire pas d'acide ne ayant pas réagi reste en solution. Dissolvant l'acide fort HCl dans l'eau peut donc être exprimée:
- HCl (aq) → H + + Cl -
Cela signifie que dans un / L solution à 0,01 mole de HCl, il est approximée qu'il existe une concentration d'ions hydrogène / L dissous 0,01 mole. De ce qui précède, le pH est de: pH = -log 10 [H +]:
- pH = -log (0,01)
qui est égal à 2.
Pour les acides faibles, la réaction de dissociation ne va pas à son terme. Un équilibre est atteint entre les ions hydrogène et le conjugué de base. Ce qui suit montre la réaction d'équilibre entre l'acide formique et de ses ions:
- HCOOH (aq) ⇌ H + HCOO + -
Il est nécessaire de connaître la valeur de la la constante d'équilibre de la réaction pour chaque acide afin de calculer son pH. Dans le contexte de pH, ce est appelé le constante d'acidité de l'acide, mais est travaillé de la même manière (voir l'équilibre chimique ):
- K a = [ions hydrogène] [ions d'acide] / [acide]
Pour HCOOH, K a = 1,6 × 10 -4
Lors du calcul du pH d'un acide faible, il est généralement supposé que l'eau ne contient pas d'ions d'hydrogène. Cela simplifie le calcul, et de la concentration fournie par l'eau, 1 x 10 -7 mol / L, est généralement insignifiante.
Avec un / L solution à 0,1 mole d'acide formique (HCOOH), la constante d'acidité est égale à:
- K a = [H +] [HCOO -] / [HCOOH]
Étant donné qu'une quantité inconnue de l'acide a dissocié, [HCOOH] sera réduit de ce montant, tandis que [H +] et [HCOO -] sera porté par ce montant. Par conséquent, [HCOOH] peut être remplacé par 0,1 - x, et [H +] et [HCOO -] peuvent chacun être remplacé par x, nous donnant l'équation suivante:
La résolution de cette donne pour x 3,9 x 10 ~ 3, qui est la concentration d'ions hydrogène après dissociation. Par conséquent, le pH est -log (3,9 × 10 -3), soit environ 2,4.
Mesures
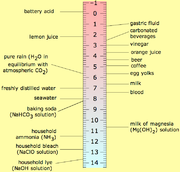
| Substance | pH |
|---|---|
| L'acide chlorhydrique , 10M | |
| La batterie plomb-acide | |
| L'acide gastrique | |
| Jus de citron | |
| Cola | |
| Vinaigre | |
| Orange ou de pomme de jus | |
| Jus De Tomate | |
| Bière | |
| Pluie Acide | |
| Café | |
| Thé ou en bonne santé peau | |
| Urine | |
| Lait | |
| Eau Pure | |
| Santé humaine salive | |
| Sang | |
| L'eau de mer | |
| Savon pour les mains | |
| ammoniac des ménages | |
| Javellisant | |
| lessive de ménages |
pH peut être mesuré:
- par addition d'un indicateur de pH dans la solution étudiée. La couleur de l'indicateur varie en fonction du pH de la solution. L'utilisation d'indicateurs, des déterminations qualitatives peuvent être faites avec indicateurs universels qui ont une grande variabilité de la couleur sur une large gamme de pH et de déterminations quantitatives peuvent être faites en utilisant des indicateurs qui ont une forte variabilité de la couleur sur une petite plage de pH. Des mesures précises peuvent être effectués sur une large gamme de pH en utilisant des indicateurs qui ont de multiples équilibres en conjonction avec méthodes spectrophotométriques afin de déterminer l'abondance relative de chaque composant dépendant du pH qui composent la couleur de la solution, ou
- en utilisant un pH-mètre avec des électrodes de pH sélectif ( électrode de pH, l'électrode d'hydrogène, quinhydrone électrode, transistor ion domaine sensible de l'effet et d'autres).
- en utilisant du papier pH, papier indicateur qui change de couleur correspondant à un pH sur une touche de couleur. papier pH est habituellement de petites bandes de papier (ou un ruban continu qui peut être déchiré) qui a été trempée dans une solution d'indicateur, et est utilisé pour des approximations.
Les extrémités inférieure et supérieure de l'échelle de pH ne se oxydent pas. Le milieu de l'échelle est ce qui se oxyde, comme l'eau et le sang.
Comme l'échelle du pH est logarithmique, il ne commence pas à zéro. Ainsi les plus acides de liquides rencontrés peuvent avoir un pH aussi bas que -5. Le plus alcaline a typiquement pH de 14. Mesure de valeurs extrêmement faibles de pH a diverses complications. Etalonnage de l'électrode dans de tels cas peut être fait avec des solutions standard d'acide sulfurique concentré dont les valeurs pH peut être calculée avec le modèle de Pitzer.
A titre d'exemple d'application d'origine, la mesure de la valeur du pH peut être utilisé pour quantifier la quantité d'acide dans une piscine.
pOH
Il est également pOH, dans un sens à l'opposé de pH, qui mesure la concentration des ions OH -, ou le basicité. Etant donné que l'eau libre se ionise et notation de [OH -] lorsque la concentration de l'hydroxyde ions, nous avons
 (*)
(*)
où K w est la constante d'ionisation de l'eau.
Maintenant, étant donné que
par identités logarithmiques, nous avons alors la relation:
et ainsi
Cette formule est valable pour la température exactement = 298,15 K (25 ° C) seulement, mais est acceptable pour la plupart des calculs de laboratoire.
Indicateurs
Une indicateur est utilisé pour mesurer le pH d'une substance. Les indicateurs communs sont papier de tournesol, la phénolphtaléine, l'orange de méthyle, rouge de phénol, le bleu de bromothymol, vert de bromocrésol et pourpre de bromocrésol. Pour démontrer le principe avec des matériaux communs de ménage, chou rouge, qui contient le colorant anthocyanes, est utilisé.
L'eau de mer
En mesure du pH océanographie chimique est compliquée par le les propriétés chimiques de l'eau de mer , et plusieurs échelles de pH distinctes existent.
Dans le cadre de son définition opérationnelle de l'échelle de pH, le IUPAC définir une série de des solutions de tampon à travers une gamme de valeurs de pH (souvent désignées par NBS ou Désignation NIST). Ces solutions ont une relativement faible force ionique (~ 0,1) par rapport à celle de l'eau de mer (~ 0,7), et par conséquent ne sont pas recommandés pour une utilisation dans la caractérisation du pH de l'eau de mer (car les différences de force ionique provoquent des changements dans le potentiel de l'électrode). Pour résoudre ce problème, une alternative série de tampons basée sur eau de mer artificielle a été développé. Cette nouvelle série résout le problème des différences de force ionique entre les échantillons et les tampons, et la nouvelle échelle de pH est appelé l'échelle totale, souvent désigné comme pH T.
L'échelle totale a été définie en utilisant un milieu contenant sulfate ions. Ces ions subissent protonation, H + + SO 4 2- ⇌ HSO 4 -, de telle sorte que la dimension totale comprend l'effet des deux protons (ions hydrogène "libres") et des ions sulfate d'hydrogène:
- [H +] T = [H +] F + [HSO 4 -]
Une autre échelle, l'échelle libre, souvent désigné pH F, omet cette considération et se concentre uniquement sur [H +] F, en principe ce qui en fait une représentation simple de la concentration d'ions d'hydrogène. Analytiquement, que [H +] T peut être déterminée, de sorte [H +] F doit être estimée en utilisant le [SO 4 2-] et la constante de stabilité de HSO 4 -, K S *:
- [H +] F = [H +] T - [HSO 4 -] = [H +] T (+ 1 [SO 4 2-] / K S *) -1
Cependant, il est difficile d'estimer K S * dans l'eau de mer, ce qui limite l'utilité de l'échelle libre autrement plus simple.
Un autre échelle, connu sous le nom d'eau de mer échelle, souvent désigné SWS du pH, tient compte d'une relation de protonation supplémentaire entre les ions d'hydrogène et ions fluorure, H + F + - ⇌ HF. Résultant en l'expression suivante pour SWS [H +]:
- [H +] SWS = [H +] F + [HSO 4 -] + [HF]
Cependant, l'avantage de tenir compte de cette complexité supplémentaire dépend de l'abondance de fluorure dans le milieu. Dans l'eau de mer, par exemple, des ions sulfate se produisent à des concentrations beaucoup plus importantes (> 400 fois) que ceux de fluorure. Par conséquent, à des fins plus pratiques, la différence entre les échelles totales et l'eau de mer est très faible.
Les trois équations suivantes résument les trois échelles de pH:
- pH F = - log [H +] F
- pH T = - log ([H +] F + [HSO 4 -]) = - log [H +] T
- pH SWS = - log ([H +] F + [HSO 4 -] + [HF]) = - log SWS [H +]
En termes pratiques, les trois échelles de pH eau de mer diffèrent dans leurs valeurs jusqu'à 0,12 unités de pH, les différences qui sont beaucoup plus grande que la précision des mesures de pH généralement requis (en particulier par rapport à l'océan de système carbonate). Comme il omet de considérer d'ions sulfate et fluorure, l'échelle libre est significativement différente de la fois les échelles totales et eau de mer. En raison de la faible importance relative de l'ion fluorure, les échelles totales et l'eau de mer ne diffèrent que très légèrement.
Les fluides corporels
| Fluide | pH |
|---|---|
| acide gastrique | 0,7 |
| lysosome | 5.5 |
| Granulé cellulaire chromaffine | 5.5 |
| H 2 O Neutre à 37 ° C | 6,81 |
| cytosol | 7.2 |
| CSF | 7.3 |
| artériel le plasma sanguin | 7.4 |
| matrice mitochondriale | 7,5 |
| sécrétions exocrines du pancréas | 8.1 |
Le pH différent les fluides corporels et varie avec la fonction d'autres facteurs. Généralement, il est un système étroitement régulé pour maintenir la homéostasie acido-basique.

![\ Text {pH} = - \ log_ {10} \ left [\ frac {\ gamma_1 [\ text {} ^ H +])} {\ text {1 mol L} ^ {- 1}} \ right] \ h 0,02](../../images/122/12238.png)

![\ Mbox {pH} \ approx - \ log_ {10} {\ frac {[\ mathrm {^ H +}]} {1 ~ \ mathrm {mol / L}}}](../../images/122/12251.png)
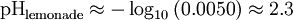
![\ Mbox {pH} = - \ log_ {10} {[{\ mbox {} ^ H +}]}](../../images/122/12254.png)