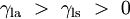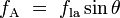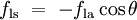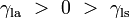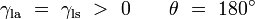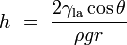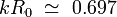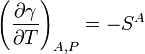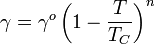La tension de surface
Renseignements généraux
Cette sélection écoles a été choisi par SOS Enfants pour les écoles dans le monde en développement ne ont pas accès à Internet. Il est disponible en téléchargement intranet. SOS Enfants a regardé des enfants en Afrique depuis quarante ans. Pouvez-vous aider dans leur travail en Afrique ?
| Mécanique des milieux continus |
|---|
 |
Lois
|
Mécanique des solides
|
|
Rhéologie
|
La tension superficielle est une propriété de la surface d'un liquide qui l'amène à se comporter comme un feuille élastique. Il permet insectes , tels que la araignée d'eau (étang de patineur, Royaume-Uni ), de marcher sur l'eau . Il permet de petits objets, même métalliques, tels que des aiguilles, des lames de rasoir, ou des fragments de feuilles, de flotter à la surface de l'eau, et elle est la cause de l'action capillaire.
Le comportement physique et chimique des liquides ne peut être comprise sans prendre la tension de surface en compte. Elle régit la forme que de petites masses de liquide peuvent assumer et le degré de contact d'un liquide peut faire avec une autre substance.
Application de la physique newtonienne aux forces qui se posent en raison de la tension de surface prédit avec précision de nombreux comportements liquides, qui sont tellement banal que la plupart des gens prennent pour acquis. Application de la thermodynamique à ces mêmes forces prédit en outre d'autres comportements liquides plus subtiles.
Cause

La tension de surface est provoquée par l'attraction entre les molécules du liquide par diverses des forces intermoléculaires. Dans la majeure partie du liquide est tiré chaque molécule dans toutes les directions par les molécules liquides voisine, résultant en une force nette de zéro. A la surface du liquide, les molécules sont tirés vers l'intérieur par d'autres molécules plus profondes à l'intérieur du liquide et ne sont pas attirés par le plus intensément les molécules dans le milieu voisin (que ce soit sous vide, de l'air ou un autre liquide). Par conséquent, la totalité des molécules à la surface sont soumises à une force vers l'intérieur de l'attraction moléculaire qui peuvent être en équilibre que par la résistance du liquide de compression. Cette traction vers l'intérieur tend à diminuer l'aire de surface, et à cet égard une surface liquide ressemble à une membrane élastique étiré. Ainsi, le liquide lui-même comprime ensemble jusqu'à ce qu'il a le plus bas Superficie localement possible de surface.
Une autre façon de voir cela est que la molécule en contact avec un voisin est dans un état d'énergie plus faible que si elle ne était pas en contact avec un voisin. Les molécules d'intérieur ont tous comme de nombreux voisins, car ils peuvent avoir. Mais les molécules limites ont moins de voisins que de molécules intérieures et sont donc dans un état d'énergie supérieure. Pour minimiser le liquide à son état d'énergie, il faut minimiser le nombre de molécules limites et doit donc minimiser sa surface.
À la suite de surface minimisation, une surface assumera la forme lisse, il peut (preuve mathématique que les formes "lisses" minimiser surface repose sur l'utilisation de la Euler-Lagrange équation). Depuis toute courbure dans les résultats de forme de surface de grande région, une énergie plus élevée entraînera également. En conséquence, la surface sera repousser contre toute courbure dans la même manière comme une boule poussée en montée va repousser à minimiser son énergie potentielle gravitationnelle.
Effets de la vie quotidienne
 |  chute d'eau du robinet |
Quelques exemples des effets de la tension de surface vu l'eau ordinaire:
- Perles d'eau de pluie sur la surface d'une automobile ciré. Eau adhère faiblement à la cire et fortement à lui-même, de sorte clusters d'eau en gouttes. La tension de surface leur donne leur forme quasi-sphérique, parce que une sphère a la plus petite surface possible par rapport au volume.
- Formation de gouttes se produit quand une masse de liquide est étirée. L'animation montre adhérente de l'eau à la masse du robinet gagner ce qu'il soit tendu à un point où la tension de surface ne peuvent plus se lient au robinet. On sépare alors la tension de surface et la chute en forme d'une sphère. Si un courant d'eau ont été en cours d'exécution du robinet, le flux se briserait en gouttes lors de sa chute. Gravity étend le flux, puis la tension superficielle pince en sphères.
- Flottaison des objets plus denses que l'eau se produit lorsque l'objet est non mouillable et son poids est assez petit pour être né par les forces résultant de la tension de surface.
- La séparation de l'huile et de l'eau est provoquée par une tension dans la surface entre les liquides dissemblables. Ce type de tension de surface va par le nom «tension d'interface», mais ses physique sont les mêmes.
- Larmes de vin est la formation de gouttes et des ruisseaux sur le côté d'un verre contenant une boisson alcoolisée. Sa cause est une interaction complexe entre les tensions de surface différentes de l'eau et de l'éthanol .
La tension de surface est visible dans d'autres phénomènes commune, surtout quand certaines substances, tensioactifs, sont utilisés pour diminuer:
- Les bulles de savon ont de très grandes surfaces avec très peu en vrac. Bulles dans l'eau pure sont instables. L'utilisation d'agents tensio-actifs, bien que, indroducir un effet de stabilisation à bulle (voir Effet Marangoni). Notez que les agents tensio-actifs réduisent effectivement la tension superficielle de l'eau par un facteur de trois ou plus.
- Les emulsions sont d'un type de solution dans laquelle la tension de surface joue un rôle. De minuscules fragments d'huile en suspension dans l'eau pure spontanément se assembler en beaucoup plus grandes masses. Mais la présence d'un agent tensio-actif fournit une diminution de la tension superficielle, ce qui permet la stabilité de gouttelettes d'huile minutes dans la masse d'eau (ou vice versa).
La physique de base
Deux définitions
 , Appuie sur la surface, et qui est équilibrée par les forces de tension de surface de chaque côté,
, Appuie sur la surface, et qui est équilibrée par les forces de tension de surface de chaque côté,  , Qui sont chacune parallèle à la surface de l'eau au niveau des points où elle contacte l'aiguille. Notez que les composantes horizontales des deux
, Qui sont chacune parallèle à la surface de l'eau au niveau des points où elle contacte l'aiguille. Notez que les composantes horizontales des deux  flèches pointent dans des directions opposées, de sorte qu'ils se annulent l'un l'autre, mais les composantes verticales pointent dans la même direction et donc ajouter jusqu'à équilibrer
flèches pointent dans des directions opposées, de sorte qu'ils se annulent l'un l'autre, mais les composantes verticales pointent dans la même direction et donc ajouter jusqu'à équilibrer  .
. La tension de surface, représentée par le symbole σ, γ ou T, est définie comme la force le long d'une ligne de longueur unitaire, où la force est parallèle à la surface, mais perpendiculaire à la ligne. Une façon de cette image est d'imaginer un film de savon plat délimitée d'un côté par un fil tendu de la longueur, L. Le fil sera tiré vers l'intérieur du film par une force égale à 2γL (le facteur 2 est parce que le film de savon a deux côtés par conséquent deux surfaces). La tension de surface est donc mesurée en forces par unité de longueur. Son Unité SI est newton par mètre mais la unité CGS de dynes par cm est le plus couramment utilisé.
Une définition équivalente, qui est utile dans la thermodynamique , est le travail effectué par unité de surface. En tant que tels, afin d'augmenter la zone de surface d'une masse de liquide d'une quantité, delta A, une quantité de travail, γδA, est nécessaire. Ce travail est stockée sous forme d'énergie potentielle. Par conséquent la tension superficielle peut être également mesurée en tant que système SI joules par mètre 2 et dans la système CGS que ergs par cm 2. Comme les systèmes mécaniques essaient de trouver un état d'énergie potentielle minimale, une goutte de liquide libre suppose naturellement une forme sphérique, qui a la surface minimale pour un volume donné.
L'équivalence de mesure de l'énergie par unité de surface à la force par unité de longueur peut être prouvée par analyse dimensionnelle.
araignées d'eau

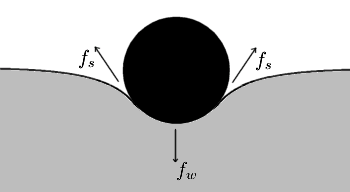
Les spectacles de photographie araignées d'eau debout sur la surface d'un étang. Il est clairement visible que les pieds provoquent des indentations dans la surface de l'eau. Et il est intuitivement évident que la surface d'indentations a une plus grande surface d'une surface plane. Si la tension de surface tend à minimiser la surface, comment est-il que les araignées d'eau augmentent la surface?
Rappelons que ce que la nature essaie vraiment de minimiser est l'énergie potentielle. En augmentant l'aire de surface de l'eau, les araignées d'eau ont augmenté l'énergie potentielle de cette surface. Mais notez aussi que le centre de masse les araignées d'eau de est inférieur à ce qu'il serait si elles étaient debout sur une surface plane. Ainsi, leur énergie potentielle est diminuée. En effet, lorsque vous combinez les deux effets, l'énergie potentielle nette est réduite au minimum. Si les araignées d'eau déprimés la surface plus, l'énergie de surface accrue serait plus annuler l'énergie a diminué d'abaisser le centre de la masse des insectes. Se ils déprimés la surface pas moins, leur centre supérieur de la masse serait plus annuler la réduction de l'énergie de surface.
La photo des araignées d'eau illustre également la notion de tension superficielle étant comme avoir un film élastique sur la surface du liquide. Dans les dépressions de surface à leurs pieds, il est facile de voir que la réaction de ce film élastique imaginé est exactement la lutte contre le poids des insectes.
Courbure et la pression de surface
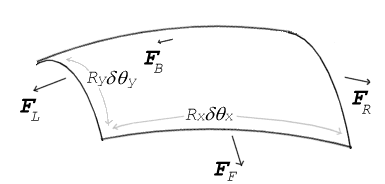
Si aucune force agit normale à une surface tendue, la surface doit rester plat. Mais si la pression sur un côté de la surface est différente de la pression sur l'autre côté, les résultats différence de pression dans la région de temps de surface d'une force normale. Pour que les forces de tension de surface pour annuler la force due à la pression, la surface doit être courbé. Le diagramme montre comment courbure de la surface d'un petit morceau de surface conduit à une nette composante de forces de tension superficielle agissant perpendiculairement à l'axe de la pièce. Lorsque toutes les forces sont équilibrées, l'équation résultante est connue sous le nom Équation de Young-Laplace:
où:
- Δ P est la différence de pression.
- γ est la tension superficielle.
- R x et R y sont des rayons de courbure dans chacun des axes qui sont parallèles à la surface.
Solutions à cette équation déterminent la forme de gouttes d'eau, flaques d'eau, ménisques, bulles de savon, et toutes les autres formes déterminées par la tension de surface (comme la forme des impressions que les pieds d'une araignée d'eau font sur la surface d'un étang).
Le tableau ci-dessous montre comment la pression interne d'une goutte d'eau augmente avec la diminution de rayon. Pour pas très petites gouttes l'effet est subtil, mais la différence de pression devient énorme quand les tailles de gouttes se approchent de la taille moléculaire.
| Δ P de gouttes d'eau à des rayons différents STP | ||||
|---|---|---|---|---|
| Rayon Droplet | 1 mm | 0,1 mm | 1 um | 10 nm |
| Δ P ( atm) | 0,0014 | 0,0144 | 1,436 | 143,6 |
Surface du liquide comme un ordinateur

Pour trouver la forme de la surface minimale délimitée par un certain cadre de forme arbitraire en utilisant des moyens strictement mathématiques peut être une tâche intimidante. Pourtant, en façonnant le cadre de fil métallique et en le plongeant dans le savon-solution, une surface d'environ minimale (exacte en l'absence de gravité) apparaîtra dans le soap-film résultant en quelques secondes. Sans un seul calcul, le savon-film arrive à une solution d'une équation complexe de minimisation de sa propre.
La raison en est que la différence de pression à travers une interface de fluide est proportionnelle à la courbure moyenne, comme on le voit dans le Équation de Young-Laplace. Pour un film de savon ouverte, la différence de pression est égale à zéro, d'où la courbure moyenne est égale à zéro, et les surfaces minimales ont la propriété de courbure moyenne nulle.
Les angles de contact
Étant donné qu'aucun liquide ne peut exister dans un vide parfait, la surface de tout liquide est une interface entre ce liquide et un autre milieu. La surface supérieure d'un bassin, par exemple, est une interface entre l'eau du bassin et l'air. La tension de surface est donc pas une propriété du liquide seul, mais une propriété de l'interface du liquide avec un autre support. Si un liquide est dans un conteneur, puis en dehors de l'interface liquide / air, lors de sa surface supérieure, il existe également une interface entre le liquide et les parois du récipient. La tension superficielle entre le liquide et l'air est généralement différent (supérieur à) sa tension de surface avec les parois du récipient. Et où les deux surfaces se rencontrent, leur géométrie doit être telle que l'équilibre des forces tous.
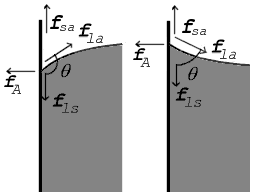 |
Lorsque les deux surfaces se rencontrent, ils forment un angle de contact,  Qui est l'angle de la tangente à la surface fait avec la surface solide. Le schéma de droite montre deux exemples. L'exemple de la gauche où la tension de surface liquide-solide est,
Qui est l'angle de la tangente à la surface fait avec la surface solide. Le schéma de droite montre deux exemples. L'exemple de la gauche où la tension de surface liquide-solide est, 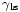 , Est inférieure à la tension de surface liquide-air,
, Est inférieure à la tension de surface liquide-air, 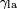 , Mais est néanmoins positive, ce est
, Mais est néanmoins positive, ce est
Dans le diagramme, les deux forces verticales et horizontales doivent annuler exactement au point de contact. La composante horizontale de  est annulée par la force d'adhérence,
est annulée par la force d'adhérence, 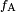 .
.
L'équilibre des forces plus révélateur, cependant, ce est dans le sens vertical. La composante verticale de  doit exactement annuler la force,
doit exactement annuler la force,  .
.
| Liquide | Solide | L'angle de contact | |||
|---|---|---|---|---|---|
| eau |
| 0 ° | |||
| éthanol | |||||
| l'éther diéthylique | |||||
| le tétrachlorure de carbone | |||||
| glycérol | |||||
| acide acétique | |||||
| eau | paraffine | 107 ° | |||
| argent | 90 ° | ||||
| l'iodure de méthyle | verre sodocalcique | 29 ° | |||
| verre au plomb | 30 ° | ||||
| quartz fondu | 33 ° | ||||
| mercure | verre sodocalcique | 140 ° | |||
| Certains angles de contact liquide-solide | |||||
Étant donné que les forces sont en proportion directe avec leurs tensions superficielles respectives, nous avons également:
où
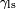 est la tension de surface liquide-solide,
est la tension de surface liquide-solide,  est la tension de surface liquide-air,
est la tension de surface liquide-air,  est l'angle de contact, où une partie concave ménisque a angle de contact inférieur à 90 ° et une forme convexe ménisque a angle supérieur à 90 ° de contact.
est l'angle de contact, où une partie concave ménisque a angle de contact inférieur à 90 ° et une forme convexe ménisque a angle supérieur à 90 ° de contact.
Cela signifie que, bien que la tension de surface liquide-solide, 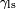 , Est difficile à mesurer directement, il peut être déduit de l'angle de contact facile à mesurer,
, Est difficile à mesurer directement, il peut être déduit de l'angle de contact facile à mesurer,  Si la tension de surface liquide-air,
Si la tension de surface liquide-air,  , Est connu.
, Est connu.
Cette même relation existe dans le diagramme sur la droite. Mais dans ce cas, nous voyons que, parce que l'angle de contact est inférieur à 90 °, la tension liquide / surface solide doit être négative:
Angles de contact spéciales
Remarquez que dans le cas particulier d'une interface eau-argent où l'angle de contact est égale à 90 °, la tension de surface liquide-solide est exactement zéro. Il est difficile de nettoyer le sol si des liquides avec déversements angle ≈ 0 ° de contact, comme l'essence, le kérosène, le benzène, etc.
Un autre cas particulier est l'endroit où l'angle de contact est exactement 180 °. Avec de l'eau spécialement préparé Teflon® aborde cette. angle de 180 ° de contact se produit lorsque la tension de surface liquide-solide est exactement égale à la tension de surface liquide-air.
Méthodes de mesure
Parce que la tension de surface se manifeste dans divers effets, il offre un certain nombre de chemins à sa mesure. Lequel procédé est optimum dépend de la nature du liquide à mesurer, les conditions dans lesquelles la tension doit être mesurée, et la stabilité de sa surface quand il est déformé.
- Du méthode Noüy Anneau: La méthode traditionnelle utilisée pour mesurer surface ou tension interfaciale. Propriétés de mouillage de la surface ou l'interface ont peu d'influence sur cette technique de mesure. Traction maximale exercée sur le noyau par la surface est mesurée.
- Une version miniaturisée de Du Noüy méthode utilise un petit diamètre aiguille métallique à la place d'un cycle, en combinaison avec une microbalance à haute sensibilité pour enregistrer traction maximale. L'avantage de cette méthode est que les volumes d'échantillon très petit (en bas à quelques dizaines de microlitres) peuvent être mesurées avec une très grande précision, sans qu'il soit nécessaire de corriger la flottabilité (pour une aiguille ou plutôt, une tige, avec une géométrie correcte). En outre, la mesure peut être effectuée très rapidement et très peu en environ 20 secondes. Premières tensiomètres multicanaux commerciales [CMCeeker] ont récemment été construites sur la base de ce principe.
- Wilhelmy méthode de la plaque: Une méthode universelle particulièrement adapté pour vérifier la tension de surface sur des intervalles de temps longues. Une plaque verticale du périmètre connu est fixé à un équilibre, et la force due à l'humidité est mesurée.
- Méthode de la goutte Spinning: Cette technique est idéale pour mesurer de faibles tensions interfaciales. Le diamètre d'une goutte dans une phase lourde est mesurée alors que les deux sont entraînés en rotation.
- Procédé de dépôt de la marine militaire: tension superficielle et interfaciale peut être mesurée par cette technique, même à des températures et pressions élevées. Géométrie d'une goutte est analysé optiquement. Pour plus de détails, voir DROP.

- Procédé de bulle à la pression (méthode de Jaeger): une technique de mesure pour déterminer la tension de surface à de courtes âges de surface. Pression maximale de chaque bulle est mesurée.
- Procédé de déposer volume: Procédé de détermination de la tension interfaciale en fonction de l'âge de l'interface. Une densité de liquide est pompé dans un second liquide d'une densité différente et le temps entre les gouttes produites est mesuré.
- Procédé de montée capillaire: L'extrémité d'un capillaire est immergé dans la solution. La hauteur à laquelle la solution arrive à l'intérieur du capillaire est lié à la tension de surface par l'équation discuté ci-dessous .
- Loi de Tate: Procédé de lecture de pondération et une goutte de liquide.
- Méthode de la goutte sessile: Procédé de détermination de la tension superficielle et la densité en plaçant une goutte sur un substrat et en mesurant la l'angle de contact (voir Technique de la goutte sessile).
Effets
Liquide dans un tube vertical

Un vieux style mercure baromètre se compose d'un tube de verre vertical d'environ 1 cm de diamètre partiellement remplis avec du mercure, et avec un vide (appelé le vide de Torricelli) dans le volume vacants (voir schéma ci-contre). Notez que le niveau de mercure dans le centre du tube est plus élevée que sur les bords, ce qui rend la face supérieure du mercure en forme de dôme. Le centre de masse de l'ensemble de colonne de mercure serait légèrement plus faible si la surface supérieure du mercure était plat sur toute la crossection du tube. Mais la partie supérieure en forme de dôme donne un peu moins de surface pour la totalité de la masse de mercure. Là encore, les deux effets se combinent pour minimiser l'énergie potentielle totale. Une telle forme de la surface est connu comme un convexe ménisque.
La raison pour laquelle on considère la surface de toute la masse de mercure, y compris la partie de la surface qui est en contact avec le verre, ce est parce que le mercure ne adhère pas du tout de verre. Ainsi, la tension de surface du mercure agit sur sa surface entière, y compris lorsqu'elle est en contact avec le verre. Si au lieu de verre, le tube a été faite de cuivre, la situation serait très différente. Mercury adhère agressivement au cuivre. Ainsi, dans un tube de cuivre, le niveau de mercure dans le centre du tube sera plus faible plutôt que plus élevée que sur les bords (ce est-il serait un ménisque concave). Dans une situation où le liquide adhère aux parois de son conteneur, on considère la partie de la surface du fluide qui est en contact avec le récipient à avoir une tension de surface négative. Le fluide fonctionne alors de maximiser la surface de contact. Donc dans ce cas augmenter la surface en contact avec les conteneurs diminue plutôt que augmente l'énergie potentielle. Cette diminution est suffisant pour compenser l'augmentation de l'énergie potentielle associée à la levée du fluide à proximité des parois du récipient.
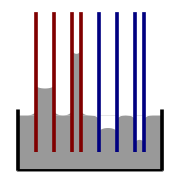
Si un tube est suffisamment étroite et l'adhérence du liquide à ses parois est suffisamment forte, la tension superficielle peut aspirer du liquide dans le tube à un phénomène connu sous le nom l'action capillaire. La hauteur de la colonne est levée à est donné par:
où
 est la hauteur du liquide est soulevé,
est la hauteur du liquide est soulevé,  est la tension de surface liquide-air,
est la tension de surface liquide-air,  est la masse volumique du liquide,
est la masse volumique du liquide,  est le rayon du capillaire,
est le rayon du capillaire,  est l'accélération due à la gravité,
est l'accélération due à la gravité,  est l'angle de contact décrite ci-dessus. Notez que si
est l'angle de contact décrite ci-dessus. Notez que si  est supérieur à 90 °, comme le mercure dans un récipient en verre, le liquide va être enfoncée au lieu de levée.
est supérieur à 90 °, comme le mercure dans un récipient en verre, le liquide va être enfoncée au lieu de levée.
Flaques sur une surface

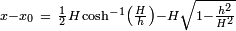 où
où 

Verser le mercure sur une feuille plane horizontale des résultats de verre dans un flaque d'eau qui a une épaisseur perceptible (ne essayez pas cela, sauf en vertu d'un hotte de fumée. La vapeur de mercure est un risque de toxicité). La flaque d'eau se propage uniquement au point où ce est un peu moins d'un demi-centimètre d'épaisseur, et pas plus mince. Là encore, cela est dû à l'action de la tension superficielle du mercure solide. La masse liquide se aplatit parce qui apporte le plus de mercure pour un niveau aussi bas que possible. Mais la tension de surface, en même temps, agit pour réduire la surface totale. Le résultat est le compromis d'une flaque d'une épaisseur presque fixe.
La même démonstration de tension de surface peut être effectué avec de l'eau, mais seulement sur une surface en une substance que l'eau ne respecte pas. La cire est une telle substance. L'eau versée sur une surface lisse, plane, horizontale cire, dire une feuille ciré du verre, se comporte de manière similaire au mercure versé sur verre.
L'épaisseur d'une flaque de liquide sur une surface dont l'angle de contact est de 180 ° est donnée par:
où
 est la profondeur de la flaque en centimètres ou mètres.
est la profondeur de la flaque en centimètres ou mètres.  est la tension superficielle du liquide en dynes par centimètre ou newtons par mètre.
est la tension superficielle du liquide en dynes par centimètre ou newtons par mètre.  est l'accélération due à la gravité et est égale à 980 cm / s 2 ou 9,8 m / s 2
est l'accélération due à la gravité et est égale à 980 cm / s 2 ou 9,8 m / s 2  est la masse volumique du liquide en grammes par centimètre cube ou en kilogrammes par mètre cube
est la masse volumique du liquide en grammes par centimètre cube ou en kilogrammes par mètre cube

En réalité, les épaisseurs des flaques d'eau seront un peu moins que ce qui est prévu par la formule ci-dessus parce que très peu de surfaces ont un angle de 180 ° avec un liquide de contact. Lorsque l'angle de contact est inférieur à 180 °, l'épaisseur est donnée par:
Pour le mercure sur le verre,  ,
,  Et
Et 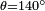 , Ce qui donne
, Ce qui donne 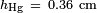 . Pour l'eau de paraffine à 25 ° C,
. Pour l'eau de paraffine à 25 ° C,  ,
,  Et
Et  ce qui donne
ce qui donne  .
.
La formule prévoit également que lorsque l'angle de contact est de 0 °, le liquide se étale en une couche de micro-mince sur la surface. Une telle surface est dite totalement mouillable par le liquide.
La rupture de flux en gouttes
 Où
Où  est le rayon du jet non perturbé,
est le rayon du jet non perturbé,  est l'amplitude de la perturbation,
est l'amplitude de la perturbation,  est la distance le long de l'axe du courant, et
est la distance le long de l'axe du courant, et  est le nombre d'onde
est le nombre d'onde Dans la vie de tous les jours nous observons que un courant d'eau sortant d'un robinet briser en gouttelettes, ne importe comment en douceur le flux est émis par le robinet. Cela est dû à un phénomène appelé le Plateau-instabilité de Rayleigh, ce qui est tout à fait à la suite des effets de la tension superficielle.
L'explication de cette instabilité commence avec l'existence de petites perturbations dans le flux. Ce sont toujours présents, ne importe comment lisser le flux est. Si les perturbations sont résolus en composantes sinusoïdales, nous constatons que certains composants se développent avec le temps tandis que d'autres se désintègrent avec le temps. Parmi ceux qui poussent avec le temps, certains poussent à des taux plus rapides que d'autres. Que ce soit un composant décroît ou croît, et la vitesse à laquelle elle pousse est entièrement fonction de son nombre d'onde (une mesure de combien de pics et de creux par centimètre) et le rayon du flux cylindrique d'origine. Le schéma de droite montre une exagération d'un seul composant.
En supposant que toutes les composantes possibles existent initialement dans amplitudes approximativement égales (mais minuscules), la taille des gouttes finales peut être prédite par la détermination de nombre d'onde où le composant se développe le plus rapidement. Au fil du temps, ce est la composante dont la croissance est maximale qui viendra à dominer et finira par être celui qui pince le flux en gouttes.
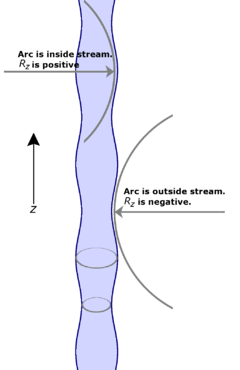
Bien qu'une compréhension approfondie de la façon dont cela se produit nécessite une développement mathématique (voir les références), le schéma peut fournir une compréhension conceptuelle. Observez les deux bandes indiquées ceinturant le flux - un à un pic et l'autre à un creux de la vague. A l'auge, le rayon du courant est plus faible, donc en fonction de la Équation de Young-Laplace (voir plus haut) la pression due à la tension de surface est augmentée. De même au sommet du rayon du courant est plus grande et, par le même raisonnement, la pression due à la tension superficielle est réduite. Si ce était le seul effet, nous nous attendons à ce que la pression plus élevée dans la cuve serait presser liquide dans la région de basse pression dans le pic. De cette façon, nous voyons comment la vague pousse dans amplitude dans le temps.
Mais le Équation de Young-Laplace est influencée par deux composants distincts de rayon. Dans ce cas, on est le rayon, déjà discuté, du flux lui-même. L'autre est le rayon de courbure de l'onde elle-même. Les arcs encastrés dans le diagramme montrent ceux-ci à un pic et à un creux. Notez que le rayon de courbure du creux est, en fait, négatif, ce qui signifie que, selon Young-Laplace, il diminue en fait la pression dans la cuve. De même, le rayon de courbure au sommet est positive et augmente la pression dans cette région. L'effet de ces composants se trouve face aux effets du rayon du flux lui-même.
Les deux effets, en général, ne se annulent pas exactement. L'un d'eux aura une plus grande ampleur que l'autre, selon le nombre d'onde et le rayon initial du flux. Lorsque le nombre d'onde est telle que le rayon de courbure de l'onde domine celle du rayon du flux, de tels composants ne se désintégrer au cours du temps. Lorsque l'effet du rayon du courant domine celle de la courbure de l'onde, ces composants se développent de façon exponentielle avec le temps.
Lorsque tout le calcul est effectué, on constate que les composants instables (ce est-composants qui se développent dans le temps) sont celles où le produit du nombre d'onde avec le rayon initial est inférieur à l'unité (  ). La composante qui pousse le plus rapide est celui dont le nombre d'onde satisfait l'équation:
). La composante qui pousse le plus rapide est celui dont le nombre d'onde satisfait l'équation:
Thermodynamique
Comme indiqué plus haut, le travail mécanique nécessaire pour augmenter une surface est  . Par conséquent, à température et pression constante, la tension de surface est égale à énergie libre de Gibbs par unité de surface:
. Par conséquent, à température et pression constante, la tension de surface est égale à énergie libre de Gibbs par unité de surface:
où 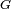 Gibbs est l'énergie libre et
Gibbs est l'énergie libre et 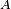 est la zone.
est la zone.
Thermodynamique exige que tous les changements spontanés d'Etat sont accompagnés par une diminution de l'énergie libre de Gibbs.
De cela, il est facile de comprendre pourquoi la diminution de la surface d'une masse de liquide est toujours spontané (  ), À condition qu'elle ne est pas couplée à d'autres modifications de l'énergie. Il se ensuit que, pour augmenter la surface, une certaine quantité d'énergie doit être ajouté.
), À condition qu'elle ne est pas couplée à d'autres modifications de l'énergie. Il se ensuit que, pour augmenter la surface, une certaine quantité d'énergie doit être ajouté.
Énergie libre de Gibbs est définie par l'équation, 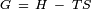 Où
Où  est l'enthalpie et
est l'enthalpie et  est l'entropie . Sur la base de ceci et du fait que la tension de surface est libre de Gibbs énergie par unité de surface, il est possible d'obtenir l'expression suivante pour l'entropie par unité de surface:
est l'entropie . Sur la base de ceci et du fait que la tension de surface est libre de Gibbs énergie par unité de surface, il est possible d'obtenir l'expression suivante pour l'entropie par unité de surface:
Kelvin de l'équation pour les surfaces se pose en réarrangeant les équations précédentes. Elle indique que l'enthalpie de surface ou de l'énergie de surface (différente de l'énergie libre de surface) dépend à la fois sur la tension superficielle et de son dérivé avec la température à pression constante par la relation.
Influence de la température
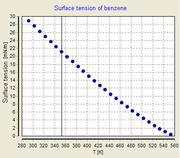
La tension de surface dépend de la température. Pour cette raison, quand une valeur est donnée à la tension superficielle d'une interface, la température doit être explicitement indiquée. La tendance générale est que la tension superficielle diminue avec l'augmentation de la température, atteignant une valeur de 0 à la température critique. Pour plus de détails, voir Eötvös règle. Il existe seulement équations empiriques pour rapporter la tension de surface et de la température:
- Eötvös:
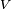 est le volume molaire de la substance
est le volume molaire de la substance  est le température critique
est le température critique  est une constante pour chaque substance.
est une constante pour chaque substance.
Par exemple pour l'eau k = 1,03 erg / ° C (103 nJ / K ), V = 18 ml / mole et T C = 374 ° C.
Une variante de Eötvös est décrit par Ramay et Shields:
où le décalage de température de 6 kelvins fournit la formule avec un meilleur ajustement à la réalité à des températures inférieures.
- Guggenheim-Katayama:
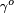 est une constante pour chaque liquide et n est un facteur empirique, dont la valeur est 9.11 pour les liquides organiques. Cette équation a également été proposé par van der Waals, qui en outre proposé que
est une constante pour chaque liquide et n est un facteur empirique, dont la valeur est 9.11 pour les liquides organiques. Cette équation a également été proposé par van der Waals, qui en outre proposé que  pourrait être donnée par l'expression,
pourrait être donnée par l'expression,  Où
Où 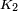 est une constante universelle pour tous les liquides, et
est une constante universelle pour tous les liquides, et 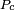 est le pression critique du liquide (bien que des expériences ultérieures trouvé
est le pression critique du liquide (bien que des expériences ultérieures trouvé 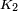 faire varier dans une certaine mesure d'un liquide à un autre).
faire varier dans une certaine mesure d'un liquide à un autre).
Les deux Guggenheim-Katayama et Eötvös prennent en compte le fait que la tension de surface atteint 0 à la température critique, alors que Ramay et Shields ne correspond pas à la réalité à ce critère.
Influence de la concentration de soluté
Solutés peuvent avoir différents effets sur la tension de surface en fonction de leur structure:
- Pas d'effet, par exemple le sucre
- Augmentation de la tension superficielle, des sels inorganiques
- Diminuer la tension de surface progressivement, alcools
- Diminuer la tension de surface et, une fois minimum est atteint, pas plus d'effet: tensioactifs
Ce qui complique l'effet est un soluté qui peut exister en une concentration différente à la surface d'un solvant par rapport à son encombrement. Cette différence varie d'un soluté / combinaison de solvants à l'autre.
Gibbs isotherme stipule que:
 il est connu que la concentration de surface, il représente l'excès de soluté par unité de surface de la surface au-dessus de ce qui serait présente si la concentration apparente a prévalu tout le chemin vers la surface. Il a des unités de mol / m 2
il est connu que la concentration de surface, il représente l'excès de soluté par unité de surface de la surface au-dessus de ce qui serait présente si la concentration apparente a prévalu tout le chemin vers la surface. Il a des unités de mol / m 2
 est la concentration de la substance dans la solution en vrac.
est la concentration de la substance dans la solution en vrac.
 est le constante des gaz et
est le constante des gaz et latempérature
latempérature
Certaines hypothèses sont prises dans sa déduction, donc Gibbs isotherme ne peut être appliquée à des solutions idéales (très diluées) à deux composantes.
Influence de la taille des particules sur la pression de vapeur
Le Formule de clapeyron conduit à une autre équation également attribué à Kelvin. Cela explique pourquoi, en raison de la tension superficielle, la pression de vapeur pour petites gouttelettes de liquide en suspension est supérieure à la pression de vapeur de la même norme de liquide lorsque l'interface est plate. Cela revient à dire que lorsqu'un liquide se forme de petites gouttelettes, la concentration d'équilibre de la vapeur dans son environnement est plus grande. Ceci vient du fait que la pression à l'intérieur de la gouttelette est plus grande qu'à l'extérieur.

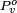 est la pression de vapeur standard pour ce liquide à cette température et de pression.
est la pression de vapeur standard pour ce liquide à cette température et de pression. 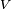 est le volume molaire.
est le volume molaire.  est le constante des gaz
est le constante des gaz
 est le rayon Kelvin, le rayon des gouttelettes.
est le rayon Kelvin, le rayon des gouttelettes.
L'effet explique sursaturation de vapeurs. En l'absence de sites de nucléation, de minuscules gouttelettes doivent former avant qu'ils peuvent évoluer vers de plus grosses gouttelettes. Cela nécessite de nombreuses fois par la pression de vapeur la pression de vapeur à la point de transition de phase.
Cette équation est également utilisé dans le catalyseur à évaluer la chimie mésoporosité pour les solides.
L'effet peut être considéré en termes de nombre moyen de voisins moléculaires de molécules de surface (voir schéma).
Le tableau montre quelques valeurs calculées de cet effet pour l'eau à différentes tailles de gouttes:
| P / P 0 pour des gouttes d'eau à des rayons différents STP | ||||
|---|---|---|---|---|
| Rayon de gouttelettes (nm) | 1000 | 100 | 10 | 1 |
| P / P 0 | 1,001 | 1,011 | 1,114 | 2,95 |
L'effet devient clair pour de très petites tailles de gouttes, comme une goutte de 1 rayon nm a environ 100 molécules à l'intérieur, ce qui est une quantité suffisamment petite pour nécessiter unemécanique quantiqueanalyse.
Tableau de données
Les données sont tiréesdu Manuel de Lange de Chimie, 10e éd.pp 1661-1665
| La tension de surface de divers liquides dansdyn / cm contre l'air Mélange% 's sont en poids | ||
|---|---|---|
| Liquide | Température ° C | La tension de surface,γ |
| Acide acétique | 20 | 27,6 |
| L'acide acétique (40,1%) + eau | 30 | 40,68 |
| L'acide acétique (10,0%) + eau | 30 | 54.56 |
| Acétone | 20 | 23,7 |
| De l'éther diéthylique | 20 | 17,0 |
| Éthanol | 20 | 22.27 |
| De l'éthanol (40%) + eau | 25 | 29.63 |
| De l'éthanol (11,1%) + eau | 25 | 46,03 |
| Glycérol | 20 | 63 |
| n-hexane | 20 | 18,4 |
| L'acide chlorhydrique17,7M de solution aqueuse | 20 | 65,95 |
| Isopropanol | 20 | 21,7 |
| Mercure | 15 | 487 |
| Méthanol | 20 | 22,6 |
| noctane | 20 | 21,8 |
| Chlorure de sodium 6,0 Solution aqueuse M | 20 | 82,55 |
| Saccharose(55%) + eau | 20 | 76.45 |
| Eau | 0 | 75.64 |
| Eau | 25 | 71,97 |
| Eau | 50 | 67.91 |
| Eau | 100 | 58.85 |