
Méthane
Renseignements généraux
Cette sélection Wikipedia est déconnecté disponibles à partir enfants SOS pour la distribution dans le monde en développement. Cliquez ici pour en savoir plus sur le parrainage d'enfants.
| Méthane | |
|---|---|
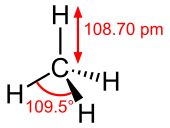 | |
 |  |
| |
| Identificateurs | |
| Numéro CAS | 74-82-8 |
| PubChem | 297 |
| ChemSpider | 291 |
| Numéro CE | 200-812-7 |
| Numéro ONU | 1971 |
| KEGG | C01438 |
| MeSH | Méthane |
| ChEBI | CHEBI: 16183 |
| ChEMBL | CHEMBL17564 |
| Numéro RTECS | PA1490000 |
| Beilstein Référence | 1718732 |
| Gmelin Référence | 59 |
| 3DMet | B01450 |
| images de Jmol-3D | Image 1 |
SMILES
| |
InChI
| |
| Propriétés | |
| Formule moléculaire | CH 4 |
| Masse molaire | 16,04 g mol -1 |
| Apparence | Gaz incolore |
| Odeur | Inodore |
| Densité | 0,6556 g L -1 |
| Point de fusion | -182 ° C, 90,7 K, -296 ° F |
| Point d'ébullition | -164 À -160 ° C, de 109 à 113 K, de -263 à -256 ° F |
| Solubilité dans l'eau | 22,7 mg L -1 |
| log P | 1,09 |
| k H | 14 nmol Pa -1 kg -1 |
| Structure | |
| Forme moléculaire | Tétraèdre |
| Moment de dipôle | 0 D |
| Thermochimie | |
| Std enthalpie de formation Δ f H | -74,87 KJ mol -1 |
| Std enthalpie de combustion Δ c H | -891,1 À -890,3 kJ mol -1 |
| Molaire standard entropie S | 186,25 JK -1 mol -1 |
| Capacité thermique spécifique, C | 35,69 JK -1 mol -1 |
| Risques | |
| FS | MSDS externe |
| Pictogrammes SGH |  |
| SGH mot de signal | DANGER |
| Mentions de danger du SGH | H220 |
| SGH conseils de prudence | P210 |
| Indice de l'UE | 601-001-00-4 |
| Classification UE | |
| Phrases-R | R12 |
| Phrases S | (S2), S16, S33 |
| NFPA 704 |  4 1 0 |
| Point d'éclair | -188 ° C |
| D'auto-inflammation température | 537 ° C |
| Limites d'explosivité | 5-15% |
| Des composés apparentés | |
| Alcanes connexes |
|
| Page de données supplémentaire | |
| Structure et propriétés | n, ε r, etc. |
| Thermodynamique données | comportement de phase Solide, liquide, gaz |
| Les données spectrales | UV, IR, RMN , MS |
Sauf indication contraire, les données sont données pour le matériel dans leur état standard (à 25 ° C, 100 kPa) | |
| Références d'Infobox | |
Le méthane (prononcé / Mɛθeɪn / ou / miːθeɪn /) est un composé chimique avec la formule chimique CH 4. Il est le plus simple alcane , la principale composante de gaz naturel , et probablement le plus abondant composé organique sur la terre. L'abondance relative de méthane fait un attractif carburant. Cependant, parce que ce est un gaz à des conditions normales, le méthane est difficile de transporter, de sa source.
Le méthane est un puissant relativement gaz à effet de serre . La concentration de méthane dans l' atmosphère terrestre à 1998, exprimée en fraction molaire, était 1,745 nmol / mol (parties par milliard, ppb), en hausse de 700 nmol / mol en 1750. En 2008, cependant, les niveaux de méthane mondiales, qui étaient restés essentiellement stables depuis 1998, avaient augmenté à 1,800 nmol / mol.
Propriétés et collage
Le méthane est un Molécule tétraédrique avec quatre liaisons CH équivalents. Sa structure électronique est décrite par quatre orbitales moléculaires liaison (OM) résultant du recouvrement des orbitales de valence de C et H. Le MO de l'énergie le plus bas est le résultat de la superposition des orbitale 2s sur du carbone avec la combinaison en phase du 1s orbitales sur les quatre atomes d'hydrogène. Au-dessus de ce niveau d'énergie est un ensemble dégénéré triplement des OM qui impliquent chevauchement des orbitales 2p sur le carbone avec diverses combinaisons linéaires des orbitales 1s sur l'hydrogène. Le schéma de liaison "trois plus un» résultant est compatible avec des mesures spectroscopiques photoélectrons.
À la température ambiante et pression standard, le méthane est un gaz incolore et inodore. L'odeur familière du gaz naturel comme utilisé dans les foyers est une mesure de sécurité atteint par l'addition d'un odorant, généralement des mélanges contenant tert-butylthiol. Le méthane a un point de -161 ° d'ébullition C (-257,8 ° F) à une pression d'une atmosphère. En tant que gaz, il est inflammable que sur une gamme étroite de concentrations (5-15%) dans l'air. Le méthane liquide ne brûle pas moins soumis à haute pression (normalement 4-5 atmosphères).
Les réactions chimiques
Réactions principales avec le méthane sont: combustion, reformage à la vapeur à gaz de synthèse, et halogénation. En général, les réactions de méthane sont difficiles à contrôler. L'oxydation partielle de méthanol , par exemple, est difficile parce que la réaction progresse généralement tout le chemin vers le dioxyde de carbone et eau , même avec des quantités d'oxygène incomplètes. Les enzymes méthane monooxygénase peut produire du méthanol à partir du méthane, mais ils ne peuvent pas être utilisés pour les réactions à l'échelle industrielle.
Des réactions acido-basiques
Comme les autres hydrocarbures, le méthane est un acide très faible. Son pKa DMSO est estimé à 56. Il ne peut être déprotoné en solution, mais le conjugué avec la base méthyllithium est connue.
Une variété d' ions positifs issus de méthane ont été observées, pour la plupart des espèces instables dans des mélanges gazeux à basse pression. Il se agit notamment Méthylium cation ou un groupe méthyle CH 3 +, cations méthane CH 4 +, et Méthanium ou de méthane protonée CH 5 +. Certains d'entre eux ont été détectée dans l'espace. Méthanium peut également être produit que des solutions diluées de méthane avec super acides. Cations avec plus responsable, tel que CH 6 ++ et +++ 7 CH, ont été étudiées théoriquement et conjecturé être stable.
Malgré la force de ses liaisons CH, il ya un intérêt intense dans les catalyseurs qui facilitent Activation liaison C-H dans le méthane (et d'autres faibles alcanes ).
Combustion
Dans le combustion du méthane, plusieurs étapes sont nécessaires. Les équations suivantes font partie du processus, avec le résultat net être:
CH 4 + 2 O 2 → CO 2 + 2 H 2 O (AH = -891 k J / mol (dans des conditions standard))
- CH 4 + M * → CH 3 + H + M
- CH 4 + O 2 → CH 3 + 2 HO
- CH 4 + 2 HO → CH 3 + 2 OH
- CH 4 + OH → CH 3 + H 2 O
- O 2 + H → O + OH
- CH 4 + O → CH 3 OH +
- CH 3 + O 2 → CH 2 O + OH
- CH 2 O + O → CHO + OH
- CH 2 O + OH CHO + → H 2 O
- CH 2 O → H + + H 2 CHO
- CHO + O → CO + OH
- + CHO OH → CO + H 2 O
- CHO + H → CO + H 2
- H 2 O + → H + OH
- H 2 + OH → H + H 2 O
- CO + OH → CO 2 + H
- H + OH + M → H 2 O + M *
- H + H + M → H 2 + M *
- H + O 2 + M → HO 2 + M *
L'espèce M * représente un troisième corps énergétique, à partir de laquelle l'énergie est transférée au cours d'une collision moléculaire. Formaldéhyde (HCHO ou H 2 CO) est un intermédiaire précoce (réaction 7). L'oxydation du formaldehyde donne le formyle radicales (HCO) (réactions 8, 9 et 10), qui donnent ensuite le monoxyde de carbone (CO) (réactions 11, 12 & 13). De préférence H 2 obtenu se oxyde en H 2 O ou d'autres produits intermédiaires de réaction (14 & 15). Enfin, le CO oxyde, formant CO 2 (réaction 16). Dans les dernières étapes (réactions 17, 18 & 19), l'énergie est transférée à d'autres organismes tiers. La vitesse globale de la réaction est fonction de la concentration des différentes entités au cours du processus de combustion. Plus la température est élevée, plus la concentration d'espèces radicalaires et la plus rapide du processus de combustion.
Réactions avec les halogènes
Le méthane réagit avec les halogènes donnés conditions appropriées comme suit:
- X 2 + UV → 2 X •
- • X + CH 4 → HX + CH 3 •
- • CH 3 + X 2 → CH 3 X + X •
où X est un halogène : fluor (F), chlore (Cl), le brome (Br) ou l'iode (I). Ce mécanisme de ce processus est appelé halogénation radicaux libres. Elle est initiée par de la lumière UV ou d'un autre initiateur de radicaux. Un atome de chlore est généré à partir du chlore élémentaire, qui fait abstraction d'un atome d'hydrogène à partir du méthane, ce qui entraîne la formation de chlorure d'hydrogène. Le radical méthyle résultant, CH 3 ·, peut se combiner avec une autre molécule de chlore pour donner le chlorure de méthyle (CH 3 Cl) et une nouvelle atome de chlore. Des réactions similaires peuvent produire dichlorométhane (CH 2 Cl 2), chloroforme (CHCl 3), et, finalement, le tétrachlorure de carbone (CCl 4), en fonction des conditions réactionnelles et le rapport du chlore au méthane.
Utilisations
Le méthane est utilisé dans les procédés chimiques industriels et peut être transporté comme un liquide réfrigéré (gaz naturel liquéfié, ou GNL). Bien que les fuites à partir d'un récipient de liquide réfrigéré sont initialement plus lourdes que l'air en raison de la densité accrue du gaz froid, le gaz à la température ambiante est plus léger que l'air. Gazoducs distribuer de grandes quantités de gaz naturel, dont le méthane est le composant principal.
Carburant
Gaz naturel
Le méthane est important pour la production d'électricité par la combustion comme carburant dans un Turbine à gaz ou de la vapeur chaudière. Comparé à d'autres carburants d'hydrocarbures , le méthane brûlant produit moins de dioxyde de carbone par unité de chaleur dégagée. À environ 891 kJ / mol, de méthane la chaleur de combustion est inférieure à celle de tout autre hydrocarbure mais le rapport entre la chaleur de combustion (891 kJ / mol) à la masse moléculaire (16,0 g / mole, dont 12,0 g / mol est le carbone) montre que le méthane, l'hydrocarbure étant simple , produit plus de chaleur par unité de masse (55,7 kJ / g) que les autres hydrocarbures complexes. Dans de nombreuses villes, le méthane est canalisée dans des maisons à usage domestique chauffage et de cuisson fins. Dans ce contexte, il est généralement connu que le gaz naturel , ce qui est considéré comme ayant une teneur en énergie de 39 mégajoules par mètre cube, ou 1000 BTU par pied cube standard.
Le méthane sous forme de gaz naturel comprimé est utilisé comme carburant de véhicule et est revendiquée à être plus respectueux de l'environnement que les autres combustibles fossiles comme l'essence / essence et le diesel. La recherche sur les méthodes de stockage de méthane pour une utilisation comme carburant automobile d'adsorption a été réalisée.
Le gaz naturel liquéfié
Le gaz naturel liquéfié ou GNL est du gaz naturel (principalement du méthane, CH 4) qui a été converti en une forme liquide pour la facilité de stockage ou de transport.
Le gaz naturel liquéfié prend environ 1 / 600ème du volume de gaz naturel à l'état gazeux. C'est inodore, incolore, non-toxique et non corrosif. Les risques comprennent inflammabilité, la congélation et l'asphyxie.
Le Procédé de liquéfaction implique l'élimination de certains composants, tels que la poussière, gaz acides, l'hélium , de l'eau, et lourd hydrocarbures, ce qui pourrait causer des difficultés aval. Le gaz naturel est alors condensée en un liquide à proximité de la pression atmosphérique (pression maximale de transport fixé à environ 25 kPa / 3,6 psi) en le refroidissant à environ -162 ° C (-260 ° F).
GNL permet une réduction plus élevée en volume que du gaz naturel comprimé (GNC) de sorte que la la densité d'énergie du GNL est 2,4 fois plus lourd que celui de GNC ou 60% de celle de le carburant diesel. Cela rend le coût de GNL efficace de transporter sur de longues distances où il ne existe pas pipelines. Spécialement conçu navires de mer (cryogénique méthaniers) ou camions-citernes cryogéniques sont utilisés pour son transport.
GNL, quand il ne est pas très raffinée pour des usages spécifiques, est principalement utilisé pour le transport de gaz naturel vers les marchés, où il est regazéifié et distribué comme pipeline de gaz naturel. Il peut être utilisé dans véhicules au gaz naturel, même se il est plus fréquent de concevoir des véhicules à utiliser gaz naturel comprimé. Son coût relativement élevé de la production et de la nécessité de le stocker dans plus cher réservoirs cryogéniques ont entravé l'utilisation commerciale à grande échelle.
Le méthane liquide carburant de fusée
Dans une forme très raffinée, le méthane liquide a été Identifié comme un carburant de fusée. Un certain nombre de russes roquettes ont été proposées pour utiliser méthane liquide depuis les années 1990, et les entreprises américaines Orbitech et XCOR Aerospace a développé une liquide / liquide moteur méthane de fusée d'oxygène en 2005 et une plus grande force de £ 7500 (33 000 N) moteur -thrust en 2007 pour une utilisation potentielle comme CEV moteur de retour lunaire. Plus récemment, l' Amérique privé société spatiale SpaceX a annoncé (en 2012) une initiative pour développer liquides moteurs méthane de roquettes, y compris d'abord, le Raptor deuxième étape moteur de fusée.
La recherche a été menée par la NASA en ce qui concerne le potentiel de méthane comme carburant de fusée. Un avantage de méthane, ce est qu'il est abondante dans de nombreuses parties du système solaire et il pourrait être récolté à la surface d'un autre corps du système solaire, en fournissant du carburant pour un voyage de retour. Moteurs de méthane actuelles en matière de développement produisent une poussée de 7500 livres-force (33 kN), qui est loin de la 7000000 lbf (31 MN) nécessaire pour lancer le Navette Spatiale. Au lieu de cela, ces moteurs seront probablement propulser voyages de la Lune ou envoyer des expéditions robotiques à d'autres planètes dans le système solaire.
Matière première chimique
Bien qu'il y ait un grand intérêt pour convertir le méthane en composés utiles ou plus facilement liquéfié, les seuls procédés pratiques sont peu sélectives. Dans l'industrie chimique, le méthane est converti en gaz de synthèse, mélange de monoxyde de carbone et d'hydrogène, par reformage à la vapeur. Ce processus endergonic (nécessitant l'énergie) utilise nickel catalyseurs et nécessite des températures élevées, autour de 700 à 1100 ° C:
- CH 4 + H 2 O → CO + 3 H 2
Chimiques connexes sont exploitées dans le Haber-Bosch de synthèse d'ammoniac à partir de l'air, qui est réduite avec du gaz naturel à un mélange de dioxyde de carbone , eau et ammoniac .
Le méthane est également soumis à radicalaire chloration dans la production de chlorométhanes, bien que le methanol est un précurseur plus typique.
Production
Itinéraires biologiques
Naturellement produisant du méthane est produit essentiellement par le procédé de méthanogénèse. Ce procédé en plusieurs étapes est utilisé par les micro-organismes en tant que source d'énergie. La réaction est nette:
- CO 2 + H + 8 + 8 e - → CH 4 + 2 H 2 O
L'étape finale dans le procédé est catalysé par l'enzyme coenzyme M méthyl-réductase. Méthanisation est une forme de respiration anaérobie utilisée par les organismes qui occupent décharge, ruminants (par exemple, le bétail), et le courage de termites.
Il est incertain si les plantes sont une source d'émissions de méthane.
Serpentinisation
Le méthane peut également être produit par un procédé non biologique appelé serpentinisation impliquant de l'eau, du dioxyde de carbone, et le minéral olivine, qui est connu pour être commune sur Mars.
Itinéraires industriels
Le méthane peut être produit par hydrogénation du dioxyde de carbone à travers le Processus Sabatier. Le méthane est également un produit secondaire de l'hydrogénation du monoxyde de carbone dans le Procédé Fischer-Tropsch. Cette technologie est pratiquée à grande échelle pour produire des molécules à chaîne plus longue que le méthane.
Le gaz naturel est si abondante que la production intentionnelle de méthane est relativement rare. La seule installation à grande échelle de ce type est le Grande plante Plains Synfuels, commencé en 1984 à Beulah, au Dakota du Nord comme un moyen de développer les ressources locales abondantes de bas grade lignite, une ressource qui est par ailleurs très difficile à transporter pour son poids, contenu cendres, faible pouvoir calorifique et la propension à combustion spontanée pendant le stockage et le transport.
synthèse de laboratoire
Le méthane peut également être produit par la distillation destructive de l'acide acétique en présence de la chaux sodée ou similaire. L'acide acétique est décarboxylé dans ce processus. Le méthane peut également être préparé par réaction de carbure d'aluminium avec de l'eau ou acides forts.
Occurrence
Le méthane a été découvert et isolé par Alessandro Volta entre 1776 et 1778 lors de l'étude des gaz des marais Lac Majeur. Ce est le principal composant du gaz naturel, environ 87% en volume. La principale source de méthane est l'extraction de gisements géologiques connues comme champs de gaz naturel, avec l'extraction de gaz de couche de charbon de devenir une source majeure (voir l'extraction de méthane des gisements de charbon, un procédé d'extraction de méthane à partir d'un charbon de dépôt, tandis que la récupération du méthane de houille est un procédé de récupération du méthane des couches de charbon non exploitables). Il est associé à l'autre combustibles hydrocarbonés, et parfois accompagnés d' hélium et d'azote . Le gaz à des niveaux peu profonds (basse pression) par formes anaérobie désintégration de la matière organique et le méthane retravaillé de profondeur sous la surface de la Terre. En général, les sédiments enterrés températures plus profondes et à plus élevés que ceux qui contiennent l'huile produire du gaz naturel.
Il est généralement transporté en vrac par pipeline dans sa forme de gaz naturel ou méthaniers dans sa forme liquéfié; quelques pays transportent par camion.
Le méthane atmosphérique

Le méthane est créée près de la surface de la Terre, principalement par des microorganismes par le procédé de méthanogénèse. Elle est réalisée dans le stratosphère par la hausse de l'air dans les tropiques . Incontrôlée accumulation de méthane dans l'atmosphère est naturellement contrôlé - bien que l'influence humaine peut perturber cette régulation naturelle - par la réaction de méthane avec les radicaux hydroxyles formés à partir de des atomes d'oxygène singulet et de vapeur d'eau. Il a une durée de vie net d'environ 10 ans, et est principalement éliminé par conversion en dioxyde de carbone et l'eau.
Le méthane affecte également la dégradation de la couche d'ozone.
En outre, il existe une grande (mais inconnue) en quantité de méthane clathrates de méthane dans les fonds océaniques ainsi que de la Terre la croûte . La plupart du méthane est le résultat de processus biologique appelé méthanogénèse.
En 2010, les niveaux de méthane dans l'Arctique ont été évalués à 1 850 nmol / mol, un niveau deux fois plus élevé que à tout moment dans les 400000 années avant la révolution industrielle . Historiquement, les concentrations de méthane dans l'atmosphère de la planète ont varié entre 300 et 400 nmol / mol pendant les périodes glaciaires communément appelées périodes glaciaires , et entre 600 à 700 nmol / mol pendant l'échauffement périodes interglaciaires. Il a une haute potentiel de réchauffement global: 72 fois celui du dioxyde de carbone de plus de 20 ans, et 25 fois plus de 100 années, et les niveaux sont en hausse. Des recherches récentes suggèrent que les océans de la Terre sont une nouvelle source potentiellement importante de méthane de l'Arctique.
A l'Université de Bristol étude publiée dans Nature affirme que le méthane sous la Inlandsis de l'Antarctique peut encore jouer un rôle important à l'échelle mondiale. Les chercheurs pensent que ces environnements sous-glace pour être biologiquement actif, en ce que les microbes sont la conversion du carbone organique à l'anhydride carbonique et le méthane.
Méthane dans l'atmosphère de la Terre est un important gaz à effet de serre avec un potentiel de réchauffement planétaire de 25 par rapport à CO 2 sur une période de 100 ans (bien que les chiffres acceptées représentent probablement une sous-estimation). Cela signifie qu'une émission de méthane aura 25 fois l'effet sur la température d'une émission de dioxyde de carbone de la même masse au cours des 100 années suivantes. Le méthane a un effet important pour une courte période (une durée de vie net de 8,4 années dans l'atmosphère), tandis que le dioxyde de carbone a un petit effet pendant une longue période (plus de 100 ans). En raison de cette différence en vigueur et période de temps, le potentiel de réchauffement global du méthane sur une période de 20 ans est la concentration de méthane dans l'atmosphère 72. Le de la Terre a augmenté d'environ 150% depuis 1750, et il représente 20% du total forçage radiatif de tous les gaz à effet de serre à long terme et à l'échelle mondiale mixtes (ces gaz ne comprennent pas la vapeur d'eau qui est de loin la plus grande composante de l'effet de serre). Habituellement, l'excès de méthane provenant des décharges et d'autres producteurs naturelles de méthane est brûlé si CO 2 est libéré dans l'atmosphère au lieu de méthane, parce que le méthane est un gaz à effet de serre plus efficace. Récemment, le méthane émis par les mines de charbon a été utilisé avec succès pour produire de l'électricité.
Clathrates
La libération de méthane de l'Arctique à partir pergélisol et clathrates de méthane est une conséquence attendue et autre cause de réchauffement de la planète .
Sécurité
Le méthane ne est pas toxique; Cependant, il est extrêmement inflammable et peut former des mélanges explosifs avec l'air. Le méthane est violemment réactif avec oxydants, les halogènes , et certains composés contenant des halogènes. Le méthane est également un asphyxiant et peut déplacer l'oxygène dans un espace clos. Asphyxie peut entraîner si la concentration en oxygène est réduite à moins d'environ 16% par le déplacement, comme la plupart des gens peuvent tolérer une réduction de 21% à 16% sans effets nocifs. La concentration de méthane au cours de laquelle le risque d'asphyxie devient significatif est beaucoup plus élevée que la concentration de 5 à 15% dans un mélange inflammable ou explosif. Effets possibles sur la santé de la respiration en méthane à des concentrations élevées, entraînant une carence en oxygène, sont respiration et un pouls, le manque de coordination musculaire, troubles émotifs, des nausées et des vomissements, une perte de conscience, un collapsus respiratoire et la mort ont augmenté. Le méthane des effluents gazeux peut pénétrer l'intérieur des bâtiments situés à proximité décharges et exposent les occupants à des niveaux significatifs de méthane. Certains bâtiments ont spécialement conçu des systèmes de récupération en dessous de leurs sous-sols à capturer activement ce gaz et de ventilation à l'écart de l'immeuble.
explosions de gaz de méthane sont responsables de nombreuses catastrophes minières mortelles. Une explosion de gaz méthane a été la cause de la Upper Big Branch catastrophe minière de charbon en Virginie-Occidentale le 5 Avril 2010, tuant 25.
Méthane extraterrestre
Le méthane a été détecté ou est censé exister dans plusieurs endroits du système solaire . Dans la plupart des cas, il est censé avoir été créé par processus abiotiques. Exceptions possibles sont Mars et Titan.
- Vénus - l'atmosphère contient une quantité importante de méthane à partir de 60 km (37 mi) à la surface d'après les données recueillies par le Pioneer Venus Grand Probe Neutre spectromètre de masse
- Lune - traces sont dégazés de la surface
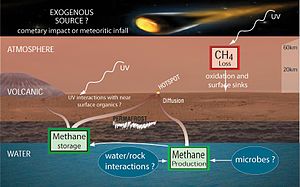
- Mars - la Atmosphère martienne contient 10 nmol / mol de méthane. La source de méthane sur Mars n'a pas été déterminée. Des recherches récentes suggèrent que le méthane peut provenir de volcans , des lignes de faille , ou méthanogènes, ou qu'il peut être un sous-produit de décharges électriques de tourbillons de poussière et les tempêtes de poussière, ou qu'il peut être le résultat d' UV rayonnement. En Janvier 2009, les scientifiques de la NASA ont annoncé qu'ils avaient découvert que la planète vents souvent du méthane dans l'atmosphère dans des domaines spécifiques, conduisant certains à spéculer cela peut être un signe de l'activité biologique se passe sous la surface. Analyse des observations faites par un Météo de recherche et le modèle de prévision pour Mars (MarsWRF) et connexes Mars modèle de circulation générale (MGCM) suggère qu'il est potentiellement possible d'isoler source panache de méthane endroits à quelques dizaines de kilomètres, ce qui est dans les capacités de mèches de futurs robots martiens . Le Curiosité rover, qui a atterri sur Mars en Août 2012, est capable de faire des mesures qui distinguent entre les différents isotopologues de méthane; mais même si la mission est de déterminer que la vie martienne microscopique est la source du méthane, les formes de vie susceptibles résident loin de la surface, en dehors de la portée du rover. Curiosité de Analyse des échantillons sur Mars (SAM) instrument est capable de suivre la présence de méthane dans le temps afin de déterminer se il est constant, variable saisonnière, ou aléatoire, fournir d'autres indices sur sa source. Les premières mesures avec le Spectromètre laser accordable (TLS) a indiqué qu'il y est moins de 5 ppb de méthane sur le site d'atterrissage au point de la mesure. Le Mars Trace Gas Orbiter Mission prévu de lancer en 2016 serait en outre étudier le méthane, ainsi que ses produits de décomposition tels que le formaldéhyde et le méthanol . En variante, ces composés peuvent être reconstituées à la place par des moyens géologiques volcaniques ou autres, telles que la serpentinisation.
- Jupiter - l'atmosphère contient environ 0,3% de méthane
- Saturn - l'atmosphère contient environ 0,4% de méthane
- Japet
- Titan - l'atmosphère contient 1,6% de méthane et des milliers de lacs de méthane ont été détectées sur la surface dans la haute atmosphère, le méthane est converti en des molécules plus complexes notamment l'acétylène , un procédé qui produit également moléculaire hydrogène . Il est prouvé que l'acétylène et de l'hydrogène sont recyclés en méthane près de la surface. Ceci suggère la présence soit d'un catalyseur exotique, ou une forme de vie inconnue méthanogène. Un lac apparente de méthane liquide a été repéré par la mission Cassini-Huygens sonde, provoquant chercheurs à spéculer sur la possibilité de la vie sur Titan. douches de méthane, probablement provoquées par le changement des saisons, ont également été observés.
- Encelade - l'atmosphère contient 1,7% de méthane
- Uranus - l'atmosphère contient 2,3% de méthane
- Ariel - le méthane est considéré comme un constituant de la glace de surface d'Ariel
- Miranda
- Oberon - environ 20% de la glace de surface d'Obéron est composé de composés carbone / azote liés au méthane
- Titania - environ 20% de la glace de surface de Titania est composé de composés organiques liés au méthane
- Umbriel - le méthane est un constituant de la glace de surface de Umbriel
- Neptune - l'atmosphère contient 1,6% de méthane
- Triton - Triton a une atmosphère d'azote ténu avec de petites quantités de méthane près de la surface.
- Pluton - spectroscopique analyse de la surface de Pluton révèle à contenir des traces de méthane
- Charon - méthane est considéré présent sur Charon, mais il ne est pas complètement confirmée
- Eris - lumière infrarouge de l'objet a révélé la présence de glace de méthane
- La comète de Halley
- Comet Hyakutake - observations terrestres trouvé l'éthane et de méthane dans la comète
- Planètes extrasolaires - le méthane a été détectée sur la planète extrasolaire 189733b HD; ce est la première détection d'un composé organique sur une planète en dehors du système solaire. Son origine est inconnue, puisque haute température de la planète (700 ° C) devrait normalement favoriser la formation de monoxyde de carbone à la place. La recherche indique que les météorites qui claquent contre les exoplanètes atmosphères pourraient ajouter gaz organiques tels que le méthane, les exoplanètes font regarder comme si elles sont habitées par la vie, même se ils ne sont pas.
- Les nuages interstellaires
