
Nickel
Contexte des écoles Wikipédia
Enfants SOS offrent un chargement complet de la sélection pour les écoles pour une utilisation sur les intranets des écoles. parrainage SOS enfant est cool!
| Nickel | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
28 Ni | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||
lustré, métallique, et l'argent avec une teinte d'or  | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | nickel, Ni, 28 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / n ɪ k əl / NIK -əl | ||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | métal de transition | ||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 10, 4, ré | ||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 58,6934 (4) (2) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Ar ] 4s 2 3d 8 ou [ Ar ] 4s 3d 1 9 (voir le texte) 2, 8, 16, 2 ou 2, 8, 17, 1 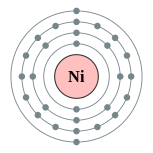 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Axel Fredrik Cronstedt (1751) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Axel Fredrik Cronstedt (1751) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 8,908 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 7,81 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1728 K , 1455 ° C, 2651 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 3186 K, 2913 ° C, 5275 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 17,48 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 377,5 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 26,07 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 4, 3, 2, 1, -1 (Légèrement oxyde de base) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,91 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 737,1 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1753,0 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 3395 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 124 h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 124 ± 16 heures | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 163 h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique à faces centrées  | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | ferromagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 69,3 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 90,9 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 13,4 um · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | ( rt) 4,900 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 200 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 76 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 180 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,31 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 4.0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 638 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 700 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-02-0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de nickel | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Le nickel est un élément chimique avec le symbole chimique Ni et de numéro atomique 28. Ce est un brillant blanc argenté métallique avec une légère teinte dorée. Nickel appartient aux métaux de transition et il est difficile et ductile. Le nickel pur montre une importante activité chimique qui peut être observé lorsque le nickel est poudre pour maximiser le exposé zone de surface sur laquelle des réactions peuvent se produire, mais de plus grandes pièces de métal sont lents à réagir avec de l'air dans les conditions ambiantes en raison de la formation d'une surface d'oxyde protectrice. Même alors, le nickel est suffisamment réactif avec l'oxygène de sorte que nickel natif est rarement trouvé sur la surface de la Terre, étant essentiellement confinée à l'intérieur des plus grande météorites nickel-fer qui ont été protégés de l'oxydation pendant leur temps dans l'espace. Sur Terre, comme le nickel natif se trouve toujours en combinaison avec du fer, un reflet de l'origine de ces éléments que les principaux produits finaux de nucléosynthèse supernova. Un mélange de fer-nickel est pensé pour composer la Terre noyau interne.
L'utilisation de nickel (sous forme naturelle fulgurante alliage nickel-fer) a été tracée dès 3500 av. Nickel a été isolé et classé comme un élément chimique en 1751 par Axel Fredrik Cronstedt, qui ont d'abord confondu son minerai de minerai de cuivre. Le nom de l'élément provient d'un sprite espiègle de la mythologie de mineur allemand, Nickel (similaire à Old Nick), qui personnifiait le fait que les minerais de cuivre-nickel résisté raffinement en cuivre. Une source importante économiquement de nickel est le fer du minerai limonite, qui contient souvent 1-2% de nickel. Autres minéraux importants de minerai de Nickel comprennent garniérite, et pentlandite. Les principaux sites de production comprennent Région de Sudbury au Canada (qui est pensé pour être d'origine météorique), Nouvelle-Calédonie dans le Pacifique et Norilsk en Russie.
En raison de la lenteur de nickel l'oxydation à la température ambiante, il est considéré résistant à la corrosion. Historiquement cela a conduit à son utilisation pour les métaux de placage comme le fer et laiton, son utilisation pour appareils chimiques, et son utilisation dans certains alliages qui conservent un vernis argenté élevé, comme Argent allemand. Environ 6% de la production mondiale de nickel est encore utilisé pour résistant à la corrosion pure nickelage. Nickel était une fois une composante commune des pièces, mais a été largement remplacée par le fer moins cher à cet effet, d'autant plus que le métal est une peau allergène pour certaines personnes.
Le nickel est l'un des quatre éléments qui sont ferromagnétique autour de la température ambiante. Alnico aimants permanents à base de nickel sont en partie de la force intermédiaire entre aimants permanents à base de fer et des aimants de terres rares. Le métal est surtout valable dans le monde moderne pour la alliages qu'il forme; environ 60% de la production mondiale est utilisé dans les aciers nickel-(en particulier acier inoxydable). Autres alliages courants, ainsi que quelques nouvelles superalliages, constituent la majeure partie du reste de l'utilisation mondiale de nickel, avec utilise chimiques pour les composés de nickel consommant moins de 3% de la production. En tant que composé, le nickel a un certain nombre d'utilisations de fabrication niche chimiques, comme un catalyseur pour l'hydrogénation. Les enzymes de certains micro-organismes et les plantes contiennent du nickel en tant que site actif, ce qui rend le métal d'un élément nutritif essentiel pour eux.
Caractéristiques
Propriétés atomiques et physiques
Le nickel est un métal blanc argenté avec une légère teinte dorée qui prend un beau poli. Il est l'un des quatre éléments qui sont magnétiques à ou près de la température ambiante, les autres étant le fer, le cobalt et le gadolinium . Son Température de Curie est de 355 ° C, ce qui signifie que le nickel en vrac est non magnétique au-dessus de cette température. La cellule unitaire de nickel est un visage cube centré avec le paramètre de maille de 0,352 nm donnant une rayon atomique de 0,124 nm. Nickel appartient aux métaux de transition et il est difficile et ductile.
Litige de configuration Electron
L'atome de nickel a deux configurations électroniques, [ar] 4s 2 3d 8 et [Ar] 4s 1 3d 9, qui sont très proches en énergie, où le symbole [Ar] se réfère à l' argon structure de base -comme. Il ya un certain désaccord quant à ce qui devrait être considéré comme la configuration de plus basse énergie. manuels de chimie citent la configuration électronique du nickel [Ar] 4s 2 3d 8, ou de manière équivalente comme [Ar] 3d 8 4s 2. Cette configuration est d'accord avec la Règle d'ordonnancement d'énergie Madelung, qui prédit que 4s est rempli avant 3d. Il est soutenu par le fait expérimental que l'état de plus basse énergie de l'atome de nickel est un niveau 4s 2 3d 8 de l'énergie, en particulier la 3d 8 (3 F) 4s 2 3 F, J = 4 niveaux.
Cependant chacun de ces deux configurations en fait donne lieu à un ensemble d'états à différentes énergies. Les deux ensembles d'énergies se chevauchent et l'énergie moyenne des Etats ayant une configuration [Ar] 4s 1 3d 9 est en fait inférieure à l'énergie moyenne des Etats ayant une configuration [Ar] 4s 2 3d 8. Pour cette raison, la littérature de recherche sur des calculs atomiques cite la configuration de l'état fondamental de nickel comme une 4s 3d 9.
Isotopes
Naturellement nickel survenant est composé de cinq stables isotopes ; 58 Ni, 60 Ni, Ni 61, 62 et 64 Ni Ni Ni avec 58 étant le plus abondant (68,077% abondance naturelle). 62 Ni est le nucléide stable plus de tous les éléments existants, avec une énergie de liaison supérieure à la fois 56 Fe, souvent incorrectement cité comme le plus stable, et 58 Fe. 18 des radio-isotopes ont été caractérisés par le plus stable étant 59 Ni avec une demi-vie de 76000 années, Ni 63, avec une demi-vie de 100,1 années, Ni et 56 avec une demi-vie de 6,077 jours. Tout le reste isotopes radioactifs ont des demi-vies qui sont moins de 60 heures et la majorité d'entre eux ont des demi-vies qui sont moins de 30 secondes. Cet élément a également une méta Etat.
Nickel-56 est produite par le processus de combustion et de silicium tard libéré en grandes quantités lors type Ia supernovae . La forme de la courbe de lumière de ces supernovae intermédiaire à la fin des temps correspond à la désintégration par capture d'électrons du nickel-56 au cobalt -56 et finalement au fer-56. Nickel-59 est une longue durée de vie cosmogénique radionucléides avec une demi-vie de 76.000 ans. 59 Ni a trouvé de nombreuses applications dans géologie isotopique. Ni 59 a été utilisé à ce jour, l'âge terrestre météorites et de déterminer l'abondance de poussière extraterrestre dans la glace et les sédiments . Nickel-60 est le produit de filiation du radionucléide éteint 60 Fe, qui se désintègre avec une demi-vie de 2,6 millions d'années. Parce que 60 Fe a une telle longue demi-vie, sa persistance dans les matériaux dans le système solaire à des concentrations suffisamment élevées peut avoir généré variations observables dans la composition isotopique de 60 Ni. Par conséquent, l'abondance de 60 Ni présent dans la matière extraterrestre peut donner un aperçu de l'origine du système solaire et début de son histoire. Nickel 62 a la plus haute l'énergie par nucléon d'un isotope de liaison pour tout élément (8,7946 MeV / nucléon). Isotopes plus lourds de 62 Ni ne peut être formé par la fusion nucléaire sans perdre d'énergie. Ni 48, découvert en 1999, est l'élément le plus isotope lourd de protons riche connue. Avec 28 protons et 20 neutrons 48 Ni est " Double Magic "(comme 208 Pb ) et donc particulièrement stable.
Les isotopes de gamme de nickel dans poids atomique de 48 u (48 Ni) à u 78 (78 Ni). La demi-vie de 78 nickel a récemment été mesurée à 110 millisecondes, et on pense un isotope important nucléosynthèse supernova d'éléments plus lourds que le fer.
Occurrence

Sur la Terre, le nickel se produit le plus souvent en combinaison avec du soufre et du fer dans pentlandite, avec du soufre dans millerite, avec l'arsenic dans le minéral nickeline, et avec de l'arsenic et de soufre dans le nickel galène. Nickel est communément trouvée dans météorites de fer que les alliages kamacite et taenite.
La majeure partie du nickel extrait provient de deux types de dépôts de minerai. Les premiers sont latérites où les principaux minéraux de minerai sont nickélifère limonite: (Fe, Ni) O (OH) et garnierite (un silicate de nickel hydraté): (Ni, Mg) 3 Si 2 O 5 (OH) 4. Les seconds sont des gisements de sulfures magmatiques où le minéral principal minerai est pentlandite: (Ni, Fe) 9 S 8.
L'Australie et la Nouvelle-Calédonie ont les plus grandes réserves d'estimation (45% tous ensemble).
En termes de ressources mondiales, les ressources terrestres identifiés en moyenne 1% de nickel ou plus contiennent au moins 130 millions de tonnes de nickel (environ le double de réserves connues). Environ 60% est en latérites et 40% est en les dépôts de sulfure.
Basé sur preuves géophysique, la plupart du nickel sur Terre est postulé à se concentrer dans la Terre noyau externe et noyau interne. Kamacite et taenite sont d'origine naturelle alliages de fer et de nickel. Pour kamacite l'alliage est généralement dans la proportion de 90:10 à 95: 5, bien que des impuretés telles que du cobalt ou du carbone peut être présent, tandis que pour taenite la teneur en nickel est comprise entre 20% et 65%. Kamacite et taenite se produisent dans météorites de fer de nickel.
Composés

La plus courante état d'oxydation du nickel est 2, mais les composés de Ni 0, Ni +, Ni 3+ et sont bien connus, et Ni 4+ a été démontrée.
Nickel (0)
Tetracarbonylnickel (Ni (CO) 4), découvert par Ludwig Mond, est un liquide volatil, très toxique à la température ambiante. Le chauffage, le complexe se décompose retour au nickel et monoxyde de carbone:
- Ni (CO) 4
 Ni + 4 CO
Ni + 4 CO
Ce comportement est exploitée dans le Procédé de purification d'Mond nickel, tel que décrit ci-dessus. Le nickel liés (0) complexe bis (cyclooctadiène) nickel (0) est un catalyseur utile dans la chimie organonickel due aux déplacés facilement ligands morue.
Nickel (I)
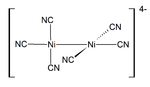
Nickel (I) et des composés complexes sont rares. Le rouge foncé diamagnétique K 4 [Ni 2 (CN) 6] est un exemple représentatif de Ni (I). Il est préparé par réduction de K 2 [Ni 2 (CN) 6] en utilisant l'amalgame de sodium. Ce composé est instable et libère du gaz H 2 de l'eau.
Nickel (II)


Nickel (II) forme des composés avec les anions communs, à savoir le sulfure, sulfate, carbonate, hydroxyde, les carboxylates, et les halogénures. Sulfate de nickel (II) est produit en grandes quantités par dissolution de métaux ou d'oxydes de nickel dans l'acide sulfurique. Il existe à la fois comme un hexa- et heptahydrates. Ce composé est utile pour nickel électrolytique.
Les quatre halogènes forment des composés de nickel, lesquels adoptent géométries octaédriques. Nickel (II) est la plus courante, et son comportement est indicative des autres halogénures. Nickel (II) est produit en dissolvant les résidus de nickel dans de l'acide chlorhydrique. Le dichlorure est habituellement rencontré hexahydraté comme le vert, mais il peut être déshydraté pour donner le jaune NiCl2 anhydre. Certains nickel tétracoordonné (II) complexes forment deux géométries planes tétraédriques et carrés. Les complexes sont tétraédriques complexes paramagnétiques et planes carré sont diamagnétique. Cet équilibre ainsi que la formation de complexes octaédriques contraste avec le comportement des complexes bivalents du groupe 10 métaux lourds, le palladium (II) et de platine (II), qui ont tendance à ne adopter que des complexes plan carré.
Nickelocène est connu; il a un nombre d'électrons de 20, ce qui rend relativement instable.

Nickel (III) et (IV)
Pour les composés simples de nickel (III) et nickel (IV) se produit uniquement avec du fluorure et des oxydes, à l'exception de KNiIO 6, qui peut être considéré comme un sel formelle de la [IO 6] 5- ions. Ni (IV) est présent dans l'oxyde mixte BANIO 3, tandis que Ni (III) est présent en nickel (III) de l'oxyde, qui est utilisé en tant que cathode dans de nombreux batteries rechargeables, y compris nickel-cadmium, nickel-fer, nickel-hydrogène, et nickel-hydrure métallique, et utilisé par certains fabricants Les batteries Li-ion. Nickel (III) peut être stabilisé par des ligands donneurs σ tels que thiols et phosphines.
Histoire
Parce que les minerais de nickel sont facilement confondus avec des minerais d'argent, la compréhension de ce métal et son utilisation remonte à l'époque relativement récente. Cependant, l'utilisation involontaire de nickel est ancienne et remonte aussi loin que 3500 ans avant JC. Bronzes de ce qui est maintenant la Syrie avait contenu jusqu'à 2% de nickel. En outre, il ya des manuscrits chinois suggérant que «cuivre blanc» ( cupronickel, connu sous le nom Baitong) il a été utilisé entre 1700 et 1400 avant JC. Ce cuivre blanc paktong a été exporté en Grande-Bretagne dès le 17ème siècle, mais la teneur en nickel de cet alliage n'a été découvert qu'en 1822.
En Allemagne médiévale, un minéral rouge a été trouvé dans le Erzgebirge (Monts Métallifères) qui ressemblait à du minerai de cuivre. Cependant, lorsque les mineurs ne ont pas pu extraire tout le cuivre de lui, ils ont blâmé un sprite espiègle de la mythologie allemande, Nickel (similaire à Old Nick), pour l'assaillent cuivre. Ils ont appelé ce minerai Kupfernickel du Kupfer allemande pour le cuivre. Ce minerai est maintenant connu pour être nickeline ou niccolite, nickel arséniure. En 1751, le baron Axel Fredrik Cronstedt essayait pour extraire le cuivre de kupfernickel et la place a produit un métal blanc qu'il nommé d'après l'esprit qui avait donné son nom au minéral, nickel. En allemand moderne, Kupfernickel ou Kupfer-Nickel désigne l'alliage cupronickel.
Après sa découverte, la seule source de nickel est le Kupfernickel rare mais, à partir de 1824 sur, le nickel a été obtenue comme sous-produit de la production bleu cobalt. Le premier producteur à grande échelle de nickel est la Norvège, qui exploitait riche en nickel pyrrhotite de 1848 sur. L'introduction de nickel dans la production d'acier en 1889 a augmenté la demande pour le nickel, et les gisements de nickel de Nouvelle-Calédonie , qui ont été découverts en 1865, a fourni la plupart de l'approvisionnement du monde entre 1875 et 1915. La découverte d'importants gisements dans le Bassin de Sudbury, au Canada en 1883, en Norilsk-Talnakh, la Russie en 1920, et dans le Merensky Reef, Afrique du Sud en 1924 a rendu la production à grande échelle de nickel possible.

Nickel a été un élément de pièces de monnaie depuis le milieu du 19ème siècle. Aux États-Unis, le terme "nickel" ou "nick" à l'origine appliqué au cuivre-nickel Flying Eagle cent, qui a remplacé le cuivre avec 12% de nickel 1857-1858, le Indian Head cent du même alliage 1859-1864. Plus tard encore, en 1865, le terme désigné trois-cent de nickel, de nickel a augmenté à 25%. En 1866, le cinq cents bouclier nickel (25% de nickel, 75% de cuivre) se approprie la désignation. Avec la proportion de l'alliage, ce terme est utilisé dans la présente pour les États-Unis. Coins de nickel presque pur ont été utilisés la première fois en 1881 en Suisse, et plus notamment 99,9% de nickel pièces de cinq cents ont été frappés au Canada (plus grand producteur de nickel au monde à l'époque) pendant les années non-guerre 1922-1981, et leur teneur en métaux fait ces pièces magnétique. Au cours de la période de la guerre de 1942 à 1945, plusieurs ou la totalité du nickel a été retiré de pièces de monnaie canadiennes et américaines, en raison de la guerre critique l'utilisation de nickel dans l'armure. Canada alliages commuté de nouveau à l'acier plaqué au cours de la Guerre de Corée, mais a été contraint de cesser de faire nickel "nickels" pures en 1981, se réservant le pur 99,9% alliage de nickel à partir de 1968 seulement pour ses pièces de plus grande valeur. Enfin, dans le 21e siècle, avec la hausse des prix du nickel, la plupart des pays qui utilisaient autrefois nickel dans leurs pièces de monnaie ont abandonné le métal pour des raisons de coûts, et les Etats-Unis cinq cents reste l'un des quelques pièces de monnaie qui utilise encore le métal autre que l'extérieur rien placage.
La production mondiale
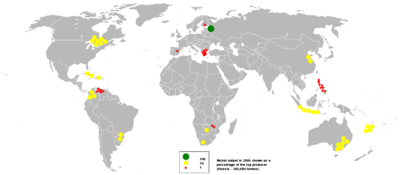
| Production et les réserves de la mine | 2010 | 2011 | Réserves |
|---|---|---|---|
| Australie | 170000 | 180000 | 24000000 |
| Botswana | 28000 | 32000 | 490000 |
| Brésil | 59100 | 83000 | 8700000 |
| Canada | 158000 | 200000 | 3300000 |
| Chine | 79000 | 80000 | 3000000 |
| Colombie | 72000 | 72000 | 720000 |
| Cuba | 70000 | 74000 | 5500000 |
| République Dominicaine | 0 | 14000 | 1000000 |
| Indonésie | 232000 | 230000 | 3900000 |
| Madagascar | 15000 | 25000 | 1600000 |
| Nouvelle-Calédonie | 130000 | 140000 | 12000000 |
| Philippines | 173000 | 230000 | 1100000 |
| Russie | 269000 | 280000 | 6000000 |
| Afrique Du Sud | 40000 | 42000 | 3700000 |
| Autres pays | 99000 | 100000 | 4600000 |
| Total mondial (tonnes métriques, arrondies) | 1590000 | 1800000 | 80000000 |
En 2011, la Russie était le plus grand producteur de nickel avec environ un cinquième part du monde suivi de près par le Canada, l'Australie et l'Indonésie et les Philippines, tel que rapporté par le US Geological Survey. Les plus grands gisements de nickel en Europe non russe sont situés en Finlande et le deuxième plus grand en Grèce. Un gisement de nickel dans l'ouest de la Turquie avait été exploitée, avec cet endroit étant particulièrement pratique pour les fonderies européennes, sidérurgistes, et les usines.
Ressources terrestres identifiés en moyenne 1% de nickel ou plus contiennent au moins 130 millions de tonnes de nickel. Environ 60% est en latérites et 40% est en gisements de sulfures. En outre, d'importantes ressources en eau profonde de nickel sont en croûtes et nodules couvrant de vastes zones du fond de l'océan, en particulier dans l'océan Pacifique manganèse.
L'une localité aux États-Unis où le nickel a été exploité commercialement est Riddle, Oregon, où se trouvent plusieurs miles carrés de nickel portant dépôts de surface de garniérite. La mine a fermé en 1987. La Projet de mine Eagle est une nouvelle mine de nickel proposé dans Michigan péninsule supérieure.
Extraction et purification
Nickel est récupéré par métallurgie extractive. Le nickel est extrait à partir de ses minerais par des procédés de grillage et de réduction classiques qui produisent un métal supérieure à 75% de pureté. Dans de nombreux applications en acier inoxydable, 75% de nickel pur peuvent être utilisés sans autre purification, en fonction de la composition des impuretés.
La plupart des minerais sulfurés ont traditionnellement été traités à l'aide techniques pyrométallurgiques pour produire un mat pour raffinage. Les progrès récents dans hydrométallurgie ont abouti à la purification de nickel significative l'utilisation de ces processus. La plupart des gisements de sulfures ont traditionnellement été traitée par la concentration à travers une processus de mousse de flottation suivie extraction pyrométallurgique. Dans les procédés hydrométallurgiques, nickel de minerais sulfurés subissent flottation (flottation différentielle si le rapport Ni / Fe est trop faible), puis fondu. Après la production de la matte de nickel, plus le traitement est effectué par l'intermédiaire du Processus Sherritt-Gordon. En premier lieu, le cuivre est éliminé par addition sulfure d'hydrogène, en laissant seulement un concentré de cobalt et de nickel. Ensuite, l'extraction par solvant est utilisée pour séparer le cobalt et le nickel, la concentration finale en nickel supérieure à 99%.

Électro
Une deuxième forme courante de raffinage consiste en outre la lixiviation de la matte de métal dans une solution de sel de nickel, suivie de l'extraction électrolytique du nickel de la solution par plaquage sur une cathode elle aussi nickel électrolytique.
Procédé Mond

La purification d'oxydes de nickel afin d'obtenir le métal pur est réalisée via le Procédé Mond, ce qui augmente le concentré de nickel à plus de 99,99% de pureté. Ce processus a été breveté par L. Mond et a été en usage industriel depuis avant le début du 20e siècle. Dans le procédé, le nickel est mis à réagir avec du monoxyde de carbone à environ 40-80 ° C pour former nickel carbonyle en présence d'un catalyseur au soufre. Fer donne pentacarbonyle de fer aussi, mais cette réaction est lente. Si nécessaire, il peut être séparé par distillation. Dicobaltoctacarbonyle est également formée dans ce processus, mais il se décompose à tetracobalt dodécacarbonyle à la température de réaction pour donner un solide non volatile.
Le nickel est de nouveau obtenu à partir du nickel carbonyle par l'un de deux procédés. Il peut être passé à travers une grande chambre à haute température dans laquelle des dizaines de milliers de sphères en nickel, appelées pastilles, sont constamment agités. Il se décompose puis le dépôt de nickel pur sur les sphères de nickel. Alternativement, le nickel carbonyle peut être décomposé dans une chambre plus petite à 230 ° C pour créer la poudre fine de nickel. Le monoxyde de carbone résultant est recyclée et réutilisée dans le processus. Le nickel de haute pureté produit par ce procédé est appelé «nickel carbonyle".
valeur du métal
Le prix du nickel a bondi de marché en 2006 et les premiers mois de 2007; à compter du 5 Avril 2007, le métal se échangeait à 52 300 USD / tonne ou 1,47 USD / oz Le prix se écroula suite de ces sommets, et à partir du 19 Janvier 2009, le métal se échangeait à 10 880 USD / tonne.
Le Pièce de nickel US contient 0,04 oz (1,25 g) de nickel, qui au prix Avril 2007 valait 6,5 cents, avec 3,75 grammes de cuivre vaut environ trois cents, ce qui rend la valeur métallique sur 9 cents. Depuis la valeur nominale d'un nickel est 5 cents, ce fait une cible attrayante pour la fusion par des gens qui veulent vendre les métaux à profit. Cependant, la United States Mint, en prévision de cette pratique, mise en œuvre de nouvelles règles provisoires le 14 Décembre 2006, sous réserve de commentaires du public pendant 30 jours, qui criminalisent la fonte et l'exportation de cents et nickels. Les contrevenants peuvent être punis d'une amende pouvant aller jusqu'à $ 10,000 et / ou emprisonnés pour une durée maximale de cinq ans.
Au 16 Septembre 2011, la valeur de fusion de nickel US $ 0,0600409 est, ce qui est 20% plus élevé que la valeur nominale.
Applications

La fraction de la production mondiale de nickel actuellement utilisé pour différentes applications est la suivante: 46% pour la fabrication des aciers au nickel; 34% en non ferreux alliages et superalliages; 14% la galvanoplastie, et de 6% dans d'autres utilisations.
Le nickel est utilisé dans de nombreux produits industriels et de consommation spécifiques et reconnaissables, y compris acier inoxydable, aimants Alnico, monnaie, piles rechargeables, cordes de guitare électrique, capsules de microphone, et alliages spéciaux. Il est également utilisé pour le placage et comme une teinte verte en verre. Le nickel est un métal par excellence de l'alliage, et son utilisation principale est dans les aciers au nickel et nickel fontes, dont il existe de nombreuses variétés. Il est aussi largement utilisé dans de nombreux autres alliages, tels que les laitons et les bronzes de nickel et les alliages de cuivre, le chrome, l'aluminium, le plomb, le cobalt, l'argent et l'or ( Inconel, Incoloy, Monel, Nimonic).

En raison de sa résistance à la corrosion, le nickel a été parfois utilisé historiquement comme un substitut à l'argent décoratif. Nickel a également été parfois utilisé dans certains pays après 1859 comme une monnaie métallique pas cher (voir ci-dessus) mais à partir des années ultérieures du 20ème siècle a largement remplacé par moins cher acier inoxydable (c.-à-fer) alliages, à l'exception notamment des Etats-Unis.
Le nickel est un excellent agent d'alliage pour certains autres métaux précieux, et ainsi utilisé dans ce qu'on appelle pyroanalyse, comme un collecteur de éléments du groupe du platine (MGP). En tant que tel, est capable de nickel collection complète de tous les éléments de PGE 6 à partir de minerais, en plus de la collecte partielle de l'or. Mines de nickel à haut débit peuvent également se engager dans la récupération PGE (principalement de platine et palladium ); exemples sont Norilsk en Russie et le bassin de Sudbury au Canada.
mousse de nickel ou de nickel Mesh est utilisée dans des électrodes à diffusion de gaz pour les piles à combustible alcalines.
Le nickel et ses alliages sont fréquemment utilisés comme catalyseurs pour hydrogénation réactions. Raney nickel, un alliage nickel-aluminium finement divisée, est une forme courante, cependant catalyseurs connexes sont aussi souvent utilisés, y compris les catalyseurs 'Raney de type «connexe.
Le nickel est un matériau magnétostrictif naturellement, ce qui signifie que, en présence d'un champ magnétique, le matériau est soumis à une faible variation de longueur. Dans le cas du nickel, cette variation de longueur est négative (contraction de la matière), qui est connu comme négatif magnétostriction et est de l'ordre de 50 ppm.
Le nickel est utilisé comme liant dans la cémenté carbure de tungstène ou en métal dur et l'industrie utilisé dans des proportions de six à 12% en poids. Le nickel peut rendre le carbure de tungstène et ajoute des propriétés magnétiques résistants à la corrosion sur les pièces de carbure de tungstène cémenté, bien que la dureté est inférieure à celles des pièces à base de liant de cobalt.
Rôle biologique
Bien que non reconnu jusqu'aux années 1970, le nickel joue un rôle important dans la biologie des micro-organismes et des plantes. L'enzyme de la plante uréase (une enzyme qui aide à l'hydrolyse de l' urée ) contient du nickel. Le NiFe- hydrogénases contiennent du nickel en plus groupes fer-soufre. Cette [NiFe] -hydrogenases caractéristique oxyder H 2. Un coenzyme nickel-tétrapyrrole, Cofacteur F430, est présent dans le méthyl coenzyme M réductase, qui alimente méthanogène archées. L'une des enzymes déshydrogénase de monoxyde de carbone est constituée d'un groupe de Fe-Ni-S. D'autres enzymes contenant du nickel comprennent une classe bactérienne rare de la superoxyde dismutase et glyoxalase I enzymes dans les bactéries et les parasites plusieurs eucaryote trypanosomes parasites (cette enzyme dans les organismes supérieurs, y compris la levure et les mammifères, utilise divalent zinc , Zn 2+).
Toxicité
Aux États-Unis, le niveau de risque minimal de nickel et de ses composés est réglé à 0,2 ug / m 3 pour l'inhalation pendant 15 à 364 jours. Nickel fumées de sulfure et la poussière sont soupçonnés autres composés de nickel cancérigènes, et divers peuvent être ainsi. Nickel carbonyle, [Ni (CO) 4], est un gaz extrêmement toxique. La toxicité des métaux carbonyles est une fonction à la fois de la toxicité du métal ainsi que la capacité du groupe carbonyle pour donner de très toxiques du monoxyde de carbone gazeux, et celui-ci ne fait pas exception; carbonyle de nickel est aussi explosif avec l'air. Les personnes sensibilisées peuvent montrer une allergie au nickel, affectant leur peau, également connus comme une dermatite. Sensibilité au nickel peut également être présent dans les patients avec pompholyx. Nickel est une cause importante d'allergies de contact, en partie en raison de son utilisation dans les bijoux destinés aux oreilles percées. Une allergie au nickel affectant les oreilles percées sont souvent marquées par, peau rouge démangeaisons. Beaucoup de boucles d'oreilles sont maintenant faites sans nickel en raison de ce problème. La quantité de nickel autorisés dans les produits qui entrent en contact avec la peau humaine est régie par la Union européenne . En 2002, les chercheurs ont trouvé des quantités de nickel étant émis par 1 et 2 Euro bien au-delà de ces normes. On pense en raison d'une réaction galvanique.
Nickel a été voté Allergène de l'année en 2008 par l'American Contact Dermatitis Society.
Les rapports ont également montré que l'activation induite à la fois du nickel de facteur inductible par hypoxie (HIF-1) et la régulation positive des gènes inductibles par l'hypoxie sont dus à des niveaux intracellulaires d'ascorbate épuisés. L'addition d'ascorbate dans le milieu de culture augmente le niveau intracellulaire de l'ascorbate et inversée à la fois la stabilisation induite par métal de HIF-1 et l'expression du gène HIF-1α-dépendante.
