
Brome
Contexte des écoles Wikipédia
SOS Enfants a essayé de rendre le contenu plus accessible Wikipedia par cette sélection des écoles. Un lien rapide pour le parrainage d'enfants est http://www.sponsor-a-child.org.uk/
| Brome | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
35 Br | |||||||||||||||||||
| |||||||||||||||||||
| Apparence | |||||||||||||||||||
| gaz / liquide: rouge-brun solide: lustre métallique  | |||||||||||||||||||
| Propriétés générales | |||||||||||||||||||
| Nom, symbole, nombre | brome, Br, 35 | ||||||||||||||||||
| Prononciation | / b r oʊ m Je n / Broh -meen ou / b r oʊ m ɨ n / Broh -min | ||||||||||||||||||
| Catégorie Metallic | halogène | ||||||||||||||||||
| Groupe, période, bloc | (17) les halogènes , 4, p | ||||||||||||||||||
| Poids atomique standard | 79,904 (1) | ||||||||||||||||||
| Configuration électronique | [ Ar ] 4s 2 4p 3d 10 5 2, 8, 18, 7 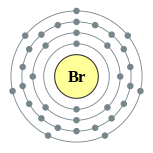 | ||||||||||||||||||
| Histoire | |||||||||||||||||||
| Découverte | Antoine Jérôme Balard et Leopold Gmelin (1825) | ||||||||||||||||||
| Premier isolement | Antoine Jérôme Balard et Leopold Gmelin (1825) | ||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||
| Phase | liquide | ||||||||||||||||||
| Densité (à proximité rt) | (Br 2, liquide) 3,1028 g · cm -3 | ||||||||||||||||||
| Point de fusion | 265,8 K , -7,2 ° C, 19 ° F | ||||||||||||||||||
| Point d'ébullition | 332,0 K, 58,8 ° C, 137,8 ° F | ||||||||||||||||||
| Point critique | 588 K, 10,34 MPa | ||||||||||||||||||
| La chaleur de fusion | (Br 2) 10,571 kJ · mol -1 | ||||||||||||||||||
| Chaleur de vaporisation | (Br 2) 29,96 kJ · mol -1 | ||||||||||||||||||
| Capacité thermique molaire | (Br 2) 75,69 J · mol -1 · K -1 | ||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||
| |||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||
| États d'oxydation | 7, 5, 4, 3, 1, -1 (Fortement acide oxyde) | ||||||||||||||||||
| Électronégativité | 2,96 (échelle de Pauling) | ||||||||||||||||||
| énergies d'ionisation | 1er: 1139,9 kJ · mol -1 | ||||||||||||||||||
| 2ème: 2103 kJ · mol -1 | |||||||||||||||||||
| 3ème: 3470 kJ · mol -1 | |||||||||||||||||||
| Rayon atomique | 120 h | ||||||||||||||||||
| Rayon covalente | 120 ± 15 heures | ||||||||||||||||||
| Rayon de Van der Waals | 185 h | ||||||||||||||||||
| Miscellanées | |||||||||||||||||||
| Crystal structure | orthorhombique  | ||||||||||||||||||
| Ordre magnétique | diamagnétique | ||||||||||||||||||
| Résistivité électrique | (20 ° C) de 7,8 × 10 10 Ω · m | ||||||||||||||||||
| Conductivité thermique | 0,122 W · m -1 · K -1 | ||||||||||||||||||
| Vitesse du son | (20 ° C) 206 m · s -1 | ||||||||||||||||||
| Numéro de registre CAS | 7726-95-6 | ||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||
| Article détaillé: Isotopes du brome | |||||||||||||||||||
| |||||||||||||||||||
Brome (de grec : βρῶμος, Bromos, qui signifie «odeur (de boucs)") est un élément chimique avec le symbole Br et numéro atomique de 35. Ce est dans le groupe halogène (17) . L'élément a été isolé indépendamment par deux chimistes, Carl Jacob Löwig et Antoine Jérôme Balard, en 1825-1826. Brome élémentaire est un liquide brun-rouge fumant à température ambiante, corrosif et toxique, ayant des propriétés entre ceux de chlore et l'iode . Brome libre ne se produit pas dans la nature, mais se produit sels d'halogénures solubles minérales incolores cristallin, analogue à sel de table.
Le brome est plus rare que les trois quarts environ des éléments dans la croûte de la Terre; Cependant, la forte solubilité de l'ion bromure a causé son accumulation dans les océans, et commercialement l'élément est facilement extraite de lacs de saumure, principalement aux États-Unis, Israël et la Chine. A propos de 556 000 tonnes ont été produites en 2007, un montant similaire à l'élément beaucoup plus abondante magnésium .
A des températures élevées, composés organo-bromés sont facilement convertis à des atomes de brome libre, un procédé qui sert à mettre fin chimique de radicaux libres des réactions en chaîne. Cela rend ces composés utiles ignifuges et ce est un usage industriel principal de brome, de consommer plus de la moitié de la production mondiale de l'élément. La même propriété permet composés organobromés volatils, sous l'action de la lumière solaire, pour former des atomes de brome libre dans l'atmosphère qui sont très efficaces pour la couche d'ozone . Cet effet secondaire indésirable a causé beaucoup de matières organiques bromés volatils communs comme bromure de méthyle, un pesticide qui était autrefois un grand consommateur industriel de brome, d'être abandonné. Utilisations restantes des composés de brome sont dans les fluides de forage et, comme intermédiaire dans la fabrication de produits chimiques organiques, et la photographie du film.
Le brome n'a aucune fonction essentielle chez les mammifères, mais il est de préférence utilisé au cours de chlorure par une enzyme anti-parasitaire dans le système immunitaire humain. Organobromides sont nécessaires et produites par voie enzymatique à partir de bromure de certaines formes de vie inférieures à la mer, en particulier des algues , et les cendres d'algues est une source de la découverte de brome. Comme un produit pharmaceutique, l'ion bromure simple, Br -, a des effets inhibiteurs sur le système nerveux central, et sels de bromure ont été une fois un sédatif médical majeur, avant d'être remplacé par des médicaments courte durée d'action. Ils conservent niche utilise comme antiépileptiques.
Caractéristiques
Physique

Brome élémentaire existe en tant que molécule diatomique, Br 2. Ce est un, mobile, liquide brun rougeâtre légèrement transparent dense, qui se évapore facilement au températures et pressions standard pour donner une vapeur orange (ses ressemble de couleurs dioxyde d'azote) qui a une odeur fortement désagréable qui ressemble à celle de chlore . Ce est l'un des deux éléments de la classification périodique des éléments qui sont connus pour être des liquides à température ambiante ( mercure est l'autre, bien que le césium , le gallium , et le rubidium fondre juste au-dessus de la température ambiante).
Sous une pression de 55 GPa (environ 540 000 fois la pression atmosphérique) de brome se transforme en un métal . À 75 GPa il convertit à une structure orthorhombique à faces centrées. À 100 GPa il convertit à une forme monoatomique orthorhombique corps centré.
Chimique
Étant moins réactif que le chlore mais plus réactif que l'iode , le brome réagit vigoureusement avec des métaux, en particulier en présence d'eau, pour donner des sels de bromure. Il est également réactifs vis plupart des composés organiques, en particulier sur illumination, des conditions qui favorisent la dissociation de la molécule diatomique en radicaux de brome:
- Br 2
 2 Br ·
2 Br ·
Il Obligations facilement avec de nombreux éléments et a une forte l'action de blanchiment.
Le brome est légèrement soluble dans l'eau , mais il est très soluble dans les solvants organiques tels que le disulfure de carbone, le tétrachlorure de carbone , aliphatiques d'alcools et de l'acide acétique .
Isotopes
Le brome a deux stables isotopes , 79 Br (50,69%) et 81 Br (49,31%). Au moins 23 autres radio-isotopes sont connus. Un grand nombre des isotopes du brome sont des produits de fission. Plusieurs des isotopes plus lourds de brome de fission sont retardés émetteurs de neutrons. Tous les isotopes radioactifs de brome sont relativement de courte durée. La demi-vie plus longue est le neutron déficiente 77 Br à 2,376 jours. La demi-vie plus longue sur le côté riche en neutrons est de 82 Br à 1,471 jours. Un certain nombre d'isotopes du brome présentent isomères métastables. Stable 79 Br présente une radioactifs isomère, avec une demi-vie de 4,86 secondes. Il se désintègre par transition isomérique à l'état du sol stable.
Histoire
Brome a été découvert indépendamment par deux chimistes, Carl Jacob Löwig et Antoine Balard, en 1825 et 1826, respectivement.
Balard trouvé des produits chimiques de bromure dans les cendres de algues de la marais salants de Montpellier. L'algue a été utilisé pour produire l'iode, mais contenait également du brome. Balard distille le brome à partir d'une solution de cendres d'algues, saturé avec du chlore. Les propriétés de la substance résultant ressemblait à celui d'un intermédiaire de chlore et l'iode; avec ces résultats qu'il a essayé de prouver que la substance était monochlorure d'iode (ICI), mais après avoir échoué à faire, il était sûr qu'il avait trouvé un nouvel élément et l'a nommé muride, dérivé du latin muria de mots pour la saumure.
Löwig isolé brome d'une source d'eau minérale de sa ville natale Bad Kreuznach en 1825. Löwig utilisé une solution du sel minéral saturé et extrait avec du chlore le brome avec éther diéthylique. Après évaporation de l'éther est resté un liquide brun. Avec ce liquide comme un échantillon de son travail, il a demandé une position dans le laboratoire de Leopold Gmelin dans Heidelberg. La publication des résultats a été retardée et Balard abord publié ses résultats.
Après les chimistes français Louis Nicolas Vauquelin, Louis Jacques Thénard, et Joseph-Louis Gay-Lussac a approuvé les expériences de la jeune pharmacien Balard, les résultats ont été présentés lors d'une conférence de la Académie des Sciences et publiée dans les Annales de Chimie et Physique. Dans sa publication Balard affirme qu'il a changé le nom de muride Brome sur la proposition de M. Anglada. (Brôme (brome) découle de la βρωμος grec (odeur).) D'autres sources affirment que le chimiste et physicien français Joseph-Louis Gay-Lussac a suggéré le nom Brôme de l'odeur caractéristique des vapeurs. Brome n'a pas été produit en grandes quantités jusqu'en 1860.
La première utilisation commerciale, en dehors de quelques applications médicales mineures, était l'utilisation de brome pour le daguerréotype. En 1840, il a été découvert que le brome a quelques avantages par rapport à la vapeur d'iode précédemment utilisée pour créer la lumière sensible couche aux halogénures d'argent utilisée pour daguerréotype.
Le bromure de potassium et le bromure de sodium ont été utilisés comme anticonvulsivants et sédatifs à la fin du 19e et début du 20e siècles, jusqu'à ce qu'ils ont été progressivement remplacées par l'hydrate de chloral et le barbituriques.
Occurrence


L'élément diatomique Br 2 ne se produit pas naturellement. Au lieu de cela, le brome existe exclusivement comme sels de bromure en quantités diffuses dans la croûte rocheuse. En raison de lessivage, sels de bromure ont accumulé dans l'eau de mer à 65 partie par million (ppm), qui est inférieure à chlorure. Le brome peut être récupéré économiquement de puits de saumure riche en bromure et des Dead Sea eaux (jusqu'à 50 000 ppm). Il existe dans la croûte de la Terre à une concentration moyenne de 0,4 ppm, ce qui en fait la 62e élément le plus abondant. La concentration en brome dans les sols varie normalement entre 5 et 40 ppm, mais certains sols volcaniques peut contenir jusqu'à 500 ppm. La concentration de brome dans l'atmosphère est extrêmement faible, à seulement quelques ppt. Un grand nombre de composés organo-bromés sont trouvés en petites quantités dans la nature.
Brome réserves de la Chine sont situés dans le Province de Shandong et les réserves de brome d'Israël sont contenus dans les eaux de la Mer Morte . La plus grande réserve de brome dans les États-Unis se trouve dans Comté de Columbia et Union County, Arkansas, Etats-Unis
Production
la production de brome est plutôt dynamique et a sextuplé depuis les années 1960. Environ 556 000 tonnes (valeur d'environ 2,5 milliards de dollars) a été produit en 2007 dans le monde entier, avec la contribution prédominante de l' États-Unis (226 000 t) et Israël (210 000 t). La production américaine a été exclu du United States Geological Survey après 2007, et à partir des 380 000 tonnes extraites par d'autres pays en 2010, 140 000 t ont été produites par la Chine, 130 000 t par Israël et 80 000 t par la Jordanie.
saumures riche en bromure sont traitées avec du chlore gazeux, le rinçage avec de l'air. Dans ce traitement, les anions bromure de brome sont oxydés par le chlore gazeux.
- 2 Br - + Cl 2 → 2 Cl - + Br 2
les méthodes de production de laboratoire
En laboratoire, en raison de sa disponibilité commerciale et de longue durée de conservation, de brome ne est pas typiquement préparé. De petites quantités de brome peuvent cependant être générés par la réaction du solide le bromure de sodium concentré avec de l'acide sulfurique (H 2 SO 4). La première étape est la formation de le bromure d'hydrogène (HBr), qui est un gaz, mais dans les conditions de réaction une partie du HBr est oxydé en outre par l'acide sulfurique pour former du brome (Br 2) et le dioxyde de soufre (SO 2).
- NaBr (s) + H 2 SO 4 (aq) → HBr (aq) + NaHSO 4 (aq)
- HBr 2 (aq) + H 2 SO 4 (aq) → Br 2 (g) + SO 2 (g) + 2 H 2 O (l)
Oxydants alternatives non-acides, tels que l'utilisation de l'acide bromhydrique dilué acide avec du sodium hypobromite, sont également disponibles, comme le l'acide hypobromeux formé à partir d'eux est instable en présence de bromure, étant réduit par ce selon la réaction:
- 2 OBr - (aq) + 4 HBr (aq) → 2Br 2 + 2H 2 O + 2Br -
Les réactions sont inversées par dismutation réactions de brome élémentaire dans la base, et sont appelés comproportionation. Une réaction similaire se produit avec de l'hypochlorite de sodium, l'acide et le chlorure, conduisant à du chlore élémentaire.
Les réactions impliquant un agent oxydant, tel que le permanganate de potassium ou le dioxyde de manganèse, d'ions bromure, en présence d'un acide, donnent également de brome dans des réactions analogues à la formation de chlore et de l'iode élémentaire à partir d'un acide et d'oxydant.
Comme l'iode, le brome est soluble dans chloroforme, mais seulement légèrement soluble dans l'eau. Dans l'eau, la solubilité peut être augmentée par la présence d'ions bromure. Les solutions concentrées de brome sont rarement préparés dans le laboratoire à cause de risques. Comme ce est le cas avec les solutions de chlore ou des solutions d'iode, du thiosulfate de sodium (ou tout thiosulfate soluble) est un réactif efficace pour réduire le bromure de brome incolore et inodore, traitant ainsi les taches et les odeurs de l'élément à des endroits non désirés. Pour la même raison, le thiosulfate ("hypo de fixer") est utilisé en photographie pour faire face à brome libre en argent émulsions de film de bromure.
Les composés et la chimie
Chimie organique

Comme avec d'autres atomes d'halogène, des substituts de brome un atome d'hydrogène dans les hydrocarbures, la liaison covalente au carbone. Comme avec d'autres atomes d'halogène, le produit C-Br de cette substitution est généralement incolore si le composé correspondant est CH incolore. L'addition de brome lié de manière covalente a tendance à augmenter la densité et augmenter le point de fusion de composés organiques.
Les composés organiques sont bromés soit par ou plus des réactions de substitution. Brome subit une addition électrophile pour les doubles liaisons de alcènes , via un intermédiaire cyclique bromonium. Dans des solvants non aqueux tels que le disulfure de carbone, on obtient le produit di-bromo. Par exemple, la réaction avec l'éthylène produira 1,2-dibromoéthane. Le brome subit également l'addition électrophile de phénols et anilines. Lorsqu'il est utilisé comme eau de brome, une petite quantité du correspondant bromhydrine est formée ainsi que le composé dibromé. Donc fiable est la réactivité du brome que l'eau de brome est utilisé comme réactif pour tester la présence d'alcènes, les phénols, les anilines et. Comme les autres halogènes, brome participe à réactions des radicaux libres. Par exemple, des hydrocarbures bromés sont par traitement avec du brome en présence de lumière.
Brome, parfois avec une quantité catalytique de phosphore , brome facilement des acides carboxyliques à la position α. Cette méthode, la Hell-Volhard réaction-Zelinsky, est la base de la route commerciale vers acide bromoacétique. N-bromosuccinimide est couramment utilisé comme un substitut de brome élémentaire, qui est plus facile à manipuler, et en faisant réagir plus légèrement et donc plus sélective. Bromures organiques sont souvent préférables par rapport aux chlorures moins réactifs et réactifs contenant de l'iodure plus chers. Ainsi, Et le composé de Grignard organolithium sont le plus souvent produites à partir des bromures correspondants.
Certains composés liés brome ont été évalués d'avoir un appauvrissement de l'ozone ou potentiel accumulent dans les organismes vivants. En conséquence, de nombreux composés de brome industrielle ne sont plus fabriqués, sont restreints ou prévue pour l'élimination. Le Protocole de Montréal mentionne plusieurs composés organo-bromés pour cette élimination.
La chimie inorganique
Composés bromés inorganiques adopter une variété d'états d'oxydation -1-7. Dans la nature, le bromure (Br -) est de loin l'Etat le plus commun, et les départs de cette -1 état d'oxydation sont entièrement dues à des organismes vivants et l'interaction de bromure avec les oxydants produits biologiquement, tels que l'oxygène libre.
Comme d'autres atomes d'halogène, un ion bromure est incolore et forme un certain nombre de sels minéraux ioniques transparentes, analogue au chlorure. Ion bromure est très soluble dans l'eau.
Des exemples de composés pour divers états d'oxydation de brome sont reportés ci-dessous:
| États d'oxydation de brome | |
|---|---|
| -1 | HBr |
| 0 | Br 2 |
| 1 | BrCl |
| 3 | BrF 3 |
| 5 | BrF 5 |
| 5 | Bro - 3 |
| 7 | Bro - 4 |
Le brome est un oxydant, et il se oxydera des ions iodure en iode, étant lui-même réduit à bromure:
- Br 2 + 2 I - → 2 Br - + I 2
Brome sera également oxyder les métaux et métalloïdes aux bromures correspondants. Brome anhydre est moins réactif vers de nombreux métaux que le brome hydraté, cependant. Sec brome réagit énergiquement avec l'aluminium , du titane , du mercure ainsi que des métaux alcalino-terreux et les métaux alcalins .
La dissolution de brome en solution alcaline, on obtient un mélange de bromure et hypobromite:
- Br 2 + 2 OH - → Br - + OBr - + H 2 O
Cette hypobromite est responsable de la capacité de blanchiment des solutions de bromure. Réchauffement de ces solutions provoque la réaction de disproportion de l'hypobromite de donner bromate, un puissant agent oxydant très similaire au chlorate.
- 3 Bro - → Bro -
3 + 2 Br -
Contrairement à la voie de perchlorates, perbromates ne sont pas accessibles par électrolyse, mais seulement par la réaction de solutions de bromate avec le fluor ou l'ozone .
- BrO 3 - + H 2 O + F 2 → Bro -
+ 4 HF 2 - BrO 3 - + O 3 → Bro -
4 + O 2
Le brome réagit violemment et de façon explosive avec de l'aluminium métallique, formant le bromure d'aluminium:
- 2 Al + 3 Br 2 → 2 AlBr3
Le brome réagit avec l'hydrogène sous forme gazeuse et donne le bromure d'hydrogène:
- H 2 + 2 Br 2 → HBr
Le brome réagit avec métaux alcalins iodures dans une réaction de déplacement. Cette réaction forme des bromures de métaux alcalins et produit élémentaire iode :
- 2 Nal + Br 2 → 2 NaBr + I 2
- 2 KI + Br 2 → 2 KBr + I 2
Applications
Une grande variété de composés organo-bromés sont utilisés dans l'industrie . Certains sont préparés à partir de brome et les autres sont préparés à partir de le bromure d'hydrogène, qui est obtenue par la combustion de l'hydrogène en brome.
Des exemples de la réaction d'addition est la préparation de Le 1,2-dibromoéthane, le composé organobromé produit en plus grandes quantités:
- C 2 H + 4 Br 2 → CH 2 BrCH 2 Br
Ignifuge
Retardateurs de flamme bromés représentent une marchandise d'une importance croissante, et représentent la plus grande utilisation commerciale de brome. Lorsque le matériau brûle bromé, le retardateur de flamme produit l'acide bromhydrique qui interfère dans le radical réaction en chaîne de la réaction d'oxydation de l'incendie. Le mécanisme est que les radicaux hautement réactifs d'hydrogène, des radicaux d'oxygène et les radicaux hydroxy réagissent avec l'acide bromhydrique pour former des radicaux de brome moins réactifs libres (à savoir, les atomes de brome). Les atomes de brome peuvent également réagir directement avec d'autres radicaux pour aider à mettre fin aux réactions en chaîne de radicaux libres qui caractérisent la combustion.
Pour fabriquer des polymères et plastiques bromés, composés contenant du brome peut incorporé dans le polymère lors polymérisation. Une méthode consiste à inclure une quantité relativement faible de monomère bromé au cours du processus de polymérisation. Par exemple, le bromure de vinyle peut être utilisé dans la production de le polyéthylène, le polychlorure de vinyle ou polypropylene. Molécules fortement bromés spécifiques peuvent également être ajoutés qui participent dans le processus de polymérisation, par exemple, tétrabromobisphénol A peut être ajouté à des polyesters ou des résines époxy, où il devient une partie du polymère. Époxydes utilisés dans cartes de circuits imprimés sont normalement fabriqués à partir de tels f boiteux r etardant résines, indiquées par le FR dans l'abréviation des produits ( FR-4 et FR-2). Dans certains cas, le composé contenant du brome peut être ajouté après la polymérisation. Par exemple, décabromodiphényléther peut être ajouté aux polymères finaux.
Un certain nombre de brome gazeux ou très volatile halogénométhane composés sont non-toxiques et font supérieures agents d'extinction des incendies par ce même mécanisme, et sont notamment efficace dans des espaces clos tels que des sous-marins, avions et engins spatiaux. Cependant, ils sont coûteux et leur production et leur utilisation a été considérablement réduit en raison de leur effet comme agents de la couche d'ozone. Ils ne sont plus utilisés dans les extincteurs de routine, mais conservent niche utilise dans l'aérospatiale et les applications d'extinction d'extinction automatique militaires. Ils comprennent bromochlorométhane (halon 1011, CH 2 BrCl), bromochlorodifluorométhane (halon 1211, CBrClF 2), et bromotrifluorométhane (Halon 1301, CBrF 3).
additifs essence
bromure d'éthylène est un additif dans les essences contenant de plomb anti- moteur agents frapper. Il nettoie le plomb en formant bromure de plomb volatile, qui est expulsé par le moteur. Cette application représentait 77% de l'utilisation de brome en 1966 aux États-Unis. Cette application a diminué depuis les années 1970 en raison de la réglementation environnementale (voir ci-dessous).
Pesticide
Toxique le bromure de méthyle a été largement utilisé comme pesticide fumigation des sols et pour la fumigation des logements, par la méthode de tentes. bromure d'éthylène a été utilisé de manière similaire. Ces composés volatils organobromés sont tous désormais réglementés comme appauvrissement de l'ozone agents. Le Protocole de Montréal relatif à des substances qui appauvrissent la couche d'ozone prévu l'élimination de la couche d'ozone chimique par 2005, et les pesticides organobromure ne sont plus utilisés (dans le logement fumagation ils ont été remplacés par des composés tels que fluorure de sulfuryle, qui contiennent ni le chlore ou de brome organiques qui nuisent à l'ozone). Avant le protocole de Montréal en 1991 (par exemple) d'environ 35 000 tonnes de la substance chimique ont été utilisées pour contrôler les nématodes , champignons , mauvaises herbes et d'autres maladies transmises par le sol.
Médical et vétérinaire

Utilisez. Composés bromure, en particulier bromure de potassium, ont été fréquemment utilisé comme sédatifs généraux dans le 19ème et début du 20ème siècle. Bromures sous la forme de sels simples sont toujours utilisés comme anticonvulsivants à la fois vétérinaire et la médecine humaine, bien que ce dernier utilisation varie d'un pays à l'autre. Par exemple, aux Etats-Unis Food and Drug Administration (FDA) ne approuve pas le bromure pour le traitement de toute maladie, et il a été retiré de over-the-counter produits sédatifs comme Bromo-Seltzer, en 1975. Ainsi, les niveaux de bromure ne sont pas systématiquement mesurée par les laboratoires médicaux aux États-Unis Cependant, américains laboratoires vétérinaires de tests diagnostiques médicaux permettront de mesurer les niveaux de bromure de sang à la demande, comme une aide au traitement de l'épilepsie chez les chiens.
Toxicité. De l'utilisation à long terme de bromure de potassium (ou tout sel de bromure) peut conduire à bromisme. Cet état de dépression du système nerveux central provoque la toxicité modérée de bromure à des doses multi-grammes pour les humains et d'autres mammifères. La demi-vie très longue de l'ion bromure dans le corps (~ 12 jours) contribue également à la toxicité de bromure accumulation dans les fluides corporels. Bromure ingestion peut également provoquer une éruption cutanée ressemblant à l'acné .
D'autres utilisations
- Les bromures de calcium, de sodium, de zinc et de compte pour une partie importante du marché de brome. Ces sels font solutions denses dans l'eau qui sont utilisés comme parfois fluides de forage de saumure appelés fluides clairs.
- Le brome est également utilisé dans la production de huile végétale bromée, qui est utilisé en tant que émulsifiant dans de nombreux agrumes -flavored boissons gazeuses (par exemple, Mountain Dew). Après l'introduction dans les années 1940 le composé a été largement utilisé jusqu'à ce que le Royaume-Uni et les États-Unis limitent son utilisation dans les milieu des années 1970 et des émulsifiants alternatives ont été développées.
Les boissons gazeuses contenant de l'huile végétale bromée sont encore vendus aux États-Unis (2011).
- Plusieurs des colorants, des produits agrochimiques, et les produits pharmaceutiques sont des composés organo-bromés. 1-bromo-3-chloropropane, le 1-bromoéthylbenzène et le 1-bromoalcanes sont préparés par le antimarkovnikov addition de HBr à alcènes. Le bromure d'éthidium, EtBr, est utilisé comme ADN de tache électrophorèse sur gel.
- Élevé composés d'indice de réfraction
- Brome, comme le chlore, est utilisé dans l'entretien des piscines, en particulier les spas (bains à remous), où il est généré in situ à partir d'un bromure, plus de peroxyde d'hydrogène. Dans les spas, les températures élevées de l'eau rendent la purification de l'eau et des tampons composés chlorés instable, et des composés de brome peuvent améliorer la vie de l'agent antimicrobien sans halogène.
- purification de l'eau , composés désinfectants et des insecticides, tels que tralométhrine (C 22 H 19 Br 4 NO 3).
- Le bromure de potassium est utilisé dans certains révélateurs photographiques pour inhiber la formation de brouillard (réduction indésirable de l'argent).
- vapeur de brome est utilisé comme seconde étape dans sensibilisant plaques de daguerréotype à développer dans la vapeur de mercure. Brome agit comme un accélérateur pour la sensibilité à la lumière de la plaque précédemment iodé.
- Le brome est également utilisé pour réduire la pollution au mercure provenant des centrales électriques au charbon. Ceci peut être réalisé soit par traitement de charbon actif avec du brome ou par injection de composés bromes sur le charbon avant la combustion.
- Le brome peut également être substitué artificiellement pour le substituant méthyle dans la thymine de base azotée de l'ADN, la création de l'analogue de base 5-bromo-uracile. Lorsque cette base est incorporée dans l'ADN de ses différentes propriétés de liaison hydrogène peuvent provoquer une mutation au niveau du site de cette paire de bases. Le composé 5-bromo-uracile est donc un agent mutagène artificielle.
Rôle biologique

Brome n'a pas de rôle essentiel connu dans la santé humaine ou de mammifère, mais le brome inorganique et composés organo-bromés ne se produisent naturellement, et certains peuvent être utiles pour les organismes supérieurs dans le traitement des parasites. Par exemple, en présence de H 2 O 2 formé par la éosinophiles, et soit ions chlorure ou le bromure, peroxydase éosinophile fournit un mécanisme puissant qui éosinophiles tuer multicellulaire parasites (tels que, par exemple, les vers nématodes impliqués dans filariose); ainsi que certaines bactéries (telles que la tuberculose bactéries). Est une peroxydase éosinophile haloperoxydase qui utilise préférentiellement le bromure sur du chlorure à cet effet, générant hypobromite ( l'acide hypobromeux).
Les organismes marins sont la principale source de composés organiques bromés. Plus de 1 600 composés ont été identifiés par 1999. Le plus abondant est le bromure de méthyle (CH 3 Br) avec une estimation de 56 000 tonnes produites par des algues marines chaque année. L'huile essentielle de l'algue hawaïenne Asparagopsis taxiformis se compose de 80% de bromure de méthyle. La plupart de ces composés organo-bromés dans la mer sont faites par l'action d'une enzyme algues unique vanadium bromoperoxydase. Bien que cette enzyme est le créateur le plus prolifique de bromures organiques par des organismes vivants, d'autres bromoperoxydases existent dans la nature qui ne utilisent pas le vanadium.
Un exemple célèbre d'un composé organique contenant du brome qui a été utilisé par l'homme depuis les temps anciens est le colorant de tissu Pourpre de Tyr. Le brome indole colorant indigo est produit par une taille moyenne mer prédatrice escargot, la marin gastéropode Brandaris Murex. La nature de organobrome du composé n'a été découvert qu'en 1909 (voir Paul Friedländer).
Sécurité
Brome élémentaire est toxique et Provoque des brûlures. Comme agent oxydant, il est incompatible avec la plupart des composés organiques et inorganiques. Des précautions doivent être prises lors du transport de brome; il est communément effectuée en cuves d'acier doublés de plomb, soutenus par des cadres métalliques solides.
Lorsque certains composés ioniques contenant du brome sont mélangés avec du permanganate de potassium (KMnO 4) et une substance acide, ils formeront un nuage brun pâle de gaz de brome.
- 6 Br - + 2 MnO -
4 + 8 H + → 3 Br 2 + 2 MnO 2 + 4 H 2 O
Ce gaz sent l'eau de Javel et est très irritant pour les muqueuses. Lors de l'exposition, on doit se déplacer à l'air frais immédiatement. Si des symptômes d'empoisonnement de brome se posent, une attention médicale est nécessaire.

