
Iridium
Renseignements généraux
SOS croit que l'éducation donne une meilleure chance dans la vie des enfants dans le monde en développement aussi. parrainage SOS enfant est cool!
| Iridium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
77 Ir | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
blanc argenté  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | iridium, Ir, 77 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / ɨ r ɪ ré Je ə m / i- -ee-əm RID | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | métal de transition | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 9, 6, ré | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 192,217 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 4f 14 5d 7 6s 2 2, 8, 18, 32, 15, 2  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Smithson Tennant (1803) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Smithson Tennant (1803) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 22,56 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 19 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 2739 K , 2466 ° C, 4471 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 4701 K, 4428 ° C, 8002 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 41,12 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 563 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 25,10 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | -3, -1, 0, 1, 2, 3, 4, 5, 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 2,20 (échelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1e: 880 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1600 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 136 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 141 ± 18 heures | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique à faces centrées  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 47,1 nΩ · m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 147 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | 6,4 um / (m · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 4,825 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 528 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 210 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 320 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 6.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 1760 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 1670 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7439-88-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes d'iridium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L'iridium est l' élément chimique avec le nombre atomique 77, et est représenté par le symbole Ir. Une très dur, cassant, blanc argenté métal de transition de la la famille du platine, de l'iridium est le deuxième plus dense élément (après osmium ) et est le plus corrosion métallique, résistante, même à des températures aussi élevées que 2000 ° C. Bien que certains sels fondus et halogènes sont corrosifs pour l'iridium solide, la poussière d'iridium finement divisée est beaucoup plus réactif et peut être inflammable.
Iridium a été découvert en 1803 parmi les impuretés insolubles naturelles platine . Smithson Tennant, le découvreur primaire, nommé l'iridium pour la déesse Iris, personnification de l'arc en ciel, en raison des couleurs vives et diverses de ses sels. Iridium est l'un des éléments les plus rares au la croûte terrestre , avec une production annuelle et la consommation de seulement trois 191 tonnes. Ir Ir et 193 sont les deux seuls origine naturelle des isotopes de l'iridium, ainsi que les seuls isotopes stables ; celle-ci est la plus abondante des deux.
Les composés d'iridium plus importants utilisés sont les sels et les acides qu'il forme avec le chlore , mais iridium forme également un certain nombre de composés organométalliques utilisés dans l'industrie la catalyse , et dans la recherche. Iridium métal est utilisé lorsque la résistance à la corrosion à haute température est nécessaire, comme dans haut de gamme bougies, creusets pour la recristallisation de semi-conducteurs à haute température, et des électrodes pour la production de chlore dans le processus de chlore-alcali. radioisotopes Iridium sont utilisés dans certains générateurs thermoélectriques radio-isotopes.
Iridium est trouvé dans les météorites avec une abondance beaucoup plus élevé que son abondance moyenne dans la croûte de la Terre. Pour cette raison, l'abondance inhabituellement élevée d'iridium dans la couche d'argile au Limite Crétacé-Paléogène a donné lieu à la Alvarez hypothèse que l'impact d'un objet extraterrestre massif causé la extinction des dinosaures et de nombreuses autres espèces, il ya 65 millions d'années. On pense que le montant total de l'iridium dans la planète Terre est beaucoup plus élevé que celui observé dans les roches de la croûte terrestre, mais comme avec d'autres métaux du groupe du platine, la forte densité et tendance de l'iridium de se lier avec le fer a causé la plupart d'iridium à descendre sous la croûte quand la planète était jeune et encore en fusion.
Caractéristiques
Propriétés physiques

Un membre de la groupe platine des métaux , de l'iridium est blanc, ressemblant à du platine , mais avec une légère teinte jaunâtre. En raison de sa la dureté, la fragilité, et très haute température de fusion , l'iridium solide est difficile à usiner, la forme, ou de travail, et donc métallurgie des poudres est couramment employé à la place. Ce est le seul métal de maintenir de bonnes propriétés mécaniques à l'air à des températures supérieures à 1600 ° C. Iridium a une très haute température d'ébullition ( 10e parmi tous les éléments) et devient un supraconducteur à des températures inférieures 0,14 K .
Iridium module d'élasticité est le deuxième plus élevé parmi les métaux, ne étant dépassé par l'osmium . Ceci, combiné avec une grande module de cisaillement et un chiffre très faible pour Le coefficient de Poisson (la relation d'longitudinal latérales souche), indiquer le degré élevé de rigidité et résistance à la déformation qui ont rendu sa fabrication en composants utiles d'une question d'une grande difficulté. Malgré ces limites et le coût élevé de l'iridium, un certain nombre de demandes ont développé où la résistance mécanique est un facteur essentiel dans certaines des conditions extrêmement sévères rencontrées dans la technologie moderne.
La mesure la densité de l'iridium ne est que légèrement inférieur (d'environ 0,12%) que celui de l'osmium , le élément dense connue. Il y avait eu une certaine ambiguïté au sujet de laquelle des deux éléments était plus dense, en raison de la petite taille de la différence de densité et de difficultés à mesurer avec précision, mais, avec une précision accrue dans les facteurs utilisés pour calculer la densité X-ray données cristallographiques ont donné des densités de 22,56 g / cm 3 pour l'iridium et 22,59 g / cm 3 pour l'osmium.
Propriétés chimiques
Iridium est le métal le plus résistant à la corrosion connu: il ne est pas attaqué par presque ne importe quel acide , l'eau régale, de métaux ou de silicates à des températures élevées. Il peut, cependant, être attaqué par certains fondus sels , tels que le cyanure de sodium et le cyanure de potassium, ainsi que de l'oxygène et les atomes d'halogène (en particulier fluor ) à des températures plus élevées.
Composés
| États d'oxydation | |
|---|---|
| -3 | [Ir (CO) 3] 3- |
| -1 | [Ir (CO) 3 (PPh 3)] - |
| 0 | Ir 4 (CO) 12 |
| 1 | [Ir (CO) Cl (PPh 3) 2] |
| 2 | IrCl 2 |
| 3 | IrCl 3 |
| 4 | IrO 2 |
| 5 | Ir 4 F 20 |
| 6 | IrF 6 |
Iridium forme des composés dans les états d'oxydation entre -3 à 6; états d'oxydation les plus courants sont les 3 et 4. Exemples bien caractérisés de l'état d'oxydation le plus élevé sont rares, mais comprennent IrF 6 et deux oxydes mixtes Sr 2 Mgiro 6 et Sr 2 Caire 6. En outre, il a été rapporté en 2009 que l'iridium (VIII) oxyde (IRO 4) a été préparé dans des conditions d'isolement de matrice (K en Ar 6) par irradiation UV d'un complexe d'iridium-peroxo. Cette espèce, toutefois, ne devrait pas être stables en vrac solide à des températures plus élevées.
Le dioxyde d'iridium, IrO 2, une poudre brune, est le seul oxyde bien caractérisé de l'iridium. Un sesquioxyde, Ir 2 O 3, a été décrit comme une poudre bleu-noir qui est oxydé en IrO 2 par HNO 3. Les disulfures, diséléniures, sesquisulfures et sesquiselenides correspondants sont connus et IrS 3 a également été rapportée. Iridium iridates forme également avec des états d'oxydation 4 et 5, tels que K 2 et 3 IrO Kiro 3, qui peuvent être préparés par la réaction de oxyde de potassium ou superoxyde de potassium avec de l'iridium à des températures élevées.
Bien que personne ne binaire hydrures d'iridium, Ir x H y sont connus, complexes sont connus qui contiennent IRH 4-
5 et IRH 3-
6, dans lequel l'iridium a des états d'oxydation 1 et 3, respectivement. L'hydrure ternaire Mg 6 Ir 2 H 11 est censé contenir à la fois l'IRH 4-
5 et le 18 électrons IRH 5-
4 anion.
Aucun monohalogénures ou dihalogénures sont connus, alors que trihalogénures, iRx 3, sont connus pour tous les halogènes. Pour les états d'oxydation 4 et au-dessus, seul le tétrafluorure, et le pentafluorure hexafluorure sont connus. Iridium hexafluorure, IrF 6, est un volatile et hautement réactif solide jaune, composé de molécules octaédriques. Il se décompose dans l'eau et est réduite à IrF 4, un solide cristallin, par black iridium. Pentafluorure Iridium a des propriétés similaires, mais il est en fait un tétramère, Ir 4 F 20, formé par quatre octaèdres coin de partage.
Hexachloroiridique (IV) de l'acide, H 2 IrCl 6, et son sel d'ammonium sont les plus importantes de composés de l'iridium à partir d'un point de vue industriel. Elles sont impliquées dans la purification de l'iridium et utilisés comme précurseurs pour la plupart des autres composés de l'iridium, ainsi que dans la préparation de les revêtements d'anode. Le IrCl 2-
6 ion a une couleur brun foncé intense, et peut être facilement réduit à la couleur claire IrCl 3-
6 et vice versa. le trichlorure d'iridium, IrCl 3, qui peut être obtenu sous forme anhydre de l'oxydation directe de poudre d'iridium par du chlore à 650 ° C, ou sous forme de suspension en dissolvant Ir 2 O 3 dans de l'acide chlorhydrique , est souvent utilisé comme matière de départ pour la synthèse d'autres composés Ir (III). Un autre composé utilisé comme matière de départ est hexachloroiridate d'ammonium (III), (NH 4) 3 IrCl 6. Iridium complexes (III) sont diamagnétique ( bas spin) et ont généralement une géométrie moléculaire octaédrique.
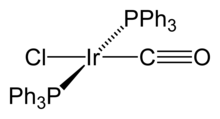
Organoiridium composés contiennent iridium carbone obligations où le métal est habituellement dans des états d'oxydation inférieurs. Par exemple, l'état d'oxydation zéro se trouve dans tetrairidium dodécacarbonyle, Ir 4 (CO) 12, qui est le binaire le plus commun et stable carbonyle de l'iridium. Dans ce composé, chacun des atomes d'iridium est lié à trois autres, formant un ensemble tétraédrique. Certains composés organométalliques Ir (I) sont assez notable à être nommé d'après leurs découvreurs. Un est Complexe de Vaska, IrCl (CO) [P (C 6 H 5) 3] 2, qui a la propriété inhabituelle de se lier à la molécule de dioxygène O 2. Un autre est Le catalyseur de Crabtree, un catalyseur homogène pour l'hydrogénation réactions. Ces composés sont à la fois plan carré, D 8 complexes, avec un total de 16 électrons de valence, ce qui représente leur réactivité.
Isotopes
Iridium a deux naturellement, stables isotopes , 191 et 193 Ir Ir, avec abondances naturelles de 37,3% et 62,7%, respectivement. Au moins 34 des radio-isotopes ont également été synthétisés, allant dans nombre de masse de 164 à 199. 192 Ir, qui se situe entre les deux isotopes stables, le radio-isotope est le plus stable, avec une demi-vie de 73,827 jours, et trouve une application dans curiethérapie et industrielle radiographie, en particulier pour les essais non destructifs des soudures en acier dans les industries pétrolières et gazières; sources d'iridium-192 ont été impliqués dans un certain nombre d'accidents radiologiques. Trois autres isotopes ont des demi-vies d'au moins un jour- 188 Ir, 189 Ir, 190 Ir. Isotopes avec des masses ci-dessous 191 se désintègrent en une combinaison de β + décroissance, désintégration α, et émission de protons, à l'exception de 189 Ir, qui se désintègre par capture d'électrons, et 190 Ir, qui se désintègre par la tomographie par émission. Synthétique isotopes plus lourds que 191 décroissance par β - décroissance, bien que 192 Ir a aussi un mineur capture d'électrons de chemin de décroissance. Tous les isotopes connus d'iridium ont été découverts entre 1934 et 2001; le plus récent est 171 Ir.
Au moins 32 isomères métastables ont été caractérisés, allant dans nombre de masse de 164 à 197. Le plus stable de ces derniers est 192m2 Ir, qui se désintègre par transition isomérique avec une demi-vie de 241 années, ce qui rend plus stable que l'un des isotopes de synthèse de l'iridium dans leurs états fondamentaux. L'isomère le moins stable est 190m3 Ir avec une demi-vie de seulement 2 us. L'isotope 191 Ir a été le premier de ne importe quel élément à afficher de présenter une Effet Mössbauer. Ceci le rend utile pour Spectroscopie Mössbauer de recherche en physique, chimie, biochimie, la métallurgie et la minéralogie.
Histoire

La découverte d'iridium se confond avec celle de platine et les autres métaux de la groupe du platine. Platine natif utilisé par les Éthiopiens anciens et par les cultures d'Amérique du Sud toujours contenait une petite quantité des autres métaux du groupe du platine, y compris l'iridium. Platinum a atteint l'Europe comme le platine («petit argent»), a trouvé dans le 17ème siècle par les conquérants espagnols dans une région aujourd'hui connue sous le nom département du Chocó en Colombie . La découverte que ce métal ne était pas un alliage d'éléments connus, mais à la place un nouveau élément distinct, n'a pas eu lieu jusqu'en 1748.
Les chimistes qui ont étudié le platine dissous dans eau régale (mélange d' chlorhydrique et l'acide nitrique ) pour créer des sels solubles. Ils ont toujours observé une petite quantité d'un résidu insoluble sombre. Joseph Louis Proust pensait que le résidu était graphite. Les chimistes français Victor Collet-Descotils, Antoine-François Fourcroy, et Louis Nicolas Vauquelin a également observé le résidu noir en 1803, mais n'a pas obtenu assez pour d'autres expériences.
En 1803, le scientifique britannique Smithson Tennant (1761-1815) a analysé le résidu insoluble et a conclu qu'il doit contenir un nouveau métal. Vauquelin traité la poudre en alternance avec alcalins et acides et a obtenu un nouveau oxyde volatil, qu'il croyait être qu'il nomma ptene cette nouvelle qui métal, du mot grec πτηνός ptēnós, "ailes". Tennant, qui avait l'avantage d'une plus grande quantité de résidus, a poursuivi ses recherches et a identifié les deux éléments précédemment non découvertes dans le résidu noir, l'iridium et l'osmium. Il a obtenu des cristaux rouge foncé (probablement de Na 2 [IrCl 6] n · H 2 O) par une séquence de réactions avec de l'hydroxyde de sodium et l'acide chlorhydrique . Il a nommé l'iridium après Iris (Ἶρις), la déesse ailée grecque de l'arc en ciel et le messager des dieux de l'Olympe, parce que beaucoup de sels qu'il a obtenus ont été fortement coloré. Découverte des nouveaux éléments a été documentée dans une lettre à la Royal Society le 21 Juin, 1804.
Scientifique britannique John George enfants était le premier à faire fondre un échantillon de l'iridium en 1813 à l'aide de «la plus grande batterie galvanique qui ait jamais été construit" (à l'époque). Le premier à obtenir une haute pureté était l'iridium Robert Hare en 1842. Il a conclu qu'il avait une densité d'environ 21,8 g / cm 3 et a noté que le métal est presque malléable et très dur. La première fusion en quantité appréciable a été effectuée par Henri Sainte-Claire Deville et Jules Henri Debray en 1860. Ils doivent incinération de plus de 300 L d'O 2 pur et H 2 pour chaque kilogramme d'iridium.
Ces difficultés extrêmes à fondre le métal limitent les possibilités de manipulation de l'iridium. John Isaac Hawkins cherchait à obtenir une fine et le point dur pour pointes de stylet de fontaine et en 1834 a réussi à créer un stylo en or iridium pointu. En 1880, John Holland et William Dudley Lofland étaient capable de faire fondre l'iridium en ajoutant du phosphore et breveté le processus aux États-Unis; Société britannique Johnson Matthey a déclaré plus tard qu'ils avaient été en utilisant un procédé similaire depuis 1837 et avait déjà présenté l'iridium fusionné à un certain nombre de Expositions universelles. La première utilisation d'un alliage d'iridium avec du ruthénium en thermocouples a été faite par Otto Feussner en 1933. Elles ont permis pour la mesure de températures élevées dans l'air jusqu'à 2000 ° C.
En 1957, Rudolf Mössbauer, dans ce qu'on a appelé un des "expériences emblématiques de la physique du XXe siècle", a découvert la résonance et émission et d'absorption de la libre-recul rayons gamma par des atomes dans un échantillon de métal solide ne contenant que 191 Ir. Ce phénomène, connu sous le nom Effet Mössbauer (qui a depuis été observé pour d'autres noyaux, tels que 57 Fe), et développé comme Spectroscopie Mössbauer, a fait d'importantes contributions à la recherche en physique, chimie, biochimie, la métallurgie et la minéralogie. Mössbauer reçu le prix Nobel de physique en 1961, à l'âge de 32 ans, trois ans seulement après avoir publié sa découverte.
Occurrence

L'iridium est un des éléments abondants dans moins de la Terre la croûte , ayant une fraction de la masse moyenne de 0,001 ppm dans la roche de la croûte; or est 40 fois plus abondant, le platine est 10 fois plus abondant, et l'argent et le mercure . sont 80 fois plus abondant Tellure est à peu près aussi abondante que l'iridium, et seulement trois éléments stables naturels sont moins abondantes: le rhénium , ruthénium et rhodium , l'iridium étant 10 fois plus abondant que les deux derniers. Contrairement à son faible abondance dans la roche de la croûte, l'iridium est relativement commun dans météorites, avec des concentrations de 0,5 ppm ou plus. On pense que la concentration globale de l'iridium sur la Terre est bien plus élevé que ce qui est observé dans les roches de la croûte terrestre, mais en raison de la densité et sidérophiles ("fer aimer") caractère de l'iridium, il est descendu en dessous de la croûte et dans le Noyau de la Terre quand la planète était encore en fusion.
Iridium existe dans la nature en tant qu'élément non combiné ou dans naturel alliages; en particulier les alliages d'iridium osmium, osmiridium (osmium riche), et iridiosmium (iridium riche). Dans les nickel et de cuivre dépose les métaux du groupe du platine se produisent en tant que sulfures (ce est à dire (Pt, Pd) S), tellurures (c.-à-PtBiTe), antimoniures (PDSB), et arséniures (c.-à-pesetas 2). Dans tous ces composés du platine est échangée par une petite quantité d'iridium et l'osmium. Comme avec tous les métaux du groupe du platine, l'iridium se trouve naturellement dans les alliages au nickel brut ou cuivre brut.
Dans la croûte de la Terre, l'iridium se trouve à des concentrations plus élevées dans trois types de structure géologique: dépôts ignées (intrusions de la croûte de ci-dessous), des cratères d'impact, et les dépôts remaniés de l'une des anciennes structures. Les plus grandes réserves connues primaires sont dans le Complexe igné du Bushveld en Afrique du Sud , bien que les grands gisements de cuivre-nickel près de Norilsk en Russie , et de la Bassin de Sudbury dans le Canada sont également des sources importantes d'iridium. De plus petites quantités sont disponibles aux Etats-Unis. Iridium est également trouvé dans les dépôts secondaires, combinée avec du platine et d'autres métaux du groupe du platine dans alluvions. Les dépôts alluviaux utilisés par les pré-colombiennes dans le Chocó ministère de la Colombie sont encore une source pour les métaux du groupe du platine. En 2003, les réserves mondiales ne avaient pas été estimée.
Crétacé-Paléogène présence de limite

Le Crétacé-Paléogène limite de 65 millions d'années, qui marque la frontière temporelle entre le Crétacé et Paléogène périodes de temps géologique , a été identifié par une mince strate riche en iridium argile. Une équipe dirigée par Luis Alvarez a proposé en 1980 une origine extraterrestre pour cette iridium, l'attribuant à un astéroïde ou comète impact. Leur théorie, connue sous le nom Hypothèse Alvarez, est maintenant largement acceptée pour expliquer la disparition des dinosaures . Une grande structure l'impact du cratère enterré avec un âge estimé à environ 65 millions d'années a été plus tard identifié sous ce qui est maintenant la Péninsule du Yucatán (la Cratère de Chicxulub). Dewey M. McLean et d'autres soutiennent que le iridium peut-être des volcanique origine au lieu, comme la Terre coeur s 'est riche en iridium, et des volcans actifs tels que Piton de la Fournaise, sur l'île de Réunion, sont toujours publie iridium.
Production
| Année | Consommation (tonnes) | Prix ( $ / ozt) |
|---|---|---|
| 2001 | 2.6 | 415,25 |
| 2002 | 2,5 | 294,62 |
| 2003 | 3.3 | 93,02 |
| 2004 | 3,60 | 185,33 |
| 2005 | 3,86 | 169,51 |
| 2006 | 4,08 | 349,45 |
| 2007 | 3,70 | 444,43 |
| 2008 | 3.10 | 448,34 |
| 2009 | 2,52 | 420,4 |
| 2010 | 10,40 | 642,15 |
Iridium est obtenu dans le commerce comme un sous-produit de nickel et de cuivre extraction et de traitement. Pendant électroraffinage du cuivre et du nickel, des métaux nobles tels que l'argent, l'or et les métaux du groupe du platine ainsi que le sélénium et le tellure se déposent au fond de la cellule sous forme de boue d'anode, qui forme le point de départ de leur extraction. Pour séparer les métaux, ils doivent d'abord être mis en solution. Plusieurs méthodes sont disponibles selon le procédé de séparation et la composition du mélange; deux procédés représentatifs sont fusion avec le peroxyde de sodium, puis par dissolution dans l'eau régale, et la dissolution dans un mélange de chlore avec de l'acide chlorhydrique .
Après dissolution, de l'iridium est séparé des autres métaux du groupe du platine par précipitation (NH 4) 2 IrCl 6 ou par extraction IrCl 2-
6 avec des amines organiques. La première méthode est similaire à la procédure Tennant Wollaston et utilisés pour leur séparation. La deuxième méthode peut être prévu que continue extraction liquide-liquide et est donc plus adapté à la production industrielle à grande échelle. Dans les deux cas, le produit est réduit avec de l'hydrogène, ce qui donne la forme d'une poudre métallique ou une éponge qui peut être traité en utilisant des techniques de métallurgie des poudres.
Le prix de l'iridium varie considérablement, comme le montre le tableau, en raison de l'approvisionnement instable, la demande, la spéculation, et la thésaurisation, amplifié par la petite taille du marché et de l'instabilité dans les pays producteurs. La forte baisse vers 2003 a été liée à l'offre excédentaire de creusets RI pour la croissance industrielle de gros cristaux simples.
Applications
La demande de l'iridium bondi de 2,5 tonnes en 2009 à 10,4 tonnes en 2010, principalement en raison de liés à l'électronique applications qui ont connu une hausse de 0,2 à 6 tonnes - creusets de l'iridium sont couramment utilisés pour la culture de gros cristaux de haute qualité unique, la demande pour ce qui a fortement augmenté. Cette augmentation de la consommation d'iridium est prévu pour saturer en raison de l'accumulation de stocks de creusets, comme ce est arrivé plus tôt dans les années 2000. Autres applications principales incluent des bougies qui ont consommé 0,78 tonnes de Ir en 2007, électrodes pour le processus de chlore-alcali (1,1 t en 2007) et des catalyseurs chimiques (0,75 t en 2007).
Industriels et médicaux

La résistance haut point de fusion, la dureté et la corrosion d'iridium et de ses alliages déterminer la plupart de ses applications. Iridium et en particulier des alliages platine-iridium ou des alliages iridium-osmium ont une faible usure et sont utilisés, par exemple, de multiples pores filières, à travers lequel un polymère fondu est extrudé en matière plastique pour former des fibres, telles que rayonne. Osmium-iridium est utilisée pour paliers et pour les soldes boussole.
Corrosion et résistance à la chaleur rend iridium agent d'alliage importante. Certaines pièces de moteurs d'avions long-vie sont faites d'un alliage d'iridium et un iridium titane alliage est utilisé pour les tuyaux en raison de sa résistance à la corrosion en eau profonde. Iridium est également utilisé comme agent de durcissement dans les alliages de platine. Le Dureté Vickers de platine pur est 56 HV tout en platine avec 50% d'iridium peut atteindre plus de 500 HV.
Les appareils qui doivent résister à des températures extrêmement élevées sont souvent fabriqués à partir de l'iridium. Par exemple, à haute température creusets en iridium sont utilisés dans le processus de Czochralski pour produire des monocristaux oxyde (comme saphirs) pour utilisation dans des dispositifs de mémoire de l'ordinateur et dans les lasers à l'état solide. Les cristaux, tels que gadolinium gallium grenat d'yttrium et du grenat de gallium, sont cultivées par fusion de charges pré-frittées d'oxydes mixtes dans des conditions oxydantes à des températures jusqu'à 2100 ° C. Sa résistance à l'érosion arc fait alliages d'iridium idéal pour contacts électriques pour bougies d'allumage.
composés d'iridium sont utilisés comme catalyseurs dans la Procédé Cativa pour carbonylation du methanol pour produire de l'acide acétique .
Le radio-isotope iridium-192 est l'un des deux plus importantes sources d'énergie pour une utilisation dans l'industrie γ-radiographie pour le contrôle non destructif de métaux . En outre, Ir 192 est utilisé comme une source de un rayonnement gamma pour le traitement du cancer par brachythérapie, une forme de radiothérapie où une source radioactive scellée est placée à l'intérieur ou à côté de la zone nécessitant un traitement. Traitements spécifiques comprennent haute dose de curiethérapie de la prostate, conduit biliaire curiethérapie, et la curiethérapie endocavitaire col.
Scientifique

Un alliage de 90% de platine et 10% d'iridium a été utilisé en 1889 pour construire le Prototype international du mètre et kilogramme de masse, tenu par le Bureau international des poids et mesures, près de Paris . La barre du compteur a été remplacé comme la définition de l'unité fondamentale de la longueur en 1960 par une ligne dans le spectre atomique de krypton , mais le prototype du kilogramme est toujours la norme internationale de la masse.
Iridium a été utilisé dans la générateurs thermoélectriques radio-isotopiques de vaisseau spatial inhabité comme le Voyager, Viking, Pioneer, Cassini , Galileo, et Nouveaux Horizons. Iridium a été choisi pour encapsuler le plutonium-238 combustible dans le générateur, car il peut supporter les températures de fonctionnement allant jusqu'à 2000 ° C et pour sa grande force.
Une autre utilisation concerne l'optique rayons X, en particulier les télescopes à rayons X. Les miroirs de la Observatoire de rayons X Chandra sont revêtues d'une couche d'iridium 60 nm d'épaisseur. Iridium se est avéré être le meilleur choix pour réfléchir les rayons X après le nickel, l'or, le platine et ont également été testés. La couche d'iridium, qui doit être lisse à l'intérieur de quelques atomes, a été appliquée par dépôt de vapeur d'iridium sous un vide poussé sur une couche de base de chrome .
Iridium est utilisé en physique des particules pour la production de antiprotons, une forme de antimatière. Les antiprotons sont faits en tirant un faisceau de protons de haute intensité sur une cible de conversion, qui doit être réalisé en un matériau de très haute densité. Bien que le tungstène peuvent être utilisés à la place, l'iridium présente l'avantage d'une meilleure stabilité dans le des ondes de choc induites par l'élévation de température due au faisceau incident.

Carbone-hydrogène activation de liaison (C-H activation) est un domaine de recherche sur les réactions qui clivent liaisons carbone-hydrogène, qui ont été traditionnellement considéré comme non réactif. Le premier succès rapportés à activer liaisons C-H dans des hydrocarbures saturés , publiés en 1982, utilisé complexes d'iridium organométalliques qui subissent une addition oxydante avec l'hydrocarbure.
complexes Iridium sont à l'étude en tant que catalyseurs pour hydrogénation asymétrique. Ces catalyseurs ont été utilisés dans la synthèse du des produits naturels et capable d'hydrogéner certains substrats difficiles, tels que les alcènes non fonctionnalisés, énantiosélective (générant un seul des deux possible énantiomères).
Iridium forme une variété de complexes d'intérêt fondamental dans la récolte triplet.
Historique

Alliages Iridium-osmium ont été utilisés à la pointe pointes de stylo. La première utilisation importante d'iridium était en 1834 à plumes montées sur or. Depuis 1944, la célèbre 51 Parker stylo plume a été équipé d'une plume à pointe de ruthénium et un alliage d'iridium (avec 3,8% d'iridium). Le matériau de la pointe de stylos modernes est encore convenu d'appeler "l'iridium," même se il est rarement toute l'iridium en elle; d'autres métaux tels que le tungstène ont pris sa place.
Un alliage platine-iridium a été utilisé pour la touchez trous ou de ventilation des morceaux de canon. Selon un rapport de la Exposition de Paris en 1867, l'une des pièces étant exposées par Johnson Matthey et "a été utilisé dans une arme à feu Withworth plus de 3000 tours, et montre encore guère de signes d'usure. Ceux qui connaissent le problème constant et dépenses qui sont occasionnés par le port de l'évent-pièces de canon quand en service actif , apprécieront cette importante adaptation ».
Le pigment noir d'iridium, qui se compose d'iridium très finement divisé, est utilisé pour la peinture porcelaine un noir intense; il a été dit que «toutes les autres couleurs noires en porcelaine apparaissent en gris à côté de celui-ci".
Précautions
Iridium en vrac métallique ne est pas biologiquement importante ou dangereuse pour la santé en raison de son manque de réactivité avec les tissus; il ya seulement environ 20 parties par billion de l'iridium dans les tissus humains. Cependant, la poudre d'iridium finement divisée peut être dangereux à manipuler, car il est un irritant et peut se enflammer à l'air. Très peu est connu sur la toxicité des composés d'iridium, car ils sont utilisés en très petites quantités, mais des sels solubles, tels que les halogénures d'iridium, pourrait être dangereux en raison des éléments autres que l'iridium ou raison de se iridium. Cependant, la plupart des composés d'iridium sont insolubles, ce qui rend l'absorption dans le corps difficile.
Un radio-isotope d'iridium, 192 Ir, est dangereux comme d'autres isotopes radioactifs. Les seules blessures déclarées liées à l'iridium préoccupation exposition accidentelle à des rayonnements de 192 Ir utilisé dans curiethérapie. Haute énergie de rayonnement gamma 192 Ir peut augmenter le risque de cancer. L'exposition externe peut causer des brûlures, empoisonnement par radiation, et la mort. L'ingestion de 192 Ir peut brûler les garnitures de l'estomac et les intestins. 192 Ir, 192m Ir et 194m Ir ont tendance à se déposer dans le foie, et peut poser des risques pour la santé à la fois gamma et rayonnement bêta.
