
Hafnium
Saviez-vous ...
SOS Enfants, qui se déroule près de 200 sos écoles dans le monde en développement, a organisé cette sélection. Parrainer un enfant de faire une réelle différence.
| Hafnium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
72 Hf | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
gris acier  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | hafnium, Hf, 72 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / h æ fa n Je ə m / HAF -neE-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Catégorie Metallic | métal de transition | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 4, 6, ré | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 178,49 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 4f 14 5d 2 6s 2 2, 8, 18, 32, 10, 2 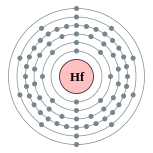 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prédiction | Dmitri Mendeleev (1869) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Dirk Coster et George de Hevesy (1922) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Dirk Coster et George de Hevesy (1922) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 13,31 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 12 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 2506 K , 2233 ° C, 4051 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 4876 K, 4603 ° C, 8317 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 27,2 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 571 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 25,73 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 4, 3, 2 ( l'oxyde amphotère) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,3 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 658,5 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1440 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 2250 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 159 h | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 175 ± 22 heures | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 331 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 23,0 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) de 5,9 um · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 3,010 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 78 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 30 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 110 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,37 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 5.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 1760 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 1700 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-58-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Les isotopes d'hafnium | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hafnium (pron .: / h æ fa n Je əm / HAF--neE əm) est un élément chimique avec le symbole Hf et de numéro atomique 72. Un brillant, gris argenté, tétravalent métal de transition , l'hafnium ressemble chimiquement zirconium et se trouve dans zirconium minéraux . Son existence était prédite par Dmitri Mendeleev en 1869. hafnium était l'avant-dernier isotope stable élément à découvert ( rhénium a été identifié deux ans plus tard). Le hafnium est nommé après la Hafnia latine nom " de Copenhague ", où il a été découvert.
Le hafnium est utilisé en filaments et électrodes. Certains semi-conducteurs procédés de fabrication utilisent son oxyde pour circuits intégrés à 45 nm et dispose de plus petites longueurs. Certains superalliages utilisés pour des applications spéciales contiennent hafnium en combinaison avec du niobium , du titane ou du tungstène .
Hafnium de grande capture de neutrons section rend hafnium un bon matériau pour neutrons absorption dans des barres de commande dans les centrales nucléaires, mais en même temps exige qu'il soit retiré des alliages de zirconium résistant à la corrosion neutrons transparent utilisés dans les réacteurs nucléaires.
Caractéristiques
Caractéristiques physiques

Le hafnium est un brillant, argenté, ductile métallique qui est corrosion , résistante et chimiquement semblable à du zirconium (en raison de son ayant le même nombre de cantonnière électrons et étant dans le même groupe). Les propriétés physiques des échantillons de métal d'hafnium sont nettement affectées par des impuretés de zirconium, et en particulier les propriétés nucléaires, car ces deux éléments sont parmi les plus difficiles à séparer en raison de leur similitude chimique.
Une différence physique notable entre ces métaux est leur densité , de zirconium d'environ la moitié de la densité comme hafnium. Les plus notables nucléaires propriétés de hafnium est sa thermique élevée neutrons section efficace de capture, et que les noyaux de plusieurs isotopes différents d'hafnium absorbent facilement deux ou plusieurs neutrons chacun. En contraste avec cela, zirconium est pratiquement transparent aux neutrons thermiques, et il est couramment utilisé pour les composants métalliques de réacteurs nucléaires - en particulier les revêtements de leur crayons de combustible nucléaire.
Caractéristiques chimiques

Hafniums réagissent dans l'air pour former un film protecteur qui inhibe d'autres corrosions . Le métal ne est pas facilement attaqué par les acides mais peut être oxydé par des halogènes ou peut être brûlé à l'air. Comme son zirconium soeur de métal, l'hafnium finement divisée peut se enflammer spontanément à l'air-similaire à celle obtenue dans Souffle du dragon. Le métal est résistant à concentré alcalis.
La chimie de l'hafnium et du zirconium est si similaire que les deux ne peuvent être séparés sur la base de différentes réactions chimiques. Les points de fusion et les points des composés à point d'ébullition et la solubilité dans des solvants sont les principales différences dans la composition chimique de ces éléments jumeaux.
Isotopes
Au moins 34 isotopes du hafnium ont été observées, allant dans un nombre de masse de 153 à 186. Les cinq isotopes stables sont dans la gamme de de 176 à 180. Les isotopes radioactifs de demi-vie comprise entre seulement 400 ms pour 153 Hf, à 2,0 petayears (10 15 ans) pour la plus stable, 174 Hf.
Le isomère 178m2 nucléaire Hf était au centre d'une controverse depuis plusieurs années en ce qui concerne son utilisation potentielle comme une arme.
Occurrence

Le hafnium est estimé à représenter environ 5,8 ppm de la Terre supérieure de la croûte en poids. Il ne existe pas comme un élément libre dans la nature, mais on le trouve combiné dans solution solide pour le zirconium dans naturelles zirconium composés tels que zircon, ZrSiO 4, qui a généralement un sujet de 1 à 4% de Zr remplacé par le Hf. Rarement, le rapport Hf / Zr augmente pendant la cristallisation pour donner le minéral isostructural 'hafnon' (Hf, Zr) SiO 4, avec atomique Hf> Zr. Un ancien nom (obsolète) pour une variété de zircon contenant contenu exceptionnellement élevé Hf est alvite.
Une source importante de zircon (et donc hafnium) minerais sont sables minéraux lourds dépôts de minerai, pegmatites en particulier au Brésil et au Malawi , et intrusions de carbonatite notamment le dépôt de la Couronne au polymétalliques Mont Weld, en Australie occidentale. Une source potentielle de hafnium est tufs trachytiques contenant rares silicates de zircon-hafnium eudialyte ou d'Armstrong, au Dubbo dans Nouvelle-Galles du Sud, Australie.
Production
Le sables minéraux lourds minerai des gisements de minerais de titane ilménite et rendement rutile plus du zirconium extrait, et donc également le plus hafnium.
Le zirconium est un bon barreaux de combustible nucléaire gaine métallique, avec les propriétés souhaitables d'une section transversale très faible par capture de neutrons et une bonne stabilité chimique à haute température. Toutefois, en raison des propriétés d'absorption des neutrons de hafnium, les impuretés de hafnium dans zirconium seraient amener à être beaucoup moins utile pour des applications de réacteurs nucléaires. Ainsi, une séparation presque complète de zirconium et hafnium est nécessaire pour leur utilisation dans l'énergie nucléaire. La production de zirconium gratuitement hafnium est la principale source de hafnium.

Les propriétés chimiques de l'hafnium et le zirconium sont presque identiques, ce qui rend les deux difficiles à séparer. Les méthodes utilisées pour la première - cristallisation fractionnée de sels de fluorure d'ammonium ou la distillation fractionnée du chlorure - ne ont pas prouvé approprié pour une production à l'échelle industrielle. Après zirconium a été choisi comme matériau pour les programmes de réacteurs nucléaires dans les années 1940, une méthode de séparation devait être développé. Procédés d'extraction liquide-liquide avec une grande variété de solvants ont été élaborés et sont encore utilisés pour la production de hafnium. Environ la moitié de tous les métaux de hafnium fabriqué est produit comme un sous-produit du zirconium raffinement. Le produit de la séparation d'extrémité est hafnium (IV) chloride. Le hafnium purifié (IV) est converti en chlorure du métal par réduction avec du magnésium ou de sodium , comme dans le Procédé Kroll.
- HfCI4 Mg + 2 (1100 ° C) → 2 MgCl 2 + Hf
Une purification supplémentaire est effectuée par un réaction de transport chimique développé par Arkel et de Boer: Dans un récipient fermé, l'hafnium réagit avec l'iode à des températures de 500 ° C, la formation d'hafnium (IV) un iodure; à un filament de 1700 ° C de tungstène la réaction inverse se produit, et l'iode et le hafnium sont mis en liberté. Le hafnium forme un revêtement solide sur le filament de tungstène, et l'iode peut réagir avec hafnium supplémentaire, résultant en un tour stable au cours.
- Hf + 2 I 2 (500 ° C) → 4 HfI
- HfI 4 (1700 ° C) → Hf + 2 I 2
Les composés chimiques
Hafnium et le zirconium formulaire de série de composés chimiques presque identiques. Hafnium tend fortement forme des composés inorganiques à l'état d'oxydation de +4. mais halogènes réagissent avec elle pour former des tétrahalogénures de hafnium. Aux températures plus élevées, de l'hafnium réagit avec l'oxygène , l'azote , le carbone , le bore , le soufre et le silicium . En raison de lanthanide contraction des éléments dans le sixième période, le zirconium et le hafnium ont presque identique rayons ioniques. Le rayon ionique de Zr 4+ est 0,79 Ångström et celle de Hf 4+ est 0,78 Angström.
Le hafnium (IV) et du chlorure d'hafnium (IV) ont iodure certaines applications dans la production et la purification d'hafnium métal. Ils sont solides volatils avec des structures polymères. Ces tétrachlorure est un précurseur de différents organohafnium composés tels que le dichlorure d'hafnocène et tetrabenzylhafnium.
Le blanc oxyde d'hafnium (HfO 2), avec un point de 2812 ° C de fusion et un point d'environ 5100 ° C d'ébullition, est très similaire à la zircone, mais légèrement plus basique. Carbure d'hafnium est le plus réfractaire Composé binaire connu, ayant un point de fusion supérieur à 3890 ° C , et le nitrure d'hafnium est la plus réfractaire de tous les nitrures métalliques connus, avec un point de 3310 ° C de fusion. Cela a conduit à des propositions qui hafnium ou de ses carbures pourraient être utiles comme matériaux de construction qui sont soumis à des températures très élevées. Le carbure mixte tantale hafnium (Ta 4 HfC 5) possède le point de fusion le plus élevé de tout composé actuellement connue, 4215 ° C.
Histoire
Dans son rapport sur le droit périodique des éléments chimiques, en 1869, Dmitri Mendeleïev avait implicitement prédit l'existence d'un analogue plus lourd de titane et le zirconium. Au moment de son élaboration en 1871, Mendeleïev estimé que les éléments ont été commandés par leur masses atomiques et placé lanthane (élément 57) à l'endroit ci-dessous zirconium. L'emplacement exact des éléments et l'emplacement des éléments manquants a été effectuée en déterminant le poids spécifique des éléments et en comparant les propriétés chimiques et physiques.
Le Spectroscopie des rayons X effectuée par Henry Moseley en 1914 a montré une dépendance directe entre spectrale et charge nucléaire effective. Cela a conduit à la charge nucléaire ou numéro atomique d'un élément, utilisé pour assurer sa place dans le tableau périodique. Avec cette méthode, Moseley a déterminé le nombre des lanthanides et a montré les lacunes dans la séquence de numéro atomique 43, aux numéros 61, 72, et 75.
La découverte des lacunes a conduit à une recherche intensive pour les éléments manquants. En 1914, plusieurs personnes ont affirmé après la découverte Henry Moseley prédit l'écart dans le tableau périodique pour l'élément alors inconnues 72. Georges Urbain a affirmé qu'il a trouvé l'élément 72 dans le éléments de terres rares en 1907 et publié ses résultats sur celtium en 1911. Ni les spectres, ni le comportement chimique correspondance avec l'élément trouvé plus tard, et donc sa demande a été rejetée après une longue controverse. La controverse est due en partie au fait que les chimistes ont favorisé les techniques chimiques qui ont conduit à la découverte de celtium, tandis que les physiciens se appuyaient sur l'utilisation de la nouvelle méthode de spectroscopie X-ray qui ont prouvé que les substances découvertes par Urbain ne contiennent pas d'élément 72. Au début de 1923, plusieurs physiciens et chimistes tels que Niels Bohr et Charles R. Bury a suggéré que l'élément 72 devrait ressembler zirconium et ne était donc pas partie du groupe des rares éléments de terres. Ces suggestions ont été basées sur les théories de Bohr de l'atome, la spectroscopie des rayons X de Mosley, et les arguments chimiques de Friedrich Paneth.
Encouragé par ces suggestions et par la réapparition en 1922 des allégations de Urbain cet élément 72 est un élément de terre rare découvert en 1911, Dirk Coster et Georg von Hevesy étaient motivés pour rechercher le nouvel élément dans les minerais de zirconium. Hafnium a été découvert par deux en 1923 à Copenhague, au Danemark, la validation de la prévision 1869 d'origine de Mendeleïev. Il a finalement été trouvé dans zircon en Norvège par l'analyse de spectroscopie X-ray. L'endroit où a eu lieu la découverte a conduit à l'élément étant nommé pour le nom latin de "Copenhague", Hafnia, la ville natale de Niels Bohr . Aujourd'hui, le Faculté des sciences de la Université de Copenhague utilise dans son sceller une image stylisée de l'atome de hafnium.
Hafnium a été séparé de zirconium par recristallisation répétée de la double d'ammonium ou de potassium de fluorures Valdemar Thal Jantzen et von Hevesey. Eduard van Arkel et Jan Hendrik de Boer ont été les premiers à préparer métallique de hafnium en passant hafnium vapeur d'tétra-iodure sur une chauffée tungstène filament en 1924. Ce processus de purification différentielle de zirconium et hafnium est encore en usage aujourd'hui.
En 1923, quatre prédit éléments étaient encore absents de la table périodique: 43 ( technétium ) et 61 ( promethium ) sont des éléments radioactifs et ne sont présents en quantités traces dans l'environnement, rendant ainsi les éléments 75 ( rhénium ) et 72 (hafnium) le deux derniers éléments non radioactifs inconnus. Depuis le rhénium a été découvert en 1925, le hafnium était l'avant-dernier élément avec des isotopes stables à découvrir.
Applications
Plusieurs détails contribuent au fait qu'il n'y a que quelques utilisations techniques de hafnium: Tout d'abord, la similitude entre l'hafnium et le zirconium, il est possible d'utiliser zirconium pour la plupart des applications; secondes, le hafnium était d'abord disponible en tant que métal pur après l'utilisation dans l'industrie nucléaire pour le zirconium gratuitement hafnium dans les années 1950. En outre, la faible abondance et de techniques de séparation difficiles nécessaires en font un produit rare.
La plupart du hafnium produit est utilisé dans la production de des barres de commande pour les réacteurs nucléaires.
Réacteurs nucléaires
Les noyaux de plusieurs isotopes du hafnium peuvent absorber chaque multiples neutrons. Cela rend l'hafnium un bon matériau pour une utilisation dans les barres de contrôle pour les réacteurs nucléaires. Sa capture de neutrons section est environ 600 fois celle de zirconium. (Autres éléments qui sont de bons absorbeurs de neutrons pour barres de contrôle sont le cadmium et le bore .) Excellentes propriétés mécaniques et résistance à la corrosion exceptionnelles permettent son utilisation dans l'environnement hostile d'un réacteurs à eau pressurisée. Le réacteur de recherche allemand FRM II utilise hafnium comme absorbeur de neutrons.
Alliages

Le hafnium est utilisé dans le fer , le titane, le niobium , le tantale , et d'un autre métal alliages. Un alliage utilisé pour liquides buses fusée de propulseur, par exemple le moteur principal de la Modules lunaire d'Apollo est C103, qui se compose de 89% de niobium , l'hafnium et 10% à 1% de titane .
De petites additions d'hafnium augmentent l'adhérence des écailles d'oxyde de protection sur des alliages à base de nickel. Il améliore de ce fait la corrosion en particulier la résistance dans des conditions de température cycliques qui ont tendance à rompre les échelles d'oxyde en induisant des contraintes thermiques entre le produit en vrac et la couche d'oxyde.
Microprocesseurs
L'industrie électronique a découvert que le composé à base de hafnium peut être utilisé dans isolants de grille dans la génération 45 nm de circuits intégrés de Intel , IBM et d'autres. Des composés à base d'oxyde de hafnium sont pratiques diélectriques high-k, permettant la réduction de la porte courant de fuite qui améliore les performances à ces échelles.
D'autres utilisations
En raison de sa résistance à la chaleur et son affinité pour l'oxygène et de l'azote, de l'hafnium est un bon piégeur d'oxygène et d'azote dans rempli de gaz et les lampes à incandescence. Le hafnium est aussi utilisé comme l'électrode en découpe plasma en raison de sa capacité à mettre en électrons dans l'air,
Le contenu énergétique élevé de 178m2 Hf était la préoccupation d'un DARPA programme aux États-Unis financé. Ce programme a déterminé la possibilité d'utiliser un isomère nucléaire de hafnium (mentionnées ci-dessus 178m2 Hf) pour construire des armes à haut rendement avec des mécanismes, une radiographie de déclenchement de demande émission gamma induite, était impossible en raison de sa charge. Voir Controverse hafnium.
