Thorium
À propos de ce écoles sélection Wikipedia
Enfants SOS offrent un chargement complet de la sélection pour les écoles pour une utilisation sur les intranets des écoles. Cliquez ici pour en savoir plus sur le parrainage d'enfants.
| Thorium | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
90 Th | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||
argenté, souvent avec ternissement noir  | |||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | thorium, Th, 90 | ||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / θ ɔər Je ə m / THOHR -ee-əm | ||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | actinides | ||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 7, fa | ||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 232,03806 | ||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Rn ] 6d deux 7s 2 2, 8, 18, 32, 18, 10, 2  | ||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||
| Découverte | Jöns Jakob Berzelius (1829) | ||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 11,7 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 2115 K , 1842 ° C, 3348 ° F | ||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 5061 K, 4788 ° C, 8650 ° F | ||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 13,81 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 514 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 26,230 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 4, 3, 2, 1 (Faiblement oxyde de base) | ||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,3 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 587 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1110 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||
| 3ème: 1930 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 179 h | ||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 206 ± 18 heures | ||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique à faces centrées  | ||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (0 ° C) 147 nΩ · m | ||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 54,0 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 11,0 um · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 2,490 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 79 GPa | ||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 31 GPa | ||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 54 GPa | ||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,27 | ||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 3.0 | ||||||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 350 MPa | ||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 400 MPa | ||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-29-1 | ||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de thorium | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
Le thorium est un phénomène naturel radioactifs élément chimique avec le symbole Th et de numéro atomique 90. Il a été découvert en 1828 par le minéralogiste norvégienne Morten Thrane Esmark et identifié par le chimiste suédois Jöns Jakob Berzelius et nommé d'après Thor , le Dieu scandinave du tonnerre.
Thorium produit un gaz radioactif, le radon -220, comme un de ses produits de désintégration. Produits de désintégration du thorium secondaires comprennent le radium et de l'actinium . Dans la nature, la quasi-totalité du thorium se trouve que thorium-232, qui subit désintégration alpha avec une demi-vie d'environ 14,05 milliards d'années. Autre isotopes de thorium sont des intermédiaires de courte durée dans les chaînes de désintégration d'éléments plus élevés, et ne se trouvent en quantités infimes. Thorium est estimé à environ trois à quatre fois plus abondant que l'uranium dans la croûte de la Terre, et est principalement raffiné à partir de sables de monazite sous forme de sous-produit de l'extraction des métaux des terres rares.
Le thorium est couramment utilisé comme une fois la source de lumière en manchons à incandescence et comme un matériau d'alliage, mais ces demandes ont diminué en raison de préoccupations au sujet de sa radioactivité. Le thorium est également utilisé comme élément d'alliage en non consommables TIG électrodes de soudage.
Canada , la Chine , l'Allemagne , l'Inde , le Pays-Bas , le Royaume-Uni et le Royaume-Unis ont expérimenté avec l'utilisation du thorium comme combustible nucléaire dans les réacteurs nucléaires de remplacement. Par rapport à l'uranium, il ya un intérêt croissant pour le développement d'un cycle du combustible de thorium en raison de ses avantages plus de sécurité, l'absence de non- isotopes fertiles, et sa fréquence plus élevée et la disponibilité. Trois étapes du programme nucléaire de l'Inde est probablement le plus bien connu et bien financé de tels efforts.
Caractéristiques
Propriétés physiques
Thorium pur est un métal blanc argenté qui est stable à l'air et conserve son lustre pendant plusieurs mois. Lorsque contaminés par le l'oxyde de thorium ternit lentement à l'air, devenant gris et enfin noir. Les propriétés physiques de thorium sont fortement influencées par le degré de contamination par l'oxyde.
Les échantillons les plus purs contiennent souvent de quelques dixièmes de pour cent de l'oxyde. Thorium pur est doux, très ductile et peut être laminées à froid, estampée, et dessinée. Le thorium est dimorphisme, changeant à 1360 ° C à partir d'un cubique face centrée à une structure cubique centré; une forme de réseau tétragonale centrée sur le corps existe à haute pression avec des impuretés de conduite les températures et pressions de transition exactes.
Poudre métallique de thorium est souvent pyrophorique et nécessite une manipulation minutieuse. Lorsqu'il est chauffé dans l'air, le métal thorium tournures enflammer et brûler brillamment avec une lumière blanche. Thorium a une des plus grandes plages de température de liquide de ne importe quel élément, avec 2 946 ° C entre le point de fusion et le point d'ébullition. Métal thorium est paramagnétique avec un état fondamental des deux 7s 6d 2.
Propriétés chimiques
Thorium est lentement attaqué par l'eau, mais ne se dissout pas facilement dans les acides les plus courants, à l'exception de l'acide chlorhydrique . Il se dissout dans l'acide nitrique concentré contenant une petite quantité catalytique d'ion fluorure.
L'oxyde de thorium est ThO 2. État le plus d'oxydation comon de thorium est 4, comme dans ThF 4, mais également thorium a un état d'oxydation de +3, comme dans ThI 3. Le thorium a été montré pour activer liaisons carbone-hydrogène, formant les composés inhabituels. atomes de thorium peuvent également se lier à d'autres atomes que ne importe quel autre élément. Par exemple, dans le composé thorium obligations tetrakisaminodiborane de thorium à quinze atomes d'hydrogène.
Composés
composés de thorium sont stables à l'état d'oxydation +4.
Le dioxyde de thorium, le point culminant de fusion (3300 ° C) de tous les oxydes.
Thorium (IV) et de nitrate thorium (IV) sont connus dans le fluorure leurs formes hydratées: Th (NO 3) 4 · 4H 2 O et du THF 4 · 4H 2 O, respectivement. De thorium (IV) carbonate, Th (CO 3) 2, est également connue.
Lorsqu'ils sont traités avec le fluorure de potassium et l'acide fluorhydrique, Th 4+ forme l'anion complexe ThF 2-
6, qui précipite sous forme de sel insoluble, K 2 6 THF.
De thorium (IV) hydroxyde, Th (OH) 4, est fortement insoluble dans l'eau, et ne est pas amphotère. Le peroxyde de thorium, ThO ou Th 4 (O 2) 2, est rare en étant un solide insoluble. Cette propriété peut être utilisée pour séparer le thorium à partir d'autres ions en solution.
En présence de des anions phosphates, des formes Th 4+ précipités de diverses compositions, qui sont insolubles dans les solutions d'eau et d'acide.
Thorium monoxyde a récemment été produit par l'ablation au laser de thorium en présence d'oxygène. Cette molécule très polaire a le plus grand champ électrique interne connue.
Isotopes
Vingt-sept des radio-isotopes ont été caractérisés, avec une gamme de poids atomique de 210 u (210 Th) à 236 u (236 Th). Les plus stables isotopes sont:
- 232 Th avec une demi-vie de 14050000000 années, mais elle représente l'ensemble des traces de thorium naturel.
- 230 Th avec une demi-vie de 75380 années. Se produit comme le produit de fille de 238 U décroissance.
- 229 Th avec une demi-vie de 7340 années. Il a un isomère nucléaire (ou état métastable) avec un remarquablement faible énergie d'excitation de 7,6 eV.
- 228 Th avec une demi-vie de 1,92 ans.
Tout le reste isotopes radioactifs ont des demi-vies qui sont moins de 30 jours et la majorité d'entre eux ont des demi-vies qui sont moins de dix minutes.
Applications
Thorium
Le thorium est un élément du magnésium série en alliage, appelé Mag-Thor, utilisé dans les moteurs d'avions et de fusées et conférant haute la force et résistance au fluage à des températures élevées. Magnésium thorié a été utilisé pour construire le CIM-10 missiles Bomarc, bien que des inquiétudes sur la radioactivité ont abouti à plusieurs missiles étant retiré de l'affichage public.
Le thorium est également utilisé sous sa forme d'oxyde (oxyde de thorium) en arc de tungstène de gaz de soudage (TIG) pour augmenter la résistance à haute température des électrodes en tungstène et d'améliorer la stabilité de l'arc. Les électrodes étiquetés EWTH-1 contiennent 1% l'oxyde de thorium, tandis que le EWTH-2 contiennent 2%. Dans les équipements électroniques, le thorium revêtement de tungstène fil améliore la électrons émission de chauffe cathodes.
Le thorium est un moyen très efficace protection contre les radiations, mais elle n'a pas été utilisée à cet effet, autant que le plomb ou l'uranium appauvri. Uranium-thorium datation a été utilisé à ce jour hominidés fossiles , les fonds marins, et des chaînes de montagnes.
Les préoccupations environnementales liées à la radioactivité ont entraîné une forte baisse de la demande pour des usages non nucléaires de thorium dans les années 2000.
composés de thorium
Dioxyde de thorium (ThO 2) et de nitrate de thorium (Th (NO 3) 4) ont été utilisés dans manteaux de feux de gaz portables, y compris les lampes de gaz naturel, des lampes à huile et des lumières de camping. Ces manteaux brillent avec une lumière blanche intense (sans rapport avec la radioactivité) lorsqu'il est chauffé dans une flamme de gaz, et sa couleur pourrait être déplacé au jaune par addition de cérium.
Dioxyde de thorium est un matériau pour résistant à la chaleur la céramique, par exemple, pour le laboratoire à haute température creusets. Lorsqu'il est ajouté à verre , il contribue à augmenter indice de réfraction et la diminution dispersion. Tel verre trouve son application dans de haute qualité lentilles pour appareils photo et d'instruments scientifiques. Le rayonnement de ces lentilles peut se auto-assombrir (jaune) les sur une période d'années et dégradent film, mais les risques pour la santé sont minimes. Lentilles jaunies peuvent être restaurés dans leur état incolore original avec une longue exposition à d'intenses UV lumière.
Dioxyde de thorium a été utilisé pour contrôler la taille des grains de tungstène métal utilisé pour les spirales de lampes électriques. Éléments de tungstène thorié se trouvent dans les filaments de tubes à magnétron. Le thorium est ajoutée en raison de sa capacité à émettre des électrons à des températures relativement basses lors du chauffage sous vide. Ces tubes génèrent micro-onde fréquences et sont appliqués dans fours à micro-ondes et les radars .
Dioxyde de thorium a été utilisé en tant que catalyseur dans la conversion de l'ammoniac à l'acide nitrique , en pétrole fissuration et dans la production de l'acide sulfurique . Ce est le principe actif du Thorotrast, qui a été utilisé en tant que Produit de contraste pour Diagnostic X-ray. Cet usage a été abandonné en raison de son caractère cancérigène.
En dépit de sa radioactivité, le fluorure de thorium (THF 4) est utilisé comme un matériau antireflet à des revêtements optiques multicouches. Il a une excellente transparence optique dans la gamme de 0,35 à 12 um, et son rayonnement est principalement due à les particules alpha, qui peut être facilement arrêté par une couche de couverture mince d'un autre matériau. fluorure de thorium a également été utilisé dans la fabrication lampes à arc de carbone, qui ont fourni un éclairage de haute intensité pour les projecteurs de cinéma et des lumières de recherche.
Thorium comme combustible nucléaire
Avantages et défis
L'isotope naturel thorium-232 est un matériau fertile, et avec une source de neutrons adapté peut être utilisé comme combustible nucléaire réacteurs nucléaires, y compris surgénérateurs. En 1997, le Département de l'énergie des États-Unis a souscrit à la recherche en combustible de thorium, et de la recherche a également commencé en 1996 par le Agence internationale de l'énergie atomique (AIEA), pour étudier l'utilisation de réacteurs au thorium. Scientifique nucléaire Alvin Radkowsky de Université de Tel Aviv en Israël fondé un consortium pour développer des réacteurs de thorium, qui comprenait d'autres entreprises: Raytheon Nuclear Inc., Brookhaven National Laboratory, et le Institut Kourtchatov à Moscou.
Radkowsky était scientifique en chef aux États-Unis programme de sous-marin nucléaire dirigé par Amiral Hyman Rickover et plus tard a dirigé l'équipe de conception qui a construit premier civil des Etats-Unis centrale nucléaire à Shippingport, en Pennsylvanie, qui était une version réduite en place du premier réacteur navale. Le troisième noyau Shippingport, initié en 1977, élevé thorium. Encore plus tôt Des exemples de réacteurs utilisant du combustible à thorium existent, y compris le premier noyau à la Energy Centre Indian Point en 1962.
Certains pays, dont l'Inde , investissent maintenant dans la recherche pour construire des réacteurs nucléaires à base de thorium. Un rapport de 2005 par le Agence internationale de l'énergie atomique discute des avantages potentiels ainsi que les défis de réacteurs au thorium. L'Inde a également fait réacteurs nucléaires à base de thorium une priorité avec son accent sur le développement la technologie à neutrons rapides.
Certains avantages du thorium comme combustible par rapport à l'uranium ont été résumées comme suit:
- Matières fissiles de qualité militaire (233 U) est plus difficile de récupérer en toute sécurité et dans la clandestinité d'un réacteur de thorium;
- Thorium produit des déchets radioactifs 10 à 10 000 fois moins long terme;
- extraction de thorium produit un seul isotope pur, tandis que le mélange d'isotopes d'uranium naturel doit être enrichi à fonctionner dans les modèles de réacteurs les plus courantes. Le même cycle pourrait également utiliser le composant fissile U-238 de l'uranium naturel, et aussi contenue dans le combustible du réacteur appauvri;
- Thorium ne peut pas soutenir une réaction nucléaire en chaîne sans primaire, donc la fission se arrête par défaut dans un réacteur piloté par accélérateur.
Lorsqu'il est utilisé dans un réacteur surgénérateur comme, cependant, à la différence des réacteurs à eau légère à base d'uranium, le thorium nécessite l'irradiation et de retraitement avant les avantages mentionnés ci-dessus de thorium-232 peut être réalisé, ce qui rend d'abord combustibles thorium solides plus cher que les combustibles d'uranium. Mais les experts notent que "le deuxième réacteur de thorium peut activer un troisième réacteur de thorium. Cela pourrait se poursuivre dans une chaîne de réacteurs depuis un millénaire si nous choisissons." Ils ajoutent qu'en raison de l'abondance de thorium, il ne sera pas épuisé en 1000 années.
Le Alliance thorium énergie (TEA), une organisation de défense de l'éducation, souligne que «il ya assez de thorium dans le États-Unis seulement pour alimenter le pays à son niveau actuel de l'énergie depuis plus de 10.000 ans."
Cycle du combustible énergétique Thorium
Comme 238 U, 232 Th ne est pas se fissiles, mais il est fertile: il absorbera neutrons lents à produire, après deux désintégrations bêta, 233 U, qui est fissile. En outre, la préparation du thorium comme combustible ne nécessite pas la séparation isotopique.
Le cycle du combustible de thorium crée 233 U, qui, si séparé de carburant du réacteur, pourrait avec une certaine difficulté être utilisé pour la fabrication d'armes nucléaires. Ce est une raison pour laquelle un cycle de combustible liquide (par exemple, Réacteur à sels fondus ou MSR) est préféré - seulement une quantité limitée de 233 U ne existe jamais dans le réacteur et ses systèmes de transfert de chaleur, empêchant tout accès au matériel d'armement; toutefois, les neutrons produits par le réacteur peuvent être absorbés par une couverture de thorium ou de l'uranium fissile et 233 U ou Pu 239 produit. En outre, le 233 U pourrait être continu extrait du combustible fondu dans le réacteur est en fonctionnement. Les neutrons de la désintégration de l'uranium-233 peuvent être réintroduites dans le cycle du combustible pour recommencer le cycle.
Le flux de neutrons de fission spontanée de 233 U est négligeable. 233 U peut donc être utilisé facilement dans un type de pistolet conception simple de bombe nucléaire. En 1977, un réacteur à eau légère à la Réacteur nucléaire de Shippingport a été utilisé pour établir un cycle du combustible U 232 Th 233. Le réacteur a travaillé jusqu'à son démantèlement en 1982. thorium peut être et a été utilisé pour alimenter des centrales nucléaires utilisant à la fois la traditionnelle modifiés Conception de réacteur de génération III et prototype Génération conceptions de réacteurs IV. L'utilisation du thorium comme combustible de substitution est une innovation à l'étude par le Projet international sur les réacteurs nucléaires et les cycles du combustible (INPRO), menée par le Agence internationale de l'énergie atomique (AIEA).
Contrairement à son utilisation dans Réacteurs à sels fondus, lors de l'utilisation du thorium solide modifiés réacteur à eau légère (LWR) problèmes comprennent: la technologie peu développée pour la fabrication de carburant; dans, une fois par traditionnelle LWR conçoit les problèmes potentiels en matière de recyclage en raison de thorium 228 Th hautement radioactifs; un risque de prolifération des armes grâce à la production de 233 U; et les problèmes techniques (pas encore résolus de manière satisfaisante) au retraitement. Beaucoup de travail de développement est encore nécessaire avant que le cycle du combustible au thorium peut être commercialisé pour une utilisation dans LWR. L'effort requis n'a pas semblé vaut la peine tout l'uranium abondante est disponible.
Station commerciale de l'énergie nucléaire
Inde s ' Kakrapar-réacteur est une premier réacteur au monde qui utilise thorium plutôt que de l'uranium appauvri pour obtenir une puissance d'aplatissement à travers le coeur du réacteur. L'Inde, qui compte environ 25% des réserves de thorium dans le monde, développe un prototype de 300 MW d'une base de thorium Avancée réacteur à eau lourde (AHWR). Le prototype devrait être pleinement opérationnel d'ici 2013, après quoi cinq autres réacteurs seront construits. Le réacteur est un réacteur à neutrons rapides et utilise un noyau de plutonium plutôt que d'un accélérateur pour produire des neutrons. Comme les systèmes basés sur des accélérateurs peuvent fonctionner à la sous-criticité, ils pourraient être développés aussi, mais cela nécessiterait plus de recherches. Inde envisage actuellement la réunion 30% de sa demande d'électricité grâce à des réacteurs à base de thorium en 2050.
Projets d'énergie de thorium existante
L'Allemand THTR-300 était la première centrale commerciale alimenté presque entièrement avec du thorium. 300 MWe de l'Inde AHWR (réacteur à eau lourde pressurisée) réacteur a commencé la construction en 2011. Le projet prévoit une Commençons avec du plutonium de qualité réacteur qui reproduisent U-233 de Th-232. Après que l'entrée ne sera thorium pour le reste de la durée de vie du réacteur.
Le combustible principal de la HT 3 R Projet proximité Odessa, Texas, États-Unis sera perles recouvertes de céramique thorium. La première date le réacteur sera opérationnel est en 2015.
Les meilleurs résultats sont obtenus avec réacteurs de sel fondu (MSR), tels que de l'ORNL liquide du fluorure réacteur de thorium (LFTR), qui ont intégré des taux de réaction de rétroaction négative en raison de l'expansion de sel et donc réacteur étranglement par charge. Ce est un avantage de sécurité grande, car aucun système de refroidissement d'urgence est nécessaire, qui est à la fois coûteux et ajoute l'inefficacité thermique. En fait, une MSR a été choisi comme la conception de base pour les années 1960 DoD avions nucléaire principalement en raison de ses grands avantages de sécurité, même dans des manœuvres de l'avion. Dans la conception de base, une MSR génère de la chaleur à des températures plus élevées, en continu et sans ravitaillement arrêts, de sorte qu'il peut fournir de l'air chaud à une plus efficace ( Cycle de Brayton) turbine. Un terme de MSR cette façon est mieux environ 30% de l'efficacité thermique que les centrales thermiques commun, qu'elle soit nucléaire carburant solide comburant ou traditionnelle.
En 2009, membre du Congrès des États-Unis Joe Sestak a tenté en vain d'obtenir un financement pour la recherche et le développement d'un destroyer réacteur de utilisant du carburant liquide à base de thorium.
Les réacteurs CANDU d'Énergie atomique du Canada limitée sont capables d'utiliser le thorium comme source de carburant.
Lors de la conférence annuelle 2011 de la Académie chinoise des sciences, il a été annoncé que «la Chine a lancé un projet de recherche et développement en matière de technologie de réacteur à sel fondu de thorium."
Projets combinant uranium et de thorium
Fort Saint-Vrain Generating Station, une démo HTGR dans Colorado, États-Unis, opérant à partir de 1977 jusqu'en 1992, employé combustible d'uranium enrichi qui contient également le thorium. Il en est résulté un rendement énergétique élevé parce que le thorium a été converti en uranium puis brûlé.
Histoire

Morten Thrane Esmark trouvé un minéral noir sur Løvøya île, la Norvège et a donné un échantillon de son père Jens Esmark, une note minéralogiste. Le Esmark aîné était pas en mesure de l'identifier et envoyé un échantillon à chimiste suédois Jöns Jakob Berzelius pour examen en 1828. Berzelius a déterminé qu'il contenait un nouvel élément, qu'il nomma le thorium après Thor , le dieu nordique du tonnerre. Il a publié ses conclusions en 1829. Berzelius réutilisé le nom d'une découverte de l'élément précédent d'un minéral de la Falun qui se est avéré plus tard être un minéral d'yttrium. Le métal ne avait pas jusqu'à utilisations pratiques Carl Auer von Welsbach inventé le manteau de gaz en 1885.
Thorium a été observé pour la première à être radioactifs en 1898, indépendamment, par le physicien polonais-français Marie Curie et le chimiste allemand Gerhard Carl Schmidt. Entre 1900 et 1903, Ernest Rutherford et Frederick Soddy a montré comment le thorium pourri à un taux fixe au fil du temps en une série d'autres éléments. Cette observation a conduit à l'identification de demi-vie comme l'un des résultats de la expériences de particules alpha qui ont conduit à leur théorie de désintégration de la radioactivité.
Le processus de barre de cristal (ou «processus iodure") a été découvert par Eduard van Arkel et Jan Hendrik de Boer en 1925 pour produire de haute pureté métallique thorium.
Le nom a été donné ionium au début de l'étude des éléments radioactifs à la 230 Th isotope produit dans la chaîne de désintégration de 238 U avant qu'il ne soit rendu compte que ionium et de thorium étaient chimiquement identiques. Le symbole Io a été utilisée pour cet élément supposé.
Thorium-232 est un nucléide primordial, ayant existé sous sa forme actuelle pour plus de 4,5 milliards d'années, antérieure à la formation de la Terre ; il a été forgé dans les noyaux des étoiles mourantes à travers le r-process et dispersés à travers la galaxie en supernovae . Son désintégration radioactive produit une quantité importante de la chaleur interne de la terre .
Occurrence

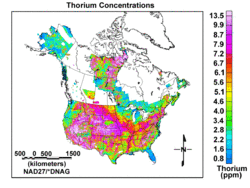
On trouve du thorium en petites quantités dans la plupart des roches et des sols ; il est trois fois plus abondant que l'étain dans la croûte de la Terre et concerne aussi commun que le plomb . Sol contient généralement une moyenne d'environ 6 parties par million (ppm) de thorium. Thorium se produit dans plusieurs minéraux dont thorite (ThSiO 4), thorianite (ThO 2 + UO 2) et monazite. Thorianite est un minéral rare et peut contenir jusqu'à environ 12% d'oxyde de thorium. Monazite contenant 2,5% de thorium, allanite a 0,1 à 2% de thorium et zircon peut contenir jusqu'à 0,4% de thorium. Minéraux contenant du thorium se produisent sur tous les continents. Le thorium est plusieurs fois plus abondant dans la croûte terrestre que tout isotopes de l'uranium et du thorium combinés-232 est plusieurs centaines de fois plus abondant que l'uranium-235.
232 Th se désintègre très lentement (sa demi-vie est comparable à l'âge de l'univers), mais d'autres thorium isotopes se produisent dans les thorium et de désintégration de l'uranium chaînes. La plupart d'entre elles sont de courte durée et donc beaucoup plus radioactif que 232 Th, mais sur une base de masse, ils sont négligeables.
extraction de thorium
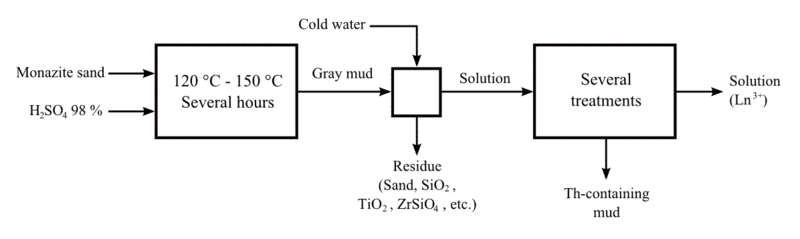
Thorium a été extrait principalement de monazite par un processus complexe en plusieurs étapes. Le sable de monazite est dissous dans du concentré chaud de l'acide sulfurique (H 2 SO 4). Le thorium est extrait sous forme de résidu insoluble en une phase organique contenant une amine. Ensuite, il est séparé ou éliminé en utilisant un ion tel que le nitrate, le chlorure, l'hydroxyde ou le carbonate, le thorium retour à une phase aqueuse. Enfin, le thorium est précipité et recueilli.
Plusieurs méthodes sont disponibles pour la production de thorium métallique: il peut être obtenu par réduction de l'oxyde de thorium avec du calcium, par électrolyse de l'anhydre de chlorure de thorium dans un mélange fondu de chlorures de sodium et de potassium, par réduction de calcium de thorium tétrachlorure mélangé avec du chlorure de zinc anhydre, et par réduction de tétrachlorure de thorium avec un métal alcalin.
Les estimations des réserves
Les connaissances actuelles sur la répartition des ressources de thorium est pauvre en raison des efforts d'exploration relativement faible-clés découlant de la demande insignifiante. Il ya deux séries d'estimations qui définissent les réserves de thorium du monde, un jeu par le US Geological Survey (USGS) et l'autre soutenu par les rapports de l'OCDE et l'Agence internationale de l'énergie atomique (AIEA). Selon la dernière estimation de l'USGS, États-Unis , l'Australie et l'Inde ont notamment d'importantes réserves de thorium.
L'AIEA et l'OCDE semblent conclure que l'Inde peut posséder la part du lion des gisements de thorium de monde. Le Gouvernement de la dernière estimation de l'Inde, partagée au Parlement du pays en Août 2011, met la réserve récupérable à 846 477 tonnes.
Inde et l'Australie sont censés posséder environ 300.000 tonnes chacun; ce est à dire chaque pays possédant 25% des réserves de thorium dans le monde. Dans les rapports de l'OCDE, toutefois, les estimations des réserves assurées raisonnables de l'Australie (RAR) de thorium indiquent seulement 19 000 tonnes et 300 000 tonnes et non, comme indiqué par l'USGS. Les deux sources varient énormément pour les pays tels que le Brésil, la Turquie et l'Australie, cependant, les deux rapports semblent montrer une certaine cohérence par rapport aux chiffres des réserves de thorium de l'Inde, avec 290 000 tonnes (USGS) et 319 000 tonnes (OCDE / AIEA).
Rapport de l'AIEA estime 2,005 réserves raisonnablement assurées de l'Inde de thorium à 319 000 tonnes, mais mentionne les récents rapports des réserves de l'Inde à 650 000 tonnes.
L'estimation des réserves en vigueur thorium économiquement disponibles provient de l'US Geological Survey, Mineral Commodity Summaries (1996-2010):
| Pays | Réserves |
|---|---|
| Inde | 650000 |
| États Unis | 440000 |
| Australie | 300000 |
| Brésil | 16000 |
| Canada | 100000 |
| Malaisie | 4500 |
| Afrique Du Sud | 35000 |
| Autres Pays | 90000 |
| Total mondial | 1660000 |
Remarque: Le rapport de l'OCDE / AEN note que les estimations (que les chiffres australiens sont basés sur) sont subjectives, en raison de la variabilité de la qualité des données, beaucoup de ce qui est vieux et incomplète. Ajoutant à la confusion sont des allégations subjectives faites par le gouvernement australien (en 2009, par le biais son département de géosciences) qui combinent les réserves raisonnablement assurées (RAR) estime avec données «présumées» (c.-à conjectures subjectives). Ce chiffre combiné étrange RAR et "deviné" réserves donne un chiffre, publié par le gouvernement australien, de 489 000 tonnes, cependant, en utilisant les mêmes critères pour le Brésil ou l'Inde donnerait chiffres des réserves comprises entre 600 000 à 1,3 millions de tonnes pour le Brésil et entre 300 000 à 600 000 tonnes pour l'Inde. Indépendamment des revendications isolées par le gouvernement australien, tiers et multi-latéraux rapports les plus crédibles, ceux de l'OCDE / AIEA et l'USGS, signalent régulièrement les réserves de thorium élevés pour l'Inde sans faire de même pour l'Australie.
Une autre estimation des réserves raisonnablement assurées (RAR) et les estimations des réserves supplémentaires (EAR) de thorium vient de l'OCDE / AEN, l'énergie nucléaire, «Tendances en cycle du combustible nucléaire", Paris, France (2001):
| Pays | RAR Th | EAR Th |
|---|---|---|
| Inde | 519000 | 21% |
| Australie | 489000 | 19% |
| USA | 400000 | 13% |
| Dinde | 344000 | 11% |
| Venezuela | 302000 | 10% |
| Brésil | 302000 | 10% |
| Norvège | 132000 | 4% |
| Egypte | 100000 | 3% |
| Russie | 75000 | 2% |
| Groenland | 54000 | 2% |
| Canada | 44000 | 2% |
| Afrique Du Sud | 18000 | 1% |
| "autres pays" | 33000 | 2% |
| «Total mondial" | 2810000 |
Les chiffres concernant les réserves précédentes se réfèrent à la quantité de thorium dans des dépôts à forte concentration inventoriés jusqu'ici et estimés à extractible à prix courants du marché; des millions de fois plus totale existent dans 3 * 10 19 tonnes la croûte terrestre, environ 120 milliards de tonnes de thorium, et moindre, mais de grandes quantités de thorium existent à des concentrations intermédiaires. Les réserves prouvées sont "un mauvais indicateur de l'approvisionnement total de l'avenir d'une ressource minérale."
Le Lemhi Pass, le long de la Idaho- Frontière du Montana, possède l'un des plus grands gisements de thorium haute qualité connus dans le monde. Thorium Energy, Inc. a le droits miniers sur environ 1360 hectares (5,5 km carrés) de celui-ci et affirme qu'ils ont des réserves d'oxyde de thorium de 600 000 tonnes et des réserves probables supplémentaires de 1,8 million de tonnes au sein de leur réclamation prouvée.
En cas de cycle du combustible de thorium, Conway granit avec 56 (± 6) parties par million thorium pourraient fournir une ressource majeure de bas grade; un mile 307 m² (795 km carrés) "de masse principale" dans New Hampshire est estimé à contenir plus de trois millions de tonnes métriques par 100 pieds (30 m) de profondeur ( ce est à dire 1 kg de thorium dans huit mètres cubes de roche), dont les deux-tiers est «facilement lessivable ". Même rocher de granit commun avec la concentration de 13 ppm de thorium (seulement deux fois la moyenne de la croûte terrestre, avec 4 ppm d'uranium) contient de l'énergie nucléaire potentielle équivalente à 50 fois la masse de l'ensemble de la roche dans le charbon, bien qu'il n'y ait aucune incitation à recourir à cette très gisements à faible teneur si longtemps autant dépôts à plus haute teneur demeurent disponibles et moins coûteux à extraire. thorium a été produite en excès de la demande provenant du raffinage du éléments de terres rares.
Dangers et rôles biologiques
Poudre métallique de thorium est pyrophorique et sera souvent se enflammer spontanément dans l'air. Thorium naturel désintégrations très lentement par rapport à beaucoup d'autres matières radioactives, et de la le rayonnement alpha émis ne peuvent pas pénétrer sens de peau humaine et possédant la manipulation de petites quantités de thorium, par exemple un manteau de gaz, est considéré comme sûr. L'exposition à un aérosol de thorium, cependant, peut entraîner un risque accru de cancers de la poumon, le pancréas et le sang , comme les poumons et d'autres organes internes peuvent être traversés par un rayonnement alpha. L'exposition au thorium conduit interne à un risque accru de les maladies du foie. Thorium est radioactif et produit un gaz radioactif, le radon -220, comme un de ses produits de désintégration. Produits de désintégration du thorium secondaires comprennent le radium et de l'actinium . Pour cette raison, il ya des préoccupations quant à la sécurité des manteaux de thorium. Certains les organismes de sécurité nucléaires faire des recommandations sur leur utilisation. Production de manteaux de gaz a conduit à certaines préoccupations de sécurité lors de fabriquer.
L'élément a pas connu rôle biologique. Les humains consomment généralement trois microgrammes par jour de thorium. Sur ce total, 99,98% ne reste pas dans le corps. Sur le thorium qui ne reste dans le corps, les trois quarts de celle-ci se accumule dans le squelette. Un certain nombre de composés de thorium sont chimiquement modérément toxique. Les gens qui travaillent avec des composés de thorium sont à un risque de une dermatite. L'exposition au thorium sur une longue période peut provoquer le cancer . Il peut prendre jusqu'à 30 années après l'ingestion de thorium pour que les symptômes se manifestent.