Bismuth
Saviez-vous ...
Enfants SOS offrent un chargement complet de la sélection pour les écoles pour une utilisation sur les intranets des écoles. Cliquez ici pour plus d'informations sur les enfants SOS.
| Bismuth | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
83 Bi | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||
argent brillant  | |||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | bismuth, Bi, 83 | ||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / b ɪ z m ə θ / BIZ -məth | ||||||||||||||||||||||||||||||||||||||||||
| Catégorie Metallic | post-métal de transition | ||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 15 (pnictogens), 6, p | ||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 208,98040 (1) | ||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 4f 14 5d 10 6s 6p 2 3 2, 8, 18, 32, 18, 5 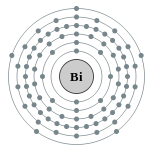 | ||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||
| Découverte | Claude François Geoffroy (1753) | ||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 9,78 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 10,05 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 544,7 K , 271,5 ° C, 520,7 ° F | ||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 1837 K, 1564 ° C, 2847 ° F | ||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 11,30 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 151 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 25,52 J · mol -1 .K -1 | ||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 5, 4, 3, 2, 1 (Légèrement acide oxyde) | ||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 2,02 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 703 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1610 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||
| 3ème: 2466 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 156 h | ||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 148 ± 16 heures | ||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 207 h | ||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | rhomboédrique  | ||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | ||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 1,29 μΩ · m | ||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 7,97 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 13,4 um · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 1,790 m · s -1 | ||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 32 GPa | ||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 12 GPa | ||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 31 GPa | ||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,33 | ||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 2,25 | ||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 94,2 MPa | ||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-69-9 | ||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de bismuth | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
Le bismuth est un élément chimique avec le symbole Bi et de numéro atomique 83. Bismuth, un pentavalent pauvre en métaux, ressemble chimiquement l'arsenic et l'antimoine . Bismuth élémentaire peut se produire naturellement, bien que ses minerais commerciales importantes de sulfure et sous forme d'oxyde. Le élément libre est de 86% plus dense que le plomb . Ce est un métal cassant avec une couleur blanc argenté lorsqu'il est fraîchement produite, mais est souvent vu dans l'air avec une nuance rose en raison à la surface l'oxydation. Bismuth est le plus naturellement diamagnétique et a l'une des valeurs les plus faibles de la conductivité thermique entre les métaux.
Bismuth métallique a été connu depuis l'antiquité, bien que jusqu'au 18ème siècle, il était souvent confondu avec le plomb et l'étain, qui part certaines propriétés physiques. L'étymologie est incertaine, mais peut-être vient de Ismid bi arabe, signifie ayant les propriétés d'antimoine ou mots allemands weisse masse ou wismuth ("masse blanche»), traduit dans le milieu du XVIe siècle New bisemutum latine.
Le bismuth a longtemps été considéré comme l'élément le plus élevé de masse atomique qui est stable. Cependant, on a récemment découvert à être légèrement radioactifs: son seul isotopes primordiale bismuth-209 alpha désintègre avec une demi-vie plus d'un milliard de fois l'estimation âge de l'univers .
Composés de bismuth représentent environ la moitié de la production de bismuth. Ils sont utilisés dans les produits cosmétiques, des pigments, et quelques produits pharmaceutiques, notamment Pepto-Bismol. Bismuth a exceptionnellement bas la toxicité pour un métal lourd. Comme la toxicité du plomb est devenu plus évident au cours des dernières années, il existe une utilisation croissante des alliages de bismuth (actuellement environ un tiers de la production de bismuth) en tant que remplacement pour le plomb.
Histoire
Le nom de bismuth est comprise entre ca. Années 1660, et est de l'étymologie incertaine. Ce est un des premiers métaux à 10 ont été découverts. Bismuth apparaît dans les années 1660, d'être obsolète allemande Bismuth, Wismut, Wissmuth (début du 16ème siècle); peut-être liée à Ancien haut-allemand hwiz («blanc»). Le New bisemutum latine (en raison de Georgius Agricola, qui latinisé nombre minière allemande et les mots techniques) est de la Wismuth allemand, peut-être de Weisse Masse, "masse blanche." L'élément a été confondu dans les premiers temps avec de l'étain et du plomb en raison de sa ressemblance avec ces éléments. Bismuth a été connu depuis l'Antiquité, donc pas une personne est crédité de sa découverte. Agricola, dans De Natura Fossilium (ca. 1546) stipule que le bismuth est un métal distincte dans une famille de métaux, y compris l'étain et le plomb. Ceci a été basée sur l'observation des métaux et de leurs propriétés physiques. Mineurs à l'ère de l'alchimie aussi donné l'bismuth argenti nom de Tectum, ou «argent étant fait," dans le sens de l'argent encore en train d'être formé à l'intérieur de la Terre.
Commençant par Johann Heinrich Pott en 1738, Carl Wilhelm Scheele et Torbern Olof Bergman la netteté de plomb et de bismuth est devenu clair et Claude François Geoffroy a démontré en 1753 que ce métal est distincte de plomb et d'étain. Bismuth a également connu des Incas et utilisé (avec le cuivre et l'étain d'habitude) dans une spéciale alliage de bronze pour les couteaux.
Caractéristiques


Caractéristiques physiques
Bismuth est un métal cassant avec un blanc, la teinte d'argent-rose, survenant souvent dans sa forme native, avec un iridescent ternissement d'oxyde montrant beaucoup de couleurs du jaune au bleu. La spirale, une structure en escalier de cristaux de bismuth est le résultat d'un taux de croissance plus élevé sur les bords extérieurs que sur les bords intérieurs. Les variations de l'épaisseur de la couche d'oxyde qui se forme sur la surface du cristal provoque différentes longueurs d'onde de la lumière pour interférer lors de la réflexion, affichant ainsi un arc en ciel de couleurs. Quand brûlé dans l'oxygène , le bismuth brûlures avec un bleu flamme et ses formes d'oxyde jaune les fumées. Son toxicité est très inférieure à celle de ses voisins dans le tableau périodique , tels que le plomb, l'antimoine , et le polonium .
Aucun autre métal est vérifié pour être plus naturellement diamagnétique de bismuth. ( Superdiamagnetism est un phénomène physique différent.) De tous les métaux, il a l'une des valeurs les plus faibles de la conductivité thermique (après manganèse , et peut-être le neptunium et le plutonium ) et le plus haut Coefficient de Hall. Il a une haute résistance électrique . Quand déposé en couches suffisamment minces sur un substrat, le bismuth est un semi-conducteur , au lieu d'un pauvre en métaux.
Bismuth élémentaire est l'un des très peu de substances dont la phase liquide est plus dense que sa phase solide (l'eau étant l'exemple le plus connu). 3,32% de bismuth se dilate lors de la solidification; Par conséquent, il a été longtemps un composant de bas point de fusion composition alliages, où il compensé la contraction des autres composants d'alliage, pour former pratiquement isostatique bismuth-plomb alliages eutectiques.
Bien que pratiquement invisible dans la nature, le bismuth-haute pureté peuvent former distinctif, coloré cristaux de Hopper. Il est relativement non toxique et présente un point de fusion bas juste au-dessus de 271 ° C, de sorte que les cristaux peuvent être cultivées à l'aide d'une cuisinière domestique, bien que les cristaux résultants ont tendance à être moins bonne qualité que les cristaux cultivées en laboratoire.
Dans les conditions ambiantes bismuth cristallise dans le réseau rhomboédrique ( Pearson symbole HR6, groupe d'espace R 3 m n ° 166), qui est souvent classé dans les systèmes de cristal trigonal ou hexagonal. Quand comprimé à la température ambiante, cette structure Bi-I change à la première monoclinique Bi-II à 2,55 GPa, puis à la tétragonale Bi-III à 2,7 GPa, et enfin à la cubique centré Bi-IV à 7,7 GPa. Les transitions correspondantes peuvent être surveillés par des changements dans la conductivité électrique; ils sont plutôt reproductible et abrupte, et sont donc utilisés pour l'étalonnage des appareils à haute pression.
Caractéristiques chimiques
Bismuth est stable à la fois à l'air sec et humide à des températures ordinaires. Lorsque rouge, il réagit avec l'eau pour faire de bismuth (III) oxyde.
- 2 Bi + 3 H 2 O → Bi 2 O 3 + 3 H 2
Il réagit avec du fluor à faire bismuth (V) le fluorure à 500 ° C ou bismuth (III) de fluorure à des températures inférieures (typiquement de Bi fond); avec d'autres atomes d'halogène , il ne donne des halogénures de bismuth (III). Les trihalogénures sont corrosifs et facilement réagissent à l'humidité, formant oxyhalogénures avec la formule BIOX.
- 2 Bi + 3 X 2 → 2 BiX 3 (X = F, Cl, Br, I)
Bismuth concentré se dissout dans l'acide sulfurique à faire bismuth (III) et de sulfate le dioxyde de soufre.
- 6 H 2 SO 4 + 2 Bi → 6 H 2 O + Bi 2 (SO 4) 3 + 3 SO 2
Il réagit avec l'acide nitrique à faire bismuth (III) nitrate.
- Bi + 6 HNO 3 → 3 H 2 O 3 + NO 2 + Bi (NO 3) 3
Il dissout aussi dans l'acide chlorhydrique , mais seulement avec l'oxygène présent.
- 4 Bi + 3 O 2 + HCl → 4 12 BiCl 3 + 6 H 2 O
Il est utilisé en tant que Agent transmetalating dans la synthèse de complexes de métaux alcalino-terreux:
- Ba + BIPH 3 → BAPH 3 + Bi
Isotopes
La seule primordiale isotope de bismuth, bismuth-209, a été traditionnellement considéré comme le plus lourd isotope stable, mais il a longtemps été soupçonné d'être instable sur le plan théorique. Ce fut finalement démontré en 2003, lorsque des chercheurs de l'Institut d'Astrophysique Spatiale à Orsay, France , mesuré la émission alpha demi-vie de 209 Bi à 1,9 × 10 19 années, au cours d'une milliard de fois plus longtemps que l'actuelle estimée âge de l'univers . Grâce à sa extraordinairement longue demi-vie, pour toutes les applications médicales et industrielles actuellement connus, le bismuth peut être traitée comme si elle est stable et non radioactif. La radioactivité est un intérêt académique car bismuth est l'un des rares éléments dont la radioactivité était soupçonné et théoriquement prédit, avant d'être détecté dans le laboratoire. Bismuth a la demi-vie plus longue connue de désintégration alpha, bien tellure 128 a une désintégration bêta demi-double vie de plus de 2,2 × 10 24 ans.
Plusieurs isotopes de bismuth avec de courtes demi-vies se produisent au sein des chaînes de désintégration radioactifs de l'actinium , le radium et de thorium et d'autres ont été synthétisés expérimentalement. Bismuth-213 se trouve également sur la chaîne de désintégration de l'uranium-233.
Commercialement, l'isotope radioactif de bismuth-213 peut être obtenu en bombardant du radium avec photons bremsstrahlung d'un Accélérateur linéaire de particules. En 1997, un conjugué d'anticorps avec le bismuth-213, qui a une demi-vie de 45 minutes et décroît avec l'émission d'une particule alpha, a été utilisé pour traiter les patients atteints de leucémie. Cet isotope a également été essayé dans le traitement du cancer, par exemple, dans le programme de thérapie ciblée alpha (TAT).
Les composés chimiques
Formes trivalents et pentavalents composés de bismuth, les trivalents étant plus fréquente. Un grand nombre de ses propriétés chimiques sont analogues à celles de l'arsenic et de l'antimoine , bien qu'ils soient moins toxiques que les dérivés de ces éléments plus légers.
Les oxydes et sulfures
A des températures élevées, les vapeurs du métal rapidement se combinent avec l'oxygène pour former du trioxyde jaune, Bi 2 O 3. Lorsque fondu, à des températures supérieures à 710 ° C, cet oxyde se corrode tout oxyde métallique, et même le platine. Sur réaction avec une base, il se forme deux séries de oxanions: BiO -
2, qui est polymère et forme des chaînes linéaires et BiO 3-
3. L'anion Li 3 BiO 3 est en fait un anion octamérique cube, Bi 8 O 24
24, alors que l'anion dans Na 3 BiO 3 est tétramérique.
Le rouge de bismuth (V) de l'oxyde noir, Bi 2 O 5, est instable, libérant O 2 du gaz lors du chauffage.
Sulfure de bismuth, Bi 2 S 3, se produit naturellement dans les minerais de bismuth. Il est également produit par la combinaison de bismuth et du soufre fondu.
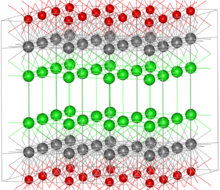
Oxychlorure de bismuth (BiOCl, voir figure à droite) et bismuth oxynitate (BiONO 3) semble stoechiométriquement sels anioniques comme de simples de la bismuthyle (III) cation (Bio +) qui se produit généralement dans les composés de bismuth aqueuses. Toutefois, dans le cas de BiOCl, les formes cristallines du sel dans une structure de plaques alternées de Bi, O, Cl, et des atomes d'oxygène avec chaque coordination avec quatre atomes de bismuth dans le plan adjacent. Ce composé minéral est utilisé en tant que pigment et cosmétiques (voir ci-dessous).
Bismuthine et bismuthures
Contrairement aux premiers membres du groupe 15 d'éléments tels que l'azote, le phosphore et l'arsenic, et similaire au précédent élément du groupe 15 d'antimoine , le bismuth ne forme pas une écurie hydrure. Bismuth hydrure, bismuthine (Bosnie-Herzégovine 3), est un composé endothermique qui se décompose spontanément à la température ambiante. Il est stable seulement en dessous de -60 ° C. Bismuthures sont des composés intermétalliques entre le bismuth et d'autres métaux.
Halogénures
Le Il a été démontré halogénures de bismuth dans des états d'oxydation bas pour adopter des structures inhabituelles. Ce qui a été pensé à l'origine pour être bismuth (I) le chlorure, BiCl, se avère être un composé complexe composé de Bi 5+
9 2- cations et BiCl
5 et Bi
2 Cl 2
8 anions. Le Bi 5+
9 cation a une tricapped déformée trigonal prismatique géométrie moléculaire, et se retrouve également dans Bi Hf 10 Cl 3 18, qui est préparé par réduction d'un mélange de hafnium (IV) et le chlorure de le chlorure de bismuth avec du bismuth élémentaire, ayant la structure [Bi +] [Bi 5+
9] [2- HfCl
6] 3. D'autres cations de bismuth polyatomiques sont également connus, tels que Bi 2 +
8, trouvé dans Bi 8 (AlCl 4) 2. Bismuth forme également un bromure faible valence avec la même structure que "BiCl". Il ya une vraie monoiodide, BiI, qui contient des chaînes de Bi 4 I 4 unités. BiI décompose lors du chauffage à la triiodure, BiI 3, et du bismuth élémentaire. Un monobromure de la même structure existe également. Dans l'état d'oxydation 3, les formes des trihalogénures de bismuth avec tous les atomes d'halogène: BiF 3, BiCl 3, BiBr 3, et BiI 3. Tous ces trois sont, sauf BiF hydrolysé par l'eau pour former le cation bismuthyle, Bio +
, Le bismuth Oxycation couramment rencontré (III) a noté ci-dessus.
Bismuth (III) réagit avec le chlorure de chlorure d'hydrogène dans l'éther solution pour produire l'acide 4 HBiCl.
L'état d'oxydation 5 est moins fréquemment rencontré. Un tel composé est le BiF 5, un oxydant puissant et agent de fluoration. Ce est aussi un fluorure solide accepteur, on fait réagir avec tétrafluorure xénon pour former le XeF +
3 cation:
- BiF 5 + XeF 4 → XeF +
3 - BiF
6
Espèces aqueuses
En solution aqueuse, le Bi 3+
ion existe dans différents états d'hydratation, en fonction de la pH:
gamme de pH Espèce <3 Bi (H 2 O) 3+
60-4 Bi (H 2 O) 5 OH 2+ 1-5 Bi (H 2 O) 4 (OH) +
25-14 Bi (H 2 O) 3 (OH) 3 > 11 Bi (H 2 O) 2 (OH) -
4
Ces espèces mononucléaires sont en équilibre. espèces polynucléaires existent également, dont le plus important est BiO +
, Qui existe sous forme hexamérique comme le complexe octaédrique [Bi 6 O 4 (OH) 4] 6+
(6 ou [+ BiO
] 2 · H 2 O).
Présence et la production
Dans la croûte de la Terre, le bismuth est d'environ deux fois plus abondant que l'or. Le plus important minerais de bismuth sont bismuthinite et bismite. Bismuth natif est connu de l'Australie, la Bolivie, et la Chine.
Selon le United States Geological Survey, la production minière mondiale de bismuth en 2010 était de 8900 tonnes, avec les contributions majeures de la Chine (6500 tonnes), le Pérou (1100 tonnes) et le Mexique (850 tonnes). La production de la raffinerie était 16 000 tonnes, dont la Chine a produit 13 000, au Mexique et en Belgique 850 800 tonnes.
La différence entre monde de bismuth mine et raffinerie de la production reflète le statut de bismuth comme un sous-produit de l'extraction d'autres métaux tels que le plomb, le cuivre, l'étain, le molybdène et le tungstène. Bismuth déplace en plomb brut (qui peut contenir jusqu'à 10% de bismuth) à travers plusieurs étapes de raffinage, jusqu'à ce qu'il soit retiré par le Procédé Kroll-Betterton qui sépare les impuretés comme laitier ou électrolytique Processus Betts. Bismuth se comporte de manière similaire avec un autre de ses principaux métaux, le cuivre.
Le bismuth métal brut des deux processus contient encore des quantités considérables d'autres métaux, le plomb avant tout. En faisant réagir le mélange en fusion avec du chlore gazeux, les métaux sont convertis en leurs chlorures tout en bismuth reste inchangée. Impuretés peuvent également être éliminés par d'autres méthodes, par exemple avec des flux et traitements rendement de haute pureté de bismuth métallique (plus de 99% de Bi). Mondial de bismuth production des raffineries est une statistique plus complète et fiable.
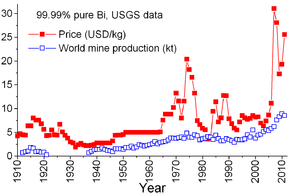
Prix
Le prix pour le bismuth métal pur a été relativement stable durant la majeure partie du 20e siècle, à l'exception d'un pic dans les années 1970. Bismuth a toujours été principalement produite comme sous-produit du raffinage du plomb, et donc le prix, qui se traduit généralement le coût de la récupération et de l'équilibre entre la production et la demande.
La demande de bismuth était petite avant la Seconde Guerre mondiale et était pharmaceutique - composés de bismuth ont été utilisés pour traiter des conditions telles que les troubles digestifs, les maladies et les brûlures sexuellement transmissibles. De petites quantités de bismuth métallique ont été consommés dans les alliages fusibles pour systèmes de gicleurs d'incendie et fil fusible. Pendant la Seconde Guerre mondiale de bismuth était considéré comme un matériel stratégique, utilisé pour les soudures, alliages fusibles, les médicaments et la recherche atomique. Pour stabiliser le marché, les producteurs fixent le prix à 1,25 $ la livre (2,75 $ / kg) pendant la guerre et à 2,25 $ la livre (4,96 $ / kg) à partir de 1950 jusqu'en 1964.
Au début des années 1970, le prix a augmenté rapidement en raison de la demande croissante pour le bismuth comme additif métallurgique à l'aluminium, le fer et l'acier. Elle a été suivie par une baisse en raison de la production accrue du monde, la consommation stabilisée, et les récessions de 1980 et de 1981 à 1982. En 1984, le prix a commencé à monter que la consommation a augmenté dans le monde entier, notamment aux Etats-Unis et le Japon. Au début des années 1990, la recherche a commencé sur l'évaluation de bismuth comme un remplacement non toxique pour le plomb dans les glaçures céramiques, plombs de pêche, les équipements de transformation des aliments, de décolletage cuivres pour des applications de plomberie, graisses lubrifiantes, et tir pour chasse à la sauvagine. La croissance dans ces domaines est restée lente pendant le milieu des années 1990, en dépit du soutien de remplacement du plomb par le gouvernement américain, mais intensifiée autour de 2005. Cela a entraîné une augmentation rapide et continue dans le prix.
Recyclage
Considérant que le bismuth est plus disponible aujourd'hui comme sous-produit, son la durabilité est plus dépendante sur le recyclage. Le bismuth est le plus souvent un sous-produit de fusion du plomb, ainsi que l'argent, le zinc , l'antimoine et d'autres métaux, ainsi que de tungstène production, en même temps que du molybdène et étain , ainsi que de la production de cuivre. Le recyclage de bismuth est difficile dans la plupart de ses utilisations finales, principalement en raison de la diffusion.
Probablement le plus facile à recycler serait contenant du bismuth alliages fusibles sous la forme de grands objets, puis de plus grands objets soudés. Moitié de la consommation de soudure du monde est dans l'électronique (ce est à dire, cartes de circuits). Comme les objets soudés deviennent plus petits ou contiennent peu de soudure ou peu de bismuth, la récupération devient progressivement plus difficile et moins économique, bien que la soudure avec une teneur en argent plus élevé sera plus intéressant récupération. Suivant dans le recyclage de faisabilité serait catalyseurs importants avec un contenu juste de bismuth, peut-être bismuth phosphomolybdate, puis bismuth utilisé dans la galvanisation et comme additif métallurgique libre-usinage.
Bismuth dans les usages où il est dispersé comprennent plus largement les médicaments de l'estomac ( le sous-salicylate de bismuth), peintures ( vanadate de bismuth) sur une surface sèche, (cosmétiques nacrés oxychlorure de bismuth), et des balles contenant du bismuth qui ont été tirés. Le bismuth dispersés dans ces utilisations est irrécupérable avec la technologie actuelle.
La durabilité fait le plus important à propos de bismuth est son statut de sous-produit, qui peut améliorer la durabilité (ce est à dire, le vanadium ou nodules de manganèse) ou, pour le bismuth à partir de minerai de plomb, la contraindre; bismuth est limitée. La mesure dans laquelle la contrainte de bismuth peut être améliorée ou non va être testé par l'avenir de l'accumulateur au plomb, étant donné que 90% du marché mondial du plomb est dans les piles de stockage de l'essence ou les véhicules à moteur diesel.
L'évaluation du cycle de vie de bismuth se concentrera sur les soudures, l'une des principales utilisations de bismuth, et celui avec l'information la plus complète. La consommation d'énergie primaire moyenne des soudures est d'environ 200 MJ par kg, avec la soudure haute-bismuth (58% Bi) seulement 20% de cette valeur, et trois soudures à basse bismuth (2% à 5% de Bi) qui passe à proximité la moyenne. Le réchauffement de la planète potentielle moyenne de 10 et 14 kg de dioxyde de carbone , avec la soudure haute-bismuth environ les deux tiers de cette et les soudures à basse bismuth environ moyenne. Le potentiel d'acidification pour les soudures est environ 0,9 à 1,1 kg le dioxyde de soufre équivalent, avec la soudure haute-bismuth et une faible bismuth soudure seulement un dixième de la moyenne et les autres soudures faible bismuth environ moyenne. Il ya très peu d'informations sur le cycle de vie sur d'autres alliages de bismuth ou composés.
Applications
Le bismuth a peu d'applications commerciales, dont aucun ne est particulièrement importante. Prenant les États-Unis à titre d'exemple, 884 tonnes de bismuth ont été consommés en 2010, dont 63% sont allés en produits chimiques (y compris les produits pharmaceutiques, des pigments et cosmétiques), 26% dans les additifs métallurgiques pour la coulée et la galvanisation, 7% dans les alliages de bismuth, les soudures et de munitions, et le solde dans la recherche et d'autres utilisations.
Certains fabricants utilisent Bismuth comme un substitut de l'équipement pour les systèmes d'eau potable tels que les vannes pour répondre mandats «sans plomb» aux États-Unis (commence en 2014). Ce est une assez grande demande car il couvre l'ensemble de la construction résidentielle et commerciale.
Au début des années 1990, les chercheurs ont commencé à évaluer le bismuth comme un remplacement pour le plomb toxique dans diverses applications.
Médecine
Bismuth est un ingrédient dans certains produits pharmaceutiques, bien que l'utilisation de certaines de ces substances est en baisse.
- Subsalicylate de bismuth est utilisé comme anti-diarrhéique ; c'est le ingrédient actif dans ces préparations "rose" que Bismuth Pepto-Bismol, ainsi que la reformulation de 2004 Kaopectate. Il est également utilisé pour traiter d'autres maladies gastro-intestinales. Le mécanisme d'action de cette substance ne est toujours pas bien documentée, bien qu'un effet oligodynamique (effet toxique de petites doses d'ions de métaux lourds sur les microbes) peut être impliqué dans au moins certains cas. L'acide salicylique à partir de l'hydrolyse du composé antimicrobien est de toxogenic E. coli, un agent pathogène important chez la diarrhée du voyageur.
- une combinaison de le subsalicylate de bismuth et citrate de bismuth sont utilisés pour traiter ulcères gastro-duodénaux.
- Bibrocathol est un composé contenant du bismuth organique utilisé pour traiter les infections oculaires.
- Sous-gallate de bismuth, le ingrédient actif dans Devrom, est utilisé comme déodorant interne pour traiter les mauvaises odeurs à partir de flatulences («gaz») et fèces.
- Composés de bismuth (y compris sodium tartrate de bismuth) ont été autrefois utilisé pour traiter la syphilis
- "Lait de bismuth" (une solution aqueuse de l'hydroxyde de bismuth et bismuth sous-carbonate) a été commercialisé comme un Cureall ailimentary dans le début du 20e siècle
- Sous-nitrate de bismuth (Bi O 5 (OH) 9 (NO 3) 4) et sous-carbonate de bismuth (Bi 2 O 2 (CO 3)) sont également utilisés en médecine.
Cosmétiques et pigments
Oxychlorure de bismuth (BiOCl) est parfois utilisé dans les cosmétiques, comme pigment dans la peinture pour ombres à paupières, des laques et des vernis à ongles. Ce composé est trouvé que le bismoclite minérale et sous forme de cristal contient des couches d'atomes (voir la figure ci-dessus) qui réfractent la lumière chromatique, résultant en une aspect irisé similaire à nacre de perle. Il a été utilisé comme un produit cosmétique dans l'Egypte ancienne et dans de nombreux endroits depuis. Bismuth blanc («blanc espagnol") peut se référer à l'oxychlorure de bismuth ou oxynitrate de bismuth (BiONO 3), lorsqu'il est utilisé en tant que pigment blanc.
Métal et alliages
Remplacement du plomb
La différence de densité entre le plomb (densité 11,32 g · cm -3) et le bismuth (densité 9,78 g · cm -3) est suffisamment petite pour que la balistique et des applications de pondération beaucoup, le bismuth peut remplacer le plomb. Par exemple, on peut remplacer le plomb en tant que matériau dense dans plombs de pêche. Il a été utilisé en remplacement du plomb dans tir, des balles et moins meurtrière émeute de munitions des armes à feu. Le Pays-Bas , Danemark, Angleterre, Pays de Galles, Etats-Unis, et de nombreux autres pays interdisent maintenant l'utilisation de la grenaille de plomb pour la chasse aux oiseaux des zones humides, comme de nombreux oiseaux sont sujettes à empoisonnement au plomb en raison de l'ingestion de plomb trompe (au lieu de petites pierres et de gravier) pour faciliter la digestion, voire interdire l'utilisation du plomb pour la chasse, comme dans le Pays-Bas . Bismuth-alliage d'étain tir est une alternative qui offre des performances balistiques similaire à plomb. (Une autre alternative moins coûteuse mais aussi plus faible rendement est shot "d'acier", qui est en fait le fer doux.) Le manque de Bismuth de malléabilité ne, cependant, la rendent impropre à l'utilisation dans le développement de munitions de chasse.
Bismuth, comme un élément dense de poids atomique élevé, est utilisé dans boucliers, des latex de bismuth-imprégné pour protéger des rayons X dans les examens médicaux, tels que TC, la plupart du temps car il est considéré comme non toxique.
L' Union européenne s ' Restriction of Hazardous Substances Directive (RoHS) pour la réduction du plomb a élargi l'utilisation de bismuth dans l'électronique en tant que composante du point de fusion bas soudures, en remplacement de traditionnels soudures étain-plomb. Sa faible toxicité sera particulièrement important pour les soudures visant à être utilisés dans les équipements de transformation des aliments et de l'eau de tuyaux en cuivre, mais il peut aussi être utilisé dans d'autres applications, y compris ceux de l'industrie automobile, dans l'Union européenne par exemple.
Le bismuth a été évalué en tant que remplacement pour le plomb dans de décolletage laitons pour applications de plomberie, même se il ne égale pas la performance des aciers au plomb.
Autres utilisations de métaux et alliages spéciaux
Beaucoup de bismuth alliages ont de faibles points de fusion et se retrouvent dans des applications spécialisées telles que soudures. Beaucoup de gicleurs automatiques, fusibles électriques, et des dispositifs de sécurité dans les systèmes de détection et d'extinction incendie contiennent l'alliage eutectique In19.1-Cd5.3-Pb22.6-Sn8.3-Bi44.7 qui fond à 47 ° C (117 ° F) Ce est une température pratique car il est peu probable d'être dépassées dans des conditions de vie normales. Alliages bas point de fusion, comme l'alliage Bi-Cd-Pb-Sn qui fond à 70 ° C, sont également utilisés dans les industries automobile et aéronautique. Avant de déformer une partie à paroi mince en métal, il est rempli avec une masse fondue ou recouverte d'une mince couche de l'alliage pour réduire le risque de rupture. Ensuite, l'alliage est éliminé en plongeant la pièce dans l'eau bouillante.
Le bismuth est utilisé pour faire aciers et alliages d'aluminium de décolletage pour les propriétés d'usinage de précision de libre-usinage. Elle a un effet similaire à diriger et améliore la puce rupture lors de l'usinage. Le rétrécissement de la solidification du plomb et l'expansion de bismuth compense l'autre et donc plomb et le bismuth sont souvent utilisés en quantités similaires. De même, les alliages contenant des parties comparables de bismuth et présentent une très faible variation (de l'ordre de 0,01%) lors de la fusion, la solidification ou le vieillissement. Ces alliages sont utilisés dans la haute précision coulée, par exemple en dentisterie, pour créer des modèles et des moules. Le bismuth est également utilisé en tant qu'agent d'alliage dans la production d'un fer à repasser en fonte malléable et en tant que matériau thermocouple.
Certains alliages de bismuth, comme Bi35-Pb37-SN25, sont combinés avec des matériaux non-adhérents tels que mica, le verre et émaux parce qu'ils mouillent facilement leur permettant de faire des joints à d'autres parties. L'addition de bismuth à césium améliore le rendement quantique de cathodes Cs. Frittage de bismuth et de manganèse poudres à 300 ° C produit un aimant permanent et matériau magnétostrictif, qui est utilisé dans des générateurs et récepteurs ultrasonores travaillant dans la plage de 10 à 100 kHz et dans des dispositifs de mémoire magnétique.
D'autres utilisations des composés
- Le bismuth est comprise dans BSCCO (bismuth strontium calcium oxyde de cuivre) qui est un groupe de composés supraconducteurs similaires découverts en 1988 qui présentent les plus hautes températures de transition supraconductrice.
- Sous-nitrate de bismuth est un composant de émaux qui produit une iridescence et est utilisé en tant que pigment dans les peintures.
- Tellurure de bismuth est un semi-conducteur et un excellent matériau thermoélectrique. Bi 2 Te 3 diodes sont utilisés dans les réfrigérateurs mobiles, CPU refroidisseurs, et comme détecteurs spectrophotomètres infrarouges.
- L'oxyde de bismuth, sous sa forme de delta, est un électrolyte solide pour l'oxygène. Ce formulaire ne existe normalement ci-dessus et se décompose dessous d'un seuil de haute température, mais peut être bien électrodéposition dessous de cette température dans une solution fortement alcaline.
- Vanadate de bismuth est un pigment jaune opaque dans le pétrole artistes et peinture acrylique. Ce composé est un solide à la lumière substitut non toxique pour citronniers pigments jaunes tels que les sulfures de cadmium et le plomb / strontium / baryum chromates. Contrairement chromate de plomb + sulfate de plomb citron, vanadate de bismuth ne noircit pas facilement à l'exposition aux UV.
- Catalyseur pour la fabrication de fibres acryliques.
- Ingrédient lubrifiant des graisses.
- Dans microstars crépitement ( les oeufs de dragon) dans pyrotechnie, comme oxyde, subcarbonate ou sous-nitrate.
Toxicologie et écotoxicologie
La littérature scientifique est d'accord que le bismuth et la plupart de ses composés sont moins toxiques par rapport à d'autres métaux lourds (plomb, antimoine, etc.) et qu'il ne est pas bioaccumulable. Ils ont de faibles solubilités dans le sang, sont facilement éliminés par l'urine, et ne présentaient aucun cancérogène, mutagènes ou effets tératogènes lors de tests à long terme sur des animaux (jusqu'à 2 ans). Sa demi-vie biologique de la rétention du corps entier est de 5 jours, mais il peut rester dans le rein des années chez les patients traités avec des composés de bismuth.
Bismuth empoisonnement existe et affecte principalement les reins, le foie et la vessie. Peau et des voies respiratoires peuvent également suivre l'exposition aux organes respectifs. Comme dans le cas du plomb, du bismuth à une surexposition peut entraîner la formation d'un dépôt noir sur la gencive, appelée ligne de bismuth.
Impacts environnementaux de bismuth sont pas très bien connus. Il est considéré que son impact sur l'environnement est faible, due en partie à la faible solubilité de ses composés. Des informations limitées signifie cependant que un œil attentif doit être conservé sur son impact.