
Polonium
Renseignements généraux
SOS Enfants a essayé de rendre le contenu plus accessible Wikipedia par cette sélection des écoles. Parrainer un enfant de faire une réelle différence.
| Polonium | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
84 Po | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||
argenté  | |||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||
| Nom, symbole, nombre | polonium, Po, 84 | ||||||||||||||||||||||||||||||
| Prononciation | / p ɵ l oʊ n Je ə m / po- LOH -neE-əm | ||||||||||||||||||||||||||||||
| Élément Catégorie | post-métal de transition état métallique post-transition est contestée (voir le texte de l'article) | ||||||||||||||||||||||||||||||
| Groupe, période, bloc | (16) chalcogènes, 6, p | ||||||||||||||||||||||||||||||
| Poids atomique standard | (209) | ||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 6s 2 4f 14 5d 10 6p 4 2, 8, 18, 32, 18, 6 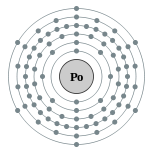 | ||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||
| Découverte | Pierre Curie et Marie Curie (1898) | ||||||||||||||||||||||||||||||
| Premier isolement | Willy Marckwald (1902) | ||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||
| Densité (à proximité rt) | (Alpha) 9,196 g · cm -3 | ||||||||||||||||||||||||||||||
| Densité (à proximité rt) | (Beta) 9,398 g · cm -3 | ||||||||||||||||||||||||||||||
| Point de fusion | 527 K , 254 ° C, 489 ° F | ||||||||||||||||||||||||||||||
| Point d'ébullition | 1235 K, 962 ° C, 1764 ° F | ||||||||||||||||||||||||||||||
| La chaleur de fusion | ca. 13 kJ · mol -1 | ||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 102,91 kJ · mol -1 | ||||||||||||||||||||||||||||||
| Capacité thermique molaire | 26,4 J · mol -1 · K -1 | ||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||
| États d'oxydation | 6, 4, 2, -2 ( l'oxyde amphotère) | ||||||||||||||||||||||||||||||
| Électronégativité | 2,0 (échelle de Pauling) | ||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 812,1 kJ · mol -1 | ||||||||||||||||||||||||||||||
| Rayon atomique | 168 h | ||||||||||||||||||||||||||||||
| Rayon covalente | 140 ± 16 heures | ||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 197 h | ||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||
| Crystal structure | cubique  | ||||||||||||||||||||||||||||||
| Ordre magnétique | amagnétique | ||||||||||||||||||||||||||||||
| Résistivité électrique | (0 ° C) (α) 0,40 μΩ · m | ||||||||||||||||||||||||||||||
| Conductivité thermique | ? 20 W · m -1 · K -1 | ||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 23,5 um · m -1 · K -1 | ||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-08-6 | ||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de polonium | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Le polonium est un élément chimique avec le symbole Po et de numéro atomique 84, découvert en 1898 par Marie et Pierre Curie. Une rare et très élément radioactif sans stable isotopes, le polonium est chimiquement similaire à bismuth et le tellure , et il se produit dans l'uranium minerais. Applications de polonium sont peu nombreux, et comprennent chauffe dans les sondes spatiales, dispositifs antistatiques, et les sources de neutrons et des particules alpha. En raison de sa position dans le tableau périodique, du polonium est parfois classée comme une métalloïde. Cependant, d'autres sources affirment que sur la base de ses propriétés et le comportement, il est "sans équivoque un métal".
Caractéristiques
Isotopes
Le polonium a 33 isotopes connus, qui sont tous des radioactifs. Ils ont masses atomiques qui vont de 188 à 220 u. 210 Po (demi-vie 138,376 jours) est la plus largement disponible. 209 Po (demi-vie 103 années) et 208 Po (demi-vie 2,9 années) peuvent être réalisés grâce à l'alpha, protons ou deutons bombardement de plomb ou de bismuth en une cyclotron.
210 Po est un émetteur alpha qui possède une demi-vie de 138,4 jours; il se désintègre directement à son écurie isotope fille, 206 Pb . Un milligramme de 210 Po émet environ autant de particules alpha par seconde que 5 grammes de 226 Ra . Quelques curies (1 curie équivaut à 37 gigabecquerels, 1 Ci = 37 GBq) de 210 Po émettent une lueur bleue qui est causée par excitation de l'air environnant.
Environ une personne sur 100 000 émissions alpha provoque une excitation dans le noyau qui se traduit alors par l'émission d'un rayon gamma avec une énergie maximale de 803 keV. Cependant, ce sont les particules alpha, pas l'effet de côté d'un rayon gamma occasionnelle, qui se traduit par 210 Po décroissance. Le niveau de polonium de rayonnement gamma est inférieure à la normale fond.
Forme à l'état solide
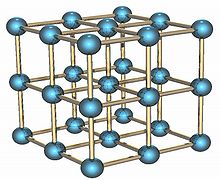
Polonium est un élément radioactif qui existe dans deux métalliques formes allotropiques . La forme alpha est le seul exemple connu d'un structure cristalline cubique simple à un atome de base unique, avec une longueur d'arête de 335,2 picomètres; la forme bêta est rhomboédrique. La structure du polonium est caractérisée par rayons X diffraction et diffraction électronique.
210 Po (en commun avec 238 Pu) a la capacité dans l'air, avec assurance: si un échantillon est chauffé à l'air à 55 ° C (131 ° F), 50% de celui-ci est vaporisée dans 45 heures, même si le point de polonium de fusion est de 254 ° C (489 ° F) et son point d'ébullition est 962 ° C (1763 ° F). Il existe plus d'une hypothèse pour la façon dont le polonium fait cela; une suggestion est que les petits amas d'atomes de polonium sont effrité off par la désintégration alpha.
Chimie
La chimie du polonium est similaire à celle de tellure et le bismuth. Polonium se dissout facilement dans diluées acides , mais ne est que légèrement soluble dans alcalis. solutions de polonium sont d'abord colorées en rose par les 2+ Po, mais deviennent rapidement jaune parce rayonnement alpha du polonium ionise le solvant et convertit Po Po en 2+ 4+. Ce processus est accompagné par bouillonnement et l'émission de chaleur et de lumière par la verrerie en raison des particules alpha absorbés; En conséquence, les solutions de polonium sont volatils et se évaporent dans les jours sauf scellé.
Il a été rapporté que certaines Les microbes peuvent polonium méthylate par l'action de méthylcobalamine. Ceci est similaire à la manière dont le mercure , le sélénium et le tellure sont méthylés dans les êtres vivants pour créer des composés organométalliques. En conséquence lors de l'examen de la biochimie du polonium on doit envisager la possibilité que le polonium suivra les mêmes voies biochimiques que le sélénium et le tellure.
Composés
Le polonium est exempt de composés communs, seuls créés artificiellement, et plus de 50 de ceux sont connus. La classe la plus stable de composés de polonium sont polonides, qui sont préparés par réaction directe de deux éléments. Na 2 PO a la la structure antifluorite, les polonides de Ca, Ba, Hg, Pb et les lanthanides forment un réseau de NaCl, Bepo et CDPO ont le wurtzite et l'BPGM la structure de l'arséniure de nickel. La plupart des polonides se décomposent par chauffage à environ 600 ° C, sauf pour HGPO qui se décompose à ~ 300 ° C et les polonides de lanthanides, qui ne fondent pas, mais se décomposent à des températures supérieures à 1000 ° C. Par exemple PRPop fond à 1250 ° C et TMPO à 2200 ° C.
Polonium hydrure (PoH 2) est un liquide volatil à la température ambiante sujettes à la dissociation. Les deux oxydes Poo 2 et Poo 3 sont les produits d'oxydation du polonium.
Halogénures de la structure PoX 2, 4 et PoX PoX 6 sont connus. Ils sont solubles dans les halogénures d'hydrogène correspondant, ce est-POCl X dans HCl, HBr dans POBr X et PoI 4 à HI. dihalogénures de polonium sont formés par réaction directe des éléments ou par réduction avec du POCl 4 SO 2 et 4 avec POBr avec H 2 S à la température ambiante. Tétrahalogénures peuvent être obtenus en faisant réagir le dioxyde de polonium avec HCl, HBr ou HI.
D'autres composés de polonium comprennent acétate, bromate, le carbonate , citrate, chromate, cyanure, formate, l'hydroxyde, nitrate , séléniate, monosulfure, sulfate et disulfate.
| Formule | Couleur | mp (° C) | Sublimation Temp. (° C) | Symétrie | Symbole de Pearson | Groupe d'espace | Aucun | un (h) | b (h) | c (h) | Z | ρ (g / cm 3) | ref |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Poo 2 | jaune pâle | 500 (décembre) | 885 | fcc | Fm 3 m | CF12 | 225 | 563,7 | 563,7 | 563,7 | 4 | 8,94 | |
| PoCL 2 | rouge sombre | 355 | 130 | orthorhombique | Op3 | PMMM | 47 | 367 | 435 | 450 | 1 | 6,47 | |
| POBr 2 | brun-violet | 270 (décembre) | |||||||||||
| PoCL 4 | jaune | 300 | 200 | monoclinique | |||||||||
| POBr 4 | rouge | 330 (décembre) | fcc | Fm 3 m | CF100 | 225 | 560 | 560 | 560 | 4 | |||
| PoI 4 | noir |
Oxydes
| Hydrures
| Halogènes composés
|
Histoire
Aussi appelé provisoirement « Radium F ", le polonium a été découvert par Marie et Pierre Curie en 1898 et a été nommé d'après la terre natale de Marie Curie de la Pologne ( latine : Polonia) Pologne à l'époque était sous Russie, la Prusse et l'Autriche partitionner et ne existait pas en tant que pays indépendant. Il était l'espoir de Curie que nommer l'élément après sa terre natale serait connaître son manque d'indépendance. Polonium peut être le premier élément nommé pour mettre en évidence une controverse politique.
Cet élément a été le premier découvert par les Curie alors qu'ils enquêtaient sur la cause de pechblende la radioactivité. Le pitchblende, après élimination des éléments radioactifs de l'uranium et du thorium , était à la fois plus radioactif que l'uranium et le thorium réunis. Cela a entraîné les Curie à trouver des éléments radioactifs supplémentaires. Les Curies abord séparé de la pechblende le polonium en Juillet 1898, et cinq mois plus tard, également isolé le radium .
Aux États-Unis, le polonium a été produit dans le cadre de la Projet Manhattan pendant la Seconde Guerre mondiale. Ce était une partie essentielle de la de type implosion conception de l'arme nucléaire utilisée dans le Fat Man bombe sur Nagasaki en 1945. Polonium et le béryllium sont les ingrédients clés de la ' Détonateur Urchin 'au centre de la sphère de la bombe Plutonium fosse. Le Urchin enflammé la réaction nucléaire en chaîne au moment de invite-criticité pour assurer la bombe n'a pas pétiller.
Une grande partie de la physique de base de polonium était classé qu'après la guerre. Le fait qu'il a été utilisé comme un initiateur a été classifiée jusqu'à ce que les années 1960.
Le Commission et l'énergie atomique Financé Manhattan Project ont été administrés expériences humaines en utilisant le polonium sur 5 personnes à l'Université de Rochester entre 1943 et 1947. Les personnes âgées entre 9 et 22 microcuries de polonium pour étudier son excrétion.
Détection
Comptage gamma
A l'aide de méthodes radiométriques tels que spectroscopie gamma (ou un procédé utilisant une séparation par voie chimique suivi d'un mesure de l'activité avec un compteur à dispersion non-énergie), il est possible de mesurer les concentrations de les radio-isotopes et à distinguer l'une de l'autre. Dans la pratique, le bruit de fond serait présent et en fonction sur le détecteur, la largeur de ligne serait plus importante qui rendrait plus difficile à identifier et mesurer les isotopes . Dans le travail biologique / médical, il est courant d'utiliser le naturel 40 K présente dans tous les tissus fluides / corps comme une vérification de l'équipement et comme standard interne.

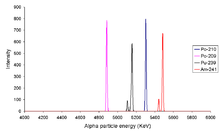
Alpha comptage
Le meilleur moyen pour tester (et mesurer) de nombreux émetteurs alpha est d'utiliser spectroscopie alpha-particule, il est courant de placer une goutte de la solution d'essai sur un disque de métal qui est ensuite séché pour donner un revêtement uniforme sur le disque. Ceci est alors utilisé comme échantillon d'essai. Si l'épaisseur de la couche formée sur le disque est trop épais puis les raies du spectre sont élargies, ce est parce que partie de l'énergie de la les particules alpha sont perdues au cours de leur mouvement à travers la couche de matière active. Une méthode alternative consiste à utiliser scintillation liquide interne où l'échantillon est mélangé avec un cocktail de scintillation. Lorsque la lumière émise est ensuite compté, certaines machines enregistreront la quantité d'énergie lumineuse par événement de la désintégration radioactive. En raison des imperfections de la méthode à scintillation liquide (comme un échec de tous les photons à détecter, les échantillons troubles ou colorés peuvent être difficile de compter) et le fait que trempe aléatoire peut réduire le nombre de photons générés par désintégration radioactive, il est possible d'obtenir un élargissement des spectres alpha obtenus par scintillation liquide. Il est probable que ces spectres de scintillation liquide sera soumis à une Gaussienne élargissement plutôt que la distorsion exposées lorsque la couche de matière active sur un disque est trop épais.
Procédé troisième dispersion d'énergie pour le comptage des particules alpha est d'utiliser un détecteur à semi-conducteur.
De gauche à droite les pics sont dus à 209 Po, 210 Po, 239 Pu et 241 Am. Le fait que les isotopes tels que Pu 239 et de Am 241 ont plus d'une ligne d'alpha indique que le noyau a la capacité d'être discret différent les niveaux d'énergie (comme une molécule peut).
Présence et la production
Le polonium est un élément très rare dans la nature en raison de la courte demi-vie de tous ses isotopes. Il se trouve dans uranium minerais à environ 0,1 mg par tonne métrique (1 partie en 10 10), qui est d'environ 0,2% de l'abondance de radium. Les quantités dans la croûte de la Terre ne sont pas nuisibles. Polonium ont été trouvés dans la fumée de tabac à partir de feuilles de tabac cultivé avec engrais phosphatés.
En raison de l'abondance des petits, l'isolement du polonium partir de sources naturelles est un processus très fastidieux. Le plus grand lot a été extrait dans la première moitié du 20ème siècle par le traitement de 37 tonnes de résidus de la production de radium. Il ne contenait que 40 Ci (9 mg) de le polonium-210. De nos jours, le polonium est obtenue en irradiant de bismuth avec des neutrons de haute énergie ou des protons.
Capture de neutrons
- Synthèse par (n, γ) réaction
En 1934, une expérience a montré que lorsque naturelle 209 Bi est bombardé de neutrons , 210 Bi est créé, qui se désintègre alors à 210 Po via β décroissance. La purification finale se fait pyrochemically suivie par des techniques d'extraction liquide-liquide. Polonium peut maintenant être fait en milligrammes dans cette procédure qui utilise les flux élevés de neutrons trouvés dans les réacteurs nucléaires. Seuls environ 100 grammes sont produites chaque année, la quasi-totalité de celui-ci en Russie, faisant le polonium extrêmement rare.
Ce processus peut causer des problèmes dans plomb-bismuth Based refroidis par métal liquide des réacteurs nucléaires tels que ceux utilisés dans la La marine soviétique K-27. Des mesures doivent être prises dans ces réacteurs pour faire face à la possibilité indésirable de 210 Po avoir été libéré de l'agent de refroidissement.
Proton capture
- Synthèse de (p, n) et (p, 2n)
Il a été trouvé que les isotopes à vie longue du polonium peuvent être formés par proton bombardement de bismuth en utilisant un cyclotron. Autres plusieurs isotopes riches en neutrons peuvent être formés par l'irradiation de platine avec carbone noyaux.
Applications
Sources de particules alpha basée polonium ont été produites dans l'ancienne Union soviétique. Ces sources ont été appliqués pour mesurer l'épaisseur de revêtements industriels par atténuation d'un rayonnement alpha. En raison de rayonnement alpha intense, un échantillon d'un gramme de 210 Po spontanément chauffer jusqu'à plus de 500 ° C (932 ° F) générer environ 140 watts d'énergie. Par conséquent, 210 Po est utilisé comme source de chaleur à puissance atomique générateurs thermoélectriques radio-isotopiques via matériaux thermoélectriques. Par exemple, les sources de chaleur 210 Po ont été utilisés dans le Lunokhod 1 (1970) et Lunokhod 2 (1973) Lune rovers pour garder leurs composants internes au chaud pendant les nuits lunaires, ainsi que la Cosmos 84 et 90 satellites (1965).
Les particules alpha émises par le polonium peuvent être convertis en des neutrons à l'aide de l'oxyde de béryllium, à un débit de 93 neutrons par million de particules alpha. Ainsi mélanges Po-BeO ou alliages sont utilisés en tant que source de neutrons, par exemple dans un déclenchement ou l'initiateur de neutrons pour des armes nucléaires et de l'inspection des puits de pétrole. A propos de 1500 de ces sources dont l'activité individuelle de 1850 Ci ont été utilisés chaque année dans l'Union soviétique.
Le polonium a également fait partie de brosses ou des outils plus complexes qui éliminent les charges statiques dans les plaques photographiques, textiles moulins, des rouleaux de papier, plastique en feuille, et sur des substrats avant l'application de revêtements (comme l'automobile). Les particules alpha émises par le polonium ionisent les molécules d'air qui neutralisent les charges sur les surfaces environnantes. Toutefois, le polonium doit être remplacé dans ces dispositifs presque chaque année en raison de sa courte demi-vie; il est également hautement radioactifs et a donc été remplacé par la plupart du temps moins dangereux sources de particules bêta.
Toxicité
Vue d'ensemble
Le polonium est très dangereux et ne joue aucun rôle biologique. En masse, le polonium-210 est d'environ 250 000 fois plus toxique que le cyanure d'hydrogène (le réel LD 50 pour 210 Po est inférieur à 1 microgrammes pour un adulte moyen (voir ci-dessous), comparativement à environ 250 milligrammes de cyanure d'hydrogène). Le risque principal est sa radioactivité intense (comme un émetteur alpha), ce qui rend très difficile à manipuler en toute sécurité. Même dans montants microgrammes, de manutention 210 Po est extrêmement dangereux, nécessitant un équipement spécialisé (une pression alpha négatif boîte à gants équipés de filtres haute performance), une surveillance adéquate et des procédures de manipulation strictes pour éviter toute contamination. Les particules alpha émises par le polonium endommager les tissus organiques facilement si le polonium est ingéré, inhalé ou absorbé, bien qu'ils ne pénètrent pas la épiderme et donc ne sont pas dangereux tant que les particules alpha restent en dehors du corps. Pendant ce temps, porter des gants résistant aux produits chimiques et "intactes" est une précaution obligatoire pour éviter transcutanée diffusion de polonium directement par le peau. Polonium livré en concentré acide nitrique peut facilement diffuser à travers des gants inadéquates (par exemple, gants en latex) ou l'acide peuvent endommager les gants.
Les effets aigus
Le dose létale médiane (DL 50) pour l'exposition d'irradiation aiguë est généralement d'environ 4,5 Sv. Le dose efficace engagée équivalent 210 Po est de 0,51 mSv / Bq en cas d'ingestion, et de 2,5 mSv / Bq en cas d'inhalation. Depuis 210 Po a une activité de 166 TBq par gramme (4,500 Ci / g) (1 g produit 12 166 x 10 désintégrations par seconde), un fatal 4,5 Sv (J / kg), la dose peut être causée par l'ingestion de 8,8 MBq (238 micro curies, uCi), environ 50 nanogrammes (ng), ou l'inhalation de 1,8 MBq (48 pCi), environ 10 ng. Un gramme de 210 Po pourrait donc en théorie poison 20 millions de personnes dont 10 millions mourrait. La toxicité réelle de 210 Po est inférieur à ces estimations, car l'exposition de rayonnement qui se étale sur plusieurs semaines (la demi-vie biologique du polonium chez l'homme est de 30 à 50 jours) est un peu moins dommageable que une dose instantanée. Il a été estimé que dose létale médiane de 210 Po est 0,015 GBq (0,4 mCi), ou 0,089 microgrammes, encore une quantité extrêmement petite.
Effets à long terme (chroniques)
En plus des effets aigus, l'exposition aux rayonnements (à la fois interne et externe) porte un risque à long terme de décès par cancer de 5-10% par Sv. La population générale est exposée à de petites quantités de polonium comme le radon fille dans l'air intérieur; les isotopes 214 et 218 Po Po sont soupçonnés de provoquer la majorité des quelque 15,000-22,000 décès par cancer du poumon aux Etats-Unis chaque année qui ont été attribués au radon à l'intérieur. Le tabagisme provoque une exposition supplémentaire au polonium.
Limites d'exposition réglementaires et manutention
La charge corporelle maximale admissible pour ingéré 210 Po est à seulement 1,1 kBq (NCI) 30, ce qui équivaut à une particule massant seulement 6,8 picogrammes. La concentration en milieu de travail maximale admissible de l'air 210 Po est d'environ 10 Bq / m 3 (3 x 10 -10 uCi / cm 3). Les organes cibles de polonium chez l'homme sont le rate et foie. Comme la rate (150 g) et le foie (1,3 à 3 kg) sont beaucoup plus petit que le reste du corps, si le polonium est concentrée dans ces organes vitaux, ce est une plus grande menace pour la vie de la dose qui serait subi (en moyenne) par l'ensemble du corps se il était réparti uniformément dans tout le corps, de la même manière que le césium ou tritium (comme T 2 O).
210 Po est largement utilisé dans l'industrie, et facilement accessible avec peu de réglementation ou restriction. Aux États-Unis, un système de suivi dirigé par la Nuclear Regulatory Commission sera mise en œuvre en 2007 pour enregistrer les achats de plus de 16 curies (590 GBq) de polonium-210 (assez pour compenser 5000 doses létales). L'AIEA "est envisagerait des réglementations plus strictes ... Il est question qu'il pourrait resserrer l'exigence de déclaration de polonium par un facteur de 10, à 1,6 curies (59 GBq)."
Polonium et ses composés doivent être manipulés dans un boîte à gants, qui est en outre enfermé dans une autre boîte, maintenu à une pression légèrement inférieure à la boîte à gants pour éviter que les matières radioactives de se échapper. Gants en naturel caoutchouc ne fournissent pas une protection suffisante contre le rayonnement de polonium; gants chirurgicaux sont nécessaires. Gants en néoprène protègent rayonnement de polonium mieux que le caoutchouc naturel.
Cas d'empoisonnement bien connu
Notamment, l'assassiner de Alexandre Litvinenko, un dissident russe, en 2006 a été annoncé comme étant due à un empoisonnement 210 Po (voir Alexandre Litvinenko, empoisonnement). Selon le professeur Nick Priest de Middlesex University, un toxicologue environnemental et expert en rayonnement, se exprimant au Sky Nouvelles le 2 Décembre, Litvinenko était probablement la première personne à mourir de la effets α-irradiation aiguë de 210 Po. Cependant, selon William Dunkerley, senior fellow à l'Université américaine à Moscou, le coroner Londres a pas encore statué que le polonium était en fait la cause de la mort de Litvinenko, ou qu'il était même victime d'un homicide.
Il a également été suggéré que Irène Joliot-Curie a été la première personne à mourir des effets de rayonnement de polonium. Elle a été accidentellement exposé à du polonium en 1946 quand une capsule scellée de l'élément a explosé sur sa paillasse. En 1956, elle est morte de la leucémie.
Selon le livre The Bomb in the Basement, plusieurs cas de mort en Israël au cours de 1957-1969 ont été causés par 210 Po. Une fuite a été découverte lors d'une Laboratoire de l'Institut Weizmann en 1957. Des traces de 210 Po ont été trouvés sur les mains de professeur Dror Sadeh, un physicien qui a étudié matières radioactives. Des tests médicaux ont indiqué aucun mal, mais les tests ne ont pas inclus la moelle osseuse. Sadeh est mort d' un cancer . Un de ses élèves sont morts de leucémie, et deux collègues sont morts au bout de quelques années, à la fois d'un cancer. La question a été étudiée en secret, et il n'y avait jamais de reconnaître officiellement que un lien entre la fuite et la mort avait existé.
Des concentrations anormalement élevées de 210 Po ont été détectés en Juillet 2012 dans les vêtements et effets personnels du dirigeant palestinien Yasser Arafat, décédé en 2004 de causes incertaines. Cependant, le porte-parole de l'Institut de Radiophysique à Lausanne, en Suisse, où ces éléments ont été analysés, a souligné que les "symptômes cliniques décrits dans les rapports médicaux d'Arafat étaient pas compatibles avec le polonium-210 et que les conclusions ne ont pas pu être tirée quant à savoir si le palestinienne chef de file a été empoisonné ou non ", et que" la seule façon de confirmer les résultats serait d'exhumer le corps d'Arafat pour le tester pour le polonium-210 ". Le 27 Novembre 2012 le corps d'Arafat a été exhumé et des échantillons ont été prélevés pour analyse séparée par des experts de France, la Suisse et la Russie. Les résultats sont attendus d'ici Avril 2013.
Traitement
Il a été suggéré que agents de chélation tels que British Anti-Lewisite ( dimercaprol) peut être utilisée pour décontaminer les humains. Dans une expérience, les rats ont reçu une dose fatale de 1,45 MBq / kg (8,7 ng / kg) de 210 Po; Tous les rats non traités sont morts après 44 jours, mais 90% des rats traités avec l'agent de chélation HOEtTTC sont restés en vie après 5 mois.
Détection des spécimens biologiques
Polonium-210 peut être quantifiée dans des échantillons biologiques par spectrométrie de particules alpha pour confirmer un diagnostic d'empoisonnement chez les patients hospitalisés ou de fournir des preuves dans une enquête médico-légale de la mort. L'excrétion urinaire de base du polonium-210 chez des personnes saines dus à l'exposition à des sources environnementales de routine est normalement dans une gamme de 5 à 15 mBq / jour. Des niveaux supérieurs à 30 mBq / jour sont évocatrices d'une exposition excessive au radionucléide.
Les produits commerciaux contenant du polonium
Certaines brosses antistatiques contiennent jusqu'à 500 microcuries (20 MBq) de 210 Po en tant que source de particules chargées pour neutraliser l'électricité statique. Aux Etats-Unis, les appareils avec pas plus de 500 uCi de (scellé) 210 Po par unité peuvent être achetés dans ne importe quelle quantité sous une "licence générale", ce qui signifie que l'acheteur n'a pas besoin d'être enregistré par des autorités.
Des petites quantités de ces radio-isotopes sont parfois utilisés en laboratoire et à des fins pédagogiques, généralement de l'ordre de 4-40 kBq (0,1-1,0 pCi), sous la forme de sources scellées, avec le polonium déposé sur un substrat ou dans une résine ou d'un polymère matrice sont souvent exemptés de l'agrément par le CNRC et les autorités similaires car ils ne sont pas considérés comme dangereux. De petites quantités de 210 Po sont fabriqués pour la vente au public aux Etats-Unis comme des «sources d'aiguilles» pour l'expérimentation en laboratoire, et sont vendus au détail par les entreprises de fournitures scientifiques. Le polonium réelle est une couche de placage qui est à son tour plaquée avec un matériau tel que l'or. Cela permet à la rayonnement alpha (utilisés dans des expériences telles que les chambres de nuages) tout en empêchant le polonium d'être libéré et de présenter un risque de toxicité. Selon Royaume-nucléaire, ils vendent généralement entre quatre et huit sources par an.
Présence chez l'homme et la biosphère
Polonium-210 est très répandue dans la biosphère , y compris dans les tissus humains, en raison de sa position dans le l'uranium-238 chaîne de désintégration. Naturel l'uranium-238 dans la croûte terrestre se désintègre à travers une série d'intermédiaires y compris radioactifs solides radium-226 au gaz radioactifs radon-222, dont une partie, au cours de sa demi-vie de 3,6 jours, se diffuse dans l'atmosphère. Il se désintègre à travers plusieurs étapes à plus polonium-210, dont une grande partie, au cours de sa demi-vie de 138 jours, est lavé vers le bas à la surface de la Terre, entrant ainsi dans la biosphère, avant de finalement en décomposition à stable plomb-206.
Dès les années 1920, Lacassagne, en utilisant le polonium fourni par son collègue Marie Curie , a montré que l'élément a un modèle très spécifique de l'absorption dans les tissus de lapin, avec des concentrations élevées en particulier dans le foie, le rein et testicules. Des données plus récentes suggèrent que ce comportement résultats de polonium remplaçant pour le soufre en acides aminés soufrés ou des molécules liées et que les modèles de distribution semblables se produire dans les tissus humains. Le polonium est en effet un élément naturellement présent dans tous les êtres humains, ce qui contribue sensiblement à la dose de fond naturel, avec de grandes variations géographiques et culturelles, et des niveaux particulièrement élevés chez les résidents de l'Arctique, par exemple.
Tabac
La présence de polonium dans la fumée de tabac a connu depuis le début des années 1960. Certains des plus grands fabricants de tabac du monde recherches façons d'éliminer la substance-vain-sur une période de 40 ans mais jamais publié les résultats.
Radioactive polonium-210 contenu dans les engrais de phosphate est absorbé par les racines des plantes (telles que le tabac) et stockée dans ses tissus. Les plants de tabac fécondés par les phosphates naturels contiennent du polonium-210, qui émet un rayonnement alpha estimée à environ 11 700 décès causer le cancer du poumon chaque année dans le monde entier.
Nourriture
Polonium se retrouve également dans la chaîne alimentaire, en particulier dans les fruits de mer.
