Rutherfordium
Contexte des écoles Wikipédia
Cette sélection écoles a été choisi par SOS Enfants pour les écoles dans le monde en développement ne ont pas accès à Internet. Il est disponible en téléchargement intranet. Avant de vous décider à propos de parrainer un enfant, pourquoi ne pas en apprendre davantage sur différents organismes de parrainage premier ?
| Rutherfordium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
104 Rf | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| inconnu | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | rutherfordium, Rf, 104 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / ˌ r ʌ ð ər fa ɔr ré Je ə m / RUDH -ər- POUR -dee-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | métal de transition | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 4, 7, ré | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | [267] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Rn ] 5f 14 6d deux 7s 2 2, 8, 18, 32, 32, 10, 2 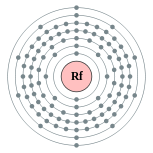 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Institut unifié de recherches nucléaires (1964) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide (prévue) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 23 (estimation) g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 2400 K , 2100 ° C, 3800 (estimation) ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 5800 K, 5500 ° C, 9900 (estimation) ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 4, 3 (prévue) (États d'oxydation ne en gras sont connus expérimentalement) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 579,9 (estimation) kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1389,4 (estimation) kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 2296,4 (estimation) kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 150 (estimation) h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 157 (estimation) h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 53850-36-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de rutherfordium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Rutherfordium est un élément chimique avec le symbole Rf et de numéro atomique 104, nommé en l'honneur de la Nouvelle-Zélande-né physicien britannique Ernest Rutherford . C'est un élément synthétique (un élément qui peut être créé dans un laboratoire, mais ne se trouve pas dans la nature) et radioactifs; le connu plus stable isotope , 267 Rf, a une demi-vie d'environ 1,3 heures.
Dans le tableau périodique des éléments, ce est un d-élément et le premier bloc de la transactinide éléments. Ce est un membre de la 7e période et appartient à la groupe 4 éléments. expériences de chimie ont confirmé que rutherfordium se comporte comme le plus lourd homologue de l'hafnium dans le groupe 4. Les propriétés chimiques de rutherfordium se caractérisent en partie seulement. Ils comparent bien avec la chimie des autres éléments du groupe 4, même si certains calculs avaient indiqué que l'élément pourrait présenter des propriétés sensiblement différentes en raison de effets relativistes.
Dans les années 1960, de petites quantités de rutherfordium ont été produites dans les laboratoires de l'ex- Union soviétique et en Californie . La priorité de la découverte et donc la nommage de l'élément a été contestée entre les scientifiques soviétiques et américains, et ce ne est qu'en 1997 que Union internationale de chimie pure et appliquée (UICPA) a établi rutherfordium que le nom officiel de l'élément.
Histoire
Découverte
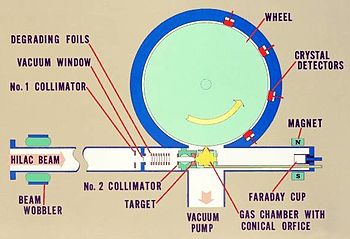
Rutherfordium aurait été détecté pour la première en 1964 à la Institut mixte de recherche nucléaire de Dubna (puis dans l' Union soviétique ). Les chercheurs y bombardés un plutonium -242 cible avec néon -22 ions séparés et les produits de réaction par thermochromatography gradient après conversion en chlorures par interaction avec ZrCl 4. L'équipe a identifié activité de fission spontanée contenue dans un chlorure volatile dépeignant propriétés de EKA-hafnium. Bien que la demi-vie n'a pas été déterminée avec précision, des calculs ultérieurs ont indiqué que le produit était probablement rutherfordium-259 (en abrégé 259 Rf dans solfège ):
- 242
94 Pu + 22
10 Ne → 264- x
104 Rf → 264- x
104 Rf Cl 4
En 1969, des chercheurs de la Université de Californie, Berkeley concluante synthétisé l'élément en bombardant une californium -249 cible avec -ions carbone 12 et mesuré la désintégration alpha de 257 Rf, en corrélation avec la désintégration de fille de nobélium -253:
- 249
98 Cf + 12
6 257 → C
104 Rf + 4 n
La synthèse américaine a été confirmé de façon indépendante en 1973 et a obtenu l'identification des rutherfordium comme parent par l'observation de K-alpha rayons X dans la signature élémentaire du produit de désintégration Rf 257, nobélium-253.
Nommer la controverse
Les scientifiques russes ont proposé le nom kurchatovium et les scientifiques américains ont suggéré le nom rutherfordium pour le nouvel élément. En 1992, le UICPA / Groupe de travail Transfermium UIPPA (GTT) a évalué les demandes de découverte et conclu que les deux équipes ont fourni des preuves contemporaines à la synthèse de l'élément 104 et que le crédit devraient être partagés entre les deux groupes.
Le groupe américain a écrit une réponse cinglante aux conclusions du groupe de travail technique, indiquant qu'ils avaient donné trop l'accent sur les résultats du groupe Dubna. En particulier, ils ont souligné que le groupe russe avait changé les détails de leurs demandes à plusieurs reprises sur une période de 20 années, un fait que l'équipe russe ne nie pas. Ils ont également souligné que le GTT avait donné trop de crédit aux expériences de chimie effectuées par les Russes et a accusé le GTT de ne pas avoir du personnel qualifié au sein du comité. Le GTT a répondu en disant que ce ne était pas le cas et après avoir évalué chaque point soulevé par le groupe américain a dit qu'ils ne ont trouvé aucune raison de modifier leur conclusion concernant la priorité de la découverte. L'UICPA a finalement utilisé le nom suggéré par l'équipe américaine (de rutherfordium) qui peuvent en quelque sorte refléter un changement d'opinion.
En conséquence de la découverte initiale de revendications, une compétition élément nommer controverse est née. Depuis les Soviétiques ont affirmé avoir détecté pour la première le nouvel élément ils ont suggéré le nom kurchatovium, Ku, en l'honneur de Igor Kourtchatov (1903-1960), ancien chef de Recherche nucléaire soviétique. Ce nom avait été utilisé dans les livres de la Bloc soviétique comme le nom officiel de l'élément. Le rutherfordium Américains, cependant, proposé (Rf) pour le nouvel élément d'honorer Ernest Rutherford , qui est connu comme le «père» de la physique nucléaire . L'Union internationale de chimie pure et appliquée ( UICPA) a adopté unnilquadium, Unq, comme temporaire, Dénomination systématique, provenant des noms latins pour les chiffres 1, 0 et 4. En 1994, l'UICPA a suggéré le nom dubnium être utilisé depuis rutherfordium a été suggéré pour l'élément 106 et l'UICPA a estimé que l'équipe Dubna doit être reconnu à juste titre pour leurs contributions . Cependant, il y avait encore un différend sur les noms des éléments 104-107. En 1997, les équipes impliquées ont résolu le litige et a adopté le nom actuel rutherfordium. Le nom dubnium a été donnée à l'élément 105 en même temps.
Nucléosynthèse
Éléments super-lourds tels que rutherfordium sont produites en bombardant des éléments plus légers dans accélérateurs de particules qui induit les réactions de fusion. Alors que la plupart des isotopes de rutherfordium peut être synthétisé directement de cette façon, certains plus lourds ne ont été observés que les produits de désintégration d'éléments plus élevés avec des numéros atomiques .
Selon les énergies mises en jeu, les premiers sont séparés en "chaud" et "froid". Dans les réactions de fusion à chaud, très légers, projectiles à haute énergie sont accélérés vers des objectifs très lourds ( actinides ), donnant lieu à des noyaux composés à haute énergie d'excitation (~ 40-50 MeV) qui peut soit la fission ou se évaporer plusieurs (3-5) neutrons. Dans les réactions de fusion à froid, les noyaux condensés produits ont une énergie relativement faible d'excitation (~ 10 à 20 MeV), ce qui diminue la probabilité que ces produits vont subir des réactions de fission. Comme les noyaux fusionnés refroidir à la état fondamental, ils ont besoin de l'émission de seulement un ou deux neutrons, et donc, permet la génération de produits plus riches en neutrons. Cette dernière est une notion distincte de celle de la fusion nucléaire selon lequel à atteindre dans des conditions de température ambiante (voir la fusion à froid).
Des études de fusion à chaud
La synthèse de rutherfordium a été tentée en 1964 par l'équipe de Dubna en utilisant la réaction de fusion à chaud de néon -22 projectiles avec le plutonium -242 objectifs:
- 242
94 Pu + 22
10 Ne → 264-x
104 Rf + 3 ou 5 n .
La première étude a produit des preuves pour un fission spontanée avec un 0,3 secondes demi-vie et une autre à 8 secondes. Alors que la première observation a été finalement rétracté, ce dernier est finalement devenu associé avec le Rf isotope 259. En 1966, l'équipe soviétique répété l'expérience en utilisant une étude chimique des produits de chlorure volatils. Ils ont identifié un chlorure volatile avec des propriétés de EKA-hafnium que cariées rapide grâce à la fission spontanée. On a obtenu des preuves solides pour la formation de RFCL 4, et bien que la demi-vie ne est pas mesurée de façon précise, la preuve suggère que plus tard, le produit était très probablement 259 Rf. L'équipe a répété l'expérience à plusieurs reprises au cours des prochaines années, et en 1971, ils ont révisé la fission spontanée mi-temps pour l'isotope à 4,5 secondes.
En 1969, des chercheurs de la Université de Californie dirigée par Albert Ghiorso, a essayé de confirmer les résultats originaux rapportés à Dubna. Dans une réaction de curium -248 avec l'oxygène-16, ils ont été incapables de confirmer le résultat de l'équipe soviétique, mais a réussi à observer la fission spontanée de 260 Rf avec une demi-vie très courte de 10 à 30 ms:
- 248
96 cm + 16
8 O 260 →
104 Rf + 4 n .
En 1970, l'équipe américaine a également étudié la même réaction avec l'oxygène-18 et a identifié 261 Rf avec une demi-vie de 65 secondes (plus tard raffiné à 75 secondes). Des expériences ultérieures au Lawrence Berkeley National Laboratory en Californie a également révélé la formation d'un isomère de courte durée de 262 Rf (qui subit la fission spontanée avec une demi-vie de 47 ms), et les activités de fission spontanée avec de longues durées de vie provisoirement affectés à 263 Rf.
La réaction du californium avec -249 carbone-13 a également été étudiée par l'équipe Ghiorso, ce qui indique la formation de l'éphémère 258 Rf (qui subit la fission spontanée dans 11 ms):
- 249
98 Cf + 13
6 258 → C
104 Rf + 4 n .
En essayant de confirmer ces résultats en utilisant carbone-12 à la place, ils ont également observé la première alpha se désintègre de 257 Rf.
La réaction des berkelium -249 avec l'azote a été étudiée -14 premier à Dubna en 1977, et en 1985, les chercheurs il a confirmé la formation de l'isotope 260 Rf qui subit rapidement fission spontanée dans 28 ms:
- 249
97 Bk + 14
7 N → 260
104 Rf + 3 n .
En 1996, l'isotope 262 Rf a été observée dans LBNL de la fusion de plutonium-244 avec néon-22:
- 244
94 Pu + 22
10 Ne → 266-x
104 Rf + 4 ou 5 n .
L'équipe a déterminé une demi-vie de 2,1 secondes, contrairement aux rapports antérieurs de 47 ms et a suggéré que les deux demi-vies pourraient être dus à différents états isomères de 262 Rf. Les études sur la même réaction par une équipe à Dubna, conduisent à l'observation en 2000 d'alpha se désintègre de 261 Rf et fissions spontanées de 261m Rf.
La réaction de fusion à chaud en utilisant une cible d'uranium a été signalée à Dubna en 2000:
- 238
92 U + 26
12 Mg → 264-x
104 Rf + x n (x = 3, 4, 5, 6).
Ils ont observé désintégrations de 260 259 Rf et Rf, et plus tard pour 259 Rf. En 2006, dans le cadre de leur programme sur l'étude de cibles d'uranium dans les réactions de fusion à chaud, l'équipe a également observé LBNL 261 Rf.
Études de fusion froide
Les premières expériences de fusion froide élément impliquant 104 ont été réalisées en 1974 à Dubna, en utilisant la lumière titane 50 noyaux visant des cibles d'isotopes de plomb-208:
- 208
82 Pb + 50
Ti 22-x → 258
104 Rf + x n (x = 1, 2, ou 3).
La mesure d'une activité de fission spontanée a été attribué à 256 Rf, alors que des études ultérieures effectuées au Gesellschaft für Schwerionenforschung Institute (GSI), également mesuré les propriétés de désintégration des isotopes 257 Rf, et 255 Rf.
En 1974 des chercheurs de Dubna étudié la réaction de plomb-207 avec du titane-50 pour produire l'isotope 255 Rf. Dans une étude réalisée en 1994 chez GSI en utilisant l'isotope de plomb-206, 255 Rf ainsi que 254 Rf ont été détectés. 253 Rf a de même été détecté cette année lorsque le plomb-204 a été utilisé à la place.
études de Decay
La plupart des isotopes avec un masse atomique ci-dessous 262 ont également observé que les produits de désintégration d'éléments avec une meilleure numéro atomique , permettant pour le raffinement de leurs propriétés précédemment mesurées. Isotopes plus lourds de rutherfordium ne ont été observés que les produits de désintégration. Par exemple, quelques événements de désintégration alpha se terminant par 267 Rf ont été observés dans la chaîne de désintégration de darmstadtium -279 depuis 2004:
- 279
110 275 Ds →
108 Hs + α → 271
Sg 106 267 + α →
104 Rf + α.
Cette nouvelle a subi une fission spontanée avec un mi-temps d'environ 1,3 h.
Enquêtes sur la synthèse de la dubnium -263 isotopes en 1999 à la Université de Berne a révélé événements compatibles avec capture d'électrons pour former 263 Rf. Une fraction de rutherfordium a été séparée, et plusieurs événements de fission spontanée avec longue durée de vie d'environ 15 minutes ont été observés, ainsi que l'alpha et décroît avec la durée de vie d'environ 10 minutes. Rapports sur la chaîne de désintégration de Flérovium -285 en 2010 ont montré cinq séquentielle alpha se désintègre qui se terminent dans 265 Rf, qui subit une nouvelle fission spontanée avec une durée de vie de 152 secondes.
Certains éléments de preuve expérimentale a été obtenu en 2004 pour un isotope encore plus lourd, 268 Rf, dans la chaîne de désintégration d'un isotope de ununpentium :
- 288
115 284 Uup →
113 Uut α → + 280
111 Rg + α → 276
109 Mt + α → 272
107 Bh + α → 268
105 Db + α? → 268
104 Rf + ν
e.
Toutefois, la dernière étape de cette chaîne était incertain. Après avoir observé les événements de désintégration alpha cinq qui génèrent dubnium -268, les événements de fission spontanées ont été observées avec une longue demi-heure. Il est difficile de savoir si ces événements étaient dus à diriger fission spontanée de 268 Db, ou 268 Db produit événements de capture d'électrons avec de longues demi-vies de 268 génèrent Rf. Si celui-ci est produit et se désintègre avec une durée de vie courte, les deux possibilités peuvent pas être distingués. Étant donné que le capture d'électrons de 268 Db ne peut pas être détecté, ces événements de fission spontanée peut être dû à 268 Rf, auquel cas la demi-vie de cet isotope ne peut pas être extraite.
Selon un rapport de 2007 sur la synthèse de ununtrium , l'isotope 282 113 a été observée à subir une décroissance similaire à former 266 Db, qui subit la fission spontanée avec une demi-vie de 22 minutes. Étant donné que la capture d'électrons de 266 Db ne peut pas être détecté, ces événements de fission spontanée peut être dû à 266 Rf, auquel cas la demi-vie de cet isotope ne peut pas être extraite.
Isotopes
| Isotope | Demi-vie | Pourriture mode | Découverte année | Réaction |
|---|---|---|---|---|
| 253 Rf | 48 ps | α, SF | 1994 | 204 Pb (Ti 50, n) |
| 254 Rf | 23 ps | SF | 1994 | 206 Pb (Ti 50, 2n) |
| 255 Rf | 2,3 | ε ?, α, SF | 1974 | 207 Pb (Ti 50, 2n) |
| 256 Rf | 6,4 ms | α, SF | 1974 | 208 Pb (Ti 50, 2n) |
| 257 Rf | 4,7 | ε, α, SF | 1969 | 249 Cf (C 12, 4n) |
| 257m Rf | 4,1 | ε, α, SF | 1969 | 249 Cf (C 12, 4n) |
| 258 Rf | 14,7 ms | α, SF | 1969 | 249 Cf (C 13, 4n) |
| 259 Rf | 3,2 | α, SF | 1969 | 249 Cf (13 C, 3n) |
| 259m Rf | 2,5 | ε | 1969 | 249 Cf (13 C, 3n) |
| 260 Rf | 21 | α, SF | 1969 | 248 cm (16 O, 4n) |
| 261 Rf | 78 | α, SF | 1970 | 248 cm (18 O, 5n) |
| 261m Rf | 4 | ε, α, SF | 2001 | Pu 244 (22 Ne, 5n) |
| 262 Rf | 2,3 | α, SF | 1996 | Pu 244 (22 Ne, 4n) |
| 263 Rf | 15 min | α, SF | 1999 | 263 Db ( e - , ν e) |
| 263m Rf? | 8 | α, SF | 1999 | 263 Db ( e - , ν e) |
| 264 Rf | 1? h | α? | inconnu | - |
| 265 Rf | 2,5 min | SF | 2010 | 269 Sg (-, α) |
| 266 Rf | 10 h? | α, SF? | 2007? | 266 Db ( e - , ν e)? |
| 267 Rf | 1,3 h | SF | 2004 | 271 Sg (-, α) |
| 268 Rf | 6 h? | α, SF? | 2004? | 268 Db ( e - , ν e)? |
Rutherfordium n'a pas d'isotopes stables ou naturels. Plusieurs isotopes radioactifs ont été synthétisés dans le laboratoire, soit par fusion de deux atomes ou en observant la décroissance des éléments plus lourds. Quinze isotopes différents ont été rapportés avec les masses atomiques 253-268 (à l'exception de 264). La plupart de ces Decay principalement par des voies de fission spontanée.
Vie fois
Les isotopes les plus légers ont généralement plus courtes demi-vies; la demi-vie de moins de 50 ms pour 253 254 Rf et Rf ont été observés. 256 Rf, Rf 258, 260 Rf sont plus stables autour de 10 ms, 255 Rf, Rf 257, 259 Rf, et 262 Rf en direct entre 1 et 5 secondes et 261 Rf, Rf 265 et 263 Rf sont plus stables, aux alentours de 1, 1,5 et 10 min respectivement. Les isotopes lourds sont les plus stables, avec 267 Rf ayant une demi-vie mesurée d'environ 1,3 h.
Les isotopes les plus légers ont été synthétisés par fusion directe entre deux noyaux plus légers et en tant que produits de désintégration. L'isotope le plus lourd produit par fusion directe est 262 Rf; isotopes plus lourds ne ont été observés que les produits de désintégration d'éléments ayant les numéros atomiques plus grandes, dont seulement 267 Rf a été confirmée. Isotopes 266 Rf et Rf 268 peuvent aussi avoir été observé que les produits de décomposition et sont considérés comme ayant une longue demi-vie de 10 h et 6 h, respectivement, mais ceux-ci ont été mesurées indirectement, à travers des études systématiques. Alors que l'isotope 264 Rf n'a pas encore été observé, il est prévu d'avoir une longue demi-vie de 1 h. Avant cette découverte, 265 Rf est prévu d'avoir une plus longue demi-vie de 13 h même, mais il a une demi-vie de seulement 2,5 min.
En 1999, des scientifiques américains de l'Université de Californie, Berkeley, ont annoncé qu'ils avaient réussi à synthétiser trois atomes de 293 118. Ces noyaux mères auraient successivement émis sept particules alpha pour former 265 noyaux Rf, mais leur demande a été rétractés en 2001.
Isomérie nucléaire
Plusieurs études antérieures sur la synthèse de 263 Rf ont indiqué que ce nucléide se désintègre principalement par fission spontanée avec une demi-vie de 10 à 20 minutes. Plus récemment, une étude de hassium isotopes a permis la synthèse d'atomes de 263 Rf décomposition avec une demi-vie plus courte de huit secondes. Ces deux modes de désintégration différents doivent être associés à deux états isomères, mais des missions spécifiques sont difficiles en raison du faible nombre d'événements observés.
Au cours de la recherche sur la synthèse des isotopes de rutherfordium utilisant le Pu 244 (22 Ne, 5n) 261 réaction Rf, le produit a été trouvé à subir exclusive 8,28 MeV désintégration alpha avec une demi-vie de 78 secondes. Des études ultérieures à GSI sur la synthèse de copernicium et hassium isotopes produits données contradictoires, que 261 Rf produite dans la chaîne de désintégration a été trouvé à subir 8,52 MeV désintégration alpha avec une demi-vie de 4 secondes. Résultats plus tard indiqué une fission branche prédominante. Ces contradictions ont conduit à un certain doute sur la découverte de copernicium. Le premier isomère est actuellement notée 261a Rf (Rf ou simplement 261) tandis que le second est notée 261b Rf (ou 261m Rf). Cependant, on pense que le premier noyau appartient à un état fondamental haut-spin et le second à un état métastable bas spin. La découverte et la confirmation de 261b Rf ont apporté la preuve pour la découverte de copernicium en 1996.
Une étude détaillée spectroscopique de la production de 257 noyaux RF en utilisant la réaction 208 Pb (50 Ti, n) 257 Rf a permis l'identification d'un niveau d'isomères dans 257 Rf. Le travail a confirmé que 257g Rf a un spectre complexe avec 15 lignes alpha. Un diagramme de structure de niveau a été calculé pour les deux isomères. Isomères similaires ont été signalés pour 256 Rf également.
Propriétés prédites
Chimique
Rutherfordium est la première Transactinide et le second élément de la série 6d de métaux de transition. Calculs sur son potentiels d'ionisation, rayon atomique, ainsi que des rayons, les énergies orbitales, et les niveaux de ses états ionisés au sol sont similaires à celles de l'hafnium et très différent de celui du plomb . Par conséquent, il a été conclu que les propriétés de base de rutherfordium se apparentent à ceux de l'autre groupe 4, en dessous des éléments titane , zirconium , et hafnium. Certains de ses propriétés ont été déterminées par des expériences en phase gazeuse et la chimie aqueuse. L'état d'oxydation 4 est le seul état stable pour les deux derniers éléments et donc rutherfordium devrait également présenter un état stable 4. En outre, est également prévu rutherfordium pour pouvoir former un état moins trois stable.
Les propriétés chimiques de rutherfordium étaient fondées sur le calcul qui a indiqué que les effets relativistes sur la coque d'électrons pourrait être suffisant que la forte orbitales p ont un niveau d'énergie inférieur à la orbitales d, lui donnant une configuration électronique valence de 1 7s 6d 2 7p une ou même deux 7s 7p 2, rendant ainsi l'élément se comporte plus comme chef de file de l'hafnium. Avec de meilleures méthodes de calcul et des études sur les propriétés chimiques des composés rutherfordium on a pu montrer que rutherfordium se comporte selon le reste de la groupe 4 éléments.
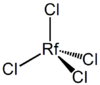
De manière analogue à zirconium et hafnium, rutherfordium devrait former un très stable, point de fusion élevé de l'oxyde de points, RFO 2. Il réagit avec les halogènes pour former des tétrahalogénures, RFX 4, qui se hydrolysent au contact de l'eau pour former des oxyhalogénures RfOX 2. Les tétrahalogénures sont des solides volatils en tant que molécules tétraédriques existants monomères dans la phase vapeur.
Dans la phase aqueuse, l'ion 4+ Rf hydrolyse inférieur de titane (IV) et à un degré similaire à celui du zirconium et du hafnium, conduisant ainsi à l'ion 2+ RFO. Le traitement des halogénures avec des ions halogénure favorise la formation d'ions complexes. L'utilisation d'ions chlorure et bromure produit les complexes de hexahalogénure RFCL 2-
6 et RFBR 2-
6. Pour les complexes de fluorure de zirconium et le hafnium ont tendance à hepta- et octa- former des complexes. Ainsi, pour la plus grande rutherfordium ions, les complexes RFF 2-
6, RFF 2-
7 et RFF 4-
8 sont possibles.
Physique atomique et
Rutherfordium devrait être un solide dans des conditions normales. Il devrait être un métal très lourd avec une densité d'environ 23 g / cm 3; En comparaison, l'élément le plus dense connue qui a eu sa densité mesurée, l'osmium , a une masse volumique de 22,61 g / cm 3. Ceci résulte du poids atomique élevé de rutherfordium, le lanthanides et des actinides contractions, et effets relativistes, bien que la production d'une quantité suffisante rutherfordium pour mesurer cette quantité ne serait pas pratique, et l'échantillon serait rapidement se dégrader. Le rayon atomique pour rutherfordium devrait se situer autour de 150 h. En raison de la stabilisation relativiste des 7s orbitales et de déstabilisation de l'orbitale 6d, les ions Rf + et Rf 2+ sont prévus pour donner des électrons au lieu de 7s 6d électrons, ce qui est le contraire du comportement de ses homologues plus légers.
Chimie expérimentale
| Formule | Noms |
|---|---|
| RFCL 4 | tétrachlorure rutherfordium, rutherfordium (IV) de chlorure |
| RFBR 4 | tétrabromure rutherfordium, rutherfordium (IV) de bromure |
| RfOCl 2 | oxychlorure rutherfordium, rutherfordyl (IV) de chlorure, rutherfordium (IV) oxyde de dichlorure |
| [RFCL 6] 2- | hexachlororutherfordate (IV) |
| [RFF 6] 2- | hexafluororutherfordate (IV) |
| K 2 [RFCL 6] | hexachlororutherfordate de potassium (IV) |
en phase gazeuse
Les premiers travaux sur l'étude de la chimie des rutherfordium axée sur thermochromatography de gaz et la mesure des courbes d'adsorption de la température de dépôt relative. Le travail initial a été effectuée à Dubna dans une tentative de réaffirmer leur découverte de l'élément. Des travaux récents est plus fiable en ce qui concerne l'identification des radio-isotopes parent de rutherfordium. L'isotope 261m Rf a été utilisé pour ces études. Les expériences se appuyaient sur l'espoir que rutherfordium commencerait la nouvelle série d'éléments 6d et devrait donc former un tétrachlorure volatile en raison de la nature tétraédrique de la molécule. Rutherfordium (IV) de chlorure est plus volatile que son homologue légers hafnium (IV) de chlorure (HfCl4) parce que ses obligations sont plus covalente.
Une série d'expériences a confirmé que rutherfordium se comporte comme un élément typique du groupe 4, en formant un chlorure tétravalent (RFCL 4) et du bromure (RFBR 4) ainsi qu'un oxychlorure (RfOCl 2). Une diminution de la volatilité a été observée pour RFCL 4 lorsque le chlorure de potassium est fournie en tant que phase solide au lieu de gaz, très représentatif de la formation de K 2 RFCL 6 non volatile de sel mixte.
La phase aqueuse
Rutherfordium devrait avoir la configuration d'électrons [Rn] 5f 14 7s 6d 2 2 et donc se comporter comme l'homologue plus lourd de l'hafnium dans le groupe 4 du tableau périodique. Il convient donc de former facilement un Rf 4+ ions hydraté dans une solution d'acide fort et devrait facilement former des complexes dans l'acide chlorhydrique , bromhydrique ou Les solutions d'acide fluorhydrique.
Les plus probants des études de chimie aqueuses de rutherfordium ont été effectuées par l'équipe japonaise à Institut japonais de recherche de l'énergie atomique en utilisant le radio-isotope 261m Rf. expériences d'extraction de solutions d'acide chlorhydrique utilisant des isotopes de rutherfordium, le hafnium, le zirconium et le thorium ont prouvé un comportement non-actinides pour rutherfordium. Une comparaison avec ses homologues plus légers rutherfordium placé fermement dans le groupe 4 et a montré la formation d'un complexe de hexachlororutherfordate dans des solutions de chlorure, d'une manière similaire à l'hafnium et le zirconium.
- 261m Rf 4+ + 6 Cl - → [261m RFCL 6] 2-
Des résultats très similaires ont été observés dans des solutions d'acide fluorhydrique. Les différences dans les courbes d'extraction ont été interprétées comme une affinité plus faible pour les ions fluorure et la formation de l'ion hexafluororutherfordate, alors que les ions hafnium et zirconium sept ou huit ions fluorure complexes aux concentrations utilisées:
- 261m Rf 4+ + 6 F - → [261m RFF 6] 2-