Lithium
Renseignements généraux
SOS Enfants, un organisme de bienfaisance de l'éducation , a organisé cette sélection. Avant de vous décider à propos de parrainer un enfant, pourquoi ne pas en apprendre davantage sur différents organismes de parrainage premier ?
| Lithium | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
3 Li | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||
blanc argenté (montré flottant dans l'huile)  Raies spectrales de lithium | |||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||
| Nom, symbole, nombre | le lithium, Li, 3 | ||||||||||||||||||||||||
| Prononciation | / l ɪ θ Je ə m / -Əm de LI | ||||||||||||||||||||||||
| Élément Catégorie | métal alcalin | ||||||||||||||||||||||||
| Groupe, période, bloc | (1) des métaux alcalins , 2, s | ||||||||||||||||||||||||
| Poids atomique standard | 6,94 (1) | ||||||||||||||||||||||||
| Configuration électronique | [Il] 2s 1 2, 1 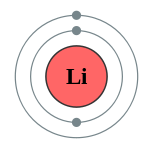 | ||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||
| Découverte | Johan Août Arfwedson (1817) | ||||||||||||||||||||||||
| Premier isolement | William Thomas Brande (1821) | ||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||
| Densité (à proximité rt) | 0,534 g · cm -3 | ||||||||||||||||||||||||
| Liquid densité au mp | 0,512 g · cm -3 | ||||||||||||||||||||||||
| Point de fusion | 453,69 K , 180,54 ° C, 356,97 ° F | ||||||||||||||||||||||||
| Point d'ébullition | 1615 K, 1342 ° C, 2448 ° F | ||||||||||||||||||||||||
| Point critique | (Extrapolation) 3223 K, 67 MPa | ||||||||||||||||||||||||
| La chaleur de fusion | 3,00 kJ · mol -1 | ||||||||||||||||||||||||
| Chaleur de vaporisation | 147,1 kJ · mol -1 | ||||||||||||||||||||||||
| Capacité thermique molaire | 24,860 J · mol -1 · K -1 | ||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||
| États d'oxydation | 1 (Fortement oxyde de base) | ||||||||||||||||||||||||
| Électronégativité | 0,98 (échelle de Pauling) | ||||||||||||||||||||||||
| énergies d'ionisation | 1e: 520,2 kJ · mol -1 | ||||||||||||||||||||||||
| 2ème: 7298,1 kJ · mol -1 | |||||||||||||||||||||||||
| 3ème: 11815,0 kJ · mol -1 | |||||||||||||||||||||||||
| Rayon atomique | 152 h | ||||||||||||||||||||||||
| Rayon covalente | 128 ± 19 heures | ||||||||||||||||||||||||
| Rayon de Van der Waals | 182 h | ||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||
| Crystal structure | cubique centré  | ||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 92,8 nΩ · m | ||||||||||||||||||||||||
| Conductivité thermique | 84,8 W · m -1 · K -1 | ||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 46 um · m -1 · K -1 | ||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 6,000 m · s -1 | ||||||||||||||||||||||||
| Le module d'Young | 4,9 GPa | ||||||||||||||||||||||||
| Module de cisaillement | 4,2 GPa | ||||||||||||||||||||||||
| Module Bulk | 11 GPa | ||||||||||||||||||||||||
| Dureté Mohs | 0,6 | ||||||||||||||||||||||||
| Numéro de registre CAS | 7439-93-2 | ||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||
| Article détaillé: Isotopes de lithium | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Lithium (à partir de la pierre 'grec lithos) est un doux blanc argenté métallique avec symbole Li et numéro atomique 3. Il appartient au métal alcalin de groupe d'éléments chimiques . Sous conditions standard, il est le plus léger métal et l'élément solide moins dense. Comme tous les métaux alcalins, le lithium est très réactif et inflammable. Pour cette raison, il est généralement stocké dans l'huile minérale. En cas de coupe ouverte, le lithium métallique présente une lustre, mais le contact avec l'air humide corrode la surface rapidement à un gris argenté terne, puis ternissement noir. En raison de sa haute réactivité, le lithium ne se produit jamais librement dans la nature, et à la place, ne apparaît que dans les composés , qui sont habituellement ionique. Lithium se produit dans un certain nombre de minéraux pegmatitiques, mais en raison de sa solubilité comme un ion est présent dans l'eau de mer et est généralement obtenu à partir de saumures et les argiles . Sur une échelle commerciale, le lithium est isolé par voie électrolytique à partir d'un mélange de le chlorure de lithium et chlorure de potassium.
Les noyaux de lithium point sur l'instabilité, étant donné que les deux stables lithium isotopes présents dans la nature sont parmi les plus bas énergies de liaison par nucléon de tous stables nucléides. En raison de son instabilité nucléaire rapport, le lithium est moins courante dans le système solaire de 25 des 32 premiers éléments chimiques, même si les noyaux sont très légers en poids atomique. Pour des raisons connexes, le lithium a des liens importants à la physique nucléaire . Le transmutation des atomes de lithium à l'hélium en 1932 fut le premier entièrement fait homme- réaction nucléaire, et lithium-6 deutérure sert de en combustible de fusion mise en scène armes thermonucléaires.
Le lithium et ses composés ont plusieurs applications industrielles, y compris le verre et résistant à la chaleur la céramique, de haute résistance-poids alliages utilisés dans les aéronefs, les piles au lithium et batteries lithium-ion. Ces utilisations consomment plus de la moitié de la production de lithium.
Des traces de lithium sont présents dans tous les organismes. L'élément n'a pas de fonction biologique vitale apparente, puisque les animaux et les plantes survivent en bonne santé sans elle. Fonctions non vitales ne ont pas été exclu. Le lithium ion Li + administrée en une quelconque de plusieurs lithium sels se est révélée utile en tant que médicaments de stabilisation de l'humeur dans le traitement de trouble bipolaire, en raison de neurologique effets de l'ion dans le corps humain.
Propriétés
Atomique et physique


Comme les autres métaux alcalins , le lithium a une seule électron de valence qui est facilement donnée pour former un cation . Pour cette raison, il est un bon conducteur de chaleur et d'électricité ainsi que d'un élément très réactif, bien que le moins réactif des métaux alcalins. Faible réactivité du lithium par rapport à d'autres métaux alcalins est due à la proximité de ses électrons de valence à son noyau (les deux électrons restants sont en lithium du Orbitale 1s et sont beaucoup moins d'énergie, et donc ils ne participent pas dans les liaisons chimiques).
Métal lithium est suffisamment souple pour être coupé avec un couteau. A la coupe, il possède une couleur blanc argenté qui change rapidement au gris due à l'oxydation. Même se il a l'un des des points de fusion plus bas parmi tous les métaux (180 ° C), il a les points culminants de fusion et d'ébullition des métaux alcalins.
Ce est le métal le plus léger du tableau périodique, si léger qu'il peut flotter sur l'eau et même sur le pétrole, et il est l'un des trois métaux qui peuvent (les deux autres sont le sodium et le potassium ). Il a une très faible densité, d'environ 0,534 g / cm 3, ce qui donne des bâtons de métal d'un Heft similaire à chevilles de bois de densité moyenne, comme le pin. Il flotte sur l'eau, mais réagit aussi avec elle.

Ce est le moins dense de l'ensemble des éléments qui ne sont pas des gaz à la température ambiante. Le prochain élément le plus léger est plus de 60% plus dense (potassium, à 0,862 g / cm 3). En outre, en dehors de l'hélium et de l'hydrogène , ce est l'élément dense moins à l'état solide ou liquide, ne étant plus dense que 2/3 l'azote liquide (0,808 g / cm 3).
Lithium de coefficient de dilatation thermique est deux fois celle de l'aluminium et de presque quatre fois supérieure à celle du fer. Il a le plus haut la capacité thermique spécifique de tout élément solide. Le lithium est supraconductrice en dessous de 400 μK à pression normale et à des températures élevées (plus de 9 K) à des pressions très élevées (> 20 GPa) à des températures inférieures à 70 K, le lithium, comme le sodium, subit sans diffusion transformations à changement de phase. A 4,2 K a un système cristallin rhomboédrique (avec un espacement de répétition neuf couches); à des températures plus élevées, il se transforme en cubique à faces centrées puis cubique centré. A des températures de l'hélium liquide (4 K) la structure rhomboédrique est la plus répandue. Plusieurs formes allotropiques ont été rapportés pour le lithium à des pressions élevées.
En raison de sa capacité thermique spécifique, le plus élevé de toutes les matières solides, le lithium métallique est souvent utilisé dans réfrigérants pour les applications de transfert de chaleur.
Chimie et composés
Lithium réagit avec l'eau facilement, mais avec nettement moins d'énergie que les autres métaux alcalins font. La réaction forme hydrogène et de gaz l'hydroxyde de lithium en solution aqueuse. En raison de sa réactivité avec l'eau, le lithium est généralement stocké sous le couvert d'un hydrocarbure visqueux, souvent de la vaseline. Bien que les métaux alcalins lourds peuvent être stockés dans des substances moins denses, tels que l'huile minérale, le lithium ne est pas suffisamment dense pour être entièrement immergée dans ces liquides. Dans l'air humide, de lithium ternit rapidement pour former un revêtement noir de l'hydroxyde de lithium (LiOH et LiOH · H 2 O), le nitrure de lithium (Li 3 N) et le carbonate de lithium (Li 2 CO 3, le résultat d'une réaction secondaire entre LiOH et CO 2 ).
Lorsqu'il est placé sur une flamme, composés de lithium dégagent une couleur pourpre frappante, mais quand il brûle vivement la flamme devient un argent brillant. Lithium de se enflammer et brûler dans l'oxygène lorsqu'il est exposé à des vapeurs d'eau ou de l'eau. Le lithium est inflammable, et il est potentiellement explosive lorsqu'elle est exposée à l'air et en particulier à l'eau, mais moins que les autres métaux alcalins . La réaction de lithium-eau à des températures normales est vif mais pas violente, l'hydrogène produit ne se enflamme pas sur son propre. Comme avec tous les métaux alcalins, les feux de lithium sont difficiles à éteindre, nécessitant secs extincteurs à poudre, spécifiquement type Class D (voir Types d'agents extincteurs). Le lithium est le seul métal qui réagit avec l'azote sous conditions normales.
Le lithium a un diagonale relation avec le magnésium , un élément atomique de similaire et rayon ionique. Ressemblances chimiques entre les deux métaux comprennent la formation d'une nitrure par réaction avec le N 2, la formation d'une oxyde (Li 2 O) et le peroxyde (Li 2 O 2) lorsqu'il est brûlé en O 2, des sels similaires avec des solubilités et l'instabilité thermique des carbonates et des nitrures. Le métal réagit avec de l'hydrogène gazeux à des températures élevées pour produire de l'hydrure de lithium (LiH).
Autres connue composés binaires comprennent la (halogénures LiF, LiCl, LiBr, LII), et le sulfure de ( Li 2 S), la dismutase ( LiO 2), carbure ( Li 2 C 2). De nombreux autres composés inorganiques sont connus, où lithium se combine avec des anions pour former divers sels: borates, les amides, carbonate, nitrate, ou borohydrure ( LiBH 4). Multiple réactifs organolithiens sont connus où il existe un lien direct liaison entre carbone et des atomes de lithium créant effectivement un carbanion. Elles sont extrêmement puissante des bases et nucléophiles. Dans plusieurs de ces composés organiques du lithium, les ions lithium ont tendance à se agréger en amas de haute symétrie par eux-mêmes, ce qui est relativement fréquent que des cations alcalins.
Isotopes
Naturellement survenant lithium est composé de deux stables isotopes , 6 Li et 7 Li, cette dernière étant la plus abondante (92,5% abondance naturelle). Les deux isotopes naturels ont anormalement bas énergie de liaison par nucléon nucléaire par rapport à l'autre des éléments plus légers et plus lourds, de l'hélium et le béryllium , ce qui signifie que seuls les éléments légers stables, le lithium peut produire de l'énergie nette par fission nucléaire . Les deux noyaux de lithium ont énergies de liaison inférieurs par nucléon que tout autres nucléides stables autre que deutérium et de hélium-3. A la suite de ceci, bien que très léger en poids atomique, le lithium est moins courant dans le système solaire que 25 des 32 premiers éléments chimiques. Sept des radio-isotopes ont été caractérisées, le plus stable étant Li 8 avec une demi-vie de 838 Li et 9 ms avec une demi-vie de 178 ms. Tout le reste isotopes radioactifs ont des demi-vies plus courtes que 8,6 ms. L'isotope le plus éphémère de lithium est 4 Li, qui se désintègre par émission de proton et a une demi-vie de 7,6 × 10 -23 s.
7 Li est l'un des éléments primordiaux (ou, plus correctement, primordiale nucléides) produites dans Nucléosynthèse Big Bang. Une petite quantité de fois 6 Li et 7 Li sont produits dans les étoiles, mais sont pensés pour être brûlé aussi vite que produit. De petites quantités supplémentaires de lithium à la fois 6 Li et 7 Li peuvent être générés par le vent solaire, les rayons cosmiques frappent des atomes plus lourds, et de système solaire début 7 Soyez et 10 Soyez désintégration radioactive. Bien que le lithium est créée dans les étoiles pendant la Nucléosynthèse stellaire, il est en outre brûlé. 7 Li peut également être généré en étoiles de carbone.
isotopes du lithium fractionnent sensiblement au cours d'une grande variété de processus naturels, y compris la formation minérale (précipitation chimique), le métabolisme, et l'échange d'ions. Ions lithium substitut pour le magnésium et le fer dans les sites octaédriques en argile minéraux, où 6 Li est préférable à 7 Li, résultant dans l'enrichissement de l'isotope léger dans les processus de hyperfiltration et altération des roches. L'exotique 11 Li est connu pour présenter un halogéno nucléaire. Le processus connu sous le nom séparation isotopique par laser peut être utilisée pour séparer les isotopes du lithium.
La fabrication d'armes nucléaires et d'autres utilisations de la physique nucléaire sont une source majeure de artificielle fractionnement de lithium, avec l'isotope léger 6 Li étant retenu par l'industrie et les stocks militaires à un point tel que légèrement, mais mesurable changer le 6 Li à 7 rapports Li même dans naturelle sources, comme les rivières. Cela a conduit à l'incertitude inhabituelle dans le standardisée poids atomique de lithium, étant donné que cette quantité dépend des rapports de teneurs isotopiques naturelles de ces isotopes naturels stables de lithium, car ils sont disponibles dans les sources minérales lithium commerciaux.
Occurrence
Astronomique
Selon la théorie cosmologique moderne, à la fois comme lithium-isotopes stables de son lithium-6 et lithium-7 a été parmi les trois éléments synthétisé dans le Big Bang . Bien que la quantité de lithium générée en Big Bang nucléosynthèse dépend du nombre de photons par baryon, pour les valeurs reconnues de l'abondance de lithium peut être calculée, et il ya un "écart de lithium cosmologique" dans l'Univers: étoiles âgées semblent avoir moins de lithium que ce qu'ils devraient, et quelques étoiles plus jeunes ont beaucoup plus. Le manque de lithium dans les étoiles âgées est apparemment provoqué par le "mélange" de lithium à l'intérieur d'étoiles, où elle est détruite. En outre, le lithium est produit chez les jeunes étoiles. Bien qu'il transmute en deux atomes d' hélium en raison de collision avec un proton à des températures supérieures 2.400.000 degrés Celsius (la plupart des étoiles atteignent facilement cette température dans leurs intérieurs), le lithium est plus abondante que prévu au plus tard génération étoiles, pour des raisons non encore complètement compris.
Bien que ce était l'un des trois premiers éléments (ainsi que l'hélium et de l'hydrogène) à synthétiser dans le Big Bang, de lithium, de concert avec le béryllium et le bore sont nettement moins abondantes que les autres éléments à proximité. Ce est le résultat de la faible température nécessaire pour détruire le lithium, et l'absence de processus communs pour le produire.
Le lithium est également présent dans brunes objets substellaires nains et certaines étoiles orange anormales. Parce que le lithium est présent dans plus froides naines brunes, moins massives, mais est détruit dans plus chauds naines rouges étoiles, sa présence dans le spectre des étoiles peut être utilisé dans le "test de lithium" pour différencier les deux, car les deux sont plus petite que le Soleil . Certaines étoiles oranges peuvent également contenir une forte concentration de lithium. Ces étoiles oranges trouvés d'avoir une concentration plus élevée que d'habitude de lithium (tels que Centaurus X-4) orbite massif étoiles à neutrons ou des objets plus noire lithium-trous dont la gravité tire évidemment plus lourd de lithium à la surface d'une étoile d'hydrogène et d'hélium, provoquant à observer.
Terrestre
| Pays | Production | Réserves |
|---|---|---|
| | 3200 | 850000 |
| | 9260 | 970000 |
| | 160 | 64000 |
| | 480 | 180000 |
| | 12600 | 7500000 |
| 5200 | 3500000 | |
| | 820 | 10000 |
| | 470 | 23000 |
| Total mondial | 34000 | 13000000 |
Bien que le lithium est largement distribué sur la Terre, il ne se produit pas naturellement sous forme élémentaire en raison de sa forte réactivité. La teneur totale en lithium de l'eau de mer est très grand et on estime que 230 milliards de tonnes, où l'élément existe à une concentration relativement constante de 0,14 à 0,25 partie par million (ppm), ou 25 micromolaire; des concentrations plus élevées approchant 7 ppm se trouvent près de évents hydrothermaux.
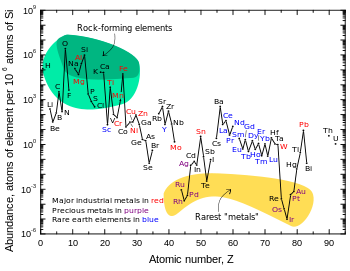
Les estimations pour la croûte à teneur de 20 à 70 ppm en poids. En accord avec son nom, le lithium constitue une partie mineure de roches ignées , avec les plus grandes concentrations de granites . Granitique pegmatites fournissent également la plus grande abondance de minéraux contenant du lithium, avec spodumène et pétalite étant les sources les plus commercialement viables. Un autre minéral de lithium est important lépidolite. Une source de lithium est plus récente argile hectorite, la seule active de développement qui est à travers le Western Lithium Corporation aux Etats-Unis. À 20 mg par kg de lithium de la croûte terrestre, le lithium est l'élément le plus abondant 25.
Selon le Manuel de lithium et de calcium naturel, "Le lithium est un élément relativement rare, même se il se trouve dans de nombreuses roches et des saumures, mais toujours en très faibles concentrations. Il ya un assez grand nombre des deux minéraux et de la saumure gisements de lithium, mais que relativement peu d'entre eux sont de la valeur commerciale réelle ou potentielle. Beaucoup sont très petits, d'autres sont trop faibles dans le grade. "
Un de la plus grande base de réserve de lithium est dans le Zone de Salar de Uyuni en Bolivie , qui a 5,4 millions de tonnes. US Geological Survey, estime qu'en 2010, le Chili avait les plus grandes réserves de loin (7,5 millions de tonnes) et la production annuelle la plus élevée (8800 tonnes). Autres principaux fournisseurs sont l'Australie, l'Argentine et la Chine.
En Juin 2010, le New York Times a rapporté que les géologues américains effectuaient des enquêtes de terrain sur sec lacs de sel dans l'ouest de l'Afghanistan croire que d'importants gisements de lithium se trouvent là-bas. "Les responsables du Pentagone ont déclaré que leur analyse initiale à un endroit dans La province de Ghazni a montré le potentiel de gisements de lithium aussi grand de ceux de la Bolivie, qui a maintenant plus grandes réserves de lithium connus du monde. "Ces estimations sont" principalement fondé sur des données anciennes, qui ont été recueillies principalement par les Soviétiques durant leur occupation de l'Afghanistan à partir de 1979 -1989 »et« Stephen Peters, le chef de projet de l'Afghanistan Minerals USGS, a dit qu'il ignorait La participation USGS dans toute nouvelle arpentage pour les minéraux en Afghanistan dans les deux dernières années. «Nous ne sommes pas au courant d'aucune découvertes de lithium, dit-il."
Biologique
Lithium se trouve dans l'état de traces dans de nombreuses plantes, le plancton et les invertébrés, à des concentrations de 69 à 5760 parties par milliard (ppb). Chez les vertébrés la concentration est légèrement plus faible, et presque toutes vertébré les tissus et liquides corporels ont été trouvés contenir lithium allant de 21 à 763 ppb. Les organismes marins ont tendance à bioaccumulation lithium plus terrestres. On ne sait pas si lithium a un rôle physiologique dans l'un de ces organismes, mais les études nutritionnelles chez les mammifères ont indiqué son importance pour la santé, conduisant à une suggestion qu'il soit classé comme un oligo-élément essentiel et une RDA de 1 mg / jour. Des études d'observation au Japon, signalés en 2011, a suggéré que le lithium naturel dans l'eau potable peut augmenter la durée de vie humaine.
Histoire de la découverte et l'utilisation

Petalite (LiAlSi 4 O 10) a été découvert en 1800 par le Brésil chimiste et homme d'État José Bonifácio Andrada e Silva dans une mine sur l'île de Utö, Suède. Cependant, ce ne est qu'en 1817 que Johan Août Arfwedson, qui travaillait alors dans le laboratoire du chimiste Jöns Jakob Berzelius, détecter la présence d'un nouvel élément lors de l'analyse du minerai de pétalite. Cet élément formé des composés semblables à ceux de sodium et de potassium , bien que son carbonate et hydroxyde étaient moins solubles dans l'eau et plus alcalin. Berzelius a donné la substance alcaline le nom "lithion / Lithina", du grec mot λιθoς (translittéré comme lithos, ce qui signifie «pierre»), pour tenir compte de sa découverte dans un solide minéral, par opposition au potassium, qui avait été découvert dans les cendres végétales , et de sodium qui a été connu pour sa grande partie l'abondance dans le sang des animaux. Il a nommé le métal à l'intérieur du "lithium" matériau.
Arfwedson plus tard a montré que ce même élément est présent dans les minéraux spodumène et lépidolite. En 1818, Christian Gmelin a été le premier à observer que les sels de lithium donnent une couleur rouge vif à la flamme. Toutefois, les deux Arfwedson et Gmelin essayé en vain d'isoler l'élément pur de ses sels. Il n'a pas été isolé jusqu'en 1821, lorsque William Thomas Brande obtenu par l'électrolyse du oxyde de lithium, un processus qui avait été employée par le chimiste Sir Humphry Davy pour isoler le potassium et le sodium métaux alcalins. Brande également décrit certains sels purs de lithium, tels que le chlorure, et, estimant que la lithine ( l'oxyde de lithium) contenait environ 55% de métal, de l'ordre de 9,8 g / mol (valeur moderne ~ 6,94 g / mol) a estimé le poids atomique du lithium. En 1855, des quantités plus importantes de lithium ont été produits par l'électrolyse de le chlorure de lithium par Robert Bunsen et Augustus Matthiessen. La découverte de cette procédure désormais conduit à la production commerciale de lithium, à partir de 1923, par la société allemande Metallgesellschaft AG, qui effectue une électrolyse d'un mélange liquide de chlorure de lithium et chlorure de potassium.
La production et l'utilisation du lithium ont subi plusieurs changements drastiques dans l'histoire. La première application importante du lithium était en-haute température lithium graisses pour moteurs d'avions ou des applications similaires dans la Seconde Guerre mondiale et peu de temps après. Cette utilisation a été soutenue par le fait que sur la base de lithium- les savons ont un point de fusion plus élevé que d'autres savons alcalins, et sont moins corrosifs que les savons à base de calcium. Le petit marché pour les savons de lithium et les graisses lubrifiantes basées sur eux a été soutenu par plusieurs petites opérations minières principalement aux États-Unis.
La demande pour le lithium a augmenté de façon spectaculaire au cours de la guerre froide avec la production de armes de fusion nucléaire. Les deux produits de lithium-6 et lithium-7 tritium lorsqu'il est irradié par des neutrons et sont donc utiles pour la production de tritium par lui-même, ainsi que d'une forme de combustible de fusion solide utilisé à l'intérieur des bombes à hydrogène sous forme de lithium deutérure . Les États-Unis sont devenus le premier producteur de lithium dans la période entre la fin des années 1950 et le milieu des années 1980. À la fin, les stocks de lithium était d'environ 42 000 tonnes d'hydroxyde de lithium. Le lithium a été stocké appauvrie en lithium-6 de 75%, ce qui était suffisant pour affecter le mesurée poids atomique du lithium dans de nombreux produits chimiques normalisées, et même le poids atomique du lithium dans quelques «sources naturelles» de lithium-ion qui avaient été «contaminés» par des sels de lithium rejetés par les installations de séparation des isotopes, qui avait trouvé son chemin dans les eaux souterraines.
Lithium a été utilisé pour diminuer la température de fusion du verre et d'améliorer le comportement de fusion de l'oxyde d'aluminium pour l'utilisation de la Procédé Hall-Héroult. Ces deux utilisations ont dominé le marché jusqu'à ce que le milieu des années 1990. Après la fin de la course aux armements nucléaires à la demande pour le lithium diminué et la vente du Département des stocks d'énergie sur le marché libre des prix réduits davantage. Mais au milieu des années 1990, plusieurs entreprises ont commencé à extraire du lithium la saumure qui se est avéré être une méthode moins coûteuse que l'exploitation minière souterraine ou même à ciel ouvert. La plupart des mines fermées ou déplacé leur attention à d'autres matériaux comme seul le minerai de pegmatites zonées pourrait être exploité pour un prix compétitif. Par exemple, les mines américaines près de Kings Mountain, Caroline du Nord fermé avant la fin du 21 e siècle.
L'utilisation dans les batteries lithium-ion a augmenté la demande pour le lithium et est devenu l'utilisation dominante en 2007. Avec la hausse de la demande de lithium dans les batteries dans les années 2000, de nouvelles entreprises ont élargi extraction de saumure efforts pour répondre à la demande croissante.
Production


Depuis la fin de la Seconde Guerre mondiale la production de lithium a considérablement augmenté. Le métal est séparé des autres éléments minéraux ignés tels que ceux ci-dessus. Les sels de lithium sont extraits de l'eau de sources minérales, les lacs de saumure et dépôts de saumure. Le métal est produit par électrolyse à partir d'un mélange fondu de 55% le chlorure de lithium et 45% chlorure de potassium à environ 450 o C. En 1998, elle était d'environ 95 $ US / kg (ou 43 US $ / livre).
Les réserves mondiales de lithium identifiés en 2008 ont été estimées par le US Geological Survey que 13 millions tonnes. Dépôts de lithium se trouvent en Amérique du Sud à travers le Andes chaîne de montagne. Le Chili est le premier producteur de lithium, suivi par l'Argentine . Les deux pays à se remettre du lithium à partir de lacs de saumure. Dans le lithium États-Unis est récupéré dans les lacs de saumure Nevada. Cependant, la moitié des réserves connues du monde se trouvent dans la Bolivie , un pays assis le long du versant oriental des Andes centrale. En 2009 la Bolivie a été négocie avec le japonais, le français, et les entreprises coréennes pour commencer l'extraction. Selon le US Geological Survey, la Bolivie de Uyuni Desert possède 5,4 millions de tonnes de lithium.
Une source potentielle est puits géothermiques. Fluides géothermiques portent lixiviats à la surface; récupération de lithium a été démontrée dans le domaine. Comme le lithium est séparé par des techniques de filtration simples, le processus et les coûts environnementaux sont principalement celui de la géothermie déjà fonctionnant bien; impacts environnementaux relatifs peuvent donc être positif.
Selon une étude de 2011 menée à Lawrence Berkeley National Laboratory et le Université de Californie à Berkeley, l'assiette des réserves actuellement estimée du lithium ne devrait pas être un facteur limitant pour la production de batteries à grande échelle pour les véhicules électriques, comme l'étude estime que de l'ordre de 1 milliard 40 batteries à base de Li kWh pourraient être construits avec des réserves actuelles. Une autre étude de 2011 par des chercheurs du Université du Michigan et Ford Motor Company a constaté qu'il existe des ressources de lithium suffisantes pour soutenir la demande mondiale jusqu'en 2100, y compris le lithium nécessaire pour l'utilisation potentielle généralisée de hybride électrique, plug-in hybride électrique et Véhicules électriques à batterie. L'étude a estimé mondiaux réserves de lithium à 39 millions de tonnes, et la demande totale de lithium au cours de la période de 90 années analysées au 12-20000000 tonnes, selon les scénarios concernant la croissance économique et les taux de recyclage.
Applications
Céramique et verre
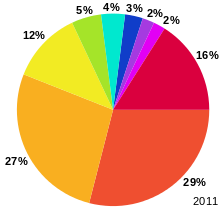
oxyde de lithium est un flux largement utilisé pour le traitement de la silice , en réduisant le point de fusion et viscosité de la matière et conduisant à glacis de propriétés physiques améliorées, y compris de faibles coefficients de dilatation thermique. Oxydes lithium sont une composante de plats à four. Dans le monde, ce est le plus grand usage unique pour les composés de lithium (voir graphique). Le carbonate de lithium (Li 2 CO 3) est généralement utilisé dans la présente demande: il convertit par chauffage en l'oxyde.
Électrique et électronique
Dans les dernières années du 20ème siècle, devint lithium important en tant que un matériau d'anode. Utilisé dans batteries lithium-ion en raison de sa haute potentiel électrochimique, une cellule typique peut produire environ 3 volts , contre 2,1 volts pour du plomb / acide ou 1,5 volts pour cellules zinc-carbone. En raison de sa faible masse atomique, elle a aussi une haute charge-et rapport puissance-poids. Les piles au lithium sont jetable ( primaire) batteries au lithium ou ses composés comme un anode. Les piles au lithium ne doivent pas être confondus avec batteries lithium-ion, qui sont haute densité d'énergie batteries rechargeables. Autres piles rechargeables comprennent la batterie polymère lithium-ion, lithium fer phosphate de la batterie, et de la Batterie de nanofil.
Graisses
La troisième utilisation la plus courante de lithium est dans les graisses. L'hydroxyde de lithium est une forte base et, lorsqu'il est chauffé avec une graisse, produit un savon en lithium stéarate. Savon de lithium a la capacité de épaissir les huiles, et il est utilisé pour la fabrication de tout usage, à haute température graisses lubrifiantes.
Alliages
Lorsqu'il est utilisé comme Flux pour soudure ou brasage, du lithium métallique favorise la fusion des métaux lors du processus et élimine la formation de oxydes en absorbant les impuretés. La qualité de fixation est également important en tant que flux de production la céramique, émaux et de verre. Les alliages du métal avec de l'aluminium, le cadmium , le cuivre et le manganèse sont utilisés pour fabriquer des pièces d'avions à hautes performances (voir également Alliages lithium-aluminium). composés de lithium sont également utilisés comme colorants pyrotechniques et les oxydants en rouge feux d'artifice et fusées.
Autres utilisations chimiques et industriels

Purification de l'air
Le chlorure de lithium et bromure de lithium sont hygroscopique et sont à desséchants pour les flux de gaz. L'hydroxyde de lithium et peroxyde de lithium sont les sels les plus utilisés dans des espaces confinés, comme à bord engins spatiaux et sous-marins , pour l'élimination du dioxyde de carbone et de purification de l'air. L'hydroxyde de lithium absorbe le dioxyde de carbone de l'air en formant du carbonate de lithium, et est préféré à d'autres hydroxydes alcalins pour son faible poids.
le peroxyde de lithium (Li 2 O 2) en présence d'humidité non seulement absorbe le dioxyde de carbone pour former du carbonate de lithium, mais libère également de l'oxygène. Par exemple:
- 2 Li 2 O 2 + 2 CO 2 → 2 Li 2 CO 3 + O 2.
Certains des composés précités, ainsi que le chlorate de lithium, sont utilisés dans bougies d'oxygène qui fournissent des sous-marins avec l'oxygène .
Optique
Le fluorure de lithium, cultivé artificiellement cristal , est claire et transparente et souvent utilisé en optique spécialiste IR, UV et VUV ( UV dans le vide ) applications. Il possède l'un des plus bas indices de réfraction et la gamme la plus éloignée de transmission dans l'UV profond de la plupart des matériaux courants. Finement divisé de la poudre de fluorure de lithium a été utilisé pour dosimétrie de rayonnement thermoluminescent (DTL): lorsqu'un échantillon de telle est exposé à un rayonnement, il se accumule des défauts cristallins qui, lorsqu'il est chauffé, résolvent l'intermédiaire d'une sortie de lumière bleuâtre dont l'intensité est proportionnelle à la dose absorbée, permettant ainsi à ce être quantifié. Le fluorure de lithium est parfois utilisé dans les lentilles de contact de télescopes .
La non-linéarité élevé de niobate de lithium permet également utiles dans applications de l'optique non linéaire. Il est largement utilisé dans les produits de télécommunication tels que les téléphones mobiles et modulateurs optiques, pour des composants tels que cristaux de résonance. applications au lithium sont utilisées dans plus de 60% des téléphones mobiles.
composés du lithium en chimie organique et polymères
composés d'organolithium sont largement utilisés dans la production de polymère et de produits chimiques fines. Dans l'industrie des polymères, ce qui est le consommateur dominante de ces réactifs, les composés d'alkyl-lithium sont des catalyseurs / des initiateurs. en polymérisation anionique de non fonctionnalisées oléfines . Pour la production de produits de chimie fine, des composés organiques de lithium fonctionnent comme des bases fortes et comme réactifs pour la formation de liaisons carbone-carbone. Composé organolithium sont préparés à partir de lithium métallique et les halogénures d'alkyle.
De nombreux autres composés de lithium sont utilisés en tant que réactifs pour préparer des composés organiques. Des composés appréciés comprennent l'hydrure de lithium-aluminium (LiAlH 4), le triéthylborohydrure de lithium (LiBH (C 2 H 5) 3).
Les applications militaires
Le lithium métallique et son complexe des hydrures, tels que Li [AlH 4] , sont utilisés comme additifs de haute énergie à propergols.

Le Mark 50 Torpedo système de propulsion de l'énergie chimique stockée (de SCEPS) utilise un petit réservoir de l'hexafluorure de soufre gazeux qui est pulvérisée sur un bloc de lithium solide. La réaction génère de la chaleur qui est utilisée pour générer vapeur. La vapeur propulse la torpille dans un endroit fermé Cycle de Rankine.
Nucléaire
Lithium-6 est évalué en tant que matériau de source pour production de tritium et en tant que absorbeur de neutrons dans la fusion nucléaire. Lithium naturel contient environ 7,5% de lithium-6 à partir de laquelle de grandes quantités de lithium-6 ont été produites par la séparation des isotopes pour une utilisation dans des armes nucléaires . Lithium-7 a gagné l'intérêt pour une utilisation dans réacteur nucléaire réfrigérants.

Deutérure de lithium est le combustible de fusion de choix dans les premières versions de la bombe à hydrogène . Lorsqu'il est bombardé par les neutrons , à la fois 6 Li et 7 Li produire tritium - cette réaction, qui ne est pas entièrement comprise à bombes à hydrogène ont d'abord été testés, était responsable pour le rendement de l'emballement Castle Bravo essai nucléaire. Tritium fusionne avec deutérium dans un réaction de fusion qui est relativement facile à réaliser. Bien que les détails restent secrets, le lithium-6 deutérure apparemment encore joue un rôle dans modernes armes nucléaires , en tant que matériau de fusion.
le fluorure de lithium, quand fortement enrichi en isotope lithium-7, forme le constituant basique du mélange de sel de fluorure LIF- BeF 2 utilisé dans liquides réacteurs nucléaires fluorure. Le fluorure de lithium est exceptionnellement chimiquement stable et LiF-BeF deux mélanges ont des points de fusion bas. En outre, 7 Li, Be, et F sont parmi les rares nucléides avec suffisamment bas capture neutronique sections transversales thermiques ne empoisonnent les réactions de fission à l'intérieur d'un réacteur de fission nucléaire.
Dans le nucléaire conceptualisé centrales de fusion, le lithium seront utilisés pour produire du tritium dans réacteurs confinés magnétiquement à l'aide deutérium et de tritium comme combustible. Tritium d'origine naturelle est extrêmement rare et doit être produit par synthèse par la réaction entourant le plasma par une couverture «lithié où les neutrons issus de la réaction de deutérium-tritium dans le plasma seront fission du lithium pour produire plus de tritium:
- 6 Li + n → 4 He + 3 T.
Le lithium est également utilisé comme une source pour des particules alpha, ou d'hélium noyaux. Lorsque 7 Li est bombardé par accélérées protons 8 Be est formée, qui subit une fission pour former deux particules alpha. Cet exploit, appelé «fission de l'atome" à l'époque, était le premier entièrement fait homme- réaction nucléaire. Il a été produit par Cockroft et Walton en 1932. (Les réactions nucléaires et humaine dirigée Transmutation avait été accomplie dès 1917, mais en utilisant le bombardement radioactif naturel avec des particules alpha).
Médecine
Dans le traitement du trouble bipolaire, composés de lithium continuent d'être la norme à laquelle les nouveaux médicaments sont mesurés. Les sels de lithium peuvent également être utiles pour les diagnostics associés, tels que les troubles schizo-affectifs et cyclique dépression majeure. Le principe actif dans ces sels est le lithium-ion Li + , bien que les mécanismes détaillés sont débattues.
Précautions
| NFPA 704 |
|---|
 0 3 2 |
| Le Signe de danger pour le diamant de feu pour le métal lithium |
Le lithium est corrosif et nécessite un traitement spécial pour éviter le contact de la peau. L'inhalation de poussière de lithium ou les composés de lithium (qui sont souvent alcaline) initialement irriter le nez et la gorge, tandis que l'exposition élevée peut provoquer une accumulation de liquide dans les poumons, entraînant un œdème pulmonaire. Le métal lui-même est dangereux pour la manipulation en raison de l' hydroxyde caustique produite quand il est en contact avec l'humidité. Le lithium est stocké en toute sécurité dans les composés non réactifs tels que le naphta.
Il ya eu des suggestions de risque accru de développerune anomalie cardiaque d'Ebstein chez les nourrissons nés de femmes prenant de lithium au cours du premier trimestre de la grossesse.
Réglementation
Certaines juridictions limitent la vente de batteries au lithium, qui sont la source la plus facilement disponible du lithium pour les consommateurs ordinaires. Le lithium peut être utilisé pour réduire la pseudoéphédrine et l'éphédrine à la méthamphétamine dans la méthode de réduction de Birch, qui emploie des solutions de métaux alcalins anhydre dissous dans l'ammoniac . Transport et l'expédition de certains types de batteries au lithium peuvent être interdits à bord de certains types de transport (notamment les avions) en raison de la capacité de la plupart des types de batteries au lithium à pleinement remplir très rapidement lorsque court-circuit, entraînant une surchauffe et possible explosion dans un processus appelé emballement thermique. La plupart des batteries au lithium des consommateurs disposent d'une protection de surcharge thermique intégrée pour prévenir ce type d'incident, ou leur conception limite intrinsèquement courants de court-circuit. Short internes ont été connus pour développer en raison de défauts de fabrication ou de dommages aux batteries qui peuvent conduire à un emballement thermique spontanée.