
Chrome
Saviez-vous ...
SOS Enfants produite ce site pour les écoles ainsi que ce site de vidéo sur l'Afrique . SOS enfants parrainage est cool!
| Chrome | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
24 Cr | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||
métallique argenté  | ||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | du chrome, du Cr, 24 | |||||||||||||||||||||||||||||||||||||||
| Prononciation | / k r oʊ m Je ə m / -Əm de KROH | |||||||||||||||||||||||||||||||||||||||
| Catégorie Metallic | métal de transition | |||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 6, 4, ré | |||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 51,9961 (6) | |||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Ar ] 3d 5 4s 1 2, 8, 13, 1  | |||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||
| Découverte | Louis Nicolas Vauquelin (1797) | |||||||||||||||||||||||||||||||||||||||
| Premier isolement | Louis Nicolas Vauquelin (1798) | |||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 7,19 g · cm -3 | |||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 6,3 g · cm -3 | |||||||||||||||||||||||||||||||||||||||
| Point de fusion | 2180 K , 1907 ° C, 3465 ° F | |||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 2944 K, 2671 ° C, 4840 ° F | |||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 21,0 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 339,5 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 23,35 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 6, 5, 4, 3, 2, 1, -1, -2 (Fortement acide oxyde) | |||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,66 (échelle de Pauling) | |||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 652,9 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||
| 2ème: 1590,6 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||
| 3ème: 2987 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 128 h | |||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 139 ± 17 heures | |||||||||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique centré  | |||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | AFM (plutôt: SDW) | |||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 125 nΩ · m | |||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 93,9 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) de 4,9 um · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 5,940 m · s -1 | |||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 279 GPa | |||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 115 GPa | |||||||||||||||||||||||||||||||||||||||
| Module Bulk | 160 GPa | |||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,21 | |||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 8,5 | |||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 1060 MPa | |||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 1120 MPa | |||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-47-3 | |||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de chrome | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
Le chrome est un élément chimique qui présente le symbole Cr et de numéro atomique 24. Ce est le premier élément en Groupe 6. Ce est un gris d'acier, lustrée, disque métallique qui prend un beau poli et a un point de fusion élevé. Il est également inodore, insipide, et malléable. Le nom de l'élément est dérivé du grec mot "Chroma" (χρώμα), ce qui signifie la couleur , parce que beaucoup de ses composés sont fortement colorée.
L'oxyde de chrome a été utilisé par les Chinois dans la dynastie des Qin , il ya plus de 2000 ans aux armes manteau de métal trouvés avec le Armée de terre cuite. Chrome a été découvert comme un élément après son entrée à l'attention du monde occidental dans le minéral cristallin rouge crocoïte ( plomb (II) chromate), découvert en 1761 et initialement utilisé comme pigment . Louis Nicolas Vauquelin isolé pour la première chrome métallique de ce minéral en 1797. Depuis la première production de Vauquelin de chrome métallique, de petites quantités de maternelle (gratuit) chrome métallique ont été découverts en minéraux rares, mais ceux-ci ne sont pas utilisés dans le commerce. Au lieu de cela, la quasi-totalité de chrome est commercialement extrait du minerai commercialement viable seule chromite, qui est l'oxyde de chrome fer (FeCr 2 O 4). Chromite est également désormais la principale source de chrome pour les pigments de chrome.
Le chrome métal et alliage de ferrochrome sont produit commercialement à partir de chromite par silicothermique ou réactions aluminothermiques, ou par torréfaction et processus de lixiviation. Chrome métallique se est avéré de grande valeur en raison de sa forte corrosion résistance et dureté. Un développement important a été la découverte que l'acier peut être fait très résistant à la corrosion et à la décoloration par l'addition de chrome métallique pour former acier inoxydable. Cette application, avec chromage ( galvanoplastie avec du chrome) comprennent actuellement 85% de l'utilisation commerciale de l'élément, avec des applications pour les composés de chrome formant le reste.
Trivalent de chrome (Cr (III)) ionique est éventuellement nécessaire dans l'état de traces pour le sucre et de lipides métabolisme, bien que la question reste en débat. Dans les grandes quantités et sous différentes formes, le chrome peut être toxique et cancérigène. L'exemple le plus frappant de chrome toxique est de chrome hexavalent (Cr (VI)). Chrome sites de production exigent souvent abandonnés nettoyage de l'environnement.
Caractéristiques
Physique
Le chrome est remarquable pour ses propriétés magnétiques: ce est le seul solide élémentaire qui spectacles ordre antiferromagnétique à la température ambiante (et ci-dessous). Au-dessus de 38 ° C, il se transforme en un état paramagnétique.
Passivation
Chrome métallique laissé au repos dans l'air est passivée par de l'oxygène , en formant une couche de surface mince d'oxyde protectrice. Cette couche est une Structure seulement quelques atomes d'épaisseur de spinelle. Il est très dense, et empêche la diffusion de l'oxygène dans le matériau sous-jacent. Cette barrière est en contraste avec le fer ou aciers carbone brut, où l'oxygène migre dans le matériau sous-jacent et les causes la rouille. La passivation peut être améliorée par un court contact avec acides oxydants comme l'acide nitrique . Passivation au chrome est stable aux acides. L'effet inverse peut être réalisée par traitement avec une forte agent qui détruit la couche protectrice d'oxyde sur le métal réducteur. Le chrome métallique traitée de cette façon se dissout facilement dans les acides faibles.
Le chrome, à la différence des métaux tels que le fer et le nickel, ne souffre pas de la fragilisation par l'hydrogène. Cependant, il souffre d'azote fragilisation, on fait réagir avec de l'azote à partir d'air et formant des nitrures cassants à des températures élevées nécessaires pour travailler des pièces métalliques.
Occurrence


Le chrome est la 24e plus élément abondant dans la croûte de la Terre avec une concentration moyenne de 100 ppm. Les composés de chrome sont présents dans l'environnement, en raison de l'érosion des roches contenant du chrome et peuvent être distribués par des éruptions volcaniques. Les concentrations varient dans le sol est compris entre 1 et 3000 mg / kg, dans l'eau de mer de 5 à 800 ug / litre, et dans les rivières et lacs 26 ug / litre à 5,2 mg / litre. Le chrome est exploité comme chromite (FeCr 2 O 4) minerai. Environ les deux-cinquièmes des minerais et concentrés de chromite dans le monde sont produits en Afrique du Sud , tandis que le Kazakhstan , l'Inde , la Russie et la Turquie sont également des producteurs importants. Dépôts de chromite inexploitées sont nombreuses, mais géographiquement concentrées au Kazakhstan et en Afrique australe.
Bien que rare, de dépôts chrome natif existe. Le Udachnaya tuyaux en Russie produit des échantillons de métal natif. Cette mine est un cheminée de kimberlite, riche en diamants , et de la réduire environnement a aidé à produire à la fois de chrome élémentaire et diamants .
Le rapport entre Cr (III) et Cr (VI) dépend fortement pH et propriétés oxydatives de l'emplacement, mais dans la plupart des cas, le Cr (III) est l'espèce dominante, bien que dans certaines régions l'eau souterraine peut contenir jusqu'à 39 g / litre de chrome total dont 30 ug / litre est présent sous forme de Cr ( VI).
Isotopes
Naturellement chrome se produisant est composé de trois stables isotopes ; 52 Cr, 53 Cr et 54 Cr avec Cr 52 étant le plus abondant (83,789% abondance naturelle). 19 des radio-isotopes ont été caractérisés par le plus stable étant de 50 Cr avec une demi-vie de (plus de) 1,8 × 10 17 ans et 51 Cr avec une demi-vie de 27,7 jours. Tout le reste isotopes radioactifs ont des demi-vies qui sont moins de 24 heures et la majorité d'entre eux ont des demi-vies qui sont moins de 1 minute. Cet élément a aussi 2 méta-Unis.
53 Cr est le produit de désintégration radiogénique de 53 Mn . Chrome isotopiques contenus sont généralement combinés avec manganèse teneurs isotopiques et ont trouvé une application dans géologie isotopique. Mn des rapports isotopiques -cr renforcer les éléments de preuve du 26 Al et 107 Pd pour l'histoire des débuts du système solaire . Les variations de 53 Cr / Cr et 52 rapports Mn / Cr de plusieurs météorites indiquent une 53 Mn / Mn 55 rapport initial qui suggère Mn-Cr composition isotopique doit résulter de la décomposition in situ de 53 Mn dans les corps planétaires différenciées. Ainsi 53 Cr fournit une preuve supplémentaire de processus nucleosynthetic immédiatement avant coalescence du système solaire.
Les isotopes du chrome varient en masse atomique de 43 u (43 Cr) à u 67 (67 Cr). Le primaire mode de désintégration avant l'isotope stable le plus abondant, 52 Cr, est capture d'électrons et le mode primaire après est- la désintégration bêta. 53 Cr a été posé comme un proxy pour la concentration d'oxygène atmosphérique.
Composés
| Oxydation États | |
|---|---|
| -2 | Na 2 [Cr (CO) 5] |
| -1 | Na 2 [Cr 2 (CO) 10] |
| 0 | Cr (C 6 H 6) 2 |
| 1 | K 3 [Cr (CN) 5 NO] |
| 2 | CrCl2 |
| 3 | CrCl3 |
| 4 | K 2 6 CrF |
| 5 | K 3 CrO 8 |
| 6 | K 2 CrO 4 |
Le chrome est un élément des métaux de transition , en 6. groupe chrome (0) a une configuration électronique de 4s 3d 1 5, en raison de l'énergie inférieure de la configuration haut spin. Chrome présente un large éventail de possibles états d'oxydation , où l'Etat 3 est plus stable énergétiquement; les 3 et 6 Etats sont les plus couramment observées dans les composés de chrome, tandis que les 1, 4 et 5 états sont rares.
Ce qui suit est la Diagramme de Pourbaix de chrome dans l'eau pure, l'acide perchlorique ou l'hydroxyde de sodium: 
Le chrome (III)


Un grand nombre de composés du chrome (III) sont connus. Le chrome (III) peut être obtenu par dissolution de chrome élémentaire en acides tels que l'acide chlorhydrique ou l'acide sulfurique . L'ion Cr 3+ a un rayon similaire (63 h) à l'ion Al 3+ (rayon 50 h), de sorte qu'ils peuvent remplacer l'un l'autre dans certains composés, tels que dans l'alun de chrome et alun. Quand une quantité trace de Cr 3+ à Al 3+ remplace corindon (oxyde d'aluminium, Al 2 O 3), la couleur rouge Ruby est formé.
Le chrome ions (III) ont tendance à former complexes octaédriques. Les couleurs de ces complexes est déterminé par les ligands fixés au centre Cr. Le disponible dans le commerce chrome (III) chlorure hydrate est le complexe vert foncé [CrCl 2 (H 2 O) 4] Cl. Composés étroitement apparentés ont des couleurs différentes: vert pâle [CrCl (H 2 O) 5] Cl 2 et la violette [Cr (H 2 O) 6] Cl 3. Si le vert sans eau chrome (III) chlorure est dissous dans l'eau, puis la solution verte vire au violet après un certain temps, en raison de la substitution de l'eau par le chlorure dans la intérieure sphère de coordination. Ce type de réaction est également observée avec des solutions de l'alun de chrome et d'autres sels de chrome soluble dans l'eau (III).
Le chrome (III) hydroxyde (Cr (OH) 3) est amphotères, dissolution dans des solutions acides pour former [Cr (H 2 O) 6] 3+, et dans des solutions basiques pour former [Cr (OH) 6] 3-. Il est déshydraté par chauffage pour former le vert chrome (III) oxyde (Cr 2 O 3), qui est l'oxyde stable avec une structure cristalline identique à celle du corindon .
Le chrome (VI)

Le chrome (VI) sont composés oxydants puissants à pH faible ou neutre. Les plus importants sont anion chromate (CrO 2-
4) et dichromate (Cr 2 O 7 2-) des anions, qui existent en équilibre:
- 2 [CrO 4] 2- + 2 H +
 [Cr 2 O 7] 2- + H 2 O
[Cr 2 O 7] 2- + H 2 O
Chrome (VI) halogénures sont connus et comprennent également la hexafluorure CrF 6 et le chlorure de chromyle (CrO 2 Cl 2).
chromate de sodium est produit industriellement par le grillage oxydante de minerai de chromite de calcium ou le carbonate de sodium. L'espèce dominante est donc, par le loi d'action de masse, déterminée par le pH de la solution. Le changement dans l'équilibre est visible par un changement du jaune (chromate) à l'orange ( bichromate), tel que lorsqu'un acide est ajouté à une solution neutre de chromate de potassium. A des valeurs de pH encore plus bas, outre la formation de condensation plus complexe oxyanions de chrome est possible.
Les deux Dichromate anions sont forts réactifs oxydants à faible pH:

- Cr 2 O 2-
7 + 14 H 3 O + + 6 e - → 2 Cr 3+ + 21 H 2 O (ε 0 = 1,33 V)
Ils sont, cependant, que modérément oxydant à pH élevé:
- CrO 2-
4 + 4 H 2 O + 3 e - → Cr (OH) 3 + 5 OH - (ε 0 = -0,13 V)
Le chrome (VI) en solution peut être détectée par addition d'un acide de peroxyde d'hydrogène une solution. Le bleu foncé instable chrome (VI) peroxyde (CrO 5) est formée, qui peut être stabilisée en tant que produit d'addition éther CrO 5 · OR 2.
Acide chromique a la formule hypothétique H 2 CrO 4. Ce est un produit chimique décrit vaguement, malgré de nombreuses chromates et dichromates bien définies sont connus. Le rouge foncé chrome (VI) oxyde CrO 3, l'acide l'anhydride de l'acide chromique, est vendu industriellement en tant que "l'acide chromique". Il peut être produit en mélangeant de l'acide sulfurique avec du bichromate, et est un agent oxydant fort.
Le chrome (V) et de chrome (IV)
L'état d'oxydation ne est réalisée 5 dans quelques composés sont des intermédiaires, mais dans de nombreuses réactions impliquant des oxydations en chromate. Le seul composé binaire est le chrome volatile (V) de fluorure (CrF 5). Ce solide rouge a un point de 30 ° C de fusion et un point de 117 ° C d'ébullition. Il peut être synthétisé par traitement de chrome métallique avec du fluor à 400 ° C et une pression de 200 bar. Le peroxochromate (V) est un autre exemple de l'état d'oxydation +5. peroxochromate de potassium (K 3 [Cr (O 2) 4]) est réalisée par réaction de chromate de potassium avec du peroxyde d'hydrogène à basse température. Ce composé rouge brun est stable à température ambiante, mais se décompose spontanément à 150-170 ° C.
Les composés de chrome (IV) (dans l'état d'oxydation +4) sont légèrement plus fréquentes que celles de chrome (V). Les tétrahalogénures, CRF 4, CrCl 4, CRBR et 4, peuvent être produits en traitant les trihalogénures CRX (3) avec l'halogène correspondant à des températures élevées. De tels composés sont sensibles à la dismutation des réactions et ne sont pas stables dans l'eau.
Le chrome (II)
Beaucoup chrome composés (II) sont connus, y compris la stabilité à l'eau chrome (II) chlorure, CrCl 2, qui peut être réalisée par réduction du chrome (III) avec le chlorure de zinc. La solution bleu vif résultant ne est stable en position neutre pH. Beaucoup carboxylates chromeux sont également connus, le plus célèbre, le rouge l'acétate chromeux (Cr 2 (O 2 CCH 3) 4), qui dispose d'une liaison quadruple.
Le chrome (I)
La plupart des composés Cr (I) sont obtenus par oxydation de riche en électrons, octaédriques Cr (0) complexes. Autres Cr (I) complexes contiennent ligands cyclopentadiényle. Tel que vérifié par Diffraction des rayons X, un Cr-Cr Liaison quintuple (longueur 183,51 (4) h) a également été décrite. Extrêmement ligands monodentés encombrants stabiliser ce composé en protégeant le lien quintuple partir d'autres réactions.
Le chrome (0)
Beaucoup de chrome (0) composés sont connus. La plupart sont des dérivés de chrome ou hexacarbonyle bis (benzène) chrome.
Histoire
Armes trouvées dans des fosses funéraires datant de la fin du 3ème siècle avant JC dynastie Qin de la Armée de terre cuite près Xi'an, la Chine ont été analysés par les archéologues. Bien enterré il ya plus de 2000 ans, l'ancienne conseils de bronze de carreaux d'arbalète et épées trouvées sur le site ont montré de manière inattendue peu de corrosion, peut-être parce que le bronze a été délibérément recouverte d'une fine couche d'oxyde de chrome. Cependant, cette couche d'oxyde métallique ou de chrome était pas chromage comme nous le savons.
minéraux de chrome que les pigments sont venus à l'attention de l'Occident au 18ème siècle. Le 26 Juillet 1761 Johann Gottlob Lehmann trouvé un minéral rouge-orange dans le Beryozovskoye mines dans le Oural qu'il nomme fil rouge de Sibérie. Bien à tort comme un plomb composé avec sélénium et fer composants, le minéral était en fait crocoïte ( chromate de plomb) avec une formule de PbCrO 4.
En 1770, Peter Simon Pallas a visité le même site que Lehmann et a trouvé un minéral de fil rouge qui avait des propriétés utiles en tant que pigment dans les peintures. L'utilisation du plomb rouge de Sibérie, un pigment de peinture, puis se est développée rapidement. Un lumineux pigment jaune à base de crocoïte également devenu à la mode.

En 1797, Louis Nicolas Vauquelin a reçu des échantillons de crocoïte minerai. Il produit le trioxyde de chrome (CrO 3) en mélangeant crocoïte avec de l'acide chlorhydrique . En 1798, Vauquelin découvrit qu'il pouvait isoler chrome métallique en chauffant l'oxyde dans un four à charbon de bois, faisant de lui le découvreur de l'élément. Vauquelin était également capable de détecter des traces de chrome dans précieuse pierres précieuses, telles que rubis ou émeraude.
Pendant les années 1800, le chrome a été principalement utilisé comme un composant des peintures et sels de tannage. Dans un premier temps, crocoïte de la Russie était la source principale, mais en 1827, un dépôt de chromite plus grande a été découvert près Baltimore, Etats-Unis . Cela a rendu les Etats-Unis le plus grand producteur de produits de chrome jusqu'à 1848, lorsque d'importants gisements de chromite ont été trouvés près Bursa, Turquie .
Le chrome est également connu pour son lustre lorsque poli. Il est utilisé comme un revêtement protecteur et décoratif sur les pièces de voiture, accessoires de plomberie, pièces de meubles et de nombreux autres articles, généralement appliqué par électrodéposition. Chrome a été utilisé pour la galvanoplastie dès 1848, mais cette utilisation ne se est répandue avec le développement d'un procédé amélioré en 1924.
alliages métalliques représentent désormais 85% de l'utilisation de chrome. Le reste est utilisé dans le industrie chimique et réfractaire et industries de fonderie.
Production

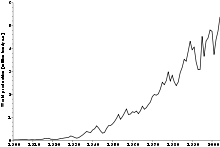

Environ 4,4 millions de tonnes de minerai de chromite commercialisables ont été produites en 2000, et convertis en ~ 3,3 millions de tonnes de ferro-chrome avec une valeur de marché d'environ 2,5 milliards de dollars des États-Unis . Les principaux producteurs de minerai de chrome ont été l'Afrique du Sud (44 de%) l'Inde (18%), le Kazakhstan (16%) du Zimbabwe (5%), la Finlande (4%) l'Iran (4%) et le Brésil (2%) avec plusieurs autres pays producteurs le reste de moins de 10% de la production mondiale.
Les deux principaux produits de minerai de chrome sont le raffinage ferrochrome et chrome métallique. Pour ces produits, le processus de fonderie de minerai diffère considérablement. Pour la production de ferrochrome, le minerai de chromite (FeCr 2 O 4) est réduite à grande échelle dans Four à arc électrique ou dans les petites fonderies avec soit l'aluminium ou le silicium dans un réaction aluminothermique.

Pour la production de chrome pur, le fer doit être séparé du chrome dans un procédé en deux étapes de grillage et lixiviation. Le minerai de chromite est chauffé avec un mélange de carbonate de calcium et carbonate de sodium en présence d'air. Le chrome est oxydé en la forme hexavalent, le fer pendant qu'il fait l'écurie Fe 2 O 3. La lixiviation ultérieure à des températures supérieures élevées dissout le chromates et laisse l'oxyde de fer insoluble. Le chromate est converti par l'acide sulfurique dans le dichromate.
- 4 FeCr 2 O 4 + 8 Na 2 CO 3 + O 2 → 7 8 Na 2 CrO 4 2 + Fe 2 O 3 + 8 CO 2
- 2 Na 2 CrO 4 + H 2 SO 4 → Na 2 Cr 2 O 7 + Na 2 SO 4 + H 2 O
Le dichromate est converti en l'oxyde de chrome (III) par réduction avec du carbone et ensuite réduit dans une réaction aluminothermique de chrome.
- Na 2 Cr 2 O 7 + 2 C → Cr 2 O 3 + Na 2 CO 3 + CO
- Cr 2 O 3 + 2 Al → Al 2 O 3 + Cr 2
Applications
Métallurgie

L'effet de renforcement de la formation des carbures métalliques stables dans les joints de grains et de la forte augmentation de la résistance à la corrosion de chrome fait un matériau d'alliage important pour l'acier. Le aciers à outils à haute vitesse contiennent entre 3 et 5% de chrome. Acier inoxydable, la principale alliage métallique résistant à la corrosion, est formé lorsque chrome est ajouté à fer à des concentrations suffisantes, généralement au-dessus de 11%. Pour sa formation, ferrochrome est ajouté au fer en fusion. Aussi augmenter les alliages à base de nickel de la résistance due à la formation de particules discrètes, stables carbure de métal aux joints de grains. Par exemple, Inconel 718 contient 18,6% de chrome. En raison des excellentes propriétés à haute température de ces nickel superalliages, ils sont utilisés dans les moteurs à réaction , et turbines à gaz au lieu des matériaux structurels communs.
La haute dureté et résistance à la corrosion relative de chrome non allié en fait un bon revêtement de surface, étant toujours le plus revêtement métallique "populaire" avec une durabilité inégalée combinée. Une fine couche de chrome est déposée sur les surfaces métalliques prétraitées par des techniques de galvanoplastie. Il existe deux méthodes de dépôt: Mince, ci-dessous 1 um d'épaisseur, les couches sont déposées par chromage, et sont utilisés pour les surfaces décoratives. Si les surfaces résistantes à l'usure sont nécessaires alors plus épaisses couches de chrome sont déposés. Les deux méthodes utilisent normalement chromate acide ou solutions dichromate. Pour éviter le changement consommant de l'énergie dans l'état d'oxydation, l'utilisation de sulfate de chrome (III) est en cours de développement, mais pour la plupart des applications, le processus établi est utilisé.
Dans le Procédé de revêtement par conversion de chromate, les propriétés fortement oxydantes de chromates sont utilisés pour déposer une couche protectrice d'oxyde sur des métaux comme l'aluminium, le zinc et le cadmium. Cette passivation et les propriétés auto-cicatrisantes par le chromate stocké dans le revêtement de conversion au chromate, qui est capable de migrer vers défauts locaux, sont les avantages de cette méthode de revêtement. En raison de réglementations environnementales et sanitaires sur les chromates, procédé de revêtement de remplacement sont en cours de développement.
L'anodisation de l'aluminium est un autre procédé électrochimique, ce qui ne entraîne pas le dépôt de chrome, mais utilisations l'acide chromique comme électrolyte dans la solution. Au cours de l'anodisation, une couche d'oxyde est formée sur l'aluminium. L'utilisation de l'acide chromique, à la place de l'acide sulfurique normalement utilisé, conduit à une légère différence de ces couches d'oxyde. La toxicité élevé de Cr (VI), utilisé dans le procédé galvanique de chrome établie, et le renforcement de la sécurité et réglementations environnementales exigent une recherche de substituts pour chrome ou au moins un changement au chrome moins toxique (III) de composés.
Teintures et de pigments

Le minéral crocoïte ( chromate de plomb PbCrO 4) a été utilisé comme pigment jaune peu de temps après sa découverte. Après un procédé de synthèse est devenue disponible à partir de la chromite plus abondante, le jaune de chrome était, avec le jaune de cadmium, un des pigments jaunes plus utilisés. Le pigment ne pas photodégradation, mais il a tendance à se assombrir en raison de la formation de chrome (III) de l'oxyde de. Il a une couleur forte, et a été utilisé pour les autobus scolaires aux États-Unis et pour le service postal (par exemple Deutsche Post) en Europe. L'utilisation de jaune de chrome diminué en raison de préoccupations environnementales et de sécurité et a été remplacé par des pigments organiques ou alternatives exempt de plomb et le chrome. D'autres pigments à base de chrome sont, par exemple, le pigment rouge vif rouge de chrome, qui est un chromate de plomb basique (PbCrO 4 · Pb (OH) 2). Un pigment de chromate très important, qui a été largement utilisé dans les formulations d'apprêt métallique est le chromate de zinc, maintenant remplacé par du phosphate de zinc. Une amorce de lavage a été formulé de manière à remplacer la pratique dangereuse pour le prétraitement d'organes d'avions d'aluminium avec une solution d'acide phosphorique. Cette tetroxychromate de zinc utilisé en dispersion dans une solution de polyvinylbutyral. Une solution à 8% d'acide phosphorique dans un solvant a été ajouté juste avant l'application. Il a été constaté que l'alcool facilement oxydé est un ingrédient essentiel. Une mince couche d'environ 10 à 15 um a été appliquée, qui se est du jaune au vert foncé quand il a été guéri. Il ya encore une question sur le mécanisme exact. Vert Chrome est un mélange de Bleu de Prusse et jaune de chrome, tandis que le vert d'oxyde de chrome est de chrome (III) de l'oxyde.
oxydes de chrome sont également utilisés en tant que couleur verte en verrerie et en tant que vernis en céramique. Vert d'oxyde de chrome est extrêmement stable à la lumière et à ce titre est utilisé dans les revêtements de gaine. Ce est aussi l'ingrédient principal dans IR reflétant peintures, utilisés par les forces armées, à peindre des véhicules, de leur donner la même réflectance IR que les feuilles vertes.
Rubis synthétique et le premier laser
Naturel rubis sont corindon (oxyde d'aluminium) de cristaux qui sont de couleur rouge (le type le plus rare) en raison des ions chrome (III) (autres couleurs de gemmes de corindon sont appelées saphirs). Un rubis synthétique de couleur rouge peut également être obtenue par dopage de chrome (III) en cristaux de corindon artificiel, ce qui rend une exigence de chrome pour la fabrication de rubis synthétiques. Un tel cristal de rubis synthétique était la base pour la première laser , produit en 1960, qui se appuyait sur l'émission stimulée de lumière à partir des atomes de chrome dans un tel cristal.
Conservateur bois
En raison de leur toxicité, le chrome (VI) les sels sont utilisés pour la protection du bois. Par exemple, arséniate de cuivre chromaté (ACC) est utilisé dans le traitement du bois à protéger le bois contre les champignons pourriture, insectes de bois attaquer, y compris les termites et les xylophages marins. Les formulations contiennent du chrome sur la base de l'oxyde CrO 3 entre 35,3% et 65,5%. Aux États-Unis, 65 300 tonnes métriques de solution CCA ont été utilisés en 1996.
Bronzage
Chrome (III), en particulier des sels l'alun de chrome et sulfate de chrome (III), sont utilisés dans la tannage de cuir. Le chrome (III) stabilise le cuir par la réticulation les fibres de collagène. Le chrome cuir tanné peut contenir entre 4 et 5% de chrome, qui est étroitement liée aux protéines. Bien que la forme de chrome utilisé pour le bronzage ne est pas la variété hexavalent toxique, il reste intérêt dans la gestion de chrome dans l'industrie du tannage comme la récupération et la réutilisation, le recyclage direct / indirect, utilisation de moins de chrome ou "chrome-moins" bronzage sont pratiquées de mieux gérer le chrome dans le tannage.
Matériau réfractaire
La résistance à la chaleur élevée et point de fusion élevé marques chromite et de chrome (III) de l'oxyde d'un matériau pour des applications réfractaires à haute température, comme les hauts fourneaux, du ciment fours, moules pour les tirs de briques et de sables de fonderie que pour le coulée de métaux. Dans ces applications, les matériaux réfractaires sont fabriqués à partir des mélanges de la chromite et de la magnésite. L'utilisation diminue en raison de la réglementation de l'environnement en raison de la possibilité de la formation de chrome (VI).
Catalyseurs
Plusieurs composés de chrome sont utilisés comme catalyseurs pour le traitement des hydrocarbures. Par exemple, le Catalyseurs de Phillips pour la production de sont des mélanges de polyethylene chrome et de dioxyde de silicium ou des mélanges de chrome et titane et l'oxyde d'aluminium . Fe-Cr oxydes mixtes sont utilisées comme catalyseurs à haute température pour la réaction de déplacement du gaz à l'eau. le chromite de cuivre est un utile hydrogénation catalytique.
Autre utilisation
- Le chrome (IV) oxyde (CrO 2) est un magnétique composé. Sa forme idéale anisotropie, qui confère haute coercivité et aimantation rémanente, ont fait un composé supérieure à la γ-Fe 2 O 3. Le chrome (IV) oxyde est utilisé pour la fabrication bande magnétique utilisé dans la bande audio de haute performance et de la norme cassettes audio. Chromates peuvent empêcher la corrosion de l'acier dans des conditions humides, et donc chromates sont ajoutés à boues de forage.
- Le chrome (III) oxyde est un vernis métallique connu comme rouge vert.
- L'acide chromique est un agent oxydant puissant et est un composé utile pour nettoyer la verrerie de laboratoire de toute trace de composés organiques. Il est préparé in situ par dissolution le bichromate de potassium dans de l'acide sulfurique concentré, qui est ensuite utilisé pour laver l'appareil. le dichromate de sodium est parfois utilisé en raison de sa solubilité plus élevée (50 g / L par rapport à 200 g / L respectivement). Le dichromate de potassium est une substance chimique réactif, utilisé pour le nettoyage verrerie de laboratoire et comme agent de titrage. Il est également utilisé en tant que mordant (à savoir un agent de fixation) dans le tissu pour les colorants.
Rôle biologique
Le chrome trivalent (Cr (III) ou Cr 3+) se produit dans l'état de traces dans les aliments et les eaux, et semble être bénigne. En revanche, chrome hexavalent (Cr (VI) ou Cr 6+) est très toxique et mutagène lorsqu'il est inhalé. Cr (VI) n'a pas été établie comme cancérogène lorsqu'il est en solution, même si elle peut provoquer allergique dermatite de contact (ACD).
la carence en chrome, impliquant un manque de Cr (III) dans le corps, ou peut-être un complexe de celui-ci, tel que facteur de tolérance au glucose est controversée, ou est au moins extrêmement rare. Chrome a pas vérifié rôle biologique et a été classé par certains comme pas essentiel pour les mammifères. Toutefois, d'autres critiques ont considéré comme un oligo-élément essentiel pour les humains.

carence en chrome a été attribué à seulement trois personnes sur le long terme la nutrition parentérale, qui est quand un patient est alimenté par une alimentation de liquide perfusions pendant de longues périodes de temps.
Bien qu'aucun rôle biologique pour le chrome n'a jamais été démontrée, compléments alimentaires pour le chrome comprennent Picolinate de chrome (III), chrome (III) polynicotinate, et des matières connexes. L'avantage de ces suppléments est interrogé par certaines études. L'utilisation de compléments alimentaires contenant du chrome est controversée, en raison de l'absence de tout rôle vérifié biologique, la charge de ces suppléments, et les effets complexes de leur utilisation. Le complément alimentaire populaire complexe de picolinate de chrome génère dommages chromosomiques dans des cellules de hamster (en raison du ligand picolinate). Aux États-Unis les directives diététiques pour l'absorption quotidienne de chrome ont été abaissés en 2001 de 50 à 200 pg pour un adulte de 35 ug (mâles adultes) et de 25 ug (femelle adulte).
Précautions
Eau de chrome (III) insoluble et composés de chrome métal ne sont pas considérés comme un danger pour la santé, alors que la toxicité et les propriétés cancérigènes de chrome (VI) sont connus depuis longtemps. Parce que des mécanismes de transport spécifiques, que des quantités limitées de chrome (III) pénètrent dans les cellules. Plusieurs études in vitro ont indiqué que des concentrations élevées de chrome (III) dans la cellule peuvent conduire à des dommages de l'ADN. Toxicité aiguë par voie orale est comprise entre 1,5 et 3,3 mg / kg. Les effets bénéfiques proposées de chrome (III) et l'utilisation comme suppléments diététiques ont donné des résultats controversés, mais les récentes critiques suggèrent que l'absorption modérée de chrome (III) par des suppléments alimentaires ne présente aucun risque.
Cr (VI)
Le aiguë oral la toxicité pour le chrome (VI) est comprise entre 50 et 150 ug / kg. Dans le corps, le chrome (VI) est réduit par plusieurs mécanismes de chrome (III) déjà dans le sang avant qu'il ne pénètre dans les cellules. Le chrome (III) est excrété par le corps, tandis que l'ion chromate est transféré dans la cellule par un mécanisme de transport, et par lequel le sulfate et des ions phosphates entrent dans la cellule. La toxicité aiguë du chrome (VI) est due à son fort oxidational propriétés. Après avoir atteint le flux sanguin, il endommage les reins, le foie et les cellules sanguines par des réactions d'oxydation. Hémolyse, rénale et d'insuffisance hépatique sont les résultats de ces dommages. Dialyse agressif peut améliorer la situation.
Le cancérogène des poussières de chromate est connu depuis longtemps, et en 1890 la première publication décrit le risque de cancer élevé de travailleurs dans une entreprise de teinture chromate. Trois mécanismes ont été proposés pour décrire la génotoxicité de chrome (VI). Le premier mécanisme comprend fortement réactif les radicaux hydroxyle et les autres radicaux réactifs qui sont produits par de la réduction du chrome (VI) en chrome (III). Le second procédé comprend la liaison directe du chrome (V), obtenue par réduction dans la cellule, et de chrome (IV) des composés de l' ADN . Le dernier mécanisme a attribué la génotoxicité pour la liaison à l'ADN du produit de la (III) la réduction du chrome final.
Les sels de chrome (chromates) sont aussi la cause de réactions allergiques chez certaines personnes. Chromates sont souvent utilisés pour fabriquer, entre autres, des produits en cuir, les peintures, le ciment, mortier et anti-corrosifs. Le contact avec des produits contenant des chromates peuvent conduire à des allergiques dermatite de contact et la dermatite irritante, résultant en une ulcération de la peau, parfois appelés «ulcères chrome". Cette condition est souvent trouvé chez les travailleurs qui ont été exposés à des solutions de chromate fortes dans la galvanoplastie, de bronzage et les fabricants de chrome-production.
Problèmes environnementaux
Comme composés de chrome ont été utilisés dans colorants et peintures et le tannage de cuir, ces composés sont souvent trouvés dans le sol et eaux souterraines sur les sites industriels abandonnés, maintenant besoin nettoyage de l'environnement et assainissement pour le traitement de friches industrielles. Apprêt de peinture contenant du chrome hexavalent est encore largement utilisé pour aérospatiale et automobile finition applications.
En 2010, le Environmental Working Group a étudié l'eau potable dans 35 villes américaines. L'étude était la première analyse nationale mesurer la présence de la substance chimique dans les systèmes d'eau des États-Unis. L'étude a révélé mesurables chrome hexavalent dans l'eau du robinet de 31 des villes de l'échantillon, avec Norman, Oklahoma, au sommet de la liste; 25 villes avaient des niveaux qui dépassent la limite proposée de la Californie. Remarque: Les concentrations de Cr (VI) aux États-Unis municipales d'approvisionnement en eau potable rapportés par EWG sont dans, les niveaux de fond naturels probables pour les domaines testés et ne préjugent pas de la pollution industrielle (CalEPA Fiche), comme l'affirme EWG. Ce facteur n'a pas été pris en considération dans leur rapport.
