
Platine
Renseignements généraux
SOS croit que l'éducation donne une meilleure chance dans la vie des enfants dans le monde en développement aussi. enfants SOS est le plus grand don de charité du monde enfants orphelins et abandonnés la chance de la vie familiale.
| Platine | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
78 Pt | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||
blanc grisâtre  | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | platine, Pt, 78 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / p l æ t ɨ n ə m / | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | métal de transition | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 10, 6, ré | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 195,084 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Xe ] 4f 14 5d 9 6s 1 2, 8, 18, 32, 17, 1 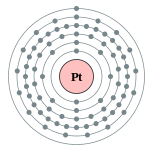 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Antonio de Ulloa (1735) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Antonio de Ulloa (1735) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 21,45 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 19,77 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 2041,4 K , 1768,3 ° C, 3214,9 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 4098 K, 3825 ° C, 6917 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 22,17 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 469 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 25,86 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 6, 5, 4, 3, 2, 1, -1, -2, -3 (Légèrement oxyde de base) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 2,28 (échelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 870 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1791 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 139 h | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 136 ± 17 heures | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 175 h | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique à faces centrées  | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 105 nΩ · m | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 71,6 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) de 8,8 um · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | ( rt) 2800 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistance à la traction | 125-240 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 168 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 61 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 230 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,38 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 4-4,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Vickers | 549 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté Brinell | 392 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-06-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de platine | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Le platine est un élément chimique avec le symbole chimique Pt et un numéro atomique de 78.
Son nom est dérivé du platine terme espagnol, qui se traduit littéralement en «peu d'argent". Ce est un dense , malléable, ductile, précieux, gris-blanc métal de transition .
Platinum a six naturellement isotopes . Ce est l'un des éléments les plus rares de la croûte de la Terre et a une abondance moyenne d'environ 5 ug / kg. C'est le métal moins réactif. Il se produit dans certains nickel et de cuivre minerais avec certains dépôts indigènes, principalement en Afrique du Sud , qui représente 80% de la production mondiale.
En tant que membre de la groupe du platine d'éléments, ainsi que du groupe 10 du tableau périodique des éléments , le platine est généralement non réactif. Il présente une résistance remarquable à la corrosion, même à haute température, et en tant que tel est considéré comme un métal noble. En conséquence, le platine se trouve souvent non combiné chimiquement que le platine natif. Parce qu'il se trouve naturellement dans le sables alluvionnaires de diverses rivières, il a été utilisé la première fois par indigènes d'Amérique du Sud précolombienne pour produire des artefacts. Il a été mentionné dans les écrits européens dès 16e siècle, mais ce ne est que Antonio de Ulloa a publié un rapport sur un nouveau métal du colombienne origine en 1748 qu'il se est étudié par les scientifiques.
Le platine est utilisé en convertisseurs catalytiques, équipement de laboratoire, électriques et contacts électrodes, Les thermomètres à résistance de platine, équipement de dentisterie, et des bijoux. Parce que seulement quelques centaines de tonnes sont produites chaque année, ce est un matériau rare, et est très précieux et est un important denrée précieuse en métal. Être un métaux lourds, elle conduit à des problèmes de santé lors d'une exposition à ses sels, mais en raison de sa résistance à la corrosion, il ne est pas aussi toxiques que certains métaux. Les composés contenant du platine, et plus particulièrement cisplatine, sont appliqués en la chimiothérapie contre certains types de cancer.
Caractéristiques
Physique
En tant que métal pur, le platine est blanc argenté en couleurs, brillant, ductile et malléable. Le platine est plus ductile que l'or, l'argent et le cuivre, étant ainsi la plus ductile de métaux purs, mais l'or est encore plus malléable que le platine. Il ne se oxyde pas à toute température, bien qu'il soit corrodé par des halogènes , cyanures, soufre et caustique alcalis. Le platine est insoluble dans chlorhydrique et l'acide nitrique , mais se dissout dans l'eau chaude l'eau régale pour former l'acide chloroplatinique H 2 PtCl 6.
La résistance à l'usure et Platinum ternissement est bien adapté pour faire bien des bijoux . Le métal a une excellente résistance à la corrosion et à haute température et a des propriétés électriques stables. Toutes ces caractéristiques ont été utilisés pour des applications industrielles.
Chimique

Les plus communs des états d'oxydation du platine sont deux et quatre. Les états d'oxydation 1 et 3 sont plus rares et sont souvent stabilisés par liaison métallique en espèces bimétalliques (ou polymétalliques). Comme cela est attendu, le platine tétracoordonné composés (II) tendent à adopter des 16 électrons carrés géométries planes. Bien platine élémentaire est généralement non réactif, il se dissout dans l'eau régale chaud pour donner aqueuse l'acide chloroplatinique (H 2 PtCl 6):
- Pt + 4 HNO 3 + 6 HCl → H 2 PtCl 6 + 4 NO 2 + 4 H 2 O
Comme un douce et acide, le platine a une grande affinité pour le soufre, comme sur le sulfoxyde de diméthyle (DMSO); de nombreux complexes de DMSO ont été signalés et les soins devraient être prises dans le choix du solvant de réaction.
Isotopes
Platinum a six naturellement isotopes : 190 Pt, Pt 192, Pt 194, Pt 195, Pt 196 et 198 Pt. Le plus abondantes de ces derniers est 195 Pt, comprenant 33,83% de l'ensemble platine. Ce est le seul isotope stable avec un spin non nul; avec un spin de 1/2, 195 Pt pics satellites sont souvent observées dans 1 H et 31 P spectroscopie RMN (c.-à-Pt-phosphine et complexes Pt-alkyle). Pt 190 est la moins abondante à seulement 0,01%. Parmi les isotopes naturels, seuls 190 Pt est instable, même se il se désintègre avec une demi-vie de 6,5 × 10 11 ans. Pt 198 peut subir désintégration alpha, mais son déclin ne avaient jamais été observées (la demi-vie est connu pour être plus longue que 3,2 × 10 14 ans), il est donc considéré comme stable. Le platine a également 31 isotopes synthétiques dans la masse atomique allant de 166 à 202, ce qui rend le nombre total des isotopes connus 37. L'moins stable de ceux-ci est Pt 166 avec une demi-vie de 300 us, tandis que la plus stable est 193 Pt avec un demi-vie de 50 ans. La plupart platine isotopes se désintègrent par une combinaison de désintégration bêta et la désintégration alpha. 188 Pt, Pt 191, et 193 Pt carie principalement par capture électronique. 190 Pt et Pt 198 ont doubles voies de désintégration bêta.
Occurrence

Le platine est un métal extrêmement rare, se produisant à une concentration de seulement 0,005 ppm dans la Terre de la croûte . Il est parfois confondu avec l'argent (Ag). Platinum est souvent trouvé non combiné chimiquement que le platine natif et allié à l'iridium comme platiniridium. Le plus souvent le platine natif se trouve dans les dépôts secondaires; le platine est combiné avec les autres métaux du groupe du platine dans alluvions. Les dépôts alluviaux utilisés par les pré-colombiennes dans le Le département du Chocó, en Colombie sont toujours une source pour les métaux du groupe du platine. Un autre grand dépôt alluvial est dans le Oural, la Russie, et il est encore exploité.
Dans nickel et cuivre dépôts, des métaux du groupe du platine se produisent en tant que sulfures (par exemple (Pt, Pd) S), tellurures (par exemple), PtBiTe antimoniures (PDSB), et arséniures (par exemple PTAS 2), et que les alliages de gamme avec le nickel ou le cuivre. Platine arséniure, sperrylite (APE) 2, est une source importante de platine associé à minerais de nickel dans le Dépôt du bassin de Sudbury en L'Ontario, Canada . À Platinum, Alaska, à environ 545 000 onces troy avaient été extraites entre 1927 et 1975. La mine a cessé ses activités en 1990. Les rares sulfure minérale cooperite, (Pt, Pd, Ni) S, contient du platine en même temps que le palladium et le nickel. Cooperite se produit dans le Merensky Reef dans le Complexe Bushveld, Gauteng, Afrique du Sud .
En 1865, chromites ont été identifiés dans la région du Bushveld en Afrique du Sud, suivie par la découverte de platine en 1906. Les plus grandes réserves connues primaires sont dans le Complexe Bushveld en Afrique du Sud . Les grands gisements de cuivre-nickel proximité Norilsk en Russie , et de la Bassin de Sudbury, au Canada , sont les deux autres grands gisements. Dans le bassin de Sudbury, les énormes quantités de minerai de nickel transformés représentent le fait de platine est présent en tant que de 0,5 ppm dans le minerai. Les petites réserves peuvent être trouvés dans les États-Unis, par exemple dans le Chaîne Absaroka dans Montana. En 2010, l'Afrique du Sud était le premier producteur de platine, avec une part de près de 77%, suivie par la Russie à 13%; la production mondiale en 2010 était de 192000 kg.
dépôts de platine sont présents à l'état de Tamil Nadu, en Inde . et un protocole d'entente a été signé entre Commission géologique de l'Inde avec Tamin - Tamil Nadu Minerals Ltd.
Platinum existe en plus grande abondance sur la Lune et dans les météorites. En conséquence, le platine se trouve dans l'abondance légèrement plus élevés sur les sites de bolide impact sur la Terre qui sont associés à résultant après l'impact du volcanisme, et peuvent être exploitées de façon économique; la Bassin de Sudbury en est un exemple.
Composés
Halogénures
L'acide hexachloroplatinique mentionné ci-dessus est probablement le composé de platine plus importante, car elle sert de précurseur pour de nombreux autres dérivés du platine. Par lui-même, il a de nombreuses applications dans la photographie, gravures de zinc, l'encre indélébile, le placage, les miroirs, la coloration de la porcelaine, et en tant que catalyseur.
Le traitement de l'acide hexachloroplatinique avec un sel d'ammonium, tel que le chlorure d'ammonium, donne hexachloroplatinate d'ammonium, qui est relativement insoluble dans les solutions d'ammonium. Le chauffage de ce sel d'ammonium en présence d'hydrogène, il se réduit à platine élémentaire. Hexachloroplatinate de potassium insoluble est de manière similaire, l'acide hexachloroplatinique et a été utilisé dans la détermination des ions potassium par gravimétrie.
Lorsque l'acide hexachloroplatinique est chauffé, il se décompose par de platine (IV) et du chlorure de platine (II) chlorure de platine élémentaire, bien que les réactions ne se produisent pas à pas:
- (H 3 O) 2 PtCl 6 · nH 2 O
 PtCl 4 + 2 HCl + (n + 2) H 2 O
PtCl 4 + 2 HCl + (n + 2) H 2 O - PtCl4
 PtCl2 + Cl 2
PtCl2 + Cl 2 - 2 PtCl
 Pt + Cl 2
Pt + Cl 2
Les trois réactions sont réversibles. Platine (II) et platine (IV) sont connus comme les bromures bien. Platinum hexafluorure est un oxydant fort capable de oxygène oxydant.
Oxydes
Platinum (IV) oxyde, PtO 2, également connu sous le nom Le catalyseur d'Adams, est une poudre noire qui est soluble dans Solutions de KOH et des acides concentrés. PtO 2 et la prise de force à la fois moins fréquente décomposer lorsqu'elle est chauffée. Platine (II, IV) oxyde, Pt 3 O 4, est formée dans la réaction suivante:
- 2 Pt 2+ + Pt 4+ + 4 O 2- → Pt 3 O 4
Platine forme également une trioxyde, où il est présent à l'état d'oxydation +4.
D'autres composés
Contrairement à l'acétate de palladium, de platine (II) acétate d'éthyle ne est pas disponible dans le commerce. Lorsque l'on désire une base, les halogénures ont été utilisées en conjonction avec l'acétate de sodium. L'utilisation de platine (II) acétylacétonate a également été rapportée.
Plusieurs platinides de baryum ont été synthétisés dans lequel le platine présente des états d'oxydation négatifs allant de -1 à -2. Il se agit notamment Bapt, Ba 3 Pt 2, et Ba 2 Pt. Platinide césium, Cs 2 Pt, un composé cristallin transparent rouge foncé a été montré pour contenir Pt 2-
anions. Platinum présente également les états d'oxydation négatifs sur des surfaces réduites par voie électrochimique. Les états d'oxydation négatifs exposés par le platine sont inhabituels pour les éléments métalliques, et ils sont attribués à la stabilisation relativiste de les 6s orbitales.
Le sel de Zeise, contenant un éthylène ligand, était l'un des premiers composés organométalliques découverts. Dichloro (cycloocta-1,5-diène) platine (II) disponible dans le commerce est une oléfine complexe, qui contient facilement déplaçable ligands morue ("de la morue" étant une abréviation de 1,5-cyclooctadiène). Le complexe de la morue et les halogénures sont des points de départ commodes à la chimie de platine.
Cisplatine, cis ou -diamminedichloroplatinum (II) est le premier d'une série de carrés plane platine (II) contenant des médicaments de chimiothérapie, y compris carboplatine et l'oxaliplatine. Ces composés sont capables de réticulation ADN , et tuer les cellules par des voies semblables à alkylant agents chimiothérapeutiques.

L'ion hexachloroplatinate

L'anion du sel de Zeise

Dichloro (cycloocta-1,5-diène) platine (II)

Cisplatine
Histoire
Le métal a été utilisé par Américains précolombiens près de moderne-jour Esmeraldas, en Equateur pour produire des artefacts d'un blanc alliage or-platine. La première référence européenne au platine apparaît en 1557 dans les écrits de l' italien humaniste Jules César Scaliger comme une description d'un métal noble inconnu trouvé entre Darién et le Mexique », qui sans feu ni aucun artifice espagnol a encore été en mesure de liquéfier."


En 1741, Charles Wood, Colombie métallurgiste , a trouvé divers échantillons de platine colombienne en Jamaïque, qu'il envoya à William Brownrigg pour complément d'enquête. Antonio de Ulloa, également crédité de la découverte de platine, est retourné en Espagne à partir de la Mission de géodésique français en 1746 après avoir été pendant huit ans. Son récit historique de l'expédition comprenait une description de platine comme ne étant ni séparables, ni calcinable. Ulloa prévoit également la découverte de mines de platine. Après la publication du rapport en 1748, Ulloa n'a pas continuer à enquêter sur le nouveau métal. En 1758, il a été envoyé pour surveiller les opérations minières de mercure dans Huancavelica.
En 1750, après avoir étudié le platine envoyé à lui par Wood, Brownrigg a présenté un compte rendu détaillé du métal à la Royal Society, mentionnant qu'il avait vu aucune mention dans les comptes antérieurs de minéraux connus. Brownrigg également note de très haut point de fusion et réfractaire de platine vers borax. Autres chimistes à travers l'Europe ont commencé à étudier dès platine, y compris Andreas Sigismund Marggraf Torbern Bergman, Jöns Jakob Berzelius, William Lewis, et Pierre Macquer. En 1752, Henrik Scheffer a publié une description scientifique détaillée du métal, qu'il appelle «l'or blanc», y compris un compte de la façon dont il a réussi à fondre le minerai de platine avec l'aide de l'arsenic . Scheffer décrit platine comme étant moins souple que l'or, mais avec une résistance similaire à la corrosion.
Carl von Sickingen platine de recherches poussées en 1772. Il a réussi à faire platine malléable par alliage d'or, dissoudre l'alliage dans l'eau régale chaude, la précipitation de la platine avec le chlorure d'ammonium, le chloroplatinate d'allumage d'ammonium, le martelage et le platine finement divisé résultant pour le rendre Cohere. Franz Karl Achard a fait le premier creuset de platine en 1784. Il a travaillé avec le platine en fusionnant avec l'arsenic, puis plus tard la volatilisation de l'arsenic.
Depuis les autres membres de la famille du platine ne ont pas été encore découvert (platine était le premier dans la liste), Scheffer et Sickingen fait la fausse hypothèse que, en raison de sa dureté - ce qui est légèrement plus que pour pur fer - platine était un matériau relativement non flexible, même parfois fragile, alors que sa ductilité et la malléabilité sont proches de celle de l'or. Leurs hypothèses ne pouvaient être évitées depuis la platine ils ont expérimenté avec a été fortement contaminée par des quantités infimes d'éléments de la famille du platine tels que l'osmium et iridium , entre autres, ce qui fragilise l'alliage de platine. Alliage ce résidu de platine impur appelé "plyoxen" avec de l'or était la seule solution à l'époque pour obtenir un composé souple, mais de nos jours, très pur platine est disponible et très long fil peut être tirée de platine pur, très facilement, en raison de son cristallin structure qui est similaire à celle de nombreux métaux mous.
En 1786, Charles III d'Espagne a fourni une bibliothèque et laboratoire Pierre-François Chabaneau pour aider dans sa recherche de platine. Chabaneau réussi à éliminer diverses impuretés dans le minerai, y compris l'or, le mercure, le plomb, le cuivre et le fer. Cela l'a amené à croire qu'il travaillait avec un seul métal, mais en vérité, le minerai contenait encore les métaux du groupe du platine encore à découvrir. Cela a conduit à des résultats incohérents dans ses expériences. À certains moments, le platine semble malléable, mais quand il a été allié avec l'iridium, il serait beaucoup plus cassants. Parfois, le métal était entièrement incombustible, mais lorsqu'il est allié à l'osmium, il se volatiliser. Après plusieurs mois, Chabaneau réussi à produire 23 kg de pur, le platine malléable par martelage et la compression la forme éponge tandis que le blanc-chaud. Chabeneau réalisé le infusibilité de platine prêterait valeur aux objets qui lui sont faites, et ainsi a commencé une entreprise avec Joaquín Cabezas produire des lingots de platine et ustensiles. Cela a commencé ce qu'on appelle «l'âge de platine" en Espagne.
En 2007, Gerhard Ertl a remporté le prix Nobel de chimie pour déterminer les mécanismes moléculaires détaillées de l'oxydation catalytique du monoxyde de carbone sur le platine ( convertisseur catalytique).
Production et commerce

Platine, en même temps que le reste de la métaux de platine, est obtenu dans le commerce comme un sous-produit de nickel et de cuivre extraction et de traitement. Pendant électrolytique de cuivre, les métaux nobles tels que l'argent, l'or et les métaux du groupe du platine ainsi que le sélénium et le tellure se déposent au fond de la cellule de "boue d'anode", qui constitue le point de départ pour l'extraction des métaux du groupe du platine.
Si platine pur se trouve dans dépôts alluviaux ou d'autres minerais, il est isolé d'eux par diverses méthodes de soustraction impuretés. Étant donné que le platine est nettement plus dense que bon nombre de ses impuretés, les impuretés plus légères peuvent être éliminés simplement en les faisant flotter dans un liquide loin. Platinum est également non magnétique, tandis que le nickel et le fer sont à la fois magnétique. Ces deux impuretés sont ainsi supprimés en exécutant un électro-aimant sur le mélange. Parce que le platine a un point de fusion supérieur à la plupart des autres substances, de nombreuses impuretés peuvent être brûlés ou fondu sans faire fondre le platine. Enfin, le platine est résistant aux acides chlorhydrique et sulfurique, tandis que d'autres substances sont facilement attaqués par eux. impuretés métalliques peuvent être éliminés par agitation du mélange dans l'une des deux acides et à récupérer le reste de platine.
Un procédé approprié pour la purification de la platine brut, qui contient du platine, de l'or, et les autres métaux du groupe du platine, est de le traiter avec de l'eau régale, dans lequel le palladium, l'or et le platine sont dissous, tandis que l'osmium, l'iridium, le ruthénium et le séjour de rhodium ne ayant pas réagi. L'or est précipité par l'addition de fer (III) chlorure et après séparation par filtration de l'or, le platine est précipité sous forme chloroplatinate d'ammonium par l'addition de chlorure d'ammonium. chloroplatinate d'ammonium peut être converti en le métal par chauffage. Hexachloroplatinate précipitée (IV) peut être réduit avec élémentaire zinc , et une méthode similaire est adapté à la petite restauration à grande échelle de platine à partir de résidus de laboratoire.
Applications

Sur les 245 tonnes de platine vendus en 2010, 113 tonnes ont été utilisées pour dispositifs de véhicules de contrôle des émissions (46%), 76 tonnes pour les bijoux (31%). Les 35,5 tonnes restants sont allés à diverses autres applications mineures, telles que l'investissement, électrodes, les médicaments anticancéreux, des capteurs d'oxygène, bougies et moteurs à turbine.
Catalyse
L'utilisation la plus courante de platine est un catalyseur dans des réactions chimiques, autant de fois que noir de platine. Il a été utilisé dans la présente demande depuis le début du 19ème siècle, lorsque la poudre de platine a été utilisé pour catalyser l'allumage de l'hydrogène. Son application la plus importante est dans les automobiles comme un convertisseur catalytique, ce qui permet la combustion complète de faibles concentrations d'hydrocarbures non brûlés provenant des gaz d'échappement en dioxyde de carbone et vapeur d'eau. Le platine est également utilisé dans l'industrie pétrolière en tant que catalyseur dans un certain nombre de procédés différents, mais surtout dans reformage catalytique du tronçon rectiligne naphtas en indice d'octane élevé de l'essence qui devient riche en composés aromatiques. PtO 2, également connu sous le nom Le catalyseur d'Adams, est utilisé comme catalyseur d'hydrogénation, en particulier pour des huiles végétales. Platinum métallique catalyse également fortement la décomposition du peroxyde d'hydrogène dans l'eau de gaz et d'oxygène.
Standard

De 1889 à 1960, le compteur a été définie comme la longueur d'une platine-iridium (90:10) barre d'alliage, connu sous le nom International bar Prototype compteur. La barre précédente a été faite de platine en 1799. Le prototype international du kilogramme reste défini par un cylindre du même alliage platine-iridium fait en 1879.
Le électrode normale à hydrogène utilise également un platiné électrode de platine en raison de sa résistance à la corrosion, et d'autres attributs.
Métal précieux

Le platine est un métal précieux produits de base; son lingots a le ISO code devise de XDR. Coins, bars et lingots sont négociés ou collectées. Platinum trouve une utilisation dans les bijoux, habituellement comme un alliage de 90-95%, en raison de son inertie et de brillance. Bijoux publications spécialisées conseillent bijoutiers de présenter les rayures superficielles minutes (qu'ils terme patine) comme une caractéristique souhaitable.
En l'horlogerie, Vacheron Constantin, Patek Philippe, Rolex, Breitling, et d'autres entreprises utilisent du platine pour produire leur série de montre en édition limitée. Horlogers apprécier les propriétés uniques du platine, comme il ne ternit ni use (par rapport à l'or).

Le prix du platine, comme les autres produits industriels, est plus volatile que celle de l'or. En 2008, le prix du platine a chuté de $ 2252 à $ 774 l'once, une perte de près de 2/3 de sa valeur. En revanche, le prix de l'or a chuté de ~ 1000 $ à ~ $ 700 / oz au cours du même laps de temps, une perte de seulement un tiers de sa valeur.
Pendant les périodes de stabilité économique et la croissance soutenue, le prix du platine a tendance à être autant que deux fois le prix de l'or, alors que pendant les périodes d'incertitude économique, le prix du platine a tendance à diminuer en raison de la demande industrielle réduite, tombant au-dessous du prix de or. Prix de l'or sont plus stables en temps de ralentissement économique, comme l'or est considéré comme un havre de paix et de la demande d'or ne est pas entraîné par les utilisations industrielles. Au 18ème siècle, la rareté de platine a fait roi Louis XV de France déclarer l'ajustement seul métal pour un roi.
D'autres utilisations
Au laboratoire, un fil de platine est utilisé pour les électrodes; casseroles de platine et les supports sont utilisés en analyse thermogravimétrique en raison des exigences rigoureuses de l'inertie chimique par chauffage à des températures élevées (~ 1 000 ° C). Le platine est utilisé comme agent d'alliage pour divers produits métalliques, y compris les fils fins, récipients de laboratoire non corrosifs, les instruments médicaux, les prothèses dentaires, les contacts électriques et thermocouples. Platine-cobalt, un alliage de platine ou moins trois parties et une partie de cobalt, est utilisé pour faire relativement fortes permanents aimants . Anodes à base de platine sont utilisés à bord des navires, des pipelines et des piliers en acier.
Symbole du prestige

La rareté de platine comme un métal a causé annonceurs de l'associer à l'exclusivité et de la richesse. "Platinum" cartes de débit ont plus de privilèges que «Ne or celles ". " prix Platinum »sont le deuxième plus élevé possible, le classement ci-dessus« or »,« argent »et« bronze », mais en dessous de diamant . Par exemple, aux États-Unis, un album musical qui a vendu plus de 1 million d'exemplaires, sera crédité comme "platine", alors un album qui a vendu plus de 10 millions d'exemplaires seront certifiés " diamant ». Certains produits, tels que les mélangeurs et les véhicules, avec une couleur blanc argenté sont identifiés comme" platine ". Le platine est considéré comme un métal précieux, bien que son utilisation ne est pas aussi commun que l'utilisation de l'or ou de l'argent. Le cadre de la Couronne de la reine Elizabeth la Reine Mère, fabriqué pour son couronnement comme Consort du Roi George VI , est faite de platine. Ce était la première couronne britannique à faire de ce métal particulier.
Les questions de santé
Selon le Centers for Disease Control and Prevention, l'exposition à court terme à des sels de platine peuvent causer une irritation des yeux, du nez et de la gorge, et l'exposition à long terme peut provoquer deux allergies respiratoires et cutanées. Le courant Normes de l'OSHA est de 2 microgrammes par mètre cube d'air en moyenne sur un quart de travail de 8 heures.
Agents antinéoplasiques à base de platine sont utilisés dans la chimiothérapie, et montrent une bonne activité contre certaines tumeurs.
Comme platine est un catalyseur dans la fabrication de la caoutchouc de silicone et de gel des composants de plusieurs types de implants médicaux (implants mammaires, les prothèses de remplacement des articulations, disques lombaires artificiels, ports d'accès vasculaires, etc.), la possibilité de platine pourraient pénétrer dans l'organisme et provoquer des effets indésirables a mérité étude. Le Food and Drug Administration et d'autres institutions ont examiné la question et n'a trouvé aucune preuve indiquant une toxicité in vivo.
