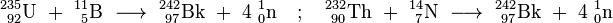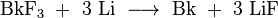Berkelium
Renseignements généraux
Les articles de cette sélection écoles ont été organisés par sujet du programme d'études grâce aux bénévoles d'enfants SOS. Parrainage d'enfants aide les enfants du monde en développement à apprendre aussi.
| Berkelium | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
97 Bk | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||||||||||||||
argenté  | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | berkelium, Bk, 97 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / b ər k Je l Je . əm / bər--əm -Lee KEE plus rarement: / b ɜr k l Je . əm / -Əm de BERK | ||||||||||||||||||||||||||||||||||||||||||||||||
| Catégorie Metallic | actinides | ||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 7, fa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | (247) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Rn ] 5f 9 7s 2 2, 8, 18, 32, 27, 8, 2 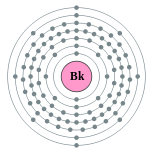 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Lawrence Berkeley National Laboratory (1949) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | (Alpha) 14,78 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | (Beta) 13,25 g · cm -3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | (Beta) 1259 K , 986 ° C, 1807 ° F | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 3, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,3 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 601 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 170 h | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 10 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-40-6 | ||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de berkelium | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Berkelium est un transuraniens radioactive élément chimique avec le symbole Bk et de numéro atomique 97, un membre de l' actinide et série Transuranien. Il est nommé d'après la ville de Berkeley, Californie, l'emplacement de la Université de Californie Radiation Laboratory où il a été découvert en Décembre 1949. Ce était l'élément transuranien cinquième découverte après le neptunium , le plutonium , le curium et américium .
Le principal isotope de berkelium, berkelium-249, est synthétisée en quantités infimes en haute flux dédié réacteurs nucléaires, surtout au Oak Ridge National Laboratory Tennessee, Etats-Unis, et à la Institut de recherche des réacteurs atomiques dans Dimitrovgrad, Russie. La production de la deuxième importante isotopes berkelium-247 implique l'irradiation de l'isotope rare curium-244 à haute énergie des particules alpha.
Un peu plus d'un gramme de berkelium a été produit aux États-Unis depuis 1967. Il n'y a aucune application pratique de berkelium en dehors de la recherche scientifique qui est principalement destinée à la synthèse de plus lourd transuraniens et transactinides. Un lot de 22 milligramme de berkelium-249 a été préparée au cours d'une période d'irradiation de 250 jours et ensuite purifié pendant encore 90 jours à Oak Ridge en 2009. Cet échantillon a été utilisé pour synthétiser l'élément Ununseptium pour la première fois en 2009 à la Institut unifié de recherches nucléaires, la Russie , après avoir été bombardé de calcium-48 ions pour 150 jours. Ce était le point culminant de la collaboration russo-américain sur la synthèse des éléments 113-118.
Berkelium est un blanc-argenté, mou, métal radioactif. L'isotope berkelium-249 émet de faible énergie des électrons et est donc relativement sûr à manipuler. Cependant, il se désintègre avec une demi-vie de 330 jours à californium -249, qui est un émetteur de forte et dangereuse de particules alpha. Cette transformation progressive est une considération importante lorsque l'on étudie les propriétés de berkelium élémentaire et ses composés chimiques, depuis la formation du californium apporte non seulement la contamination chimique, mais aussi des dommages auto-rayonnement, et l'auto-échauffement des particules alpha émises.
Histoire


Bien que de très petites quantités de berkelium ont été éventuellement produites dans des expériences nucléaires précédents, il était premier intentionnellement synthétisé, isolé et identifié en Décembre 1949 par Glenn T. Seaborg, Albert et Ghiorso Stanley G. Thompson. Ils ont utilisé le 60-pouces cyclotron au Université de Californie, Berkeley. Semblable à la découverte près simultanée de l'américium (élément 95) et le curium (élément 96) en 1944, la nouvelle éléments berkelium et californium (élément 98) ont tous deux été produites en 1949-1950.
Le choix du nom pour l'élément 97 a suivi la tradition précédente du groupe californien de faire une analogie entre le nouvellement découvert actinides et lanthanides élément positionné au-dessus dans le tableau périodique . Auparavant, l'américium a été nommé d'après un continent que son analogue l'europium et curium honoré scientifiques Marie et Pierre Curie comme lanthanides dessus, le gadolinium , a été nommé d'après l'explorateur de la éléments des terres rares Johan Gadolin. Ainsi, le rapport de la découverte par le groupe de Berkeley lit comme suit: "Il est suggéré que cet élément 97 être donné le nom berkelium (symbole Bk) après la ville de Berkeley d'une manière similaire à celle utilisée pour nommer son homologue chimique terbium (numéro atomique 65) dont nom est dérivé de la ville de Ytterby, Suède , où les minéraux de terres rares ont d'abord été trouvé. "Cette tradition a pris fin le berkelium, si, comme la désignation de la prochaine actinides découvert, californium , ne était pas liée à son lanthanides analogique dysprosium , mais après le lieu de la découverte.
Les étapes les plus difficiles dans la synthèse de berkelium étaient sa séparation des produits finaux et la production de quantités suffisantes de l'américium pour le matériau cible. Tout d'abord, l'américium (Am 241) nitrate solution a été appliquée sur une platine feuille, la solution a été évaporée et le résidu converti par recuit à dioxyde de américium (OMA 2). Cet objectif a été irradié avec 35 MeV particules alpha pour 6 heures dans le cyclotron de 60 pouces au Lawrence Radiation Laboratory, Université de Californie, Berkeley. Le (α, 2n) réaction induite par l'irradiation a donné le Bk isotope 243 et deux gratuits neutrons :
Après l'irradiation, le revêtement a été dissous avec de l'acide nitrique , puis précipité sous forme de l' hydroxyde aqueux concentré en utilisant une solution d'ammoniaque. Le produit était centrifugé et redissous dans l'acide nitrique. Pour séparer l'américium de berkelium ne ayant pas réagi, cette solution a été ajoutée à un mélange de ammonium et le sulfate d'ammonium et on chauffe à convertir tous les américium dissous dans l' état d'oxydation +6. Américium non oxydé résiduel a été précipité par l'addition de acide fluorhydrique que l'américium (III) fluorure (AMF 3). Cette étape a donné un mélange du curium de produits d'accompagnement et l'élément prévu 97 en forme de trifluorures. Le mélange a été converti en les hydroxydes correspondants par traitement avec l'hydroxyde de potassium, et après centrifugation, a été dissous dans l'acide perchlorique.
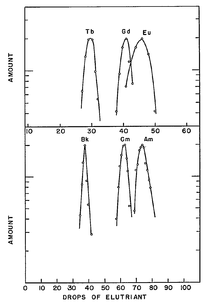
En outre la séparation a été effectuée en présence d'un acide citrique / ammonium solution tampon dans un milieu faiblement acide ( pH≈3.5), en utilisant échange d'ions à une température élevée. Le chromatographique comportement de séparation était alors inconnu pour l'élément 97, mais a été prévu par analogie avec le terbium (voir courbes d'élution). Les premiers résultats ont été décevants en aucune signature d'émission de particules alpha pu être détectée à partir du produit d'élution. Seul le plus recherche de les rayons X caractéristiques et signaux électroniques de conversion ont abouti à l'identification d'un isotope de berkelium. Son nombre de masse était incertain entre 243 et 244 dans le rapport initial, mais a ensuite été établi que 243.
Caractéristiques
Physique
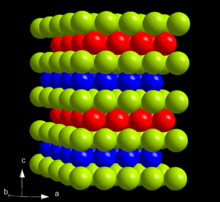
Berkelium est un blanc argenté, radioactif douce actinides métal. Dans le tableau périodique , il est situé à droite de l'actinide curium , à la gauche de l'actinide californium -dessous du lanthanide et terbium avec lequel il partage de nombreuses similitudes dans les propriétés physiques et chimiques. Sa densité de 14,78 g / cm 3 se situe entre ceux de curium (13,52 g / cm 3) et californium (15,1 g / cm 3), de même que son point de 986 ° C point de fusion, inférieure à celle du curium (1340 ° C), mais supérieure à celle du californium (900 ° C). Berkelium est relativement doux et a un des plus faibles modules en vrac parmi les actinides, à environ 20 GPa (10 x 10 2 Pa).
Berkelium (III) montre deux ions forte pics de fluorescence à 652 nanomètres (lumière rouge) et 742 nanomètres (rouge foncé - proche infrarouge) en raison de transitions internes à la shell f-électrons. L'intensité relative de ces pics dépend de la puissance d'excitation et de la température de l'échantillon. Cette émission peut être observé, par exemple, après la dispersion des ions Berkelium dans un verre de silicate, par fusion du verre en présence d'oxyde de berkelium ou halogénure.
Entre 70 K et la température ambiante, se comporte comme un berkelium Curie-Weiss matériau paramagnétique avec un moment magnétique effectif de 9,69 Magnétons Bohr (μ B) et une Température de Curie de 101 K. Ce moment magnétique est presque égale à la valeur théorique de 9,72 μ B calculé à l'intérieur de la simple atomique modèle de couplage LS. Après refroidissement à environ 34 K, berkelium subit une transition à un état antiferromagnétique. L'enthalpie de dissolution dans l' acide chlorhydrique dans des conditions standard est -600 kJ / mol -1, à partir de laquelle la changement norme enthalpie de formation (Δ f H °) du aqueuses Bk 3+ est obtenu comme -601 kJ / mol -1. Le potentiel standard Bk 3+ / Bk est 0 -2,01 V. La potentiel d'ionisation d'un atome d'berkelium neutre est 6,23 eV.
Allotropes
Dans les conditions ambiantes, berkelium assume sa forme α plus stable qui a une hexagonale symétrie, groupe spatial P6 3 / mmc, paramètres de maille de 341 h et 1107 h. Le cristal a une double Structure de garnissage hexagonal avec la succession de couches et est donc ABAC isotypique (ayant une structure similaire) avec α-α-lanthane et les formes d'actinides au-delà de curium. Cette structure cristalline varie avec la pression et la température. Quand comprimé à la température ambiante à 7 GPa, α-berkelium transforme la modification bêta, qui présente un cubique à faces centrées (cfc) symétrie et l'espace groupe Fm 3 m. Cette transition se fait sans changement de volume, mais les enthalpie augmente de 3,66 kJ / mol. Après une nouvelle compression à 25 GPa, pour un berkelium transforme structure similaire à celle de l'uranium α-γ-berkelium orthorhombique. Cette transition se accompagne d'une diminution de volume de 12% et de délocalisation des électrons à la Couche électronique 5f. Pas d'autres transitions de phase sont observés jusqu'à 57 GPa.
Lors du chauffage, α-berkelium transforme en une autre phase avec un réseau cfc (mais légèrement différente de β-berkelium), groupe d'espace Fm 3 m et la constante de réseau de 500 h; cette structure fcc est équivalent à l'emballage le plus proche avec la séquence ABC. Cette phase est métastable et va progressivement revenir à la phase initiale α-berkelium au la température ambiante. On pense que la température de la transition de phase à être très proche du point de fusion.
Chimique
Comme tous les actinides , berkelium dissout dans divers acides inorganiques aqueuses, libérant gazeux d'hydrogène et de conversion dans le berkelium (III) l'état. Cette trivalent état d'oxydation (3) est la plus stable, en particulier dans des solutions aqueuses, mais tétravalent (4) et, éventuellement, divalents (2) des composés Berkelium sont également connus. L'existence de sels de Berkelium bivalents est incertain et n'a été rapporté dans mixte lanthane chloride le chlorure de strontium fond. Un comportement similaire est observé pour l'analogue des lanthanides de berkelium, le terbium . Les solutions aqueuses des ions BK sont verts dans la plupart des acides. La couleur des ions Bk 4+ est jaune dans de l'acide chlorhydrique et de l'orange-jaune dans l'acide sulfurique . Berkelium ne réagit pas rapidement avec l'oxygène à température ambiante, éventuellement en raison de la formation d'une surface de la couche protectrice d'oxyde. Cependant, il réagit avec les métaux en fusion, l'hydrogène , les halogènes , chalcogènes et pnictogens pour former divers composés binaires.
Isotopes
Une vingtaine isotopes et six isomères nucléaires (états excités de un isotope) de berkelium ont été caractérisés avec les numéros atomiques allant de 235 à 254. Tous sont radioactifs. Les plus longues demi-vies sont observées pour 247 Bk (1380 années), 248 Bk (9 années) et 249 Bk (330 jours); les demi-vies des autres isotopes vont de microsecondes à plusieurs jours. L'isotope qui est le plus facile à synthétiser est berkelium-249. Ce HPS douce β-particules qui ne sont pas pratiques pour la détection. Son le rayonnement alpha est plutôt faible - 1,45 × 10 -3% par rapport à la β-rayonnement - mais est parfois utilisé pour détecter cet isotope. Le second isotope de berkelium importante, berkelium-247, est un émetteur alpha, comme le sont la plupart des isotopes d'actinides.
Occurrence
Tous les isotopes de Berkelium ont une demi-vie beaucoup trop courte pour être primordiale. Par conséquent, tous berkelium primordial, ce est-à berkelium présente sur la Terre lors de sa formation, a pourri maintenant.
Sur Terre, berkelium est surtout concentrée dans certaines régions, qui ont été utilisés pour l'atmosphère essais nucléaires d'armes entre 1945 et 1980, ainsi que sur les sites des incidents nucléaires, comme la catastrophe de Tchernobyl , accident de Three Mile Island et de 1968 accident Base aérienne de Thulé B-52. L'analyse des débris sur le site de test de la première US bombe à hydrogène, Ivy Mike, (1 Novembre 1952, Enewetak Atoll), a révélé des concentrations élevées de divers actinides, y compris berkelium. Pour des raisons de secret militaire, ce résultat a été publié seulement en 1956.
Les réacteurs nucléaires produisent la plupart du temps, parmi les isotopes de Berkelium, berkelium-249. Pendant le stockage et avant l'évacuation du combustible, la plupart de celui-ci beta se désintègre en californium-249. Ce dernier a une demi-vie de 351 ans, ce qui est relativement long par rapport aux autres isotopes produits dans le réacteur, et est donc indésirable dans les produits d'élimination.
Quelques atomes de berkelium peuvent être produits par réactions de capture de neutrons et désintégration bêta en très fortement concentrés uranium dépôts -bearing, ce qui en fait l'élément le plus rare d'origine naturelle.
Synthèse et extraction
Préparation d'isotopes
Berkelium est produit en bombardant léger actinides uranium (238 U) ou le plutonium (Pu 239) avec des neutrons dans un réacteur nucléaire. Dans un cas plus courant de combustible à l'uranium, le plutonium est d'abord produit par capture de neutrons (ce qu'on appelle la (n, γ) réaction neutronique ou fusion), suivi par désintégration bêta:
![\ Mathrm {^ {238} _ {\ 92} U \ \ xrightarrow {(n, \ gamma)} \ ^ {239} _ {\ 92} U \ \ xrightarrow [23,5 \ min] {\ beta ^ -} \ ^ {239} _ {\ 93} Np \ \ xrightarrow [2,3565 \ d] {\ beta ^ -} \ ^ {239} _ {\ 94}} Pu](../../images/1281/128135.png) (Les temps sont demi-vie )
(Les temps sont demi-vie )
Le plutonium-239 est en outre irradiée par une source qui a une haute flux de neutrons, plusieurs fois plus élevé que dans un réacteur nucléaire classique, tel que le 85 mégawatts High Flux Isotope Reactor (HFIR) au Oak Ridge National Laboratory, dans le Tennessee, USA. Le flux élevé favorise les réactions de fusion impliquant non pas un mais plusieurs neutrons, convertir 239 à 244 cm Pu puis à 249 cm:
Curium-249 a une demi-vie courte de 64 minutes, et donc plus sa conversion à 250 cm a une probabilité faible. Au lieu de cela, il se transforme par désintégration bêta en 249 Bk:
Le ainsi produit 249 Bk a une longue demi-vie de 330 jours et peut donc capturer un autre neutrons. Cependant, le produit, 250 Bk, a encore une demi-vie relativement courte de 3,212 heures et donc, ne donne pas de isotopes de Berkelium lourds. Au lieu de cela se désintègre à l'isotope de californium 250 Cf:
Bien que 247 Bk est l'isotope le plus stable de berkelium, sa production dans les réacteurs nucléaires est très inefficace en raison de la longue demi-vie de son géniteur potentiel curium-247, qui ne permet pas suffisamment de temps pour la désintégration bêta avant de capturer une autre neutrons. Ainsi, 249 Bk est l'isotope le plus accessible de berkelium, qui encore, ne est disponible qu'en petites quantités (seulement 0,66 grammes ont été produites aux États-Unis sur la période 1967-1983) à un prix élevée de l'ordre de 185 USD par microgramme.
L'isotope 248 Bk a été obtenu en 1956 en bombardant un mélange d'isotopes de curium avec 25 MeV α-particules. Bien que sa détection directe a été entravée par une forte interférence de signal avec 245 Bk, l'existence d'un nouvel isotope a été prouvé par la croissance du produit de désintégration 248 Cf qui avait été précédemment caractérisé. La demi-vie de 248 Cf a été estimée à 23 ± 5 heures et une valeur plus fiable ne est toujours pas connu. Berkelium-247 a été produite au cours de la même année par irradiation 244 cm avec des alpha-particules:
Berkelium-242 a été synthétisé en 1979 en bombardant 235 U avec 11 B, 238 U avec 10 B, 232 Th avec 14 N ou 232 Th avec 15 N. Il convertit par capture d'électrons de 242 cm, avec une demi-vie de 7,0 ± 1,3 minutes. Une recherche pour un départ présumé isotope 241 Bk a ensuite échoué; 241 Bk a depuis été synthétisé.
Séparation
Le fait que berkelium assume facilement l'état d'oxydation 4 dans les solides, et est relativement stable dans cet état dans les liquides aide grandement séparation des berkelium loin de beaucoup d'autres actinides. Elles sont produites inévitablement en quantités relativement importantes lors de la synthèse nucléaire et favorisent souvent l'état 3. Ce fait ne était pas encore connu dans les premières expériences, qui a utilisé une procédure de séparation plus complexe. Divers agents d'oxydation peuvent être appliqués à la berkelium solutions (III) pour le convertir en l'état 4, tels que bromates (Bro -
3), bismuthates (Bio -
3), chromates (CrO 2-
4 et Cr
O 2 2-
7), argent (I) thiolate (Ag 2 S 2 O 8), le plomb (IV) oxyde (PbO 2), l'ozone (O 3), ou des procédures d'oxydation photochimique. Berkelium (IV) est ensuite extrait avec échange d'ions extraction chromatographie ou extraction liquide-liquide en utilisant HDEHP (bis- (2-éthylhexyl) phosphorique SCID), des amines , le phosphate de tributyle ou plusieurs autres réactifs. Ces procédures se séparent berkelium de la plupart des actinides trivalents et les lanthanides , à l'exception du lanthanide cérium (lanthanides sont absents dans la cible d'irradiation mais sont créés dans diverses fission nucléaire chaînes de désintégration).
Une procédure plus détaillée adoptée à la Oak Ridge National Laboratory était la suivante: le mélange initial des actinides est traitée avec échange d'ions en utilisant de chlorure de lithium réactif, puis précipité sous forme d' hydroxydes , filtré et dissous dans de l'acide nitrique. Il est ensuite traité par haute pression élution à partir de les résines échangeuses de cations et de la phase berkelium est oxydé et extraits en utilisant l'une des procédures décrites ci-dessus. La réduction de la berkelium ainsi obtenu (IV) à l'état d'oxydation +3 donne une solution qui est presque exempt d'autres actinides (mais contient du cérium). Berkelium et le cérium sont ensuite séparés avec un autre cycle de traitement d'échange ionique.
Préparation métallique en vrac
Afin de caractériser les propriétés chimiques et physiques de berkelium solide et ses composés, un programme a été lancé en 1952 à la Material Testing Reactor, Arco, Idaho, États-Unis. Elle a abouti à la préparation d'un huit-gramme cible de plutonium-239 et la première production de quantités macroscopiques (0,6 microgrammes) de berkelium par Burris B. Cunningham et Stanley G. Thompson en 1958, après une irradiation du réacteur continue de cette cible pendant six ans. Cette méthode d'irradiation était et est toujours la seule façon de produire des quantités pesables de l'élément, et la plupart des études à l'état solide de berkelium ont été effectuées sur des échantillons de microgramme ou submicrogram taille.
Sources d'irradiation grands du monde sont de 85 mégawatts à haut flux isotopes au réacteur Oak Ridge National Laboratory, dans le Tennessee, Etats-Unis, et le réacteur SM-2 à la boucle Institut de recherche des réacteurs atomiques (NIIAR) dans Dimitrovgrad, la Russie, qui sont à la fois dédiée à la production d'éléments de transcurium (numéro atomique supérieur à 96). Ces installations ont des niveaux de puissance et de flux similaires, et on se attend à avoir des capacités de production comparables pour les éléments de transcurium, bien que les quantités produites au NIIAR ne sont pas rendus publics. Dans une "campagne de traitement typique» à Oak Ridge, des dizaines de grammes de curium sont irradiées pour produire quantités de decigramme de californium , quantités de milligrammes de berkelium-249 et einsteinium , et des quantités de l'ordre du picogramme fermium . Au total, un peu plus d'un gramme de berkelium-249 a été produite à Oak Ridge depuis 1967.
On a préparé le premier échantillon berkelium métallique pesant 1,7 microgrammes en 1971 par la réduction des berkelium (III) avec le fluorure de lithium vapeur à 1000 ° C; le fluorure est suspendue sur un fil de tungstène au-dessus d'une tantale creuset contenant du lithium fondu. Plus tard, des échantillons de métal pesant jusqu'à 0,5 mg ont été obtenus avec cette méthode.
Des résultats similaires sont obtenus avec berkelium (IV) fluorure. Berkelium métal peut également être produit par la réduction berkelium (IV) avec de l'oxyde de thorium ou de lanthane .
Composés
Oxydes
Deux oxydes de berkelium sont connus, avec le berkelium état d'oxydation de +3 (Bk 2 O 3) et 4 (BKO 2). Berkelium (IV) oxyde est un solide brun, tandis que berkelium (III) oxyde est un solide jaune-vert avec un point de 1920 ° C de fusion et est formé à partir de deux par BKO réduction moléculaire avec l'hydrogène :
Lors du chauffage à 1200 ° C, l'oxyde Bk 2 O 3 subit un changement de phase; il subit un autre changement de phase à 1 750 ° C. Un tel comportement triphasé est typique pour l'actinide sesquioxydes. Berkelium (II) oxyde, BKO, a été rapporté comme un solide gris fragile mais sa composition chimique exacte reste incertaine.
Halogénures
En halogénures, berkelium assume les états d'oxydation 3 et 4. L'état 3 est la plus stable, en particulier dans des solutions, tandis que les halogénures tétravalents BKF 4 et Cs 2 BkCl 6 ne sont connus que dans la phase solide. La coordination de l'atome de fluor dans son berkelium trivalent et le chlorure est tricapped prismatique trigonal, avec le nombre de coordination de 9. Dans le bromure trivalent, il est bicouronné trigonal prismatique (coordination 8) ou octaédrique (coordination 6), et l'iodure est octaédrique.
| Oxydation nombre | Fa | Cl | Br | Je |
|---|---|---|---|---|
| 3 | BkF 3 (Jaune) | BkCl 3 (Vert) Cs 2 NaBkCl 6 | BkBr 3 (Jaune-vert) | BKI 3 (Jaune) |
| 4 | BkF 4 (Jaune) | Cs 2 BkCl 6 (Orange) |
Berkelium (IV) fluorure (BkF 4) est un jaune-vert solide ionique et est isotypique avec tétrafluorure d'uranium ou zirconium (IV) fluorure. Berkelium (III) fluorure (BkF 3) est également un solide jaune-vert, mais il a deux structures cristallines. La phase la plus stable à basse température est isotypique avec yttrium (III) fluorure, tandis que lors d'un chauffage à entre 350 et 600 ° C, il se transforme à la structure trouvée dans lanthane (III) fluorure.
Quantités visibles de berkelium (III) chlorure (BkCl 3) ont d'abord été isolés et caractérisés en 1962, et pesés seulement 3 milliardièmes de g. Il peut être préparé en introduisant vapeurs de chlorure d'hydrogène dans un tube de quartz sous vide contenant de l'oxyde de berkelium à une température d'environ 500 ° C. Ce solide vert a un point de 600 ° C de fusion, et est isotypique avec uranium (III) chlorure. Lors du chauffage à point de fusion près, BkCl 3 se transforme en une phase orthorhombique.
Deux formes de berkelium (III) du bromure sont connus: l'un avec la coordination berkelium ayant 6, et l'autre avec la coordination 8. Ce dernier est moins stable et se transforme à la phase précédente lors d'un chauffage à environ 350 ° C. Un phénomène important pour les matières solides radioactives a été étudié sur ces deux formes cristallines: la structure de BkBr 3 249 échantillons frais et vieillis a été sondée par Diffraction des rayons X sur une période de plus de 3 ans, de sorte que différentes fractions de berkelium-249 avaient beta diminué jusqu'à californium-249. Pas de changement dans la structure a été observée sur le 249 BkBr 3 - 3 CFBR transformation 249. Cependant, d'autres différences ont été notées pour 249 BkBr 3 et 249 CFBR 3. Par exemple, celui-ci pourrait être réduite avec de l'hydrogène à 249 CFBR 2, mais l'ancien ne pouvait pas - ce résultat a été reproduite sur 249 personne BkBr 3 et 249 CFBR trois échantillons, aussi bien sur les échantillons contenant à la fois des bromures. L'enchevêtrement de californium dans berkelium se produit à un taux de 0,22% par jour et est un obstacle intrinsèque dans l'étude des propriétés de Berkelium. À côté d'une contamination chimique, 249 Cf, étant un émetteur alpha, apporte indésirables auto-dommages du réseau cristallin et l'auto-échauffement qui en résulte. L'effet chimique peut cependant être évité en effectuant des mesures en fonction du temps et de l'extrapolation des résultats obtenus.
D'autres composés inorganiques
Le pnictures d'berkelium-249 de la BKX type sont connus pour des éléments azote , phosphore , arsenic et antimoine . Ils cristallisent dans le la structure de sel gemme et sont préparés par la réaction soit berkelium (III) hydrure (bkh 3) ou métallique berkelium avec ces éléments à une température élevée (environ 600 ° C) sous vide poussé.
Berkelium (III) sulfure, Bk 2 S 3, est préparé soit par de l'oxyde de berkelium traitement avec un mélange de le sulfure d'hydrogène et le disulfure de carbone vapeurs à 1130 ° C, ou en faisant réagir directement berkelium métallique avec du soufre élémentaire. Ces procédures donnent des cristaux de brun-noir.
Berkelium (III) et berkelium (IV) hydroxydes sont à la fois stable dans une solutions molaires d' hydroxyde de sodium . Berkelium (III) phosphate (BkPO 4) a été préparé comme un solide, ce qui montre une forte fluorescence sous excitation avec une lumière verte. des hydrures de Berkelium sont produits en faisant réagir le métal avec de l'hydrogène gazeux à des températures d'environ 250 ° C. Ils sont non stoechiométrique avec la formule nominale bkh 2 + x (0 <x <1). Plusieurs autres sels de berkelium sont connus, y compris un oxysulfure (Bk 2 O 2 S), et hydraté nitrate (Bk (NO 3) 3 · 4H 2 O), le chlorure (BkCl 3 · 6H 2 O), sulfate (Bk 2 ( SO 4) 3 · 12H 2 O) et oxalate (Bk 2 (C 2 O 4) 3 · 4H 2 O). La décomposition thermique à environ 600 ° C dans une atmosphère d'argon atmosphère (afin d'éviter l'oxydation à deux OBE) de Bk 2 (SO 4) 3 · 12H 2 O, on obtient les cristaux de berkelium (III) oxysulfate (BK 2 O 2 SO 4). Ce composé est thermiquement stable à au moins 1000 ° C en atmosphère inerte.
Composés Organoberkelium
Berkelium forme un trigone (η 5 -C 5 H 5) 3 Bk complexe de métallocène avec trois des noyaux cyclopentadiényle, qui peuvent être synthétisés en faisant réagir berkelium (III) avec le chlorure beryllocene fondu ( Be (C 5 H 5) 2) à environ 70 ° C. Il a une couleur ambrée et une densité de 2,47 g / cm 3. Le complexe est stable au chauffage à au moins 250 ° C et se sublime sans fondre à environ 350 ° C. La radioactivité élevé de berkelium détruit progressivement le composé (dans un délai de semaine). Un anneau cyclopentadiényle en (η 5 à C 5 H 5) 3 Bk peut être substitué par le chlore pour donner [Bk (C 5 H 5) 2 Cl] 2. Les spectres d'absorption optique de ce composé sont très semblables à ceux de (η 5 -C 5 H 5) 3 Bk.
Applications
Il ya actuellement aucune utilisation pour tout isotope de berkelium dehors de la recherche scientifique de base. Berkelium-249 est un nucléide cible commune pour préparer encore plus lourd transuraniens et transactinides, comme lawrencium , rutherfordium et bohrium . Il est également utile en tant que source de l'isotope de californium-249, qui est utilisé pour les études sur la chimie du californium de préférence au plus radioactif californium-252 qui est produit dans des installations de bombardement de neutrons comme le HFIR.
Un lot de 22 milligramme de berkelium-249 a été préparé dans une irradiation de 250 jours et ensuite purifié pendant 90 jours à Oak Ridge en 2009. Cet objectif a donné les six premiers atomes de Ununseptium au Institut unifié de recherches nucléaires (JINR), Dubna, en Russie, après avoir bombardé avec des ions de calcium dans le cyclotron U400 pour 150 jours. Cette synthèse a été l'aboutissement de la collaboration russo-américain entre IURN et Lawrence Livermore National Laboratory sur la synthèse des éléments 113-118 qui a été lancé en 1989.
Cycle du combustible nucléaire
Les fission nucléaire propriétés de berkelium sont différents de ceux des actinides voisins curium et californium, et ils suggèrent berkelium pour effectuer mal comme combustible dans un réacteur nucléaire. Plus précisément, berkelium-249 a un modérément grand capture de neutrons section de 710 granges pour neutrons thermiques, 1200 granges résonance section fission croix intégrante, mais très faible pour les neutrons thermiques. Dans un réacteur thermique, une grande partie sera donc converti en Berkelium-250 qui se désintègre rapidement à californium-250. En principe, berkelium-249 peut soutenir une réaction nucléaire en chaîne dans un surgénérateur. Son masse critique est relativement élevée à 192 kg; elle peut être réduite d'un réflecteur de l'eau ou de l'acier, mais serait encore dépasser la production mondiale de cet isotope.
Berkelium-247 peut maintenir la réaction en chaîne à la fois dans un neutron thermique et dans un réacteur à neutrons rapides, cependant, sa production est assez complexe et donc la disponibilité est beaucoup plus faible que sa masse critique, qui est d'environ 75,7 kg pour une sphère nue, 41,2 kg avec un réflecteur d'eau et 35,2 kg avec un réflecteur d'acier (30 cm d'épaisseur).
Les questions de santé
On sait peu sur les effets de berkelium sur le corps humain, et les analogies avec d'autres éléments ne peuvent être tirées à cause des différents produits de rayonnement ( électrons pour berkelium et les particules alpha, les neutrons ou les deux pour la plupart des autres actinides). La faible énergie des électrons émis par berkelium-249 (moins de 126 keV) empêche sa détection, en raison de l'interférence de signal avec d'autres processus de décomposition, mais rend également cet isotope relativement inoffensif pour les humains par rapport aux autres actinides. Cependant, berkelium-249 transforme avec une demi-vie de seulement 330 jours à la forte émetteur alpha californium-249, ce qui est assez dangereux et doit être traitée dans un boîte à gants dans un laboratoire dédié.
La plupart des données sur la toxicité de berkelium disponibles proviennent de la recherche sur les animaux. Lors de l'ingestion par des rats, seulement environ 0,01% berkelium se termine dans le flux sanguin. De là, environ 65% va à l'os, où il reste pendant environ 50 ans, 25% dans les poumons (la demi-vie biologique d'environ 20 ans), 0,035% sur les testicules ou 0,01% aux ovaires où berkelium séjours indéfiniment. L'équilibre d'environ 10% est excrété. Dans tous ces organes berkelium pourrait favoriser le cancer, et dans le son squelette de rayonnement peuvent endommager les cellules rouges du sang. Le montant maximal autorisé de berkelium-249 dans le squelette humain est de 0,4 nanogrammes.
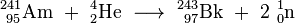
![\ Mathrm {^ {239} _ {\ 94} Pu \ \ xrightarrow {4 (n, \ gamma)} \ ^ {243} _ {\ 94} Pu \ \ xrightarrow [4,956 \ h] {\ beta ^ -} \ ^ {243} _ {\ 95} Am \ \ xrightarrow {(n, \ gamma)} \ ^ {244} _ {\ 95} Am \ \ xrightarrow [10.1 \ h] {\ beta ^ -} \ ^ { 244} _ {\} 96 cm} \ quad; \ Quad \ mathrm {^ {244} _ {\ 96 cm} \ \ xrightarrow {5 (n, \ gamma)} \ ^ {249} _ {\} 96 cm}](../../images/1679/167973.png)
![\ Mathrm {^ {249} _ {\ 96 cm} \ \ xrightarrow [64,15 \ min] {\ beta ^ -} \ ^ {249} _ {\ 97} Bk \ \ xrightarrow [330 \ d] {\ beta ^ -} \ ^ {249} _ {\ 98}} Cf](../../images/1679/167974.png)
![\ Mathrm {^ {249} _ {\ 97} Bk \ \ xrightarrow {(n, \ gamma)} \ ^ {250} _ {\ 97} Bk \ \ xrightarrow [3,212 \ h] {\ beta ^ -} \ ^ {250} _ {\ 98}} Cf](../../images/1679/167975.png)
![\ Mathrm {^ {244} _ {\ 96 cm} \ \ xrightarrow [] {(\ alpha, n)} \ ^ {247} _ {\} 98 Cf \ \ xrightarrow [3,11 \ h] {\ epsilon} \ ^ {247} _ {\ 97}} Bk](../../images/1679/167976.png)
![\ Mathrm {^ {244} _ {\ 96 cm} \ \ xrightarrow [] {(\ alpha, p)} \ ^ {247} _ {\ 97}} Bk](../../images/1679/167977.png)