
Soufre
Saviez-vous ...
SOS Enfants produite ce site pour les écoles ainsi que ce site de vidéo sur l'Afrique . SOS enfants parrainage est cool!
| Soufre | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
16 S | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Apparence | |||||||||||||||||||||||||||||||||||||
jaune citron microcristaux frittés  Raies spectrales de soufre | |||||||||||||||||||||||||||||||||||||
| Propriétés générales | |||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | soufre, S, 16 | ||||||||||||||||||||||||||||||||||||
| Prononciation | / s ʌ l fa ər / SUL -fər | ||||||||||||||||||||||||||||||||||||
| Élément Catégorie | non métalliques | ||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | (16) chalcogènes, 3, p | ||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 32,06 (1) | ||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Ne ] 3s 2 3p 4 2, 8, 6  | ||||||||||||||||||||||||||||||||||||
| Histoire | |||||||||||||||||||||||||||||||||||||
| Découverte | Chinois (Avant 2000 avant JC) | ||||||||||||||||||||||||||||||||||||
| Reconnu comme un élément par | Antoine Lavoisier (1777) | ||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||
| Phase | solide | ||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | (Alpha) 2,07 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | (Beta) 1,96 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | (Gamma) 1,92 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 1,819 g · cm -3 | ||||||||||||||||||||||||||||||||||||
| Point de fusion | 388,36 K , 115,21 ° C, 239,38 ° F | ||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 717,8 K, 444,6 ° C, 832,3 ° F | ||||||||||||||||||||||||||||||||||||
| Point critique | 1314 K, 20,7 MPa | ||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | (Mono) 1,727 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | (Mono) 45 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 22,75 J · mol -1 .K -1 | ||||||||||||||||||||||||||||||||||||
| La pression de vapeur | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||
| États d'oxydation | 6, 5, 4, 3, 2, 1, -1, -2 (Fortement acide oxyde) | ||||||||||||||||||||||||||||||||||||
| Électronégativité | 2,58 (échelle de Pauling) | ||||||||||||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 999,6 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||
| 2ème: 2252 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| 3ème: 3357 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||
| Rayon covalente | 105 ± 15 heures | ||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 180 h | ||||||||||||||||||||||||||||||||||||
| Miscellanées | |||||||||||||||||||||||||||||||||||||
| Crystal structure | orthorhombique 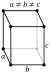 | ||||||||||||||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | ||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) (amorphe) 2 × 10 15 Ω · m | ||||||||||||||||||||||||||||||||||||
| Conductivité thermique | (Amorphe) 0,205 W · m -1 · K -1 | ||||||||||||||||||||||||||||||||||||
| Module Bulk | 7,7 GPa | ||||||||||||||||||||||||||||||||||||
| Dureté Mohs | 2.0 | ||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7704-34-9 | ||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | |||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de soufre | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
Le soufre ou le soufre ( L'anglais britannique; voir ci-dessous l'orthographe ) est un élément chimique avec le symbole S et de numéro atomique 16. C'est un abondante, multivalente non métallique. Sous des conditions normales, des atomes de soufre forment des molécules cycliques avec octatomic formule chimique S 8. Le soufre élémentaire est un jaune vif cristallin solide quand à la température ambiante. Chimiquement, le soufre peut réagir soit comme un oxydant ou agent réducteur. Il se oxyde la plupart des métaux et plusieurs non-métaux, y compris le carbone, ce qui conduit à sa charge négative dans la plupart des composés organo-soufrés, mais il réduit plusieurs oxydants forts, tels que l'oxygène et le fluor .
Soufre se produit naturellement comme l'élément pur (soufre natif) et que sulfure et minéraux sulfatés. Cristaux de soufre élémentaire sont souvent recherchés par les collectionneurs de minéraux pour leurs couleurs vives distinctes polyèdre formes. Être abondante sous forme native, le soufre a été connu dans les temps anciens, mentionné pour ses utilisations dans la Grèce antique , la Chine et l'Egypte . Les émanations de soufre brûlant ont été utilisés comme fumigants, et les mélanges de médicaments contenant du soufre ont été utilisés comme des baumes et antiparasitaires. Le soufre est référencé dans la Bible comme le soufre (brûlure pierre) en anglais , avec ce nom encore utilisé dans plusieurs tomes non scientifiques. Il a été nécessaire de faire la meilleure qualité de la poudre noire . En 1777, Antoine Lavoisier a contribué à convaincre la communauté scientifique que le soufre est un élément de base, plutôt que d'un composé.
Le soufre élémentaire a été une fois extrait de dômes de sel où il se produit parfois à l'état presque pur, mais cette méthode est périmé depuis la fin du 20e siècle. Aujourd'hui, presque tout le soufre élémentaire est produit comme sous-produit de l'élimination des contaminants contenant du soufre à partir de gaz naturel et de pétrole . Utilisation commerciale de l'élément sont essentiellement en engrais , en raison de la relativement forte exigence pour des plantes, et dans la fabrication d' acide sulfurique , un produit chimique industriel primaire. D'autres utilisations bien connues pour l'élément sont en matchs, insecticides et fongicides. Beaucoup de composés de soufre sont odorante, et l'odeur de gaz naturel odorisé, odeur de mouffette, pamplemousse, et l'ail est due à des composés soufrés. Le sulfure d'hydrogène produit par les organismes vivants confère l'odeur caractéristique d'œufs pourris et d'autres processus biologiques.
Le soufre est un élément essentiel de toute vie, et est largement utilisé dans les processus biochimiques. Dans les réactions métaboliques, des composés soufrés servent en tant que combustibles et oxygène (alternatives) matériaux respiratoires pour les organismes simples. Soufre sous forme organique est présent dans les vitamines biotine et thiamine , ce dernier étant nommé pour le mot grec pour le soufre. Le soufre est un élément important de nombreuses enzymes et molécules antioxydantes comme le glutathion et thiorédoxine. Soufre lié organiquement est une composante de toutes les protéines, les acides aminés la cystéine et méthionine. Les liaisons disulfure sont en grande partie responsable de la résistance mécanique et de l'insolubilité de la protéine kératine, trouvé dans la peau extérieure, des cheveux et des plumes, et l'élément contribue à leur odeur âcre lorsqu'il est brûlé.
Caractéristiques

Propriétés physiques
formes de soufre molécules polyatomiques avec différentes formules chimiques, avec le allotrope le plus connu étant Cyclooctasoufre, cyclo-S 8. Cyclooctasoufre est un doux, lumineux solide jaune avec seulement une légère odeur, semblable à celle de matchs. Il fond à 115,21 ° C, bout à 444,6 ° C et se sublime facilement. A 95,2 ° C, en dessous de sa température de fusion, les changements de cyclo-Cyclooctasoufre α-Cyclooctasoufre de la β- polymorphe. La structure S de la bague 8 est pratiquement inchangée par ce changement de phase, ce qui affecte les interactions intermoléculaires. Entre sa fusion et températures d'ébullition, Cyclooctasoufre change son allotrope nouveau, tournant de β-γ Cyclooctasoufre à teneur en soufre, à nouveau accompagné d'une densité plus faible mais a augmenté viscosité due à la formation de polymères. A des températures encore plus élevées, cependant, la viscosité diminue à mesure que la dépolymérisation se produit. Soufre fondu prend une couleur rouge foncé dessus de 200 ° C. La densité de soufre est d'environ 2 g · cm -3, en fonction de la forme allotropique; tous ses allotropes stables sont d'excellents isolants électriques.
Propriétés chimiques
Soufre brûle avec une flamme bleue concomitante avec formation de le dioxyde de soufre, remarquable pour son odeur suffocante particulière. Le soufre est insoluble dans l'eau mais soluble dans le disulfure de carbone et, dans une moindre mesure, dans d'autres solvants organiques non polaires, tels que le benzène et le toluène . La première et la seconde énergies d'ionisation de soufre sont 999,6 et 2252 kJ · mol -1, respectivement. Malgré ces chiffres, S 2+ est rare, S 4, 6+ étant plus fréquente. Les quatrième et sixième énergies d'ionisation sont 4556 et 8495,8 kJ · mol -1, la grandeur des chiffres provoquées par le transfert d'électrons entre les orbitales; ces états ne sont stables avec les oxydants forts comme le fluor , l'oxygène et le chlore .
Allotropes

formes de soufre de plus de 30 solides allotropes , plus que tout autre élément. Outre S 8, plusieurs autres cycles sont connus. Retrait un atome de la couronne donne S 7, qui est plus profondément jaune que S 8. L'analyse par HPLC de "soufre élémentaire" révèle un mélange de principalement 8 S à l'équilibre, mais avec S 7 et de petites quantités de S 6. Grandes anneaux ont été préparés, y compris S 12 et S 18.
Amorphe ou de soufre "plastique" est produit par un refroidissement rapide de l'exemple du soufre fondu pour, en le versant dans de l'eau froide. Études de cristallographie aux rayons X montrent que la forme amorphe peut avoir un structure hélicoïdale avec huit atomes par tour. Les molécules polymères à long enroulés font la substance brunâtre élastique, et en vrac cette forme a la sensation de caoutchouc brut. Cette forme est métastable à la température ambiante et progressivement revient cristallins allotrope moléculaire, qui ne est plus élastique. Ce processus se déroule en quelques heures à quelques jours, mais peut être catalysée rapidement.
Isotopes
Soufre a 25 connus isotopes , dont quatre sont stables: 32 S (95,02%), 33 S (0,75%), 34 S (4,21%), et 36 S (0,02%). En dehors de 35 S, avec une demi-vie de 87 jours et formée dans cosmique spallation de rayon de 40 Ar , le isotopes radioactifs de soufre ont des demi-vies de moins de 170 minutes.
Quand minéraux sulfurés précipitent, en équilibre isotopique entre les solides et le liquide peut causer de petites différences dans les valeurs δS-34 de minéraux co-génétique. Les différences entre les minéraux peuvent être utilisés pour estimer la température d'équilibre. Le δ C -13 et δS-34 de la coexistence et des sulfures minéraux carbonates peuvent être utilisés pour déterminer la pH et de l'oxygène fugacité du fluide minéralisée pendant la formation du minerai.
Dans la plupart des forêts des écosystèmes, le sulfate vient principalement de l'atmosphère; l'altération des minéraux de minerai et d'évaporites contribuent un peu de soufre. Soufre avec une composition isotopique distinctif a été utilisé pour identifier les sources de pollution, et le soufre enrichi a été ajouté comme traceur dans hydrologiques études. Les différences dans la abondances naturelles peuvent être utilisées dans les systèmes où il ya suffisamment de variation dans les 34 S de composantes de l'écosystème. Rocheuses lacs pensé à être dominé par des sources atmosphériques de sulfate ont été trouvés à avoir différents δ 34 S valeurs des lacs soupçonnés d'être dominé par bassin versant sources de sulfate.
Occurrence naturelle



32 S est créé à l'intérieur des étoiles massives, à une profondeur où la température est supérieure à 2,5 × 10 9 K, par le fusion d'un noyau de silicium plus un noyau d'hélium. Comme cela fait partie de la processus d'alpha qui produit des éléments en abondance, le soufre est le 10ème élément le plus commun dans l'univers.
Soufre, habituellement sous forme de sulfure, est présent dans de nombreux types de météorites. Chondrites ordinaires contiennent en moyenne 2,1% de soufre, et chondrites carbonées peuvent contenir jusqu'à 6,6%. Il est normalement présente que troilite (FES), mais il ya des exceptions, avec les chondrites carbonées contenant du soufre libre, aux sulfates et autres composés soufrés. Les couleurs distinctives de Jupiter s ' volcanique lune Io sont attribués à diverses formes de soufre fondu, solides et gazeux.
Sur Terre, le soufre élémentaire se trouve à proximité sources chaudes et volcaniques régions dans de nombreuses parties du monde, en particulier le long de la Anneau de feu du Pacifique; ces dépôts volcaniques sont actuellement exploités dans l'Indonésie , le Chili et le Japon. Ces dépôts sont polycristallin, avec le plus grand monocristal documentée mesure 22 × 16 × 11 cm. Historiquement, Sicile était une grande source de soufre dans la révolution industrielle .
D'importants gisements de soufre élémentaire, auraient été (et sont encore) synthétisée par bactéries anaérobies sur minéraux sulfatés comme le gypse , exister dans dômes de sel le long de la côte de la Golfe du Mexique , et évaporites en Europe orientale et en Asie occidentale. Soufre natif peut être produite uniquement par des processus géologiques. Dépôts de soufre fossiles de dômes de sel ont été jusqu'à récemment la base pour la production commerciale dans le États-Unis , la Russie , le Turkménistan et l'Ukraine . Actuellement, la production commerciale est toujours effectuée dans la mine Osiek en Pologne . Ces sources sont maintenant d'importance commerciale secondaire, et la plupart ne sont plus travaillées.
Des composés de soufre communes d'origine naturelle comprennent les minéraux sulfurés , tels que la pyrite (sulfure de fer), cinabre (sulfure de mercure), galène (sulfure de plomb), sphalérite (sulfure de zinc) et stibine (de sulfure d'antimoine); et les sulfates tels que le gypse (sulfate de calcium), alunite (sulfate d'aluminium et de potassium), et la barytine (sulfate de baryum). Sur Terre, tout comme sur la lune Io de Jupiter, le soufre élémentaire se produit naturellement dans les émissions volcaniques, y compris les émissions de évents hydrothermaux.
Production
Le soufre peut être trouvée en lui-même et historiquement été généralement obtenue de cette manière, tandis que la pyrite est une source de soufre par de l'acide sulfurique. Dans les régions volcaniques Sicile, dans les temps anciens, il a été trouvé sur la surface de la Terre, et le «processus sicilienne" a été utilisé: des dépôts de soufre ont été entassés et empilés dans des fours en briques construites sur des collines en pente, avec les espaces aériens entre eux. Puis, un peu de soufre a été pulvérisé, réparties sur le minerai empilé et enflammé, causant la soufre libre à fondre les collines. Finalement, les dépôts de surface transmises joués, et les mineurs excavés veines que finalement parsemaient le paysage sicilien mines labyrinthiques. Mines était non mécanisée et de main-d'œuvre, avec piqueurs libérer le minerai de la roche, et de mines ou garçons Carusi portant des paniers de minerai à la surface, souvent par le biais d'un mile ou plus de tunnels. Une fois que le minerai était à la surface, elle a été réduite et on l'extrait à fondre à des fours. Les conditions dans les mines de soufre siciliennes ont été horribles, incitant Booker T. Washington à écrire "Je ne suis pas prêt à dire tout à l'heure à quel point je crois en un enfer physique dans l'autre monde, mais une mine de soufre en Sicile est la chose la plus proche de l'enfer que je me attends à voir dans cette vie . ". Le sort de la Carusi est un thème secondaire dans le roman historique La Dame de la roue, par Angelo F. Coniglio.
La production de soufre du jour est en tant que produit secondaire d'autres procédés industriels tels que le raffinage du pétrole; dans ces procédés, le soufre se produit souvent que des composés indésirables ou néfastes qui sont extraites et converties en soufre élémentaire. Comme un minéral, soufre natif sous des dômes de sel est pensé pour être une ressource minérale fossile, produit par l'action des bactéries sur les dépôts anciens sulfate. Il a été retiré de ces mines de sel dôme principalement par les Processus Frasch. Dans ce procédé, l'eau surchauffée a été pompée dans un dépôt de soufre natif pour faire fondre le soufre, et de l'air comprimé puis retourné le produit fondu pur à 99,5% à la surface. Tout au long du 20e siècle, cette procédure produit du soufre élémentaire qui exigeait aucune autre purification. Cependant, en raison d'un nombre limité de ces dépôts de soufre et le coût élevé d'entre eux travaillent, ce processus pour le soufre minière n'a pas été utilisé d'une manière importante partout dans le monde depuis 2002.

Aujourd'hui, le soufre est produit à partir de pétrole, gaz naturel , et les ressources fossiles apparentées, à partir de laquelle il est obtenu principalement comme sulfure d'hydrogène. Composés organo, les impuretés indésirables dans le pétrole, peuvent être améliorés en les soumettant à hydrodésulfuration, qui clive les liaisons C-S:
- RSR + 2 H 2 → 2 RH + H 2 S
Le sulfure d'hydrogène résultant de ce procédé, et aussi car il se produit dans le gaz naturel est converti en soufre élémentaire par la Procédé Claus. Ce processus implique l'oxydation d'une partie de l'hydrogène sulfuré au dioxyde de soufre, puis la comproportionation des deux:
- 3 O 2 + 2 H 2 S → 2 SO 2 + 2 H 2 O
- SO 2 + 2 H 2 S → 3 S + 2 H 2 O

En raison de la forte teneur en soufre de la Athabasca Oil Sands, les stocks de soufre élémentaire de ce processus existe maintenant tout au long Alberta, Canada. Un autre moyen de stockage est en soufre liant pour le béton, le produit résultant ayant de nombreuses propriétés souhaitables.
La production mondiale de soufre en 2011 se élevait à 69 millions de tonnes (Mt), avec plus de 15 pays contribuant pour plus de 1 Mt chacun. Pays produisant plus de 5 Mt sont la Chine (9,6), des États-Unis (8,8), le Canada (7,1) et la Russie (7,1). Alors que la production a augmenté lentement de 1900 à 2010, le prix était beaucoup moins stable, en particulier dans les années 1980 et autour de 2010.
Composés
Communes états d'oxydation de la gamme de soufre -2 à 6. Soufre forme des composés stables avec tous les éléments sauf les gaz nobles .
Sulfures
Traitement de soufre avec de l'hydrogène donne sulfure d'hydrogène. Lorsqu'il est dissous dans l'eau, le sulfure d'hydrogène est légèrement acide:
- H 2 S
 HS - + H +
HS - + H +
L'hydrogène sulfuré gazeux et l'anion hydrosulfure sont extrêmement toxiques pour les mammifères, en raison de leur inhibition de la capacité de l'hémoglobine et l'oxygène certain porteurs cytochromes, d'une manière analogue à cyanure et azoture (voir ci-dessous, avec des précautions).
Réduction de soufre élémentaire donne des polysulfures, qui sont constitués de chaînes d'atomes de soufre - S terminés par des centres:
- 2 Na + S 8 → Na 2 S 8
Cette réaction souligne sans doute la seule propriété la plus distinctive de soufre: sa capacité à concaténer (se lier à lui-même par la formation de chaînes). La protonation de ces anions polysulfure donne les polysulfanes, H 2 S x, où x = 2, 3 et 4. En fin de compte réduction du soufre donne des sels de sulfure:
- 8 → 8 Na 2 S de 16 Na +
L'interconversion de ces espèces est exploitée dans le batterie au sodium-soufre. Le radical anion S 3 - donne la couleur bleue du minéral lapis-lazuli.

Avec oxydants très puissants, S 8 peut être oxydé, par exemple, pour donner bicyclique 8 S 2+.
Oxydes et oxanions
Les principaux oxydes de soufre sont obtenus par la combustion de soufre:
- S + O 2 → SO 2
- 2 SO 2 + O 2 → 2 SO 3
D'autres oxydes sont connus, par exemple l'oxyde de soufre et de disulfure mono- et dioxydes, mais ils sont instables.
Les oxydes de soufre forment de nombreux oxyanions de formule SO n 2. Le dioxyde de soufre et sulfites (SO 2-
3) sont liés à l'instabilité de l'acide sulfureux (H 2 SO 3). Trioxyde de soufre et de sulfates (SO 2-
4) sont liés à l'acide sulfurique . L'acide sulfurique et SO 3 se combinent pour donner de l'oléum, une solution de l'acide pyrosulfurique (H 2 S 2 O 7) dans de l'acide sulfurique.
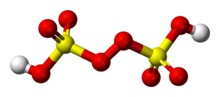 Acide peroxydisulfurique
Acide peroxydisulfurique
Peroxydes de convertir le soufre dans unstable tels que S O 8, un sulfoxyde. Acide de Caro (H 2 SO 5) et des acides peroxydisulfurique (H 2 S 2 O 8), fabriqués à partir de l'action de SO 3 sur concentré H 2 O 2 et H 2 SO 4 concentré sur H 2 O 2 respectivement.

4
Sels thiosulfate (S 2 O 2-
3), parfois appelé "hyposulfites", utilisés dans la fixation photographique (HYPO) et comme agents réducteurs, en vedette soufre dans deux états d'oxydation. le dithionite de sodium, le (S 2 O 2
4), contient l'anion dithionite plus fortement réducteur. dithionite de sodium (Na 2 S 2 O 6) est le premier élément de la polythioniques acides (H 2 S n o 6), où n peut varier de 3 à beaucoup.
Halogénures et oxyhalogénures
Les deux principaux sont les fluorures de soufre l'hexafluorure de soufre, un gaz dense utilisé comme carburant non réactif et non toxique, et tétrafluorure de soufre, un réactif organique qui est rarement utilisé très toxique. Leurs analogues chlorés sont le dichlorure de soufre et le monochlorure de soufre. Le chlorure de sulfuryle et acide chlorosulfurique sont des dérivés de l'acide sulfurique; chlorure de thionyle (SOCl 2) est un réactif commun à synthèse organique.
Pnictures
Une importante composé S-N est la cage Tétranitrure de tétrasoufre (S 4 N 4). Chauffage ce composé donne nitrure de soufre polymère ((SN) x), qui a des propriétés métalliques même si elle ne contient pas de métaux atomes. Thiocyanates contiennent le SCN - groupe. L'oxydation du thiocyanate donne thiocyanogène, (SCN) 2 grâce à la connectivité NCS-SCN. Sulfures de phosphore sont nombreux, le plus important étant l'commercialement cages P 4 S 10 et P 4 S 3.
sulfures métalliques
Les principaux minerais de cuivre, de zinc, de nickel, de cobalt, de molybdène et d'autres métaux sont des sulfures. Ces matériaux ont tendance à être de couleur sombre semi-conducteurs qui ne sont pas facilement attaqué par l'eau ou même de nombreux acides. Elles sont formées, à la fois géochimiquement et en laboratoire, par la réaction du sulfure d'hydrogène avec des sels métalliques. Le minéral galène (PBS) a été le premier semi-conducteur démontré et a trouvé une utilisation comme un signal dans le redresseur moustaches de chat de début radios de cristal. Le sulfure de fer appelé la pyrite , la soi-disant «or des fous», a la formule FeS 2. La mise à niveau de ces minerais, habituellement par torréfaction, est coûteux et dangereux pour l'environnement. Soufre corrode nombreux métaux via le processus appelé ternissement.
Composés organiques
- Des exemples de composés organiques soufrés

L'allicine, l'ingrédient actif dans l'ail

R- cystéine, un acide aminé contenant un groupe thiol

La méthionine, un acide aminé contenant un thioéther

Disulfure de diphényle, d'un disulfure représentant
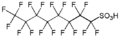
L'acide perfluorooctane sulfonique, un tensioactif controversée

Dibenzothiophène, un composant du pétrole brut

Pénicilline
Certaines des principales classes de composés organiques contenant du soufre sont les suivants:
- Thiols ou mercaptans (car ils sont mer urers Cury de capt que chélateurs) sont les analogues de soufre de alcools ; traitement de thiols avec une base donne ions thiolate.
- Des thioéthers sont les analogues de soufre de éthers .
- Ions sulfonium ont trois groupes attachés à un centre de soufre cationique. Diméthylsulfoniopropionate (DMSP) est un tel composé, important dans l'organique marine cycle du soufre.
- Sulfoxydes et sulfones sont des thioéthers avec une et deux atomes d'oxygène liés à l'atome de soufre, respectivement. Le sulfoxyde simple, le sulfoxyde de diméthyle, est un solvant commun; une sulfone commune est sulfolane.
- Les acides sulfoniques sont utilisés dans de nombreux détergents.
Composés avec des liaisons carbone-soufre sont rares à l'exception notable des le disulfure de carbone, d'un liquide incolore volatil qui est structurellement similaire au dioxyde de carbone. Il est utilisé comme réactif pour préparer le polymère rayonne et de nombreux composés organiques soufrés. Contrairement à l'oxyde de carbone , monosulfure de carbone ne est stable comme un gaz dilué, comme dans le milieu interstellaire.
Organosulfurés composés sont responsables de la partie des odeurs désagréables de la matière organique en décomposition. Ils sont utilisés dans le odoration de gaz naturel et causent l'odeur de l'ail et de pulvérisation skunk. Tous les composés organiques soufrés sentent pas désagréable à toutes les concentrations: le contenant du soufre monoterpénoïde pamplemousse mercaptan en petites concentrations est responsable de l'odeur caractéristique de pamplemousse, mais a une odeur thiol générique à des concentrations plus grandes. Le gaz moutarde, un puissant vesicant, a été utilisé dans la Première Guerre mondiale comme agent invalidante.
Des liaisons soufre-soufre sont un composant structurel pour raidir le caoutchouc, d'une manière similaire au rôle biologique des ponts disulfure pour rigidifier protéines (voir ci-dessous biologique). Dans le type le plus commun de l'industrie «guérir» ou le durcissement et le renforcement des ressources naturelles du caoutchouc , du soufre élémentaire est chauffé avec le caoutchouc au point que les réactions chimiques se forment des ponts disulfure entre motifs d'isoprène du polymère. Ce processus, breveté en 1843, a permis de caoutchouc pour devenir un produit industriel, notamment les pneus d'automobiles. En raison de la chaleur et de soufre, le procédé a été nommé vulcanisation, d'après le dieu romain de la forge et le volcanisme.
Histoire
Antiquité

Être disponible en abondance sous forme native, le soufre ( latine soufre) était connu dans l'Antiquité et est appelée dans la Torah ( Genesis). Traductions de la Bible en anglais communément appelés feu et de soufre comme "soufre", donnant lieu à la nom de ' fire-and-soufre » sermons, dans laquelle les auditeurs sont rappelé le sort des damnation éternelle qui attendent les incrédules et impénitent. Ce est dans cette partie de la Bible que Enfer est implicite à "odeur de soufre" (probablement en raison de son association avec l'activité volcanique). Selon le Papyrus Ebers, une pommade de soufre a été utilisé dans l'ancienne Egypte pour traiter paupières granulaires. Soufre a été utilisé pour la fumigation dans préclassique la Grèce ; ce est mentionné dans le Odyssey . Pline l'Ancien parle de soufre dans le livre 35 de son Histoire Naturelle, en disant que son plus connue source est l'île de Melos. Il mentionne son utilisation pour la fumigation, la médecine, et un chiffon de blanchiment.
Une forme naturelle de soufre connu comme shiliuhuang était connu en Chine depuis le 6ème siècle avant JC et retrouvés dans les Hanzhong. Par le 3ème siècle, les Chinois ont découvert que le soufre pourrait être extraite de la pyrite . Chinois taoïstes étaient intéressés à l'inflammabilité d'soufre et sa réactivité avec certains métaux, mais ses premières utilisations pratiques ont été trouvés dans la médecine traditionnelle chinoise. Une dynastie des Song militaire traité de 1044 AD décrit différentes formules pour le chinois poudre noire , qui est un mélange de nitrate de potassium (KNO 3), charbon de bois et de soufre.
Les premiers alchimistes ont donné sa propre soufre symbole alchimique, un triangle au sommet d'une croix. Dans le traitement de la peau traditionnelle avant l'ère moderne de la médecine scientifique, le soufre élémentaire a été utilisé principalement dans les crèmes, pour alléger les conditions telles que la gale, teigne, le psoriasis, l' eczéma et l'acné . Le mécanisme d'action est inconnu, bien que le soufre élémentaire ne se oxyde lentement à l'acide sulfureux, qui à leur tour (par l'action de sulfite) agit comme un agent réducteur doux et antibactérien.
Les temps modernes

En 1777, Antoine Lavoisier a contribué à convaincre la communauté scientifique que le soufre est un élément, pas un composé. Avec le soufre de la Sicile étant contrôlée principalement par le marché français, un débat a suivi sur la quantité de soufre France et la Grande-Bretagne ont obtenu. Cela a conduit à un affrontement sanglant entre les deux parties en 1840. En 1867, le soufre a été découvert dans des dépôts souterrains Louisiane et Texas. Le grand succès Frasch processus a été développé pour extraire cette ressource.
Dans la fin du 18e siècle, fabricants de meubles utilisés soufre fondu pour produire décorative incrustations dans leur métier. À cause de la le dioxyde de soufre produite pendant le processus de fusion du soufre, le métier d'inlays de soufre a été rapidement abandonnée. Soufre fondu est encore parfois utilisé pour régler des boulons en acier dans les trous forés en béton où la résistance aux chocs élevée est souhaitée pour les points de fixation de l'équipement au plancher. Soufre en poudre pur a été utilisé comme tonique médicinal et laxatif. Avec l'avènement de la processus de contact, la majorité du soufre est aujourd'hui utilisé pour faire de l'acide sulfurique pour un large éventail d'utilisations, en particulier engrais.
Orthographe et l'étymologie
Soufre vient par l'intermédiaire de l'ancien français soufre latine, qui à son tour est apparemment formé sur une racine qui signifie «brûler». L'élément était traditionnellement orthographié soufre dans le Royaume-Uni (depuis le 14ème siècle), la plupart de la Communauté , y compris l'Australie , l'Inde , la Malaisie , l'Afrique du Sud et Hong Kong , avec le reste de la Caraïbes et l'Irlande . Le soufre est utilisé aux États-Unis, tandis que les deux orthographes sont utilisées au Canada et aux Philippines .
Cependant, la UICPA a adopté le soufre d'orthographe en 1990, de même que le Société royale du Comité Chimie nomenclature en 1992. Le Qualifications and Curriculum Authority pour l'Angleterre et le Pays de Galles a recommandé son utilisation en 2000, et il apparaît maintenant dans les examens du GCSE. Les dictionnaires Oxford notent que «En chimie ... l'orthographe -f- est maintenant la forme standard dans tous les mots liés dans le domaine dans les deux contextes britanniques et américains."
En latin, le mot est diversement sulpur, le soufre et le soufre (Oxford Dictionary latine répertorie les orthographes dans cet ordre) écrit. Ce est un nom d'origine latine et pas un grec classique prêt, si la variante de ph ne désigne pas la lettre grecque φ (phi). Soufre en grec est Thion (θείον), d'où vient le préfixe thiosulfate. La simplification de la p du mot latin ou le pH à une f semble avoir eu lieu vers la fin de la période classique.
Applications
Acide sulfurique
Le soufre élémentaire est utilisé principalement en tant que précurseur d'autres produits chimiques. Environ 85% (1989) est converti en acide sulfurique ( H 2 SO 4):
- 2 S + 3 O 2 + 2 H 2 O → 2 H 2 SO 4
Avec de l'acide sulfurique être d'une importance centrale à la les économies mondiales, la production et la consommation est un indicateur de développement industriel d'une nation. Par exemple, avec 32,5 millions de tonnes en 2010, les États-Unis produisent plus d'acide sulfurique chaque année que tout autre produit chimique industriel inorganique. La principale utilisation de l'acide est l'extraction de minerais de phosphate pour la production de la fabrication d'engrais. D'autres applications de l'acide sulfurique sont le raffinage du pétrole, le traitement des eaux usées, et de l'extraction minière.

D'autres produits chimiques de soufre à grande échelle
Le soufre réagit directement avec le méthane pour donner le disulfure de carbone, qui est utilisé pour la fabrication cellophane et rayonne. L'une des utilisations directes de soufre est dans vulcanisation du caoutchouc, où polysulfures réticuler des polymères organiques. Les sulfites sont fortement utilisés pour javellisant papier et comme conservateurs dans séchés fruits . Beaucoup des agents tensioactifs et des détergents, par exemple, le laurylsulfate de sodium, sont produits sont des dérivés sulfatés. Le sulfate de calcium, le gypse, (CaSO 4 · 2H 2 O) est extrait à l'échelle de 100 millions de tonnes chaque année pour une utilisation dans Ciment Portland et des engrais.
Lorsque à base d'argent la photographie a été généralisée, de sodium et d'ammonium thiosulfate ont été largement utilisés comme "agents de fixation." Le soufre est un composant de la poudre à canon .
Engrais
Le soufre est de plus en plus utilisé en tant que composant de fertilisants . La forme la plus importante de soufre pour les engrais est le minéral du sulfate de calcium. Le soufre élémentaire est hydrophobe (ce est à dire qu'il ne est pas soluble dans l'eau) et, par conséquent, ne peuvent pas être utilisés directement par les plantes. Avec le temps, les bactéries du sol peuvent convertir en dérivés solubles, qui peuvent ensuite être utilisées par les plantes. Soufre améliore l'efficacité de l'utilisation d'autres éléments nutritifs essentiels, en particulier l'azote et le phosphore. Des particules de soufre produites biologiquement sont naturellement hydrophile en raison d'un revêtement de biopolymère. Ce soufre est donc plus facile de se disperser sur la terre (par pulvérisation comme une suspension diluée), et les résultats à une libération plus rapide.
exigences des plantes pour le soufre sont égales ou supérieures à celles pour le phosphore. Il est l'un des principaux éléments nutritifs essentiels à la croissance de la plante, de la racine la formation de nodules des légumineuses et les plantes des mécanismes de protection. carence en soufre se est répandue dans de nombreux pays en Europe. Parce que les apports atmosphériques de soufre continuent de diminuer, le déficit de l'entrée de soufre / sortie est susceptible d'augmenter, à moins que les engrais de soufre sont utilisés.
La chimie fine

Organo composés sont utilisés en les produits pharmaceutiques, des colorants, et des produits agrochimiques. De nombreux médicaments contiennent du soufre, des exemples étant le début antibactérienne sulfamides, connu sous le nom des sulfamides. Le soufre est une partie de nombreuses molécules de défense bactériennes. Plus les antibiotiques β-lactames, y compris la pénicillines, céphalosporines et monolactams contiennent du soufre.
Le sulfate de magnésium, connu sous le nom de sels d'Epsom lorsqu'elle est sous forme hydratée cristalline, peut être utilisé comme un laxatif, un additif de bain, une exfoliant, magnésium supplément pour les plantes, ou (lorsque sous forme déshydratée) comme un dessiccatif.
Fongicides et pesticides

Le soufre élémentaire est l'un des fongicides et des pesticides les plus anciennes. "Soufre Dépoussiérage," soufre élémentaire sous forme de poudre, est un fongicide commune pour les raisins, fraises, de nombreux légumes et plusieurs autres cultures. Il a une bonne efficacité contre une large gamme de maladies oïdium ainsi que la tache noire. En production biologique, le soufre est le fongicide le plus important. Il est le seul fongicide utilisé dans organiquement la production de pommes d'élevage contre la maladie principale tavelure dans des conditions froides. Biosulfur (du soufre élémentaire produit biologiquement avec des caractéristiques hydrophiles) peut être ainsi utilisé pour ces applications.
Standard-poussière soufre formulation est appliquée sur les cultures avec un chiffon de soufre ou d'un plan de formation de poussière. Soufre mouillable est le nom commercial pour le dépoussiérage de soufre formulé avec des ingrédients supplémentaires pour rendre l'eau miscibles. Elle a des applications similaires et est utilisé comme un fongicide contre la la moisissure et d'autres problèmes liés à la moisissure avec plantes et le sol.
Poudre de soufre élémentaire est utilisé comme " organique (ce est à dire "vert") " insecticide (en fait un acaricide) contre les tiques et les mites. Une méthode courante d'utilisation est à la poussière des vêtements ou des membres de la poudre de soufre.
Les solutions diluées de sulfure de calcium (faites par conjugons hydroxyde de calcium avec du soufre élémentaire dans l'eau), sont utilisés comme trempette pour les animaux de compagnie à détruire la teigne (champignon), la gale et d'autres dermatoses et parasites. bougies de soufre constitués de soufre presque pur dans des blocs ou des pastilles qui sont brûlé à la fumigation des structures. Il est plus utilisé dans le foyer en raison de la toxicité des produits de combustion.
Bactéricide dans la vinification et de conservation des aliments
De petites quantités de plus de dioxyde de soufre de gaz (ou équivalent plus de métabisulfite de potassium) pour le vin fermenté pour produire des traces de l'acide sulfureux (produit lorsque SO 2 réagit avec l'eau) et de ses sels de sulfite dans le mélange, qui a été appelé "l'outil le plus puissant dans la vinification. " Après l'étape de fermentation dans la levure de vinification, sulfites absorbent l'oxygène et inhibent la croissance des bactéries aérobies qui seraient autrement transformer l'éthanol en acide acétique, acidification du vin. Sans cette étape de conservation, réfrigération indéfinie du produit avant sa consommation est habituellement exigé. Des méthodes similaires remontent à l'antiquité, mais mentionne historique moderne de la pratique aller au XVe siècle. La pratique est utilisée par de grands producteurs de vin industriel et les petits producteurs de vin biologique de même.
Le dioxyde de soufre et divers sulfites ont été utilisés pour leurs propriétés antioxydantes conservateur antibactérien dans de nombreux autres secteurs de l'industrie alimentaire également. La pratique a diminué depuis les rapports d'une réaction allergique comme de certaines personnes sulfites dans les aliments.
Rôle biologique
Protéines et cofacteurs organiques
Le soufre est une composante essentielle de tous les vivants cellules . Ce est la septième ou huitième élément le plus abondant dans le corps humain en poids, étant d'environ aussi commun que le potassium , et un peu plus commun que le sodium ou le chlore. A 70 kg corps humain contient environ 140 grammes de soufre.
Dans les plantes et les animaux , les acides aminés la cystéine et méthionine contient la majeure partie du soufre. L'élément est donc présent dans tous les les polypeptides, les protéines , et les enzymes qui contiennent ces acides aminés. Chez l'homme, méthionine est un acide aminé essentiel qui doit être ingérée. Cependant, sauf pour les vitamines la biotine et la thiamine , la cystéine et les composés soufrés dans le corps humain peuvent être synthétisés à partir de la méthionine.
Ponts disulfure (obligations SS) formées entre les résidus cystéine dans les chaînes peptidiques sont très importants dans l'assemblage des protéines et de la structure. Ces liaisons covalentes entre chaînes peptidiques confèrent résistance et de rigidité. Par exemple, la haute résistance de plumes et de cheveux est en partie en raison de leur teneur élevée en obligations SS et leur teneur élevée en cystéine et le soufre. Les œufs sont riches en soufre, car de grandes quantités de l'élément sont nécessaires pour la formation de plume, et l'odeur caractéristique d'oeufs pourris est due à sulfure d'hydrogène. Le disulfure haute teneur en lien de poils et de plumes contribue à leur indigestibilité et de leur odeur désagréable caractéristique lorsqu'il est brûlé.
L'homocystéine et de la taurine sont d'autres acides contenant du soufre qui sont de structure similaire, mais pas codés par l'ADN , et ne font pas partie de la structure primaire des protéines. De nombreuses enzymes cellulaires importants utilisent des groupes prosthétiques se terminant avec des groupements SH pour gérer les réactions biochimiques impliquant contenant acyl-: deux exemples courants de métabolisme de base sont coenzyme A et l'acide alpha-lipoïque. Deux des 13 vitamines classiques, la biotine et la thiamine contiennent du soufre, ce dernier étant appelé pour sa teneur en soufre. Le soufre joue un rôle important, en tant que support de la réduction de l'hydrogène et ses électrons, pour la réparation cellulaire d'oxydation. Réduit glutathion, un tripeptide contenant du soufre, est un agent réducteur à travers son sulfhydryle (-SH) fragment dérivé de la cystéine. Le thiorédoxines, une classe de la petite protéine essentielle à toute vie connue, en utilisant des paires voisines de cystéines réduits à agir protéine générale des agents réducteurs, dans le même sens.
Méthanogénèse, la route à la plupart des méthane dans le monde, est une transformation biochimique en plusieurs étapes de dioxyde de carbone . Cette conversion nécessite plusieurs cofacteurs organiques soufrés. Il se agit notamment coenzyme M, CH 3 SCH 2 CH 2 SO 3 - , le précurseur immédiat de méthane .
Métalloprotéines et cofacteurs inorganiques
Inorganique du soufre fait partie des groupes fer-soufre ainsi que de nombreuses protéines de cuivre, de nickel et de fer. La plus répandue sont les ferrodoxins, qui servent de navettes d'électrons dans les cellules. Chez les bactéries, les importantes enzymes nitrogénase contient un groupe de Fe-Mo-S, est un catalyseur qui remplit la fonction importante de la fixation de l'azote , la conversion de l'azote atmosphérique en ammoniaque qui peut être utilisé par les micro-organismes et des plantes pour fabriquer des protéines, l'ADN, l'ARN, les alcaloïdes et les autres composés azotés organiques nécessaires à la vie.
le métabolisme du soufre et le cycle du soufre
Le cycle de soufre a été le premier des cycles biogéochimiques à découvrir. Dans les années 1880, alors qu'il étudiait Beggiatoa (une bactérie vivant dans un environnement riche en soufre), Sergei Winogradsky constaté qu'il oxydé sulfure d'hydrogène (H 2 S) comme source d'énergie, former des gouttelettes de soufre intracellulaires. Winogradsky référence à cette forme de métabolisme comme inorgoxidation (oxydation des composés inorganiques). Il a continué à étudier avec Selman Waksman jusqu'à ce que les années 1950.
Le soufre peut servir d'énergie (nourriture chimique) source de bactéries qui utilisent de l'hydrogène sulfuré (H 2 S) à la place de l'eau comme l' électron donneur dans une primitive photosynthèse processus -comme dans lequel l'oxygène est le récepteur de l'électron. Les photosynthétiques Chlorobi et bactérie pourpre sulfureuse et certains chémolithotrophes utilisent l'oxygène élémentaire à effectuer de tels oxydation du sulfure d'hydrogène pour produire du soufre élémentaire (S 0 ), l'état d'oxydation = 0. bactéries primitives qui vivent autour Deep Ocean évents volcaniques oxyder le sulfure d'hydrogène dans cette manière avec de l'oxygène; voir ver géant de tube pour un exemple de grands organismes qui utilisent le sulfure d'hydrogène (par l'intermédiaire de bactéries) pour l'alimentation à oxyder.
La dite les bactéries sulfato-réductrices, en revanche, "respirent sulfate" au lieu de l'oxygène. Ils utilisent le soufre comme accepteur d'électrons, et de réduire les divers composés de soufre oxydés en sulfure avant, souvent en sulfure d'hydrogène. Ils peuvent se développer sur un certain nombre d'autres composés de soufre oxydés partiellement (par exemple, les thiosulfates, les thionates, les polysulfures, les sulfites). Le sulfure d'hydrogène produit par ces bactéries est responsable d'une partie de l'odeur du gaz intestinaux ( intestinaux) et les produits de décomposition.
Le soufre est absorbé par les plantes par les racines dans le sol comme le sulfate et transporté comme un ester de phosphate. Sulfate est réduit en sulfure par le sulfite avant son incorporation dans la cysteine et d'autres composés organiques soufrés.
- SO4 2-SO →3 2-→ H2S → → cystéine méthionine
Précautions

Le soufre élémentaire est non toxique, comme le sont en général solubles dans les sulfates sels, tels que des sels d'Epsom. Les sels de sulfates solubles sont mal absorbés et laxatif. Toutefois, lorsqu'elles sont injectées par voie parenterale, ils sont librement filtrés par les reins et éliminés avec très peu de toxicité dans des quantités de plusieurs grammes.
Lors de la combustion de soufre dans l'air, il produit le dioxyde de soufre. dans l'eau, ce gaz produit de l'acide sulfureux et sulfites, qui sont des antioxydants qui inhibent la croissance des bactéries aérobies et permettent son utilisation comme additif alimentaire dans de petites quantités. Cependant, à des concentrations élevées de ces acides nuisent pas aux les poumons, yeux ou autres tissus. Chez les organismes sans poumons tels que des insectes ou des plantes, il empêche par ailleurs la respiration à des concentrations élevées. trioxyde de soufre (produit par catalyse à partir de dioxyde de soufre) et l'acide sulfurique sont tout aussi hautement corrosif, en raison de les acides forts qui forment au contact de l'eau.
La combustion du charbon et / ou de pétrole par l'industrie et les centrales électriques génère du dioxyde de soufre (SO 2 ), qui réagit avec l'eau atmosphérique et de l'oxygène pour produire de l'acide sulfurique (H 2 SO 4 ) et l'acide sulfureux (H 2 SO 3 ). Ces acides sont des composantes de la pluie acide , qui abaissent le pH du sol organismes et d'eau douce, ce qui entraîne parfois des dommages importants à l' environnement et l'altération chimique des statues et des structures. normes de carburant exigent de plus en plus que les producteurs de carburant extraient le soufre des combustibles fossiles pour empêcher la formation de pluies acides. Cet extrait soufre et raffiné représente une grande partie de la production de soufre. Dans les centrales au charbon, gaz de combustion sont parfois purifiés. Plus de centrales électriques modernes qui utilisent le gaz de synthèse extraire le soufre avant qu'elles ne brûlent le gaz.
Le sulfure d'hydrogène est aussi toxique que le cyanure d'hydrogène , et tue par le même mécanisme, bien que le sulfure d'hydrogène est moins susceptible d'entraîner des intoxications surprise de petites quantités inhalation, en raison de son odeur désagréable avertissement. Bien piquante au premier abord, cependant, le sulfure d'hydrogène amortit rapidement le sens de l'odorat-si une victime peut respirer des quantités croissantes et ne pas être conscients de sa présence jusqu'à disparition des symptômes graves se produisent, ce qui peut rapidement conduire à la mort. Dissous sulfure et sels hydrosulfures sont également toxiques par le même mécanisme .

