
Krypton
À propos de ce écoles sélection Wikipedia
SOS Enfants a essayé de rendre le contenu plus accessible Wikipedia par cette sélection des écoles. Mères SOS chaque regard après une une famille d'enfants parrainés .
| Krypton | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
36 Kr | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
gaz incolore, présentant une lueur blanchâtre dans un champ électrique élevé  Raies spectrales du krypton | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | krypton, Kr, 36 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / k r ɪ p t ɒ n / Krip -ton | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Élément Catégorie | gaz nobles | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | 18 (gaz rares) , 4, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 83,798 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Ar ] 3d 10 4s 2 4p 6 2, 8, 18, 8 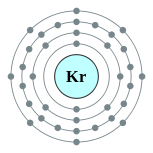 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | William Ramsay et Morris Travers (1898) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | William Ramsay et Morris Travers (1898) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | gaz | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité | (0 ° C, 101,325 kPa) 3,749 g / L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité à BP | 2,413 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 115,79 K , -157,36 ° C, -251,25 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 119,93 K, -153,22 ° C, -244,12 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point triple | 115,775 K (-157 ° C), 73,2 kPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point critique | 209,41 K, 5,50 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 1,64 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 9,08 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 5 R / 2 = 20,786 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 2, 1, 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 3,00 (échelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 1350,8 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 2350,4 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3ème: 3565 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 116 ± 16 heures | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 202 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique à faces centrées  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 9,43 × 10 -3 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | (Gaz, 23 ° C) 220, (liquide) 1120 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7439-90-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes du krypton | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Krypton (du grec : κρυπτός kryptos "le caché») est un élément chimique avec le symbole Kr et de numéro atomique 36. Ce est un membre du groupe 18 (gaz nobles) éléments. Inodore, incolore et insipide, gaz noble , le krypton se produit dans état de traces dans l' atmosphère , est isolé par distillation fractionnée de l'air liquéfié, et est souvent utilisé avec d'autres gaz rares lampes fluorescentes. Krypton est inerte à des fins plus pratiques.
Krypton, comme les autres gaz nobles , peut être utilisé dans l'éclairage et la photographie. Krypton la lumière a un grand nombre de lignes spectrales, et la sortie de la lumière élevée de krypton dans les plasmas lui permet de jouer un rôle important dans de nombreux lasers de forte puissance gaz (krypton ions et lasers excimères), qui prélèvent sur l'une des nombreuses raies spectrales à amplifier. Il existe également un spécifique Laser à fluorure de krypton. La puissance élevée et la facilité relative de fonctionnement de tubes à décharge krypton causés (1960-1983) la durée officielle d'un mètres à définir en termes de 605 nm (rouge-orange) raie spectrale de krypton-86.
Histoire

Krypton a été découvert en Grande-Bretagne en 1898 par Sir William Ramsay, un chimiste écossais, et Morris Travers, un chimiste anglais, dans les résidus de se évaporer laissé presque tous les composants de l'air liquide. Neon a été découvert par une procédure similaire par les mêmes travailleurs seulement quelques semaines plus tard. William Ramsay a reçu le 1904 Prix Nobel de chimie pour la découverte d'une série de gaz rares , y compris le krypton.
En 1960, un accord international défini le compteur en termes de longueur d'onde de la lumière émise par le krypton-86 isotope (longueur d'onde de 605,78 nm). Cet accord a remplacé le mètre étalon de longue date situé à Paris , qui était une barre de métal fait d'une platine - iridium alliage (la barre a été estimé à l'origine pour être un dix-millionième d'un quadrant de la Terre circonférence polaire s '), et était lui-même remplacé par une définition basée sur la vitesse de la lumière - une constante physique fondamentale. Cependant, en 1927, le Conférence internationale sur les poids et mesures a redéfini le compteur en termes de rouge de cadmium raie spectrale (1 m = 1,553,164.13 longueurs d'onde). En Octobre 1983, le même bureau défini le mètre comme la distance que la lumière voyage dans un vide pendant 1/299 792 458 s.
Caractéristiques
Le krypton est caractérisée par plusieurs lignes d'émission tranchants ( signatures spectrales) être le plus fort de vert et jaune. Il est l'un des produits de l'uranium fission . solidifiés krypton est blanc et cristallin avec un face-centrée cubique la structure cristalline, qui est une propriété commune de tous les gaz rares (à l'exception de l'hélium, avec une structure de cristal hexagonale compacte).
Isotopes
Naturellement krypton se produisant est faite de six stables isotopes. En outre, une trentaine d'isotopes instables et isomères sont connus. 81 Kr, le produit de réactions atmosphériques, est produit avec les autres d'origine naturelle des isotopes du krypton. Être radioactive, il a une demi-vie de 230.000 ans. Krypton est très volatil lorsqu'il est à proximité des eaux de surface, mais 81 Kr a été utilisé pour la datation des vieux (50,000-800,000 ans) les eaux souterraines.
85 Kr est un gaz rare radioactif inerte avec une demi-vie de 10,76 années. Elle est produite par la fission de l'uranium et du plutonium , comme dans la bombe nucléaire essais et réacteurs nucléaires. 85 Kr est libéré lors du retraitement des crayons combustibles de réacteurs nucléaires. Les concentrations au Pôle Nord sont 30% plus élevé qu'à la Pôle Sud en raison du mélange convectif.
Chimie
Comme les autres gaz nobles, le krypton est chimiquement non réactif. Cependant, après la première synthèse réussie de xénon dans les composés 1962, la synthèse de krypton difluorure (KrF 2) a été signalé en 1963. Dans la même année, KrF 4 a été rapporté par Grosse, et al., mais a par la suite révélé être une identification erronée. Il ya aussi des informations non vérifiées d'un baryum sel d'un krypton oxoacide. Ar Kr + et Kr H + ions polyatomiques ont été étudiés et il existe des preuves pour Kr Xe ou KrXe +.
Composés à krypton liés à des atomes autres que le fluor ont également été découvertes. La réaction de 2 avec B KrF (OTEF 5) 3 produit un composé instable, Kr (OTEF 5) 2, qui contient une liaison oxygène-krypton. Une liaison krypton-azote se trouve dans le cation [HC≡N-Kr-F] +
, Produit par la réaction de 2 avec KrF [HC≡NH] +
[ASF -
6] inférieure à -50 ° C. HKrCN et HKrC≡CH (krypton-hydrure cyanure et hydrokryptoacetylene) ont été signalés à être stable jusqu'à 40 K .
Occurrence naturelle
La Terre a conservé tous les gaz rares qui étaient présents lors de sa formation à l'exception de l'hélium . La concentration du krypton dans le atmosphère est d'environ 1 ppm. Il peut être extrait de l'air liquide par distillation fractionnée. La quantité de krypton dans l'espace ne est pas certain, lorsque la quantité est dérivée de l'activité météorique et que des vents solaires. Les premières mesures suggèrent une surabondance de krypton dans l'espace.
Applications


Plusieurs lignes d'émission de Krypton font les rejets de gaz krypton ionisé apparaissent blanchâtres, qui à son tour rend ampoules à krypton-utile dans la photographie comme une source de lumière blanche brillante. Krypton est ainsi utilisée dans certains types de flashs photographiques utilisés à haute vitesse la photographie . Le gaz Krypton est également combiné avec d'autres gaz à faire des signes lumineux qui brillent avec une lumière verdâtre-jaune vif.
Krypton mélange avec de l'argon en tant que gaz de remplissage des lampes fluorescentes d'économie d'énergie. Cela réduit leur consommation d'énergie. Malheureusement, cela réduit également leur production de lumière et soulève leur coût. Krypton coûte environ 100 fois plus que l'argon. Krypton (avec xénon) est également utilisé pour remplir les lampes à incandescence de réduire l'évaporation du filament et de permettre plus les températures de fonctionnement à utiliser pour le filament. A résultats brillantes de lumière qui contient plus de bleu que les lampes classiques.
Pertes blanches de Krypton est souvent utilisé à bon escient dans des tubes à décharge de gaz de couleur, qui sont ensuite simplement peint ou teint dans d'autres moyens pour permettre la couleur désirée (par exemple, " néon "panneaux publicitaires de type où les lettres apparaissent dans différentes couleurs sont souvent entièrement krypton-based). Krypton est également capable de densité de puissance beaucoup plus de lumière que le néon dans la région de la ligne rouge spectrale, et pour cette raison, les lasers rouges pour haute puissance lumière laser spectacles sont souvent lasers krypton avec des miroirs qui sélectionnent la ligne rouge du spectre pour l'amplification laser et des émissions, plutôt que le plus familier variété hélium-néon, qui ne pourrait jamais pratiquement atteindre les multi-sorties watts de lumière laser rouge nécessaires pour cette application.
Krypton a un rôle important dans la production et l'utilisation de la Laser à fluorure de krypton. Le laser a été important dans la communauté de recherche sur l'énergie de fusion nucléaire dans des expériences de confinement. Le laser a grande uniformité du faisceau, à court longueur d'onde, et la possibilité de modifier la taille du point de suivre un culot implosion.
Dans expérimentale en physique des particules , le krypton liquide est utilisé pour construire des quasi-homogène électromagnétique calorimètres. Un exemple notable est le calorimètre de la Expérience NA48 au CERN contenant environ 27 tonnes de krypton liquide. Cet usage est rare, puisque le liquide moins cher argon est généralement utilisé. L'avantage de krypton sur l'argon est un petit Molière rayon de 4,7 cm, ce qui permet une excellente résolution spatiale et faible degré de chevauchement. Les autres paramètres pertinents pour l'application de la calorimétrie sont: longueur de rayonnement de X 0 = 4,7 cm, densité de 2,4 g / cm 3.
Les assemblées des éclateurs scellées contenues dans excitateurs d'allumage utilisés dans certains moteurs âgés de jet contiennent une très petite quantité de Krypton-85 pour obtenir des niveaux d'ionisation cohérente et un fonctionnement uniforme.
Krypton-83 a des applications dans imagerie par résonance magnétique (IRM) pour l'imagerie des voies respiratoires. En particulier, elle peut être utilisée pour distinguer entre des surfaces hydrophobes et hydrophiles contenant une voie aérienne.
Bien que le xénon a un potentiel pour une utilisation dans la tomodensitométrie (TDM) pour évaluer la ventilation régionale, ses propriétés anesthésiques limitent sa fraction dans le gaz respiratoire à 35%. L'utilisation d'un mélange respirable contenant 30% de xénon et de krypton 30% est comparable en efficacité à CT xénon à une fraction de 40%, tout en évitant les effets indésirables d'une fraction élevée de xénon gazeux.
Précautions
Le krypton est considéré comme non toxique asphyxiant. Krypton a un puissance narcotique sept fois plus grande que l'air, respirer un gaz contenant 50% de krypton et 50% d'air causerait une narcose similaire à respirer l'air à quatre fois la pression atmosphérique. Ce serait comparable à la plongée à une profondeur de 30 m (100 pi) (voir narcose à l'azote) et pourraient potentiellement affecter ne importe qui respire. Néanmoins, ce mélange ne contiendra que 10% d'oxygène et hypoxie serait une plus grande préoccupation.
