
Einsteinium
Saviez-vous ...
SOS Enfants, qui se déroule près de 200 sos écoles dans le monde en développement, a organisé cette sélection. Cliquez ici pour en savoir plus sur le parrainage d'enfants.
| Einsteinium | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
99 Es | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||
argenté  | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | einsteinium, Es, 99 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / aɪ n s t aɪ n Je ə m / STY eyen- -neE-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Catégorie Metallic | actinides | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 7, fa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | (252) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Rn ] 5f 11 7s 2 2, 8, 18, 32, 29, 8, 2  | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Lawrence Berkeley National Laboratory (1952) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 8,84 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1133 K , 860 ° C, 1580 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 2, 3, 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,3 (échelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1e: 619 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | cubique à faces centrées  | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7429-92-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Les isotopes d'einsteinium | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
Einsteinium est un élément synthétique avec le symbole Es et de numéro atomique 99. Ce est la septième élément transuranien et un actinides .
Einsteinium a été découvert en tant que composante des débris de la première bombe hydrogène explosion en 1952, et nommé d'après Albert Einstein . Son plus courante isotopes einsteinium-253 (demi-vie 20,47 jours) est produit artificiellement à partir de la décomposition de californium-253 dans quelques haute puissance dédié réacteurs nucléaires avec un rendement total de l'ordre de un milligramme par année. La synthèse du réacteur est suivie d'une procédure complexe de séparation einsteinium-253 des autres actinides et les produits de leur décomposition. D'autres isotopes sont synthétisées dans différents laboratoires, mais en quantités beaucoup plus faibles, en bombardant des actinides lourds avec des ions légers. En raison des petites quantités de produit einsteinium et la demi-vie courte de son isotope le plus facile à produire, il ya actuellement presque aucune des applications pratiques pour l'extérieur de la recherche scientifique de base. En particulier, einsteinium a été utilisé pour synthétiser, pour la première fois, 17 atomes de l'élément nouveau mendelevium en 1955.
Einsteinium est un doux, argenté, paramagnétique métallique . Sa composition chimique est typique de la fin des actinides, avec une prépondérance de la 3 état d'oxydation ; l'état d'oxydation +2 est également accessible, notamment dans les solides. La radioactivité élevé de einsteinium-253 produit une lueur visible et rapide dommages son réseau de métal cristallin, avec chaleur dégagée d'environ 1000 watts par gramme. Difficulté dans l'étude de ses propriétés est due à Einsteinium-253 à la conversion de Berkelium puis californium à un taux d'environ 3% par jour. L'isotope de einsteinium avec la plus longue demi-vie, einsteinium-252 (demi-vie 471,7 jours) serait plus approprié pour l'étude des propriétés physiques, mais il se est avéré beaucoup plus difficile à produire et est disponible uniquement en quantités infimes, et non en vrac . Einsteinium est l'élément avec le numéro atomique plus élevé qui a été observé dans des quantités macroscopiques dans sa forme pure, et ce est l'isotope de courte durée commune einsteinium-253.
Comme tous synthétique transuraniens, isotopes de einsteinium sont extrêmement radioactifs et sont considérés comme très dangereux pour la santé en cas d'ingestion.
Histoire


Einsteinium était d'abord identifié en Décembre 1952 par Albert Ghiorso et co-travailleurs de la Université de Californie, Berkeley en collaboration avec le Argonne et Los Alamos National Laboratories, dans les retombées de la Ivy Mike test nucléaire. Le test a été effectué le 1er Novembre 1952, à Enewetak Atoll dans le Océan Pacifique et était le premier essai réussi d'un bombe à hydrogène. L'examen initial des débris de l'explosion a montré la production d'une nouvelle isotope de plutonium , 244
94 Pu, qui ne pouvait être formé par l'absorption des six neutrons par un l'uranium-238 noyau suivie de deux désintégrations bêta.
À l'époque, l'absorption de neutrons multiple a été pensé pour être un processus extrêmement rare, mais l'identification des 244
94 Pu a indiqué que toujours plus de neutrons auraient été capturés par les noyaux d'uranium, produisant ainsi de nouveaux éléments plus lourds que californium .
Ghiorso et ses collègues ont analysé des papiers-filtres qui avait été volé à travers le nuage de l'explosion à bord des avions (la même technique d'échantillonnage qui avait été utilisé pour découvrir 244
94 Pu). De plus grandes quantités de matières radioactives ont ensuite été isolés à partir de débris de coraux de l'atoll, qui ont été livrés aux États-Unis La séparation de nouveaux éléments suspects a été réalisée en présence d'un acide citrique / ammonium solution tampon dans un milieu faiblement acide ( pH ≈ 3,5), en utilisant échange d'ions à des températures élevées; moins de 200 atomes de einsteinium ont été récupérés à la fin. Néanmoins, l'élément 99 (einsteinium), à savoir sa 253 Es isotopes, a pu être détectée via sa haute énergie caractéristique désintégration alpha à 6,6 MeV. Il a été produit par la 15 capture de neutrons par uranium-238 suivi de sept noyaux bêta-désintégrations, et avait une demi-vie de 20,5 jours. Cette absorption de neutrons multiple a été rendue possible par la densité de flux de neutrons au cours de la détonation, de sorte que les isotopes lourds nouvellement générées avaient beaucoup de neutrons disponibles pour absorber avant qu'ils ne puissent se désintégrer en éléments plus légers. Capture de neutrons d'abord soulevé la nombre de masse sans changer le numéro atomique du nucléide et les désintégrations bêta-concomitants ont entraîné une augmentation progressive du nombre atomique:
Quelques 238 atomes U, cependant, pourraient absorber deux autres neutrons (pour un total de 17), résultant en 255 Es, ainsi que dans le 255 Fm isotope d'un autre élément nouveau, fermium . La découverte de nouveaux éléments et les nouvelles données associées sur la capture de neutrons multiples ont d'abord été gardé secret sur les ordres de l'armée américaine jusqu'en 1955 en raison de la guerre froide tensions et de la concurrence avec l'Union soviétique dans les technologies nucléaires. Cependant, la prise rapide de tant de neutrons fournirait nécessaires confirmation expérimentale directe de la dite r-processus neutrons multiples absorption nécessaire pour expliquer le cosmique nucléosynthèse (production) de certains éléments chimiques lourds (plus lourds que le nickel) en supernova explosions, avant désintégration bêta. Un tel processus est nécessaire pour expliquer l'existence de nombreux éléments stables dans l'univers.
Pendant ce temps, les isotopes de l'élément 99 (ainsi que du nouvel élément 100, fermium ) ont été produites dans les laboratoires Berkeley et Argonne, dans un réaction nucléaire entre l'azote et -14 uranium 238, et plus tard par irradiation intense de neutron du plutonium ou de californium :
Ces résultats ont été publiés dans plusieurs articles en 1954 avec l'avertissement que ce ne étaient pas les premières études qui ont été menées sur les éléments. L'équipe de Berkeley a également signalé quelques résultats sur les propriétés chimiques de einsteinium et fermium. Les résultats Ivy Mike ont été déclassifiés et publiés en 1955.
Dans leur découverte des éléments 99 et 100, les équipes américaines avaient participé avec un groupe au Institut Nobel de physique, Stockholm , Suède . À la fin de 1953 - début 1954, le groupe suédois a réussi à la synthèse des isotopes légers de l'élément 100, en particulier 250 Fm, en bombardant l'uranium avec des noyaux d'oxygène. Ces résultats ont également été publiés en 1954. Néanmoins, la priorité de l'équipe de Berkeley a été généralement reconnu, que ses publications précédé l'article suédois, et ils ont été basées sur les résultats précédemment non divulgués de l'explosion thermonucléaire 1952; donc l'équipe de Berkeley a eu le privilège de nommer les nouveaux éléments. Comme l'effort qui avait conduit à la conception de Ivy Mike était le nom de code du projet PANDA, élément 99 avait été en plaisantant surnommé "Pandamonium", mais les noms officiels suggéré par le groupe de Berkeley dérivé de deux éminents scientifiques et récemment décédés, Albert Einstein (décédé le 18 Avril 1955) et Enrico Fermi (décédé le 28 Novembre 1954): «Nous suggérons le nom de l'élément de numéro atomique 99, einsteinium (symbole E) après Albert Einstein et le nom de l'élément de numéro atomique 100, fermium (symbole Fm), après Enrico Fermi. " La découverte de ces nouveaux éléments a été annoncé par Albert Ghiorso à la première Conférence de Genève atomique tenue le 8-20 Août 1955. Le symbole pour einsteinium a été donné comme E et plus tard réaffecté à Es.
Caractéristiques
Physique

Einsteinium est un synthétique, blanc argenté, métal radioactif. Dans le tableau périodique , il est situé à droite de l'actinide californium , à la gauche de l'actinide fermium et en dessous du lanthanide holmium avec lequel il partage de nombreuses similitudes dans les propriétés physiques et chimiques. Sa densité de 8,84 g / cm 3 est inférieur à celui de californium (15,1 g / cm 3) et est à peu près la même que celle de l'holmium (8,79 g / cm 3), en dépit einsteinium atomique étant beaucoup plus lourd que l'holmium. Le point de einsteinium (860 ° C) de fusion est également relativement faible - ci-dessous californium (900 ° C), fermium (1527 ° C) et holmium (1461 ° C). Einsteinium est un métal mou, avec le module de masse de seulement 15 GPa, dont la valeur est l'un des plus bas parmi les non métaux alcalins .
Contrairement aux actinides légers californium, Berkelium, curium et américium qui cristallisent dans un double structure hexagonale dans les conditions ambiantes, einsteinium est censé avoir un cube (fcc) symétrie à faces centrées avec le groupe d'espace Fm 3 m et la constante de réseau a = 575 h. Cependant, il existe un rapport de la température ambiante einsteinium métal hexagonal avec a = 398 pm et 650 pm = c, qui converti à la phase fcc lors d'un chauffage à 300 ° C.
L'auto-dommages induits par la radioactivité de einsteinium est si forte qu'elle détruit rapidement le réseau cristallin, et la libération d'énergie lors de ce processus, 1000 watts par gramme de 253 Es, induit une lueur visible. Ces processus peuvent contribuer à la relativement faible point de fusion densité et einsteinium. En outre, en raison de la petite taille des échantillons disponibles, le point de fusion de einsteinium a souvent été déduite en observant l'échantillon est chauffé à l'intérieur d'un microscope électronique. Ainsi, les effets de surface dans de petits échantillons pourraient réduire la valeur point de fusion.
Le métal est divalent et a une forte volatilité nettement. Afin de réduire les dommages auto-rayonnement, la plupart des mesures de einsteinium solide et ses composés sont effectuées juste après recuit thermique. En outre, certains des composés sont étudiés sous l'atmosphère du gaz réducteur, par exemple H 2 O + HCl pour EsOCl sorte que l'échantillon est partiellement reconstruite à pendant sa décomposition.
En dehors de l'auto-destruction de einsteinium solide et ses composés, d'autres difficultés intrinsèques à étudier cet élément inclure la rareté - la 253 Es isotope le plus commun est disponible seulement une fois ou deux fois par an dans des quantités inférieures au milligramme - et l'auto-contamination due à la rapide conversion de einsteinium à Berkelium puis de californium à un taux d'environ 3,3% par jour:
Ainsi, la plupart des échantillons de einsteinium sont contaminés, et de leurs propriétés intrinsèques sont souvent déduites par extrapolation des données expérimentales accumulées retour dans le temps. D'autres techniques expérimentales pour contourner le problème de la contamination comprennent une excitation optique sélective d'ions einsteinium par un laser accordable, comme dans l'étude de ses propriétés de luminescence.
Propriétés magnétiques ont été étudiés pour einsteinium métal, son oxyde et de fluorure. Les trois matériaux ont montré Curie-Weiss comportement paramagnétique de l'hélium liquide jusqu'à la température ambiante. Les moments magnétiques effectifs ont été déduites de 10,4 ± 0,3 μ B pour Es 2 O 3 et de 11,4 ± 0,3 μ B pour le FSE 3, qui sont les valeurs les plus élevées parmi les actinides, et le correspondant Températures de Curie sont 53 et 37 K.
Chimique
Comme tous les actinides, einsteinium est plutôt réactive. Son trivalent état d'oxydation est plus stable dans les solides et une solution aqueuse où elle induit couleur rose pâle. L'existence d'divalent einsteinium est fermement établie, en particulier en phase solide; tels deux Etat ne est pas observée dans de nombreux autres actinides, dont le protactinium , l'uranium , le neptunium , le plutonium, le curium et berkelium. Einsteinium (II) composés peuvent être obtenus, par exemple, en réduisant einsteinium (III) avec samarium (II). L'état d'oxydation +4 a été postulé à partir d'études de vapeur et est encore incertain.
Isotopes
Dix-neuf et trois nucléides isomères nucléaires sont connus pour einsteinium avec des poids atomiques allant de 240 à 258. Tous sont radioactifs et le nucléide plus stable, Es 252, a une demi-vie de 471,7 jours. Suivant isotopes les plus stables sont 254 Es (demi-vie 275,7 jours), 255 Es (39,8 jours) et 253 (Es 20,47 jours). Tous les isotopes restants ont des demi-vies plus courtes que 40 heures, et la plupart d'entre eux décroissance en moins de 30 minutes. Parmi les trois isomères nucléaires, le plus stable est 254 m es avec une demi-vie de 39,3 heures.
Fission nucléaire
Einsteinium a un taux élevé de fission nucléaire qui résulte en une faible masse critique pour un soutenue réaction nucléaire en chaîne. Cette masse est de 9,89 kg à nu une sphère de 254 Es isotope, et peut être abaissé à 2,9 ou même 2,26 kg, respectivement, par addition d'un acier d'une épaisseur de 30 cm d'eau ou d'un réflecteur. Cependant, même cette petite masse critique dépasse largement le montant total de einsteinium isolé jusqu'à présent, en particulier des rares 254 Es isotopes.
Occurrence naturelle
En raison de la courte demi-vie de tous les isotopes d'einsteinium, toutes einsteinium primordial, ce est-einsteinium qui pourraient être présents sur la Terre lors de sa formation, est désintégrée par l'entreprise. Synthèse des actinides einsteinium de l'uranium et du thorium naturel dans la croûte terrestre nécessite multiple capture de neutrons, ce qui est un cas extrêmement improbable. Par conséquent, la plupart einsteinium est produite sur Terre dans les laboratoires scientifiques, les réacteurs nucléaires de forte puissance, ou dans essais d'armes nucléaires, et ne est présent que dans quelques années, à partir du moment de la synthèse. Einsteinium et fermium fait se produire naturellement dans le naturelle réacteur de fission nucléaire à Oklo, mais ne est plus le faire.
Synthèse et extraction

Einsteinium est produite en quantités infimes en bombardant actinides légers avec des neutrons en haute flux dédié les réacteurs nucléaires. Sources d'irradiation grands du monde sont de 85 mégawatts à haut flux Isotope Reactor (HFIR) au Oak Ridge National Laboratory, dans le Tennessee, États-Unis, et le réacteur SM-2 à la boucle Institut de recherche des réacteurs atomiques (NIIAR) dans Dimitrovgrad, la Russie, qui sont à la fois dédiée à la production de transcurium (Z> 96) éléments. Ces installations ont des niveaux de puissance et de flux similaires, et on se attend à avoir des capacités de production comparables pour les éléments de transcurium, bien que les quantités produites au NIIAR ne sont pas largement rapporté. Dans une "campagne de traitement typique» à Oak Ridge, des dizaines de grammes de curium sont irradiés pour produire des quantités de decigramme de californium , les quantités de milligrammes de berkelium (249 Bk) et les quantités de einsteinium et picogrammes fermium .
Le premier échantillon microscopique de 253 Es échantillon pesant environ 10 nanogrammes a été préparé en 1961 au HFIR. Un équilibre magnétique spécial a été conçu pour estimer son poids. Des lots plus importants ont été produites plus tard à partir de plusieurs kilogrammes de plutonium avec les rendements de la plupart (253 einsteinium Es) de 0,48 milligrammes 1967-1970, 3,2 milligrammes en 1971-1973, suivie par la production régulière d'environ 3 milligrammes par année entre 1974 et 1978. Ces quantités toutefois se réfèrent au montant intégral dans la cible juste après l'irradiation. Procédures de séparation ultérieure réduit la quantité de einsteinium isotope pur à peu près dix fois.
synthèse de laboratoire
Lourd irradiation neutronique des résultats de plutonium dans les quatre principaux isotopes de einsteinium: 253 Es (α-émetteur avec une demi-vie de 20,03 jours et avec une demi-vie de fission spontanée de 7 × 10 5 années); 254 m Es (β-émetteur avec demi-vie de 38,5 heures), 254 Es (α-émetteur avec une demi-vie d'environ 276 jours) et 255 (Es β-émetteur avec une demi-vie de 24 jours). Une autre voie consiste à bombardement de l'uranium-238 à haute intensité d'azote ou ions d'oxygène poutres.
Einsteinium-247 (demi-vie 4,55 minutes) a été produit par irradiation de l'américium-241 avec du carbone ou de l'uranium 238 avec des ions d'azote. La dernière réaction a été réalisée en 1967 à Dubna, en Russie, et les scientifiques impliqués ont reçu le Prix Komsomol.
L'isotope 248 Es a été produit par irradiation avec 249 Cf ions deutérium. Il se désintègre principalement par émission d'électrons à 248 Cf avec une demi-vie de 25 (± 5) minutes, mais libère également des particules d'α-6,87 MeV d'énergie, le rapport des électrons de α-particules d'environ 400.
Les isotopes plus lourds, 250 249 Es Es, Es 251 et 252 Es ont été obtenus en bombardant 249 Bk avec α-particules. Un à quatre neutrons sont libérés dans ce procédé permettant la formation de quatre isotopes différents dans une réaction.
Einsteinium-253 a été produite par l'irradiation d'un milligramme 0,1-0,2 252 Cf cible avec une flux de neutrons thermiques de (2-5) × 10 14 neutrons · cm -2 s -1 · pour 500-900 heures:
Synthèse des explosions nucléaires
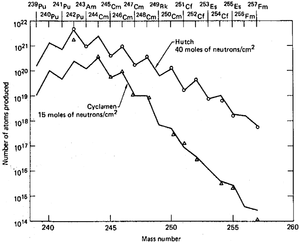
L'analyse des débris à la 10- mégatonnes Ivy Mike essai nucléaire était une partie de projet à long terme. L'un des objectifs qui a été étudient l'efficacité de la production d'éléments transuraniens dans les explosions nucléaires à haute puissance. La motivation pour ces expériences est que la synthèse de ces éléments de l'uranium nécessite capture de neutrons multiple. La probabilité de tels événements augmente avec la flux de neutrons, et les explosions nucléaires sont des sources de neutrons les synthétiques plus puissantes, fournissant des densités de l'ordre de 10 23 neutrons / cm² dans une microseconde, soit environ 10 29 neutrons / (cm² · s). En comparaison, le flux du réacteur est HFIR 5 x 10 15 neutrons / (cm² · s). Un laboratoire spécialisé a été mis en place à droite au Enewetak Atoll pour l'analyse préliminaire des débris, comme certains isotopes auraient pourri au moment où les échantillons de débris a atteint le continent américain Le laboratoire recevait échantillons pour analyse dès que possible, à partir d'avions équipés de filtres en papier qui ont survolé l'atoll après les essais . Considérant qu'il espérait découvrir de nouveaux éléments chimiques plus lourds que fermium, aucune de ces n'a été trouvée, même après une série d'explosions de mégatonnes menée entre 1954 et 1956 sur l'atoll.
Les résultats atmosphériques ont été complétées par les données de test souterraines accumulées dans les années 1960 à la Nevada Test Site, car il est à espérer que de puissantes explosions menées dans un espace confiné peut aboutir à des rendements améliorés et des isotopes plus lourds. Outre les accusations traditionnelles d'uranium, combinaisons d'uranium avec l'américium et le thorium ont été éprouvées, ainsi que des frais de plutonium neptunium mixte, mais ils étaient moins de succès en termes de rendement et a été attribué à des pertes plus fortes d'isotopes lourds en raison de l'amélioration des taux de fission des charges éléments lourds. l'isolement de produit était problématique, car les explosions se répandaient débris à travers la fusion et vaporisation des roches environnantes à des profondeurs de 300 à 600 mètres. Les forages à ces profondeurs pour extraire les produits était à la fois lent et inefficace en termes de volumes collectés.
Parmi les neuf essais souterrains qui ont été réalisées entre 1962 et 1969, la dernière était la plus puissante et avait le meilleur rendement des éléments transuraniens. Milligrammes de einsteinium qui seraient normalement prendre un an de l'irradiation dans un réacteur de grande puissance, ont été produites dans une microseconde. Toutefois, le principal problème pratique de la totalité de la proposition a été recueille les débris radioactifs dispersés par le souffle puissant. filtres d'aéronefs adsorbées seulement environ 4 × 10 -14 du montant total, et la collecte de tonnes de coraux à Enewetak Atoll augmenté cette fraction par seulement deux ordres de grandeur. Extraction d'environ 500 kg de roches souterraines 60 jours après l'explosion Hutch récupéré seulement environ 1 × 10 -7 de la charge totale. La quantité d'éléments transuraniens de ce lot de 500 kg ne était que de 30 fois plus élevé que dans un 0,4 kg de roche ramassé sept jours après le test qui a démontré la dépendance fortement non-linéaire de la transuraniens donnent sur le montant de la roche radioactive récupérée. Arbres ont été forés sur le site avant le test afin d'accélérer la collecte de l'échantillon après l'explosion, de sorte que l'explosion serait expulser matières radioactives de l'épicentre à travers les arbres et à la collecte de volumes près de la surface. Cette méthode a été jugé dans deux essais et instantanément fourni des centaines de kilogrammes de matériel, mais avec une concentration des actinides trois fois plus faible que dans les échantillons obtenus après le forage. Considérant que cette méthode aurait pu être efficace dans des études scientifiques d'isotopes de courte durée, il ne pouvait pas améliorer l'efficacité globale de la collecte des actinides produits.
Bien qu'aucune de nouveaux éléments (à l'exception de einsteinium et fermium) pourraient être détectés dans les débris des essais nucléaires, et les rendements totaux des transuraniens étaient décevants, ces tests ne fournissent des quantités significativement plus élevées d'isotopes lourds rares qu'auparavant disponibles dans les laboratoires.
Séparation

procédure de séparation de einsteinium dépend de la méthode de synthèse. Dans le cas d'un bombardement ionique à l'intérieur de la lumière d'un cyclotron, la cible des ions lourds est fixée à une feuille mince, et le einsteinium générée est simplement lavé la feuille après l'irradiation. Toutefois, les quantités produites dans ces expériences sont relativement faibles. Les rendements sont nettement plus élevés pour l'irradiation du réacteur, mais il n'y a, le produit est un mélange de divers isotopes d'actinides, de lanthanides ainsi que de produits dans la fission nucléaire se désintègre. Dans ce cas, l'isolement de einsteinium est une procédure fastidieuse qui implique plusieurs étapes répétitives d'échange de cations, à température et pression élevées, et la Chromatographie. La séparation d'avec berkelium est important, parce que l'isotope le plus commun de einsteinium produite dans les réacteurs nucléaires, 253 Es, se désintègre avec une demi-vie de seulement 20 jours à 249 Bk, qui est rapide sur le calendrier de la plupart des expériences. Cette séparation se appuie sur le fait que berkelium oxyde facilement à l'état solide et 4 précipite, tandis que d'autres actinides, y compris einsteinium, restent dans leur état 3 dans les solutions.
La séparation des actinides trivalents provenant des produits de fission lanthanide peut se faire par une colonne de résine échangeuse de cations en utilisant une solution d'éthanol à l'eau / 10% à 90%, saturé avec de l'acide chlorhydrique (HCl) en tant que éluant. Elle est généralement suivie d'une Chromatographie d'échange d'anions en utilisant 6 HCl molaire comme éluant. Une colonne de résine échangeuse de cations (colonne Dowex-50 échange) traité avec des sels d'ammonium est ensuite utilisé pour des fractions séparées contenant des éléments 99, 100 et 101. Ces éléments peuvent être ensuite identifiés simplement en fonction de leur position d'élution / heure, en utilisant α-hydroxyisobutyrate solution (α-HIB), par exemple, comme éluant.
La séparation des actinides 3+ peut également être réalisée par Chromatographie d'extraction par solvant, en utilisant du bis- (2-éthylhexyl) phosphorique (HDEHP en abrégé) comme phase stationnaire organique, et de l'acide nitrique en tant que phase aqueuse mobile. La séquence actinide d'élution est inversé à partir de celle de la colonne de résine échangeuse de cations. L'einsteinium séparés par cette méthode a l'avantage d'être exempt d'agent complexant organique, par rapport à la séparation en utilisant une colonne de résine.
Préparation du métal
Einsteinium est très réactif et donc les agents réducteurs forts sont nécessaires pour obtenir le métal pur de ses composés. Ceci peut être obtenu par réduction d'einsteinium (III) avec du fluorure métallique de lithium :
- EsF 3 + 3 Li → Es + 3 LiF
Toutefois, en raison de son faible point de fusion et le taux élevé de dommage auto-rayonnement, einsteinium a une pression de vapeur élevée, qui est supérieure à celle du fluorure de lithium. Cela rend cette réaction de réduction plutôt inefficace. Il a été jugé dans les tentatives de préparation début et rapidement abandonnée au profit de la réduction des einsteinium (III) oxyde avec le lanthane métal:
- Es 2 O 3 + La 2 → ES + La 2 O 3
Les composés chimiques
| Composé | Couleur | Symétrie | Groupe d'espace | Aucun | Symbole de Pearson | un ( h) | b (h) | c (h) |
|---|---|---|---|---|---|---|---|---|
| Es 2 O 3 | Incolore | Cubique | Ia 3 | 206 | cI80 | 1076,6 | ||
| Es 2 O 3 | Incolore | Monoclinique | C2 / m | 12 | MS30 | 1411 | 359 | 880 |
| Es 2 O 3 | Incolore | Hexagonal | P 3 m1 | 164 | HP5 | 370 | 600 | |
| EsF 3 | Hexagonal | |||||||
| EsF 4 | Monoclinique | C2 / c | 15 | MS60 | ||||
| ESCL 3 | Orange | Hexagonal | C6 3 / m | HP8 | 727 | 410 | ||
| ESBR 3 | Jaune | Monoclinique | C2 / m | 12 | MS16 | 727 | 1259 | 681 |
| ESI 3 | Ambre | Hexagonal | R 3 | 148 | HR24 | 753 | 2084 | |
| EsOCl | Quadrilatère | P4 / nmm | 394,8 | 670,2 |
Oxydes
Einsteinium (III) oxyde (Es 2 O 3) a été obtenue par la combustion einsteinium (III) nitrate. Il forme des cristaux incolores cubes, qui ont d'abord été caractérisées à partir d'échantillons de microgramme dimensionnés environ 30 nanomètres. Deux autres phases, monoclinique et hexagonale, sont connus pour cet oxyde. La formation d'une certaine phase Es 2 O 3 dépend de l'histoire de la technique de préparation et de l'échantillon, et il n'y a pas de diagramme de phase claire. Les interconversions entre les trois phases peuvent se produire spontanément, à la suite de l'auto-irradiation ou auto-échauffement. La phase hexagonale est isotypique avec lanthane (III) oxyde où l'ion Es est entouré par un groupe 6-coordonnée des ions O 2.
Halogénures

Einsteinium halogénures sont connus pour les états d'oxydation 2 et 3. L'état le plus stable est 3 pour tous les halogénures de fluorure à l'iodure.
Einsteinium (III) fluorure (FSE 3) peut être précipité à partir d'einsteinium (iii) des solutions de chlorure par réaction avec ions fluorure. Une procédure de préparation alternative est à l'exposition einsteinium (III) oxyde pour le trifluorure de chlore (ClF 3) ou F 2 gazeux à une pression de 1-2 atmosphères et une température comprise entre 300 et 400 ° C. La structure EsF 3 de cristal est hexagonale, comme dans californium (III) fluorure (CFF 3) où les ions Es 3+ sont 8 fois coordonnés par des ions de fluor dans un bicouronné Agencement de prisme trigone.
Einsteinium (III) chlorure (ESCL 3) peut être préparé par einsteinium (III) de l'oxyde recuit dans l'atmosphère de vapeurs sèches de chlorure d'hydrogène à environ 500 ° C pendant environ 20 minutes. Il cristallise lors du refroidissement à environ 425 ° C en un solide orange avec un structure hexagonale de Type UCl3, où les atomes de einsteinium sont neuf fois coordonnés par des atomes de chlore dans une géométrie du prisme trigonal tricapped. Einsteinium (III) du bromure (ESBR 3) est un solide jaune pâle avec un de structure monoclinique de type AlCl 3 , où les atomes de einsteinium sont octaédriquement coordonné par le brome (nombre de coordination 6).
Les composés divalents de einsteinium sont obtenus par réduction des halogénures trivalents avec de l'hydrogène :
- 2 ESX 3 + H 2 → 2 ESX 2 + 2 HX, X = F, Cl, Br, I
Einsteinium (II) chlorure (ESCL 2), einsteinium (II) du bromure (ESBR 2), et einsteinium (II) d'iodure (ESI 2) ont été produites et caractérisé par absorption optique, sans aucune information structurelle encore disponible.
Oxyhalogénures connus de einsteinium comprennent EsOCl, EsOBr et EsOI. Ils sont synthétisés par traitement d'un trihalogénure d'un mélange de vapeur d'eau et de l'halogénure d'hydrogène correspondant: par exemple, ESCL 3 + H 2 O / HCl pour obtenir EsOCl.
Composés Organoeinsteinium
La radioactivité élevé de einsteinium a une utilisation potentielle dans la radiothérapie, et des complexes organométalliques ont été synthétisés afin de fournir des atomes de einsteinium à un organe approprié dans le corps. Des expériences ont été réalisées sur l'injection einsteinium citrate (ainsi que les composés de fermium) à des chiens. Einsteinium (III) a également été incorporé dans bêta-dicétone complexes chélate, depuis complexes analogues avec lanthanides précédemment ont montré la plus forte UV excité parmi les composés organométalliques luminescence. Lors de la préparation einsteinium complexes, les ions Es 3+ étaient 1000 fois dilué avec des ions Gd 3+. Cela a permis à la réduction des dommages de rayonnement de sorte que les composés ne se désintègrent pas pendant la période de 20 minutes requis pour les mesures. La luminescence résultant de Es 3+ est beaucoup trop faible pour être détectée. Cela a été expliqué par les énergies relatives défavorables des constituants individuels du composé qui entravaient transfert d'énergie efficace de la matrice de chélate aux ions Es 3+. Conclusion similaire a été élaboré pour d'autres actinides américium, berkelium et fermium.
La luminescence des ions 3+ Es a cependant été observé dans les solutions d'acide chlorhydrique inorganiques ainsi que dans la solution organique avec du di (2-éthylhexyle), l'acide orthophosphorique. Il montre un pic large à environ 1064 nanomètres (demi-largeur d'environ 100 nm) qui peuvent être excités par résonance lumière verte (environ 495 nm de longueur d'onde). La luminescence a une durée de vie de quelques microsecondes et le rendement quantique inférieur à 0,1%. La relativement élevé, par rapport à lanthanides, les taux de désintégration non radiatives à Es 3+ ont été associés à l'interaction forte du f-électrons avec les électrons 3+ Es intérieures.
Applications
Il est presque inutile pour tout isotope de l'einsteinium dehors de la recherche scientifique de base visant à la production de plus transuraniens et transactinides.
En 1955, mendelevium a été synthétisé par irradiation d'une cible constituée d'environ 10 atomes de 9 253 Es dans le cyclotron de 60 pouces à Berkeley Laboratory. Les 253 Es résultant (α, n) 256 Md réaction ont donné 17 atomes de l'élément nouveau avec le numéro atomique 101.
L'isotope rare einsteinium-254 est favorisée pour la production de ultraheavy éléments en raison de sa grande masse, relativement longue demi-vie de 270 jours, et la disponibilité en quantités significatives de plusieurs microgrammes. Ainsi einsteinium-254 a été utilisé comme cible dans la tentative de synthèse Ununennium (élément 119) en 1985 en le bombardant de calcium-48 ions au superHILAC accélérateur linéaire à Berkeley, en Californie. Aucun atomes ont été identifiés, fixation d'une limite supérieure pour la section transversale de cette réaction à 300 nanobarns.
Einsteinium-254 a été utilisé comme marqueur de calibrage dans le spectromètre d'analyse chimique (" Analyseur de surface ") de la dispersion alpha- Surveyor 5 sonde lunaire. La grande masse de cet isotope a réduit le chevauchement spectral entre les signaux de la borne et les éléments plus légers étudiés de la surface lunaire.
Sécurité
La plupart des données de toxicité de einsteinium disponibles proviennent de recherches sur les animaux. Lors de l'ingestion par des rats, seulement environ 0,01% einsteinium se termine dans le flux sanguin. De là, environ 65% va à l'os, où il reste pendant environ 50 années, 25% dans les poumons (demi-vie biologique d'environ 20 ans, bien que cela soit rendue sans objet par les demi-vies courtes d'isotopes d'einsteinium), 0,035 % aux testicules ou 0,01% aux ovaires - où einsteinium reste indéfiniment. Environ 10% de la quantité ingérée est excrétée. La répartition des einsteinium sur les surfaces osseuses est uniforme et est similaire à celle du plutonium.
![\ Mathrm {^ {238} _ {\ 92} U \ \ xrightarrow [-2 \ \ beta ^ -] {+ \ 6 \ (n, \ gamma)} \ ^ {244} _ {\ 94}} Pu](../../images/1516/151667.png)
![\ Mathrm {^ {238} _ {\ 92} U \ \ xrightarrow [6 \ beta ^ -] {+ \ 15 n} \ ^ {253} _ {\} 98 Cf \ \ xrightarrow {\ beta ^ -} \ ^ {253} _ {\ 99}} Es](../../images/1516/151668.png)
![\ Mathrm {^ {252} _ {\} 98 Cf \ \ xrightarrow {(n, \ gamma)} \ ^ {253} _ {\} 98 Cf \ \ xrightarrow [17,81 \ d] {\ beta ^ -} \ ^ {253} _ {\ 99} Es \ \ xrightarrow {(n, \ gamma)} \ ^ {254} _ {\ 99} Es \ \ xrightarrow [] {\ beta ^ -} \ ^ {254} {_ 100}} Fm](../../images/1516/151669.png)
![\ Mathrm {^ {253} _ {\ 99} Es \ \ xrightarrow [20 \ d] {\ alpha} \ ^ {249} _ {\ 97} Bk \ \ xrightarrow [314 \ d] {\ beta ^ -} \ ^ {249} _ {\ 98}} Cf](../../images/1516/151674.png)
![\ Mathrm {^ {249} _ {\} 98 Cf \ + \ ^ _ {2} {1} D \ \ longrightarrow \ ^ {248} _ {\ 99} Es \ + \ 3 \ ^ {1} {_ 0} n \ quad (^ {248} _ {\ 99} Es \ \ xrightarrow [27 \ min] {\ epsilon} \ ^ {248} _ {\} 98 Cf)}](../../images/1516/151679.png)
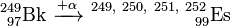
![\ Mathrm {^ {252} _ {\} 98 Cf \ \ xrightarrow {(n, \ gamma)} \ ^ {253} _ {\} 98 Cf \ \ xrightarrow [17,81 \ d] {\ beta ^ -} \ ^ {253} _ {\ 99}} Es](../../images/1516/151681.png)

