
Uranium
À propos de ce écoles sélection Wikipedia
Ce contenu de Wikipedia a été sélectionné par SOS Enfants d'aptitude dans les écoles à travers le monde. Voulez-vous savoir sur le parrainage? Voir www.sponsorachild.org.uk
| Uranium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
92 U | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
métallique gris argenté; corrode à une couche d'oxyde noir écaillage dans l'air  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, symbole, nombre | uranium, U, 92 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Prononciation | / j ʊ r eɪ n Je ə m / Ewing RAY -neE-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Catégorie Metallic | actinides | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, période, bloc | n / a, 7, fa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poids atomique standard | 238,02891 (3) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [ Rn ] 5f 3 6d 1 7s 2 2, 8, 18, 32, 21, 9, 2  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Découverte | Martin Heinrich Klaproth (1789) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Premier isolement | Eugène-Melchior Péligot (1841) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densité (à proximité rt) | 19,1 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liquid densité au mp | 17,3 g · cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 1405,3 K , 1132,2 ° C, 2070 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d'ébullition | 4404 K, 4131 ° C, 7468 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La chaleur de fusion | 9,14 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur de vaporisation | 417,1 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacité thermique molaire | 27,665 J · mol -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| États d'oxydation | 6, 5, 4, 3, 2, 1 (Faiblement oxyde de base) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité | 1,38 (échelle de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| énergies d'ionisation | 1er: 597,6 kJ · mol -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2ème: 1420 kJ · mol -1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique | 156 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon covalente | 196 ± 19 heures | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de Van der Waals | 186 h | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | orthorhombique 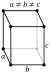 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordre magnétique | paramagnétique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Résistivité électrique | (0 ° C) 0,280 μΩ · m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 27,5 W · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 13,9 um · m -1 · K -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son (tige mince) | (20 ° C) 3,155 m · s -1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Le module d'Young | 208 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module de cisaillement | 111 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Module Bulk | 100 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coefficient de Poisson | 0,23 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-61-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article détaillé: Isotopes de l'uranium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L'uranium est un blanc argenté métallique élément chimique dans l' actinide série de la classification périodique des éléments , avec symbole U et de numéro atomique 92. Un atome d'uranium a 92 protons et 92 électrons , dont 6 électrons de valence. Uranium faiblement radioactifs parce que tous ses isotopes sont instables. Les isotopes les plus courants sont l'uranium l'uranium-238 (qui a 146 neutrons) et l'uranium-235 (qui a 143 neutrons). L'uranium a le deuxième plus haut poids atomique du éléments survenant primordialement, plus léger que de plutonium . Sa densité est d'environ 70% supérieure à celle du plomb , mais pas aussi dense que l'or ou de tungstène . Il se produit naturellement dans de faibles concentrations de quelques parties par million dans le sol, roche et l'eau, et est commercialement extrait de uranifères minéraux tels que uraninite.
Dans la nature, l'uranium se trouve que l'uranium-238 (99,2739 à 99,2752%), de l'uranium-235 (0,7198 à 0,7202%), et une très petite quantité de l'uranium-234 (de 0,0050 à 0,0059%). Uranium se désintègre lentement en émettant une particule alpha. La demi-vie de l'uranium-238 est d'environ 4,47 milliard d'années et celle de l'uranium-235 est 704 million d'années, ce qui les rend utiles dans la datation de la âge de la Terre.
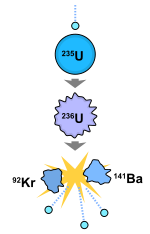
De nombreuses utilisations contemporaines de l'uranium exploitent ses uniques nucléaires propriétés. Uranium-235 a la particularité d'être le seul d'origine naturelle fissiles isotopes . L'uranium 238 est fissile par des neutrons rapides, et est fertiles, ce qui signifie qu'il peut être transmué fissiles plutonium 239 dans un réacteur nucléaire. Un autre isotope fissile, l'uranium-233, peut être produit à partir naturelle thorium et est également important dans la technologie nucléaire. Alors que l'uranium 238 a une faible probabilité pour fission spontanée ou induite par fission même avec des neutrons rapides, l'uranium-235 et dans une moindre mesure de l'uranium 233 ont une section transversale de fission beaucoup plus élevée pour les neutrons lents. En concentration suffisante, ces isotopes maintenir un soutenue réaction nucléaire en chaîne. Cela génère de la chaleur dans les réacteurs nucléaires, et produit la matière fissile pour les armes nucléaires . L'uranium appauvri (238 U) est utilisé dans pénétrateurs de l'énergie cinétique et blindage.
L'uranium est utilisé comme colorant dans verre à l'uranium, produisant rouge-orange Lemon teintes jaunes. Il a également été utilisé pour teinter et l'ombrage au début de la photographie . Le 1789 découverte d'uranium dans le minerai pechblende est crédité Martin Heinrich Klaproth, qui a nommé le nouvel élément après la planète Uranus . Eugène-Melchior Péligot était la première personne à isoler le métal et ses propriétés radioactives ont été découvertes en 1896 par Antoine Becquerel. Les recherches menées par Enrico Fermi et d'autres à partir de 1934 ont conduit à son utilisation comme carburant dans le secteur de l'énergie nucléaire et dans Little Boy, le première arme nucléaire utilisée dans la guerre. Un suivi course aux armements pendant la guerre froide entre les États-Unis et l' Union soviétique a produit des dizaines de milliers d'armes nucléaires qui ont utilisé de l'uranium métal et de l'uranium dérivés plutonium-239. La sécurité de ces armes et de leurs matières fissiles après la éclatement de l'Union soviétique en 1991 est une préoccupation constante pour la santé et la sécurité publique. Voir La prolifération nucléaire.
Caractéristiques
Quand raffiné, l'uranium est un blanc argenté, faiblement radioactifs métallique , qui est plus difficile que la plupart des éléments. C'est malléable, ductile, légèrement paramagnétique, fortement électropositive et est un pauvre conducteur électrique. Uranium métal a une très forte densité , soit environ 70% plus dense que le plomb , mais un peu moins dense que l'or .
L'uranium métal réagit avec presque tous les éléments non métalliques et de leurs composés , avec une réactivité croissante avec la température. chlorhydrique et l'acide nitrique dissoudre l'uranium, mais d'autres acides que l'attaque de l'acide chlorhydrique non oxydant l'élément très lentement. Lorsque finement divisé, il peut réagir avec l'eau froide; dans l'air, l'uranium métal est recouverte d'une couche foncée de l'oxyde d'uranium. Uranium dans les minerais est extrait chimiquement et converti en dioxyde d'uranium ou d'autres formes chimiques utilisables dans l'industrie.
L'uranium-235 a été le premier isotope qui a été jugée fissiles. Autres isotopes naturels sont fissiles, mais pas fissiles. Après bombardement avec des neutrons lents, son uranium-235 isotopes sera la plupart du temps se divisent en deux petits noyaux , libérant nucléaire énergie et plus de neutrons contraignant. Si un trop grand nombre de ces neutrons sont absorbés par d'autres noyaux d'uranium-235, un réaction nucléaire en chaîne se produit qui entraîne une explosion de chaleur ou (dans des circonstances particulières) une explosion. Dans un réacteur nucléaire, une telle réaction en chaîne est ralentie et contrôlée par un poison neutronique, absorbant une partie des neutrons libres. Matériaux absorbants tels les neutrons sont souvent partie du réacteur barres de contrôle (voir physique des réacteurs nucléaires pour une description de ce processus de contrôle du réacteur).
Aussi peu que £ 15 (7 kg) d'uranium-235 peuvent être utilisés pour fabriquer une bombe atomique. La première bombe nucléaire utilisée dans la guerre, Little Boy, se est appuyé sur la fission de l'uranium, alors que la première explosif nucléaire ( Le gadget ) et la bombe qui a détruit Nagasaki ( Fat Man) étaient des bombes au plutonium.
Uranium métal a trois allotropiques formes:
- α ( orthorhombique) stable jusqu'à 660 ° C
- β ( tétragonale) stable à partir de 660 ° C à 760 ° C
- γ ( cubique centré) à partir de 760 ° C à point de fusion-ce est l'état le plus malléable et ductile.
Applications
Militaire

La principale application de l'uranium dans le secteur militaire est en haute densité pénétrateurs. Cette munition est composée de l'uranium appauvri (UA) allié avec 1-2% d'autres éléments. A vitesse élevée aux chocs, la densité, la dureté, et pyrophoricité du projectile permettre la destruction des cibles fortement blindées. le blindage des chars et d'autres amovible le blindage des véhicules sont également durci avec des plaques d'uranium appauvri. L'utilisation de l'uranium appauvri est devenu politiquement et écologiquement litigieux après l'utilisation de munitions à l'UA par les Etats-Unis, Royaume-Uni et d'autres pays au cours des guerres dans le golfe Persique et dans les Balkans a soulevé des questions de composés d'uranium laissées dans le sol (voir Guerre du Golfe syndrome).
L'uranium appauvri est également utilisé en tant que matériau de blindage dans certains conteneurs utilisés pour le stockage et le transport de matières radioactives. Alors que le métal lui-même est radioactif, sa haute densité, il est plus efficace que le plomb à stopper rayonnements provenant de sources forts tels que le radium . D'autres utilisations de l'UA comprennent contrepoids pour les surfaces de contrôle de l'avion, comme ballast pour les missiles rentrée des véhicules et en tant que matériau de blindage. En raison de sa densité élevée, ce matériau se trouve dans systèmes de guidage inertiels et gyroscopique compas. DU est préférable à métaux denses de même en raison de sa capacité à être facilement usiné et jette ainsi que son coût relativement faible. Le principal risque de l'exposition à l'uranium appauvri est une intoxication chimique par oxyde d'uranium plutôt que la radioactivité (uranium ne étant qu'un faible émetteur alpha).
Pendant les derniers stades de la Seconde Guerre mondiale , l'ensemble de la guerre froide , et dans une moindre mesure par la suite, l'uranium 235 a été utilisé comme matière explosive fissiles pour fabriquer des armes nucléaires. Initialement, deux grands types de bombes de fission ont été construits: un dispositif relativement simple qui utilise de l'uranium-235 et un mécanisme plus complexe qui utilise plutonium-239 provient de l'uranium-238. Plus tard, un type beaucoup plus complexe et beaucoup plus puissant de la fission / fusion bombe ( thermonucléaire arme) a été construit, qui utilise un dispositif à base de plutonium pour provoquer un mélange de tritium et deutérium à subir la fusion nucléaire. Ces bombes sont gainés dans un non-fissile (non enrichi) cas de l'uranium, et ils tirent plus de la moitié de leur puissance de la fission de ce matériel par neutrons rapides provenant du procédé de fusion nucléaire.
Civil

La principale utilisation de l'uranium dans le secteur civil est d'alimenter les centrales nucléaires. Un kilogramme d'uranium 235 peut théoriquement produire environ 80 térajoules d'énergie (8 × 10 13 joules), en supposant que la fission complète; autant d'énergie que 3000 tonnes de charbon .
Commercial nucléaires plantes utilisent un combustible qui est généralement enrichi à environ 3% d'uranium-235. Le CANDU et conceptions de Magnox sont les seuls réacteurs commerciaux capables d'utiliser du carburant non enrichi de l'uranium. Carburant utilisé pour Réacteurs de la marine américaine est généralement très riches en l'uranium-235 (les valeurs exactes sont classé). Dans un surgénérateur, l'uranium-238 peut également être converti en plutonium par la réaction suivante: 238 U (n, gamma) → 239 U - (beta) → 239 Np - (beta) → 239 Pu.

Avant la découverte de la radioactivité, de l'uranium a été principalement utilisé en petites quantités pour le verre et poterie émaux jaunes, comme verre à l'uranium et en Fiestaware.
La découverte et l'isolement du radium dans le minerai d'uranium (pechblende) par Marie Curie ont suscité le développement de l'exploitation minière de l'uranium pour extraire le radium, qui a été utilisé pour faire des peintures qui brillent dans le noir pour l'horloge et avions cadrans. Cela a laissé une quantité prodigieuse de l'uranium comme un produit des déchets, car il faut trois tonnes d'uranium pour extraire une gramme de radium. Ce produit des déchets a été détourné vers l'industrie de vitrage, la réalisation de glacis d'uranium très bon marché et abondante. Outre les émaux de poterie, émaux de tuiles d'uranium ont représenté l'essentiel de l'utilisation, y compris salle de bains et cuisine communes tuiles qui peuvent être produites en vert, jaune, mauve, noir, bleu, rouge et d'autres couleurs.

Uranium a également été utilisé dans photographiques produits chimiques (notamment nitrate d'uranium comme toner), en filaments de lampe, pour améliorer l'apparence de dentiers, et dans les industries du cuir et de bois pour les taches et les colorants. des sels d'uranium sont mordants de soie ou de laine. de l'acétate d'uranyle et du formiate d'uranyle sont utilisés comme "taches" opaques aux électrons en La microscopie électronique à transmission, pour augmenter le contraste de spécimens biologiques et dans les sections ultraminces dans coloration négative du virus , isolé organites cellulaires et macromolécules.
La découverte de la radioactivité de l'uranium introduit dans des applications scientifiques et pratiques supplémentaires de l'élément. La longue demi-vie de l'isotope uranium-238 (4,51 × 10 9 années), il est bien adapté pour une utilisation dans l'estimation de l'âge des premières roches ignées et pour d'autres types de datation radiométrique, y compris l'uranium-thorium datation, l'uranium-plomb datation et uranium uranium datation. L'uranium métal est utilisé pour Cibles X-ray dans la fabrication des rayons X de haute énergie.
Histoire
Préhistorique fission naturelle
En 1972, le physicien français Francis Perrin a découvert quinze ancienne et ne est plus active réacteurs de fission nucléaire naturelles dans trois gisements distincts au La mine d'Oklo au Gabon , Afrique de l'Ouest , collectivement connu sous le nom Oklo réacteurs fossiles. Le gisement est vieux 1700000000 années; puis, l'uranium 235 a constitué environ 3% de l'uranium totale sur Terre. Ce est suffisamment élevé pour permettre une réaction en chaîne de fission nucléaire durable à se produire, pourvu que les autres conditions favorables existent. La capacité du sédiment environnant pour contenir le produits de déchets nucléaires a été cité par le gouvernement fédéral des États-Unis en tant que preuves de la faisabilité de stocker le combustible nucléaire irradié à la Yucca Mountain.
L'utilisation pré-découverte
L'utilisation de l'uranium dans son naturel Dates sous forme d'oxyde de retour à au moins l'année 79 CE, quand il a été utilisé pour ajouter une couleur jaune glaçures. Verre jaune avec 1% d'oxyde d'uranium a été trouvé dans un Roman villa sur Cap Posillipo dans le Baie de Naples, en Italie par RT Gunther de l' Université d'Oxford en 1912. Dès la fin du Moyen Age , la pechblende a été extraite de la Mines d'argent dans des Habsbourg Joachimsthal, Bohemia (maintenant Jáchymov dans la République tchèque ) et a été utilisé comme agent colorant dans la locale verrerie industrie. Au début du 19e siècle, les sources connues seulement du monde de minerai d'uranium étaient ces mines.
Découverte

Le découverte de l'élément est crédité au chimiste allemand Martin Heinrich Klaproth. Alors qu'il travaillait dans son laboratoire expérimental de Berlin en 1789, Klaproth a pu précipiter un composé jaune (probable diuranate de sodium) par dissolution pitchblende en acide nitrique et en neutralisant la solution avec de l'hydroxyde de sodium . Klaproth a assumé la substance jaune était l'oxyde d'un élément encore à découvrir et chauffé avec charbon de bois pour obtenir une poudre noire, dont il pensait être le métal nouvellement découvert lui-même (en fait, que la poudre était un oxyde d'uranium). Il a nommé l'élément nouvellement découvert après que la planète Uranus , (nommé d'après le primordiale Dieu grec du ciel), qui avait été découvert huit ans plus tôt par William Herschel.
En 1841, Eugène-Melchior Péligot, professeur de chimie analytique à la Conservatoire National des Arts et Métiers (École centrale des arts et manufactures) à Paris , a isolé le premier échantillon d'uranium métal par chauffage le tétrachlorure d'uranium avec du potassium . Uranium ne était pas considéré comme étant particulièrement dangereux pendant une grande partie du 19ème siècle, conduisant à l'élaboration des diverses utilisations de l'élément. Une telle utilisation de l'oxyde était la coloration de la poterie et de verre précitée, mais ne est plus un secret.
Antoine Henri Becquerel découvrit la radioactivité en utilisant l'uranium en 1896. Becquerel a fait la découverte à Paris en laissant un échantillon d'un sel d'uranium, K 2 UO 2 (SO 4) 2 (sulfate d'uranyle de potassium), au-dessus d'un non exposée plaque photographique dans un tiroir et notant que la plaque était devenu «voilée». Il a déterminé que une forme de lumière ou de rayons émis par l'uranium invisible avait exposé la plaque.
recherche sur la fission

Une équipe dirigée par Enrico Fermi en 1934 a constaté que bombardant l'uranium avec des neutrons produit l'émission de rayons bêta ( électrons ou positons des éléments produits; voir particules bêta). Les produits de fission ont d'abord pris pour de nouveaux éléments de numéros atomiques 93 et 94, dont le doyen de la Faculté de Rome, Orso Mario Corbino, baptisé ausonium et hesperium, respectivement. Les expériences menant à la découverte de la capacité de l'uranium à la fission (brisent) en éléments plus légers et la libération énergie de liaison ont été effectuées par Otto Hahn et Fritz Strassmann dans le laboratoire de Hahn à Berlin. Lise Meitner et son neveu, le physicien Otto Frisch, publié l'explication physique en Février 1939 et nommé le processus " de la fission nucléaire ". Peu de temps après, Fermi hypothèse que la fission de l'uranium pourrait libérer suffisamment de neutrons pour maintenir une réaction de fission. Confirmation de cette hypothèse est venu en 1939, et les travaux plus tard que, en moyenne, environ 2,5 neutrons sont libérés par chaque fission des rares isotopes de l'uranium-235. D'autres travaux a constaté que le beaucoup plus fréquent de l'uranium-238 isotopes peut être transmuté en plutonium, qui, comme l'uranium-235, est également fissiles par des neutrons thermiques. Ces découvertes ont conduit de nombreux pays à commencer à travailler sur le développement d'armes nucléaires et l'énergie nucléaire .
Le 2 Décembre 1942, dans le cadre de la Manhattan Project, une autre équipe dirigée par Enrico Fermi était en mesure de lancer la première artificielle auto-entretenue réaction nucléaire en chaîne, Chicago Pile-1. Travailler dans un laboratoire ci-dessous les stands de Stagg terrain au Université de Chicago, l'équipe a créé les conditions nécessaires à une telle réaction en empilant ensemble 400 tonnes courtes (360 tonnes métriques) de graphite, 58 tonnes courtes (53 tonnes métriques) de oxyde d'uranium, et de six tonnes courtes (5,5 tonnes) d'uranium métal.
Bombes

Deux grands types de bombes atomiques ont été développés par les États-Unis pendant la Seconde Guerre mondiale : un dispositif à base d'uranium (nom de code " Little Boy ") dont la matière fissile était hautement l'uranium enrichi, et un dispositif à base de plutonium (voir test de Trinity et " Fat Man ") dont le plutonium a été dérivé de l'uranium-238. Le dispositif à base d'uranium Little Boy est devenu la première arme nucléaire utilisée dans la guerre quand il a explosé sur la japonaise ville de Hiroshima le 6 Août 1945. Exploding avec un rendement équivalent à 12 500 tonnes de TNT, l'explosion et onde thermique de la bombe a détruit près de 50 000 bâtiments et tué environ 75 000 personnes (voir Bombardements atomiques d'Hiroshima et de Nagasaki). Initialement, on croyait que l'uranium était relativement rare, et que prolifération nucléaire pourrait être évitée simplement en acheter tous les stocks d'uranium connus, mais à l'intérieur d'une décennie de grands gisements de l'on découvrait dans de nombreux endroits à travers le monde.
Réacteurs

Le X-10 Graphite réacteur à Oak Ridge National Laboratory (ORNL) à Oak Ridge, Tennessee, anciennement connu sous le nom Pile Clinton et X-10 Pile, était deuxième réacteur nucléaire artificiel au monde (après Chicago la Pile d'Enrico Fermi) et a été le premier réacteur conçu et construit pour un fonctionnement continu . Argonne National Laboratory de Experimental Breeder Reactor I, situé à la station d'essais réacteur national de la Commission de l'énergie atomique proximité Arco, Idaho est devenu le premier réacteur nucléaire pour produire de l'électricité le 20 Décembre 1951. Initialement, quatre ampoules de 150 watts ont été allumées par le réacteur, mais des améliorations par la suite lui a permis d'alimenter l'ensemble de l'installation (plus tard, la ville de Arco est devenu le premier dans le monde d'avoir toute sa électricité proviennent de l'énergie nucléaire produite par BORAX-III, un autre réacteur conçu et exploité par Argonne National Laboratory). Première centrale nucléaire à l'échelle commerciale au monde, Obninsk dans l' Union soviétique , a commencé la production avec son AM-1 réacteur le 27 Juin 1954. Autres plantes début de centrales nucléaires étaient Calder Hall en Angleterre qui a commencé la production le 17 Octobre 1956 et le Shippingport atomique Power Station dans Pennsylvanie qui a commencé le 26 mai 1958. L'énergie nucléaire a été utilisée pour la première fois pour la propulsion par un sous-marin , le USS Nautilus, en 1954.
Contamination et l'héritage de la guerre froide
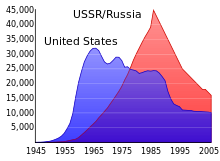
Au-dessus du sol essais nucléaires de l'Union soviétique et les Etats-Unis dans les années 1950 et au début des années 1960 et par France dans les années 1970 et 1980 répartis une quantité importante de retombées de la fille de l'uranium isotopes dans le monde entier. Retombées supplémentaires et la pollution se sont produits à partir de plusieurs accidents nucléaires.
Les mineurs d'uranium ont une incidence plus élevée de cancer . Un excès de risque de cancer du poumon chez Les mineurs d'uranium Navajo, par exemple, ont été documentées et liées à leur profession. Le Loi sur les accidents du rayonnement d'exposition, une loi de 1990 aux Etats-Unis, requis $ 100,000 dans des «paiements de compassion» pour les mineurs d'uranium diagnostiquées avec un cancer ou d'autres maladies respiratoires.
Pendant la guerre froide entre l'Union soviétique et les Etats-Unis, d'énormes stocks d'uranium ont été amassés et des dizaines de milliers d'armes nucléaires ont été créées à l'aide de l'uranium enrichi et le plutonium fabriqué à partir de l'uranium. Depuis la éclatement de l'Union soviétique en 1991, environ 600 tonnes courtes (540 tonnes métriques) de hautement enrichi armes année uranium (assez pour faire 40 000 ogives nucléaires) ont été stockés dans des installations souvent mal gardés dans la Fédération de Russie et plusieurs autres ex- Etats soviétiques. La police de l'Asie , l'Europe et l'Amérique du Sud sur au moins 16 reprises de 1993 à 2005 ont envois interceptés de contrebande d'uranium bombe de qualité ou de plutonium, dont la plupart provenaient de sources ex-soviétiques. De 1993 à 2005, la Protection des Matériaux, Contrôle et Comptabilité programme, géré par le gouvernement fédéral des États-Unis, a dépensé environ US $ 550 millions pour aider à protéger les stocks d'uranium et de plutonium en Russie. Cet argent a été utilisé pour des améliorations de sécurité dans les installations de recherche et de stockage. Scientific American a rapporté en Février 2006, que dans une partie de la sécurité des installations est composée de grillages qui étaient dans des états graves de délabrement. Selon une interview de l'article, une installation avait été stocker des échantillons de enrichi (qualité militaire) de l'uranium dans un placard à balais avant que le projet d'amélioration; une autre piste avait été gardant de son stock d'ogives nucléaires utilisant des cartes d'index conservé dans une boîte à chaussures.
Occurrence
Biotique et abiotique

L'uranium est un élément qui peut être trouvé dans de faibles niveaux dans toutes les roches, le sol et l'eau naturelle. L'uranium est l'élément 51e dans l'ordre de abondance dans la croûte terrestre. L'uranium est aussi l'élément numéro le plus élevé se trouve naturellement en quantités importantes sur Terre et. En plus de tous les éléments ayant poids atomique supérieur à celui du fer , ce ne est que naturellement formés dans supernovae . La désintégration de l'uranium, le thorium , et potassium 40 dans la Terre manteau est pensé pour être la principale source de chaleur qui maintient le liquide et durs de noyau externe la convection du manteau, ce qui entraîne à son tour la tectonique des plaques .
Concentration moyenne de l'uranium dans la Terre de la croûte est (selon la référence) 2-4 parties par million, soit environ 40 fois plus abondant que l'argent . La croûte de la Terre de la surface à 25 km (15 mi) vers le bas est calculée pour contenir 10 17 kg (2 x 10 £ 17) d'uranium alors que les océans peuvent contenir 10 13 kg (2 x 10 £ 13). La concentration de l'uranium dans le sol varie de 0,7 à 11 parties par million (jusqu'à 15 parties par million dans le sol des terres agricoles due à l'utilisation de phosphate engrais ), et sa concentration dans l'eau de mer est de 3 parties par milliard.
L'uranium est plus abondant que l'antimoine , l'étain , le cadmium , le mercure , ou de l'argent, et il est à peu près aussi abondante que l'arsenic ou le molybdène . Uranium se trouve dans des centaines de minéraux, y compris uraninite (l'uranium la plus commune le minerai), carnotite, autunite, uranophane, torbernite, et coffinite. Des concentrations significatives d'uranium se produisent dans certaines substances telles que phosphate dépôts de roches et de minéraux tels que lignite, et sables de monazite dans les minerais riches en uranium (il est récupéré commercialement à partir de sources avec aussi peu que 0,1% d'uranium).
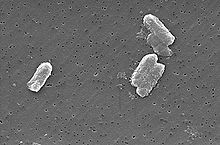
Des bactéries telles que S. putrefaciens et G. metallireducens ont été montrés pour réduire U (VI) en U (IV).
Certains organismes, tels que la involuta lichen ou Trapelia des microorganismes tels que la bactérie Citrobacter, peut absorber des concentrations d'uranium qui sont jusqu'à 300 fois plus élevés que dans leur environnement. Espèces Citrobacter absorbent uranyle ions lorsqu'il est administré le phosphate de glycérol (ou d'autres phosphates organiques similaires). Après un jour, un gramme de bactéries peut se incruster à neuf grammes de cristaux de phosphate d'uranyle; ce qui crée la possibilité que ces micro-organismes peuvent être utilisés dans biorestauration à décontaminer l'eau de l'uranium-pollué.
Dans la nature, de l'uranium (VI) forme des complexes de carbonate hautement soluble à un pH alcalin. Cela conduit à une augmentation de la mobilité et de la disponibilité de l'uranium dans les eaux souterraines et des sols par les déchets nucléaires qui conduit à des risques sanitaires. Cependant, il est difficile de précipiter l'uranium sous forme de phosphate en présence d'un excès de carbonate à un pH alcalin. Un sp Sphingomonas. souche BSAR-1 a été trouvé pour exprimer une forte activité de la phosphatase alcaline (Phok) qui a été appliquée pour bioprecipitation de l'uranium comme des espèces de phosphate d'uranyle de solutions alcalines. La capacité de précipitation a été renforcée par la surexpression de la protéine dans E. Phok coli.
Plantes absorbent une partie de l'uranium à partir du sol. Concentrations de poids sec de l'uranium dans les usines aller de 5 à 60 parties par milliard, et les cendres de bois brûlé peuvent avoir des concentrations allant jusqu'à 4 parties par million. Concentrations de poids sec de l'uranium dans l'alimentation des plantes sont généralement inférieurs avec une à deux microgrammes par jour ingérées par la nourriture que les gens mangent.
La production et l'exploitation minière
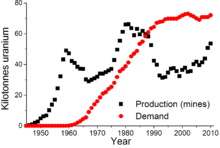

La production mondiale d'uranium en 2010 se élevait à 53 663 tonnes, dont 17 803 t (33,2%) ont été extraits au Kazakhstan . Autres pays d'extraction d'uranium importantes sont le Canada (9,783 t), l'Australie (5900 t), la Namibie (4496 t), Niger (4198 t) et la Russie (3562 t).
Le minerai d'uranium est extrait de plusieurs façons: par à ciel ouvert, souterraine, lixiviation in situ, et minière forage (voir l'exploitation minière de l'uranium). Minerai d'uranium à faible teneur extrait contient généralement de 0,01 à 0,25% d'oxydes d'uranium. De vastes mesures doivent être utilisés pour extraire le métal à partir de son minerai. Minerais à haute teneur trouvent dans Dépôts bassin de l'Athabasca dans Saskatchewan, Canada peut contenir jusqu'à 23% d'oxydes d'uranium en moyenne. Le minerai d'uranium est écrasé et rendu en une poudre fine, puis lessivé avec soit un acide ou alcalin. Le lixiviat est soumis à une ou plusieurs séquences de précipitation, extraction par solvant et l'échange d'ions. Le mélange résultant, appelé yellowcake, contient au moins 75% d'oxydes d'uranium U 3 O 8. Yellowcake est alors calciné pour éliminer les impuretés provenant du procédé de fraisage avant le raffinage et la conversion.
L'uranium de qualité commerciale peut être produit par la réduction de l'uranium avec des halogénures alcalins ou métaux alcalino-terreux . L'uranium métal peut également être préparé par électrolyse de 5 ou KUF UF 4, dissous dans de fusion du chlorure de calcium (Ca Cl 2) et chlorure de sodium ( Na Cl) en solution. Uranium très pur est produit par la la décomposition thermique des halogénures d'uranium sur un filament chaud.
Alimentation

En 2005, dix-sept pays ont produit des oxydes d'uranium concentré, le Canada (27,9% de la production mondiale) et l'Australie (22,8%) étant les plus grands producteurs et Kazakhstan (10,5%), la Russie (8,0%), la Namibie (7,5%), le Niger ( 7,4%), l'Ouzbékistan (5,5%), le Royaume-Unis (2,5%), l'Argentine (2,1%), l'Ukraine (1,9%) et la Chine (1,7%) produisant également des quantités significatives. Kazakhstan continue à augmenter la production et peut-être devenir le plus grand producteur mondial d'uranium d'ici 2009 avec une production prévue de 12 826 tonnes, par rapport au Canada avec 11 100 t et en Australie avec 9430 t. L'uranium ultime disponibles est considérée comme suffisante pour au moins les prochaines 85 années, bien que certaines études indiquent un sous-investissement dans la fin du XXe siècle peut produire des problèmes d'approvisionnement dans le 21e siècle. dépôts d'uranium semblent être log-normale distribué. Il ya une augmentation de 300 fois dans la quantité d'uranium récupérable pour chaque diminuer par dix la teneur du minerai. En d'autres termes, il ya peu de minerai à haute teneur et proportionnellement beaucoup plus faible teneur du minerai disponible.
Composés
États d'oxydation et d'oxydes
Oxydes
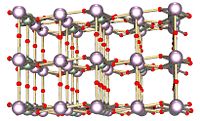 |  | |
Triuranium octaoxide (à gauche) et dioxyde d'uranium (à droite) sont les deux oxydes d'uranium plus courantes. | ||
Gâteau jaune d'uranium produit calciné comme dans de nombreuses grandes usines contient une distribution des espèces d'oxydation de l'uranium sous diverses formes allant de plus oxydé en moins oxydée. Particules avec de courts temps de séjour dans un four de calcination seront généralement moins oxydée que ceux avec des temps de rétention de longues ou de particules récupéré dans le laveur de pile. teneur en uranium est généralement référencé à U 3 O 8, qui date de l'époque de la Projet Manhattan lorsque U 3 O 8 a été utilisé comme une norme de reporting de la chimie analytique.
des relations de phase dans le système uranium-oxygène sont complexes. Les états d'oxydation les plus importants de l'uranium sont l'uranium (IV) et l'uranium (VI), et leurs deux correspondant oxydes sont, respectivement, dioxyde d'uranium (UO 2) et du trioxyde d'uranium (UO 3). Autre oxydes d'uranium comme le monoxyde d'uranium (UO), pentoxyde diuranium (U 2 O 5), et du peroxyde d'uranium (UO 4 · 2H 2 O) existent également.
Les formes les plus courantes d'oxyde d'uranium sont triuranium octaoxide (U 3 O 8) et UO 2. Les deux formes d'oxyde sont des solides qui ont une faible solubilité dans l'eau et qui sont relativement stables dans une large gamme de conditions environnementales. Triuranium octaoxide est (selon les conditions), le composé le plus stable de l'uranium et est la forme la plus couramment trouvés dans la nature. Le dioxyde d'uranium est la forme sous laquelle l'uranium est le plus souvent utilisé comme combustible de réacteur nucléaire. Aux températures ambiantes, UO 2 va progressivement pour convertir U 3 O 8. En raison de leur stabilité, oxydes d'uranium sont généralement considérés comme la forme chimique préférée pour le stockage ou l'élimination.
La chimie aqueuse

Sels de nombreux états d'oxydation de l'uranium sont l'eau solubles et peuvent être étudiés dans des solutions aqueuses. Les formes les plus courantes sont ioniques U 3+ (brun-rouge), U 4+ (vert), UO +
2 (instable) et UO 2+
2 (jaune), U (III), U (IV), U (V), et U (VI), respectivement. Quelques solides composés et semi-métalliques tels que UO et US existent pour le formel état d'oxydation de l'uranium (II), mais pas d'ions simples sont connus pour exister en solution pour cet état. Ions de l'uranium U 3+ libèrent de l'hydrogène à partir de l'eau et sont donc considérés comme très instable. L'UO 2+
2 ions représente l'uranium (VI) l'état et est connu pour former des composés tels que carbonate d'uranyle, chlorure d'uranyle et uranyle sulfate. UO 2+
2 aussi des formes complexes avec divers organique agents chélateurs, les plus couramment rencontrés qui est acétate d'uranyle.
Contrairement aux sels d'uranyle d'uranium et de formes cationiques d'ions polyatomiques oxyde d'uranium, le uranates, les sels contenant un anion polyatomique oxyde d'uranium, ne sont généralement pas solubles dans l'eau.
Carbonates
Les interactions des anions carbonate avec de l'uranium (VI) provoquent la Pourbaix diagramme de changer considérablement lorsque le milieu est changé à partir de l'eau à une solution de carbonate contenant. Alors que la grande majorité des carbonates insolubles dans l'eau (les étudiants sont souvent enseigné que tous les carbonates autres que ceux des métaux alcalins sont insolubles dans l'eau), les carbonates d'uranium sont souvent solubles dans l'eau. En effet, un U (VI) cation est capable de se lier à deux oxydes de terminaux et trois ou plusieurs carbonates pour former des complexes anioniques.
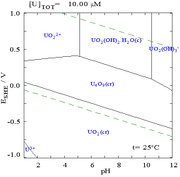 |  |  | 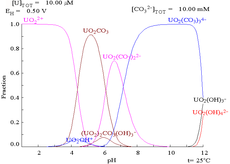 |
| L'uranium dans un milieu aqueux non-complexants (par exempleperchlorique / hydroxyde de sodium de l'acide). | Uranium en solution de carbonate | Les concentrations relatives des différentes formes chimiques de l'uranium dans un milieu aqueux non-complexants (par exempleperchlorique / hydroxyde de sodium de l'acide). | Les concentrations relatives des différentes formes chimiques de l'uranium dans une solution aqueuse de carbonate. |
Effets de pH
Les diagrammes de la fraction de l'uranium, en présence de carbonate illustrent la présente en outre: lorsque le pH d'une uranium (VI) solution augmente, l'uranium est converti en un hydroxyde d'oxyde d'uranium hydraté et à des pH élevés, il devient un complexe d'hydroxyde anionique.
Quand on ajoute du carbonate, de l'uranium est converti en une série de complexes de carbonate si le pH est augmenté. Un effet de ces réactions est augmenté la solubilité de l'uranium dans la gamme de pH de 6 à 8, ce qui a une incidence directe sur la stabilité de combustibles nucléaires de dioxyde d'uranium passé à long terme.
Des hydrures, des carbures et des nitrures
L'uranium métal chauffé à 250 à 300 ° C (482 à 572 ° F) réagit avec l' hydrogène pour former de l'hydrure d'uranium. Même des températures plus élevées seront réversible éliminer l'hydrogène. Cette propriété rend les hydrures d'uranium matériaux de départ commodes pour créer poudre d'uranium réactive avec différents uranium carbure, nitrure, et composés halogénures. Deux modifications cristallines de l'hydrure d'uranium existent: une forme de α qui est obtenu à des températures basses et une forme de β qui est créé lorsque la température de formation est au-dessus de 250 ° C.
carbures d'uranium et nitrures d'uranium sont tous deux relativement inertes composés semi-métalliques, qui sont peu solubles dans les acides , réagissent avec l'eau, et peut enflammer dans l'air pour former U 3 O 8 . Carbures d'uranium comprennent monocarbure d'uranium (U C ), dicarbure d'uranium ( UC 2 ), et diuranium tricarbide ( U 2 C 3 ). Les deux UC et l'UC 2 sont formés par addition de carbone à l'uranium fondu ou en exposant le métal de l'oxyde de carbone à des températures élevées. Stable au-dessous de 1800 ° C, U 2 C 3 est préparé en soumettant un mélange chauffé de l'UC et l'UC 2 à des contraintes mécaniques. nitrures d'uranium obtenues par exposition directe du métal à l'azote comprennent mononitrure d'uranium (ONU), dinitride d'uranium ( de l'ONU 2 ), et diuranium trinitride ( U 2 N 3 ).
Halogénures

Les fluorures d'uranium sont créés en utilisant le tétrafluorure d'uranium ( UF 4 ); UF 4 lui-même est préparé par hydrofluoration de dioxyde d'uranium. Réduction des UF 4 avec de l'hydrogène à 1000 ° C produit trifluorure d'uranium ( UF 3 ). Dans de bonnes conditions de température et de pression, la réaction du solide UF 4 gazeux avec l'hexafluorure d'uranium ( UF 6 ) peut former les fluorures intermédiaires de U 2 F 9 , U 4 F 17 et UF 5 .
A des températures ambiantes, UF 6 a une haute pression de vapeur, ce qui est utile dans le procédé de diffusion gazeuse pour séparer le rare uranium 235 de l'uranium-238 commun. Ce composé peut être préparé à partir de dioxyde d'uranium et de l'hydrure d'uranium par le procédé suivant:
- UO2+ 4 HF →UF4+ 2H2O(500 ° C, endothermique)
- UF4+F2→UF6(350 ° C, endothermique)
La résultanteUF6, un solide blanc, est hautementréactif(par fluoration), facilementse sublime (émettant une vapeur qui se comporte à peu près comme ungaz idéal), et est le composé le plus volatil de l'uranium connus pour exister.
Un procédé de préparation de tétrachlorure d'uranium ( UCl 4 ) est de combiner directement chlore soit avec l'uranium métal ou de l'hydrure d'uranium. La réduction de UCl 4 hydrogène produit par le trichlorure d'uranium ( UCl 3 ), tandis que les chlorures supérieurs de l'uranium sont préparés par réaction avec du chlore supplémentaire. Tous les chlorures d'uranium réagissent avec l'eau et l'air.
Les bromures et les iodures d'uranium sont formés par réaction directe de, respectivement, le brome et l'iode avec de l'uranium ou en ajoutant UH 3 aux acides de ceux élément. Des exemples connus comprennent: UBr 3 , UBr 4 , l'interface utilisateur 3 et l'interface utilisateur 4 . oxyhalogénures d'uranium sont solubles dans l'eau et comprennent UO 2 F 2 , UOCl 2 , UO 2 Cl 2 , et UO 2 Br 2 . Stabilité des oxyhalogénures diminuer à mesure que le poids atomique de l'halogénure composants augmente.
Isotopes
Concentrations naturelles
L'uranium naturel se compose de trois principaux isotopes : l'uranium-238 (99,28% de l'abondance naturelle), l'uranium 235 (0,71%), et de l'uranium-234 (0,0054%). Tous les trois sont radioactif, émettant des particules alpha, à l'exception que tous les trois de ces isotopes ont de petites probabilités de subir une fission spontanée, plutôt que émission alpha.
L'uranium 238 est l'isotope le plus stable de l'uranium, avec une demi-vie d'environ 4.468 × 10 9 ans, à peu près la âge de la Terre. Uranium-235 a une demi-vie d'environ 7,13 × 10 8 ans, et l'uranium 234 a une demi-vie de environ 2,48 × 10 5 ans. Pour l'uranium naturel, environ 49% de ses rayons alpha sont émis par chacun des 238 atome U, et également 49% en 234 U (puisque celle-ci est formée à partir de la première) et environ 2,0% d'entre eux par le 235 U. Quand la Terre était jeune, probablement environ un cinquième de son uranium était l'uranium-235, mais le pourcentage de 234 U était probablement beaucoup plus bas que cela.
L'uranium 238 est généralement un émetteur α (parfois, il subit une fission spontanée), en décomposition à travers la"série de l'uranium" de désintégration nucléaire, qui compte 18 membres, qui tous finissent par se décomposer enplomb-206, par une variété de différentes voies de désintégration .
Le série de désintégration de 235 U, qui est appelée la série de l'actinium compte 15 membres, qui tous finissent par se décomposer en plomb-207. Les taux de change constants de pourriture dans ces séries de désintégration rend la comparaison des ratios de parent à des éléments de fille utile datation radiométrique.
Uranium-234 est un membre de la"série de l'uranium", et il se désintègre en plomb-206 à travers une série d'isotopes relativement de courte durée.
L'uranium-233 est composé de thorium-232 par bombardement neutronique, le plus souvent dans un réacteur nucléaire, et 233 U est également fissile. Sa série de décroissance se termine avec le thallium -205.
L'uranium 235 est important pour les deuxréacteurs nucléaires et lesarmes nucléaires, car il est le seul isotope de l'uranium existant dans la nature sur Terre en toute quantité significative qui est fissiles.Cela signifie qu'il peut être divisé en deux ou trois fragments (produits de fission) par des neutrons thermiques.
L'uranium 238 est fissile pas, mais est un isotope fertile, car après activation neutronique il peut produire du plutonium-239, un autre isotope fissile. En effet, le 238 noyau U peut absorber une neutrons pour produire l'isotope radioactif de l'uranium-239. 239 U se désintègre par émission bêta de neptunium -239, également un bêta-émetteur, qui se désintègre à son tour, au bout de quelques jours en plutonium-239. 239 Pu a été utilisé comme matière fissile dans la première bombe atomique a explosé dans le " test de Trinity ", le 15 Juillet 1945 à Nouveau Mexique.
Enrichissement

Dans la nature, l'uranium se trouve que l'uranium-238 (99.2742%) et de l'uranium-235 (0.7204%). Isotope concentrés de séparation (enrichit) l'fissile de l'uranium-235 pour les armes nucléaires et la plupart des centrales nucléaires, à l'exception des réacteurs à caloporteur gaz et sous pression réacteurs à eau lourde. La plupart des neutrons libérés par un atome de fission de l'uranium-235 doivent impact sur d'autres atomes d'uranium 235. pour soutenir la réaction nucléaire en chaîne. quantité et la concentration de l'uranium-235 nécessaire pour atteindre cet objectif est une « masse critique ».
Pour être considéré comme «enrichi», la fraction de l'uranium-235 doit être comprise entre 3% et 5%. Ce processus produit d'énormes quantités d'uranium appauvri qui est de l'uranium-235 et avec une fraction accrue en conséquence de l'uranium-238, appelé uranium appauvri ou «DU». Pour être considéré comme «appauvri», la concentration en uranium 235 ne doit pas être supérieure à 0,3%. Le prix de l'uranium a augmenté depuis 2001, de sorte que les résidus d'enrichissement contenant plus de 0,35% d'uranium-235 sont à l'étude pour ré-enrichissement, de conduire le prix de l'hexafluorure d'uranium appauvri-dessus de 130 $ le kilogramme en Juillet 2007 à partir de $ 5 en 2001.
Le processus de centrifugeuses à gaz, où gazeux hexafluorure d'uranium ( UF 6 ) est séparé par la différence de poids moléculaire entre 235 UF 6 et 238 UF 6 utilisant à grande vitesse centrifugeuses, est le processus d'enrichissement moins cher et le leader. Le procédé de diffusion gazeuse avait été la principale méthode d'enrichissement et a été utilisée dans le Projet Manhattan. cours de ce processus, l'hexafluorure d'uranium est à plusieurs reprises diffusé à travers un argent - zinc membrane, et les différents isotopes de l'uranium sont séparés par des taux de diffusion (depuis l'uranium 238 est plus lourd qu'il diffuse légèrement plus lent que l'uranium-235). Le laser moléculaire méthode de séparation des isotopes emploie un laser faisceau d'énergie précise de rompre le lien entre l'uranium-235 et de fluor. Cela laisse uranium-238 lié à du fluor et permet à l'uranium 235 métal à précipiter de la solution. Une méthode laser subsidiaire de l'enrichissement est connu comme vapeur atomique séparation isotopique par laser (SILVA) et emploie visibles lasers accordables comme lasers à colorant. autre méthode utilisée est la diffusion thermique liquide.
L'exposition humaine
Une personne peut être exposée à l'uranium (ou de ses descendants radioactifs tels que le radon ) par l'inhalation de poussières dans l'air ou par l'ingestion d'eau et les aliments contaminés. La quantité d'uranium dans l'air est généralement très faible; Toutefois, les personnes qui travaillent dans les usines qui traitent phosphate engrais , vivent à proximité des installations du gouvernement qui ont fait ou testé des armes nucléaires, vivre ou travailler à proximité d'un champ de bataille moderne, où l'uranium appauvri armes ont été utilisées, ou de vivre ou de travailler à proximité d'un charbon centrale -fired, installations qui exploitent ou minerai processus de l'uranium, ou enrichir de l'uranium pour le combustible du réacteur, peuvent avoir augmenté l'exposition à l'uranium. Maisons ou des structures qui sont plus de gisements d'uranium (naturel ou dépôts de scories homme) peut avoir une incidence accrue de l'exposition au radon.
La plupart de l'uranium ingéré est excrété pendant la digestion. Seulement 0,5% est absorbée lorsque les formes insolubles de l'uranium, tels que son oxyde, sont ingérés, alors que l'absorption de la plus soluble ion uranyle peut aller jusqu'à 5%. Cependant, les composés solubles d'uranium ont tendance à passer rapidement à travers le corps tandis que les composés d'uranium insolubles, surtout quand inhalé par voie de poussière dans les poumons, pose un risque d'exposition plus grave. Après être entré dans la circulation sanguine, l'uranium absorbé tendance à la bioaccumulation et de rester pendant de nombreuses années dans le tissu osseux en raison de l'affinité de l'uranium des phosphates. L'uranium est pas absorbé par la peau, et des particules alpha libérées par l'uranium ne peut pas pénétrer dans la peau.
L'uranium incorporé devient ions uranyle, qui accumulent dans les os, le foie, les reins et les tissus reproducteurs. L'uranium peut être décontaminé les surfaces en acier et aquifères.
Effets et précautions
Le fonctionnement normal du rein , cerveau , foie, coeur , et d'autres systèmes peuvent être affectés par l'exposition de l'uranium, parce que, en plus d'être faiblement radioactif, l'uranium est un métal toxique. L'uranium est aussi toxique pour la reproduction. Effets radiologiques sont généralement locale parce que le rayonnement alpha, la principale forme de 238 U décroissance, a une portée très courte, et ne seront pas pénétrer la peau. uranyle ( UO +
2 ) des ions, tels que du trioxyde d'uranium ou de nitrate d'uranyle et d'autres composés d'uranium hexavalent, ont été montré pour causer des malformations congénitales et des lésions du système immunitaire chez les animaux de laboratoire. Alors que la CDC a publié une étude qu'aucun humain cancer a été considérée comme un résultat de l'exposition à l'uranium naturel ou appauvri, l'exposition à l'uranium et ses produits de désintégration, en particulier le radon , sont largement connus et les menaces pour la santé. L'exposition au strontium-90, l'iode-131, et d'autres produits de fission est sans rapport avec l'exposition de l'uranium, mais peut résulter de procédures médicales ou l'exposition à combustible de réacteur passé ou les retombées d'armes nucléaires. Bien que l'exposition par inhalation accidentelle à une concentration élevée de l'hexafluorure d'uranium a entraîné des décès humains, ces décès ont été associés à la production de l'acide fluorhydrique et hautement toxiques de fluorure d'uranyle plutôt que l'uranium lui-même. Uranium métal finement divisée présente un risque d'incendie en raison de l'uranium est pyrophore; petits grains vont enflammer spontanément dans l'air à température ambiante.
Uranium métal est généralement traitée avec des gants par mesure de précaution suffisante. Concentré d'uranium est manipulé et contenu de manière à assurer que les gens ne pas inhaler ou ingèrent.
| système de corps | Les études humaines | Les études animales | In vitro |
|---|---|---|---|
| Rénal | Des niveaux élevés de l'excrétion de protéine, la catalase urinaire et la diurèse | Dommages à proximal tubule contourné, les cellules nécrotiques exprimés de l'épithélium tubulaire, changements glomérulaire (insuffisance rénale) | Aucune étude |
| Cerveau / CNS | Diminution de la performance sur les tests neurocognitifs | Toxicité aiguë cholinergique; Accumulation dépendante de la dose dans le cortex, le mésencéphale, et vermis; Changements électrophysiologiques dans l'hippocampe | Aucune étude |
| ADN | Davantage de cas de cancers | Mutagène augmenté (chez la souris) et l'induction de tumeurs | Cellules binucléées avec micronoyaux, Inhibition de la cinétique du cycle cellulaire et la prolifération; Chromatides sœurs induction, phénotype tumorigène |
| Os / muscle | Aucune étude | L'inhibition de la formation de l'os parodontal; alvéolaire et la guérison de la plaie | Aucune étude |
| Reproducteur | Les mineurs d'uranium ont plus premier-né des enfants de sexe féminin | Modérée à sévère atrophie tubulaire focale; vacuolisation des cellules de Leydig | Aucune étude |
| Poumons / respiratoires | Pas d'effets néfastes sur la santé signalés | Grave congestion nasale et des hémorragies, des lésions pulmonaires et la fibrose, l'oedème et l'enflure, le cancer du poumon | Aucune étude |
| Gastrointestinal | Vomissements, diarrhée, albuminurie | Aucune étude | Aucune étude |
| Foie | Pas d'effets observés à la dose d'exposition | Foies gras, nécrose focale | Aucune étude |
| Peau | Aucune donnée d'évaluation de l'exposition disponible | Cellules épidermiques vacuolisées enflées, dommages aux follicules pileux et des glandes sébacées | Aucune étude |
| Tissus environnants noyés fragments d'UA | Les concentrations urinaires élevées d'uranium | Les concentrations urinaires élevées d'uranium, des perturbations dans les tests biochimiques et neuropsychologique | Aucune étude |
| Système immunitaire | Fatigue, éruption cutanée, oreilles et des yeux infections chroniques, les cheveux et la perte de poids, de la toux. Peut être due à l'exposition chimique combinée plutôt que DU seul | Aucune étude | Aucune étude |
| Yeux | Aucune étude | Conjonctivite, inflammation de l'irritation, oedème, ulcération de sac conjonctival | Aucune étude |
| Sang | Aucune étude | Diminution de nombre de globules rouges et de la concentration d'hémoglobine | Aucune étude |
| Cardiovasculaire | Myocardite résultant de l'ingestion d'uranium, qui a pris fin six mois après l'ingestion | Aucun effet | Aucune étude |
