
Béryllium
Contexte des écoles Wikipédia
SOS Enfants produite ce site pour les écoles ainsi que ce site de vidéo sur l'Afrique . Avec enfants SOS vous pouvez choisir de parrainer des enfants dans plus de cent pays
| Béryllium | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
4 Soyez | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Apparence | ||||||||||||||||||||||||||||
métallique blanc-gris  | ||||||||||||||||||||||||||||
| Propriétés générales | ||||||||||||||||||||||||||||
| Nom, symbole, nombre | béryllium, Be, 4 | |||||||||||||||||||||||||||
| Prononciation | / b ə r ɪ l Je ə m / bə- RIL -ee-əm | |||||||||||||||||||||||||||
| Catégorie Metallic | métal alcalino-terreux | |||||||||||||||||||||||||||
| Groupe, période, bloc | 2 (métaux alcalino-terreux) , 2, s | |||||||||||||||||||||||||||
| Poids atomique standard | 9.012182 (3) | |||||||||||||||||||||||||||
| Configuration électronique | [Il] 2s 2 2, 2  | |||||||||||||||||||||||||||
| Histoire | ||||||||||||||||||||||||||||
| Découverte | Louis Nicolas Vauquelin (1797) | |||||||||||||||||||||||||||
| Premier isolement | Friedrich Wöhler & Antoine Bussy (1828) | |||||||||||||||||||||||||||
| Propriétés physiques | ||||||||||||||||||||||||||||
| Phase | solide | |||||||||||||||||||||||||||
| Densité (à proximité rt) | 1,85 g · cm -3 | |||||||||||||||||||||||||||
| Liquid densité au mp | 1,690 g · cm -3 | |||||||||||||||||||||||||||
| Point de fusion | 1560 K , 1287 ° C, 2349 ° F | |||||||||||||||||||||||||||
| Point d'ébullition | 2742 K, 2469 ° C, 4476 ° F | |||||||||||||||||||||||||||
| La chaleur de fusion | 12,2 kJ · mol -1 | |||||||||||||||||||||||||||
| Chaleur de vaporisation | 297 kJ · mol -1 | |||||||||||||||||||||||||||
| Capacité thermique molaire | 16,443 J · mol -1 · K -1 | |||||||||||||||||||||||||||
| La pression de vapeur | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| Propriétés atomiques | ||||||||||||||||||||||||||||
| États d'oxydation | 2, 1 ( l'oxyde amphotère) | |||||||||||||||||||||||||||
| Électronégativité | 1,57 (échelle de Pauling) | |||||||||||||||||||||||||||
| énergies d'ionisation ( plus) | 1er: 899,5 kJ · mol -1 | |||||||||||||||||||||||||||
| 2ème: 1757,1 kJ · mol -1 | ||||||||||||||||||||||||||||
| 3ème: 14848,7 kJ · mol -1 | ||||||||||||||||||||||||||||
| Rayon atomique | 112 h | |||||||||||||||||||||||||||
| Rayon covalente | 96 ± 15 heures | |||||||||||||||||||||||||||
| Rayon de Van der Waals | 153 h | |||||||||||||||||||||||||||
| Miscellanées | ||||||||||||||||||||||||||||
| Crystal structure | hexagonale compacte | |||||||||||||||||||||||||||
| Ordre magnétique | diamagnétique | |||||||||||||||||||||||||||
| Résistivité électrique | (20 ° C) 36 nΩ · m | |||||||||||||||||||||||||||
| Conductivité thermique | 200 W · m -1 · K -1 | |||||||||||||||||||||||||||
| Dilatation thermique | (25 ° C) 11,3 um · m -1 · K -1 | |||||||||||||||||||||||||||
| Vitesse du son (tige mince) | ( rt) 12870 m · s -1 | |||||||||||||||||||||||||||
| Le module d'Young | 287 GPa | |||||||||||||||||||||||||||
| Module de cisaillement | 132 GPa | |||||||||||||||||||||||||||
| Module Bulk | 130 GPa | |||||||||||||||||||||||||||
| Coefficient de Poisson | 0,032 | |||||||||||||||||||||||||||
| Dureté Mohs | 5.5 | |||||||||||||||||||||||||||
| Dureté Vickers | 1670 MPa | |||||||||||||||||||||||||||
| Dureté Brinell | 600 MPa | |||||||||||||||||||||||||||
| Numéro de registre CAS | 7440-41-7 | |||||||||||||||||||||||||||
| La plupart des isotopes stables | ||||||||||||||||||||||||||||
| Article détaillé: Isotopes du béryllium | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
Le béryllium est l' élément chimique avec le symbole Be et le nombre atomique 4. En raison quelconque béryllium synthétisé dans les étoiles est de courte durée, ce est un élément relativement rare à la fois dans l'univers et dans la croûte de la Terre. C'est un élément divalent qui est naturellement présent uniquement en combinaison avec d'autres éléments minéraux. Pierres précieuses notables qui contiennent du béryllium comprennent béryl ( aigue-marine, émeraude) et chrysobéryl. Comme un élément libre, il se agit d'un gris acier, solide, léger et cassant métal alcalino-terreux .
Le béryllium augmente la dureté et la résistance à la corrosion lorsque allié à l'aluminium, le cobalt, le cuivre (en particulier cuivre au béryllium), le fer et le nickel. Dans les applications structurelles, haute rigidité à la flexion, stabilité thermique, conductivité thermique et de faible densité (1,85 fois celle de l'eau) faire béryllium une qualité matériel aéronautique pour les avions à haute vitesse, missiles, véhicules spatiaux et satellites de communication. En raison de sa faible densité et masse atomique, le béryllium est relativement transparent aux rayons X et d'autres formes de rayonnement ionisant; par conséquent, il est significatif de la fenêtre la plus courante pour appareils à rayons X et expériences de physique des particules. Les conductivités thermiques élevées de béryllium et oxyde de béryllium ont conduit à leur utilisation dans transport de chaleur et applications de dissipation thermique.
L'utilisation commerciale de béryllium métallique présente des défis techniques en raison de la toxicité (en particulier par inhalation) de poussières contenant du béryllium. Le béryllium est corrosif pour les tissus, et peut causer une maladie allergique mortelle appelée chronique bérylliose chez certaines personnes. L'élément ne est pas connu pour être nécessaire ou utile pour soit des végétaux ou des animaux.
Caractéristiques
Propriétés physiques
Le béryllium est un gris acier et métal dur qui est fragile à la température ambiante et a une hexagonale compacte la structure cristalline. Il a exceptionnelle rigidité à la flexion ( Le module de Young 287 GPa) et une assez haute température de fusion . Le module d'élasticité de béryllium est d'environ 50% supérieure à celle de l'acier. La combinaison de ce module et un nombre relativement faible des résultats de densité dans une exceptionnellement rapide vitesse du son de conduction dans le béryllium - environ 12,9 km / s à conditions ambiantes. Autres propriétés importantes sont la chaleur spécifique élevée (1 925 J · kg -1 .K -1) et la conductivité thermique (216 W · m -1 K -1), ce qui rend le béryllium métal avec les meilleures caractéristiques de dissipation de chaleur par unité de poids. En combinaison avec la relativement faible coefficient linéaire de dilatation thermique (11,4 × 10 -6 K -1), ces caractéristiques se traduisent par une stabilité unique, dans des conditions de charge thermique.
Propriétés nucléaires
Béryllium naturel, sauf pour une légère contamination par radio-isotopes cosmogéniques, est essentiellement béryllium 9, qui a un spin nucléaire de 3 / 2-. Le béryllium a une grande section efficace de diffusion de neutrons à haute énergie, d'environ 6 granges pour des énergies supérieures à ~ 0,01 MeV. Par conséquent, il fonctionne comme un réflecteur de neutrons et modérateur de neutrons, ce qui ralentit les neutrons efficacement à la gamme d'énergie thermique inférieure à 0,03 eV, où la section transversale totale est d'au moins un ordre de grandeur inférieur - valeur exacte dépend fortement de la pureté et de la taille des cristallites de la matière.
Le seul isotope de béryllium 9 primordial être aussi soumis à une (n, 2n) réaction de neutrons avec des énergies de neutrons supérieure à environ 1,9 MeV, pour produire 8 Be, qui décompose presque immédiatement en deux particules alpha. Ainsi, pour les neutrons à haute énergie béryllium est un multiplicateur de neutrons, libérant davantage de neutrons qu'elle absorbe. Cette réaction nucléaire est la suivante:
- 9
4 Soyez + n → 2 (4
2 Il) + 2n
Les neutrons sont libérés lorsque béryllium noyaux sont frappés par énergique des particules alpha qui produisent la réaction nucléaire
- 9
4 Soyez + 4
2 Il → 12
6 C + n, où 4
2 Il se agit d'une particule alpha et 12
6 C est un noyau de 12 carbone.
Béryllium libère également des neutrons sous les bombardements de rayons gamma. Ainsi, le béryllium naturelle bombardé soit par alphas ou gammas d'un radio-isotope approprié est un élément clé de la plupart des radio-isotope-alimenté réaction nucléaire les sources de neutrons pour la production en laboratoire de neutrons libres.
En tant que métal, est béryllium transparent aux longueurs d'onde de la plupart Les rayons X et les rayons gamma, ce qui est utile pour les fenêtres de sortie Tubes à rayons X et d'autres tels appareils.
Isotopes et la nucléosynthèse
Les deux isotopes stables et instables de béryllium sont créés dans les étoiles, mais elles ne durent pas longtemps. On pense que la plupart du béryllium stable dans l'univers a été créé dans le milieu interstellaire quand rayons cosmiques induites fission dans des éléments plus lourds trouvés dans le gaz et la poussière interstellaire. Béryllium Primordial ne contient qu'un seul isotope stable, 9 Be, et donc le béryllium est un monoisotopique élément.
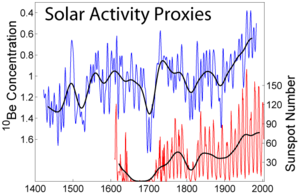
Radioactif cosmogénique 10 Be est produite dans l' atmosphère de la Terre par le cosmique spallation de rayon de l'oxygène . 10 Be se accumule au sol surface, où son relativement longue demi-vie (1,36 millions années) permet une longue temps de séjour avant de se désintégrer au bore -10. Ainsi, 10 Be et ses produits de filiation sont utilisés pour examiner naturelle érosion des sols , la formation du sol et le développement de sols latéritiques, et comme proxy pour la mesure des variations de l'activité solaire et l'âge des carottes de glace . La production de 10 Be est inversement proportionnelle à l'activité solaire, car l'augmentation vent solaire pendant les périodes de forte activité solaire diminue le flux de les rayons cosmiques galactiques qui atteignent la Terre. Les explosions nucléaires font également 10 se faire par la réaction de neutrons rapides avec 13 C en dioxyde de carbone dans l'air. Ce est l'un des indicateurs de l'activité passée à sites d'essai d'armes nucléaires. L'isotope 7 Soyez (demi-vie 53 jours) est aussi cosmogonique, et montre une abondance atmosphérique liée à taches solaires, un peu comme dix Soyez.
8 Soyez a une demi-vie très courte d'environ 7 × 10 -17 s qui contribue à son rôle cosmologique significative, comme éléments plus lourds que le béryllium ne pouvaient pas ont été produites par la fusion nucléaire dans le Big Bang . Cela est dû à l'absence de suffisamment de temps au cours de la Big Bang de la phase nucleosynthesis carbone pour produire de la fusion des noyaux 4 He et les très faibles concentrations de disponible 8-béryllium. Les Britanniques astronome Sir Fred Hoyle d'abord montré que les niveaux de huit d'énergie Be et 12 C permet la production de carbone par la soi-disant triple processus-alpha dans les étoiles d'hélium-alimentée, où plus de temps nucléosynthèse est disponible. Ce processus permet de carbone à produire dans les étoiles, mais pas dans le Big Bang. carbone Star-créé (la base de la vie à base de carbone) est donc un composant dans les éléments dans le gaz et la poussière éjectées par Étoiles AGB et supernovae (voir aussi Big Bang nucleosynthesis), ainsi que la création de tous les autres éléments ayant un numéro atomique supérieur à celui du carbone.
Les électrons les plus intimes de béryllium peuvent contribuer à la liaison chimique. Par conséquent, lorsque sept Soyez désintégrations par capture d'électrons, il le fait en prenant des électrons à partir de orbitales atomiques qui peuvent participer à la liaison. Cela rend son taux dépend à un degré mesurable sur sa configuration électronique de décroissance - un événement rare dans la désintégration nucléaire.
L'isotope connu la plus courte durée de béryllium est 13 soit qui se désintègre par émission de neutrons. Il a une demi-vie de 2,7 × 10 -21 s. 6 Be est aussi très courte durée avec une demi-vie de 5,0 × 10 -21 s. Les isotopes exotiques 11 Be et 14 Be sont connus pour présenter une halogéno nucléaire. Ce phénomène peut être comprise comme les noyaux des 11 et 14 Soyez Soyez ont, respectivement, une et quatre neutrons en orbite sensiblement à l'extérieur "goutte d'eau" Fermi modèle classique du noyau.
Occurrence


Le béryllium a une concentration de 2 à 6 parties par million (ppm) dans la croûte terrestre. Le soleil a une concentration de 0,1 partie par milliard (ppb) de béryllium, similaire à celui de rhénium . Il est le plus concentrée dans les sols, 6 ppm, et se trouve dans 0,2 parties par billion (ppt) de l'eau de mer. Des traces de 9 Be se trouvent dans l'atmosphère de la Terre. Dans l'eau de mer, le béryllium est extrêmement rare, d'autant plus que même le scandium , comprenant seulement 0,0006 ppb en poids. Dans l'eau des cours d'eau, cependant, le béryllium est plus abondante avec 0,1 ppb en poids.
Le béryllium se trouve dans plus de 100 minéraux, mais la plupart sont peu commune à rare. Le béryllium plus courante contenant des minéraux comprennent: bertrandite (Be 4 Si 2 O 7 (OH) 2), béryl (Al 2 Soyez 3 Si 6 O 18), chrysobéryl (Al 2 BeO 4) et phénacite (Be 2 SiO 4). Formes précieux de béryl sont aigue-marine, bixbite et émeraude. La couleur verte dans les formes de qualité gemme de béryl vient de quantités de chrome variable (environ 2% pour l'émeraude).
Les deux principaux minerais de béryllium, le béryl et bertrandite, se trouvent en Argentine, le Brésil, l'Inde, Madagascar, la Russie et les États-Unis. Total des réserves mondiales de minerai de béryllium sont supérieures à 400 000 tonnes.
Production
L'extraction de béryllium de ses composés est un processus difficile en raison de sa forte affinité pour l'oxygène à des températures élevées, et sa capacité à réduire l'eau lorsque sa couche d'oxyde est enlevée. Les Etats-Unis, la Chine et le Kazakhstan sont les trois seuls pays impliqués dans l'extraction à l'échelle industrielle de béryllium.
Le béryllium est plus couramment extrait de béryl, qui est soit frittée en utilisant un agent d'extraction fondu ou dans un mélange soluble. Le procédé de frittage consiste à mélanger avec le béryl le fluorosilicate de sodium et de soude à 770 ° C pour former fluorobérylliate de sodium, l'oxyde d'aluminium et dioxyde de silicium . Le béryllium hydroxyde est précipité à partir d'une solution de fluorobérylliate de sodium et l'hydroxyde de sodium dans l'eau. Extraction de béryllium en utilisant le procédé à l'état fondu implique béryl broyage en une poudre et en la chauffant à 1650 ° C. La masse fondue est rapidement refroidie à l'eau et ensuite réchauffé 250 à 300 ° C en concentration de l'acide sulfurique , qui donne principalement du sulfate de béryllium et sulfate d'aluminium. Aqueuse d'ammoniaque est ensuite utilisé pour éliminer le soufre et l'aluminium, en laissant l'hydroxyde de béryllium.
Hydroxyde de béryllium créée en utilisant soit le frittage ou fusion procédé est ensuite convertie en le fluorure de béryllium ou le chlorure de béryllium. Pour former le fluorure, le fluorure d'ammonium aqueux d'hydrogène est ajouté à l'hydroxyde de béryllium pour produire un précipité de tetrafluoroberyllate d'ammonium, qui est chauffé à 1000 ° C pour former du fluorure de béryllium. Le chauffage du fluorure à 900 ° C avec du magnésium finement divisé formes béryllium et chauffage supplémentaire à 1300 ° C crée le métal compact. chauffage de l'hydroxyde de béryllium constitue l'oxyde qui devient chlorure de béryllium, lorsqu'ils sont mélangés avec du carbone et du chlorure. L'électrolyse du chlorure de béryllium fondu est ensuite utilisé pour obtenir le métal.
Propriétés chimiques
Le comportement chimique du béryllium est en grande partie en raison de sa faible atomique et rayons ioniques. Il a donc très élevé potentiels d'ionisation et une forte polarisation tout lié à d'autres atomes, ce est pourquoi l'ensemble de ses composés sont covalente. Il est plus chimiquement similaire à l'aluminium que ses voisins proches dans le tableau périodique raison d'avoir un ratio similaire charge-rayon. Forme une couche d'oxyde de béryllium autour qui empêche d'autres réactions avec de l'air à moins chauffé au-dessus de 1000 ° C. Une fois allumé, le béryllium brûle brillamment formant un mélange de l'oxyde de béryllium et nitrure de béryllium. Béryllium se dissout facilement dans non des acides oxydants, tels que HCl dilué et H 2 SO 4, mais pas dans de l'acide nitrique ou de l'eau comme ceci forme l'oxyde. Ce comportement est similaire à celui de l'aluminium métallique. Le béryllium se dissout également dans des solutions alcalines.

Les molécules d'eau sont attachés à être omis
L'atome de béryllium a la configuration électronique [He] 2s 2. Les deux électrons de valence 2 donnent béryllium un état d'oxydation et donc l'aptitude à former le deux des liaisons covalentes; le seul élément de valence inférieure du béryllium est de la solubilité du métal dans BeCl 2. En raison de règle de l'octet, atomes ont tendance à rechercher une valence de 8 afin de ressembler à un gaz noble . Béryllium tente de parvenir à un nombre de coordination de 4 parce que ses deux liaisons covalentes remplir la moitié de cet octet. Une coordination permet de quatre composés du béryllium, tels que le fluorure ou chlorure, pour former des polymères.
Cette caractéristique est employé dans les techniques analytiques en utilisant EDTA en tant que ligand. EDTA forme préférentiellement des complexes octaédriques - absorbant ainsi d'autres cations tels que Al 3+ qui pourraient interférer - par exemple, dans le extraction au solvant d'un complexe formé entre Be 2+ et acétylacétone. Le béryllium (II) forme facilement des complexes avec des ligands donneurs forts tels que les oxydes de phosphine et des oxydes d'arsine. Il ya eu des études approfondies de ces complexes qui montrent la stabilité de la liaison O-Be.
Les solutions de sels de béryllium, p.ex. du sulfate de béryllium et le nitrate de béryllium, sont acides en raison de l'hydrolyse du [Be (H 2 O) 4] 2+ ions.
- [Be (H 2 O) 4] 2+ + H 2 O
 [Be (H 2 O) 3 (OH)] + + H 3 O +
[Be (H 2 O) 3 (OH)] + + H 3 O +
Autres produits de l'hydrolyse comprennent la ion trimérique [3 Be (OH) 3 (H 2 O) 6] 3+. L'hydroxyde de béryllium, Be (OH) 2, est insoluble dans des solutions acides, même avec un pH inférieur à 6, ce est-à pH biologique. C'est amphotère et se dissout dans fortement des solutions alcalines.
formes de béryllium composés binaires avec beaucoup de non-métaux. Anhydre halogénures sont connus pour F , Cl , Br et I . BeF 2 a une silice structure -comme avec coin-partagée BeF quatre tétraèdres. BeCl 2 et Bebr 2 ont des structures de la chaîne avec des tétraèdres de bord partagé. Tous les halogénures de béryllium ont une structure moléculaire linéaire monomère dans la phase gazeuse.
Difluorure de béryllium, BeF 2, est différent de l'autre difluorures. En général, le béryllium a une tendance à se lier de manière covalente, beaucoup plus que les autres métaux alcalino-terreux et de son fluorure est partiellement covalente (mais encore plus ionique par rapport à ses autres halogénures). BeF 2 a de nombreuses similitudes avec SiO 2 (quartz) une variété principalement lié de façon covalente solide réseau. BeF 2 a coordination tétraédrique verres métalliques et forme (est difficile à cristalliser). Lorsque le fluorure cristallin, le béryllium a la même structure cristalline à la température ambiante et que du quartz part températures beaucoup plus élevées aussi des structures. Difluorure de béryllium est très soluble dans l'eau, contrairement aux autres métaux alcalino-terreux. (Même se ils sont fortement ionique, ils ne se dissolvent pas en raison de la particulièrement forte énergie treillis de la structure fluorite.) Cependant, BeF 2 présente une conductivité électrique beaucoup plus faible lorsqu'ils sont en solution ou à l'état fondu que prévu si elle était entièrement ionique.
| Ordre et désordre dans difluorures | |
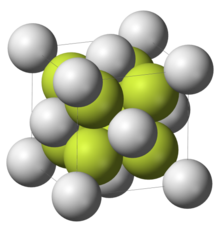 | 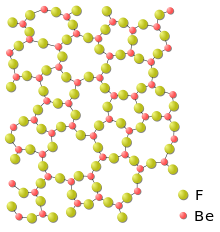 |
| La structure de fluorite ionique fort et stable adoptée par difluorure de calcium et de nombreux autres difluorures | Structure désordonnée de verre de béryllium (croquis, deux dimensions) |
oxyde de béryllium, BeO, est un blanc solide réfractaire, qui a la structure cristalline de type wurtzite et une conductivité thermique aussi élevée que dans certains métaux. BeO est amphotère. Les sels de béryllium peuvent être produits par traitement de Be (OH) 2 avec de l'acide. Béryllium sulfure, séléniure et tellurure sont connus, ayant tous la la structure blende.
Béryllium nitrure, Soyez 3 N 2 est un composé de haut point de fusion qui est facilement hydrolyse. Béryllium azoture, Ben 6 est connu et le béryllium phosphure Soyez 3 P 2 a une structure similaire à Be 3 N 2. Le nitrate de béryllium et de base l'acétate de béryllium de base ont des structures tétraédriques similaires avec quatre atomes de béryllium coordonnés à un ion oxyde central. Un certain nombre de béryllium borures sont connus, tels que Be 5 B, Be 4 B, Be 2 B, 2 BeB, BeB 6 et BeB 12. Carbure de béryllium, Be 2 C, est un composé rouge brique réfractaire qui réagit avec l'eau pour donner du méthane . Pas de béryllium siliciure a été identifiée.
Histoire
Le minéral béryl, qui contient du béryllium, a été utilisé au moins depuis le Dynastie ptolémaïque d'Egypte. Au premier siècle CE, naturaliste romain Pline l'Ancien mentionné dans son encyclopédie Histoire Naturelle que le béryl et émeraude ("émeraude") étaient similaires. Le Papyrus Graecus Holmiensis, écrit dans le troisième ou quatrième siècle de notre ère, contient des notes sur la façon de préparer émeraude artificielle et béryl.

Les premières analyses d'émeraudes et béryls par Martin Heinrich Klaproth, Torbern Olof Bergman, Franz Karl Achard, et Johann Jakob Bindheim toujours donné des éléments similaires, menant à la conclusion fallacieuse que les deux substances sont des silicates d'aluminium. Minéralogiste René Just Haüy a découvert que les deux cristaux sont géométriquement identiques, et il a demandé chimiste Louis-Nicolas Vauquelin pour une analyse chimique.
Dans un article lu devant le 1797 Annales de chimie et de physique, Vauquelin a indiqué qu'il a trouvé une nouvelle «terre» en dissolvant hydroxyde d'aluminium à partir de l'émeraude et le béryl dans un supplémentaires alcalin. Vauquelin nommé la nouvelle terre "glucine" pour le goût sucré de certains de ses composés. Klaproth préféré le nom "béryllium" en raison de fait que également formée d'oxyde d'yttrium sels douces.

Friedrich Wöhler et Antoine Bussy isolé indépendamment de béryllium en 1828 par la réaction chimique du métal de potassium avec le chlorure de béryllium, de la manière suivante:
- BeCl 2 + 2 K → 2 KCl + Soyez
Utilisation d'une lampe à alcool, Wöhler chauffé couches de chlorure de potassium et le béryllium en alternance dans un creuset de platine-fil fermés. La réaction ci-dessus a eu lieu immédiatement et a causé le creuset de devenir blanc chaud. Après refroidissement et lavage de la poudre gris-noir résultant il a vu qu'elle a été faite de fines particules avec un éclat métallique foncé. Le potassium hautement réactif a été produit par l' électrolyse de ses composés, un procédé découvert 21 ans avant. Le procédé chimique utilisant potassium a donné seulement de petits grains de béryllium à laquelle aucune lingot de métal peut être coulé ou martelé.
Le directe électrolyse d'un mélange fondu de le fluorure de béryllium et le fluorure de sodium par Paul Lebeau en 1898 a entraîné dans les premières pures (de 99,5 à 99,8%) des échantillons de béryllium. Le premier procédé commercialement réussie pour le béryllium production a été développé en 1932 par Alfred Stock et Hans Goldschmidt. Leur procédé implique l'électrolysation d'un mélange de fluorures de béryllium et de baryum , ce qui provoque le béryllium fondu à recueillir sur un fer refroidi à l'eau cathode.
Un échantillon de béryllium a été bombardé avec rayons alpha de la désintégration de radium dans une expérience 1932 par James Chadwick qui a révélé l'existence du neutron . Cette même méthode est utilisée dans une classe de laboratoire à base de radio-isotopes sources de neutrons qui produisent 30 neutrons pour chaque million de particules α.
la production de béryllium a connu une augmentation rapide au cours de la Seconde Guerre mondiale, en raison de la demande croissante pour les disques alliages de béryllium-cuivre et luminophores pour lumières fluorescentes. La plupart des lampes fluorescentes utilisées début zinc orthosilicate avec le contenu de béryllium variable pour émettre une lumière verdâtre. De petites additions de magnésium tungstate amélioré la partie bleue du spectre pour obtenir une lumière blanche acceptable. Des luminophores à base de halophosphate remplacés luminophores à base de béryllium après béryllium est révélée être toxique.
L'électrolyse d'un mélange de le fluorure de béryllium et le fluorure de sodium a été utilisé pour isoler le béryllium cours du 19ème siècle. Point de fusion élevé du métal rend ce processus plus énergivore que les procédés utilisés pour les correspondants des métaux alcalins . Au début du 20e siècle, la production de béryllium par la décomposition thermique de béryllium iodure a été étudiée après le succès d'un processus similaire pour la production de zirconium , mais ce processus se est avéré être rentable pour la production de volume.
Pur béryllium ne est pas devenu facilement disponible jusqu'en 1957, même si elle avait été utilisé comme un métal d'alliage pour durcir et durcir le cuivre beaucoup plus tôt. Le béryllium peut être produit par réduction des composés de béryllium, tels que chlorure de potassium avec du béryllium métallique ou le sodium. Actuellement, la plupart de béryllium est produit en réduisant le fluorure de béryllium avec purifié magnésium . Le prix sur le marché américain pour lingots de béryllium vide sous pression était d'environ $ 338 par livre ($ 745 par kilogramme) en 2001.
Entre 1998 et 2008, la production mondiale de béryllium avait diminué, passant de 343 à environ 200 tonnes, dont 176 tonnes (88%) provenaient des États-Unis.
Étymologie
L'utilisation précoce du mot béryllium peut être attribuée à de nombreuses langues, y compris latine Bérylle; Béry français; grec βήρυλλος, bērullos, le béryl; Prakrit veruliya (वॆरुलिय); Pāli veḷuriya (वेलुरिय), veḷiru (भेलिरु) ou Vilar (भिलर्) - "devenir pâle", en référence à la pâle semi-précieuses béryl de pierres précieuses. La source originale est probablement le sanscrit mot वैडूर्य vaidurya-, qui est de Origine dravidienne et pourrait être dérivé du nom de la ville moderne de Belur. Pour environ 160 années, le béryllium était aussi connu comme glucinum ou glucinium (avec le symbole chimique accompagnant "Gl",), le nom venant du grec mot pour le sucré: γλυκυς, en raison de la saveur sucrée de béryllium sels .
Applications
On estime que la plupart de béryllium est utilisé pour des applications militaires, afin que l'information ne est pas disponible.
fenêtres de rayonnement


En raison de son faible nombre atomique et très faible absorption pour les rayons X, la plus ancienne et toujours l'une des applications les plus importantes de béryllium est dans les fenêtres de rayonnement pour Tubes à rayons X. Exigences extrêmes sont placés sur la pureté et la propreté de béryllium pour éviter les artefacts dans les images radiographiques. Feuilles minces de béryllium sont utilisés comme fenêtres de rayonnement pour les détecteurs de rayons X, et la très faible absorption minimise les effets de chauffage causés par haute intensité, les rayons X de basse énergie typiques des rayonnement synchrotron. fenêtres étanches au vide et de faisceaux de tubes pour des expériences de rayonnement sur les synchrotrons sont fabriqués exclusivement à partir de béryllium. Dans les installations scientifiques pour des études d'émission différents rayons X (par exemple, spectroscopie des rayons X) le porte-échantillon est généralement fait de béryllium parce que ses rayons X émis ont des énergies beaucoup plus faibles (~ 100 eV) que les rayons X à partir de matériaux les plus étudiés à dispersion d'énergie.
Faible nombre atomique rend également béryllium relativement transparent pour énergétique particules. Par conséquent, il est utilisé pour construire le tube de faisceau autour de la région de collision de la physique des particules configurations, comme les quatre principales expériences de détection à la Large Hadron Collider ( ALICE, ATLAS , CMS, LHCb), le Tevatron et le SLAC. La faible densité de béryllium permet aux produits de collision pour atteindre les détecteurs qui l'entourent, sans interaction significative, sa rigidité permet un vide puissant pour être produit dans le tuyau pour minimiser l'interaction avec des gaz, sa stabilité thermique lui permet de fonctionner correctement à des températures de quelques degrés seulement au-dessus du zéro absolu , et son nature diamagnétique garde d'interférer avec les systèmes magnétiques multipolaire complexes utilisés pour diriger et concentrer le des faisceaux de particules.
Applications mécaniques
En raison de sa rigidité, légèreté et stabilité dimensionnelle sur une large plage de température, le béryllium métal est utilisé pour les composants structuraux légers dans la défense et industries de l'aérospatiale à haute vitesse des avions , missiles guidés, véhicules spatiaux, et satellites. Plusieurs fusées à combustible liquide ont utilisé tuyères de fusée en béryllium pur. poudre de béryllium a été lui-même étudié en tant que carburant de fusée, mais cette utilisation est jamais matérialisée. Un petit nombre de cadres de bicyclettes ont été construits avec le béryllium, à des prix «étonnantes». De 1998 à 2000, le McLaren Formule Un équipe a utilisé Moteurs Mercedes-Benz avec le béryllium-aluminium- pistons en alliage. L'utilisation de composants de moteurs à béryllium a été interdite suite à une réclamation par Scuderia Ferrari.
Mélangeant environ 2,0% de béryllium en cuivre forme un alliage appelé cuivre au béryllium qui est six fois plus forte que le cuivre seul. les alliages de béryllium sont utilisés dans de nombreuses applications en raison de leur combinaison d'élasticité, de haute conductivité électrique et conductivité thermique, de haute résistance et dureté, propriétés non magnétiques, ainsi que sa bonne corrosion et résistance à la fatigue. Ces applications comprennent des outils anti-étincelles qui sont utilisés à proximité de gaz inflammables ( béryllium nickel), en ressorts et membranes (nickel et le béryllium béryllium fer) utilisé dans les instruments chirurgicaux et les dispositifs à haute température. Aussi peu que 50 parties par million de béryllium allié à du liquide magnésium conduit à une augmentation significative de la résistance à l'oxydation et une diminution de l'inflammabilité.

L'excellente rigidité élastique de béryllium a conduit à son utilisation étendue dans l'instrumentation de précision, par exemple dans systèmes de guidage inertiels et dans les mécanismes de soutien pour les systèmes optiques. Alliages béryllium-cuivre ont également été appliquées en tant qu'agent de durcissement dans des pistolets "Jason", qui ont été utilisés pour enlever la peinture des coques de navires.
Une application majeure antérieure de béryllium était en freins pour militaire les avions en raison de sa dureté, point de fusion élevé, et la capacité exceptionnelle à dissiper la chaleur. Les considérations environnementales ont conduit à la substitution par d'autres matériaux.
Pour réduire les coûts, le béryllium peut être allié avec des quantités importantes d' aluminium , ce qui entraîne la AlBeMet alliage (un nom commercial). Ce mélange est moins cher que le béryllium pur, tout en conservant de nombreuses propriétés souhaitables.
Miroirs
Béryllium les miroirs sont d'un intérêt particulier. Miroirs de grande surface, souvent avec une Structure de support de nid d'abeilles, sont utilisées, par exemple, dans satellites météorologiques où le faible poids et la stabilité dimensionnelle à long terme sont essentielles. Miroirs de béryllium plus petits sont utilisés dans systèmes de guidage optique et systèmes de commande de tir, par exemple dans la fabrication allemande Leopard 1 et Leopard 2 chars de combat principaux. Dans ces systèmes, le mouvement très rapide du miroir est nécessaire, qui dicte à nouveau une faible masse et une grande rigidité. Habituellement le miroir de béryllium est protégée par un revêtement nickelage chimique qui peut être plus facilement poli pour une finition optique plus fine que le béryllium. Dans certaines applications, cependant, l'ébauche de béryllium est polie sans revêtement. Ceci est particulièrement applicable à opération cryogénique où l'expansion décalage thermique peut provoquer le revêtement à boucle.
Le Télescope spatial James Webb aura 18 sections de béryllium hexagonales pour ses miroirs. Parce JWST sera confronté à une température de 33 K, le miroir est faite de béryllium, capable de traiter un froid extrême mieux que le verre. contrats de béryllium et se déforme moins que le verre - et reste plus uniforme - dans de telles températures. Pour la même raison, l'optique de la Télescope spatial Spitzer sont entièrement construit en métal de béryllium.
Applications magnétiques
Le béryllium est non magnétique. Par conséquent, les outils fabriqués sur le béryllium sont utilisés par navale ou militaire Les équipes de neutralisation des explosifs et munitions pour le travail sur ou à proximité mines navales, étant donné que ces mines ont souvent fusées magnétiques. Ils sont également présents dans les produits d'entretien et de construction près de L'imagerie par résonance magnétique (IRM) en raison des champs magnétiques élevés engendrés par ces derniers. Dans les domaines de communications radio et puissants (souvent militaires) radars , outils à main en béryllium sont utilisés pour régler le très magnétique klystrons, magnétrons, tubes à ondes progressives, etc., qui sont utilisés pour produire des niveaux élevés de puissance micro-ondes dans le émetteurs.
Les applications nucléaires
Clichés ou plaques minces de béryllium sont parfois utilisés dans arme nucléaire conçoit que la couche externe de la très fosses de plutonium dans les stades primaires de bombes thermonucléaires, placés à entourer le des matières fissiles. Ces couches de béryllium sont bonnes "pousseurs" pour la implosion de la plutonium 239, et ils sont aussi bons réflecteurs de neutrons, tout comme ils sont en béryllium modérés les réacteurs nucléaires.
Le béryllium est aussi couramment utilisé dans certaines les sources de neutrons dans des dispositifs de laboratoire, dans lequel relativement peu de neutrons sont nécessaires (plutôt que d'avoir à utiliser un réacteur nucléaire, ou une accélérateur alimenté particules Générateur de neutrons). A cet effet, une cible de béryllium-9 est bombardée par des particules alpha à partir d'un énergétiques radio-isotope tel que le polonium -210, radium -226, plutonium -239, ou américium -241. Dans la réaction nucléaire qui se produit, un noyau de béryllium est transmuée en carbone-12, et un neutron libre est émis, voyagez dans environ la même direction que la particule alpha se dirigeait. Tel désintégration alpha entraînée sources de neutrons du béryllium, nommé "Oursin" initiateurs à neutrons, certains ont été utilisés dans les premières bombes atomiques . Les sources de neutrons dans lequel le béryllium est bombardée par les rayons gamma provenant d'une désintégration gamma radio-isotope, sont également utilisées pour produire des neutrons de laboratoire.
Le béryllium est également utilisé à la Joint European Torus laboratoire de recherche nucléaire de fusion, et il sera utilisé dans le plus avancé ITER pour conditionner les composants qui font face le plasma. Le béryllium a également été proposé en tant que Matériau de revêtement pour tiges de combustible nucléaire, en raison de sa bonne combinaison de mécanique, chimique et les propriétés nucléaires. le fluorure de béryllium est un des sels constitutifs du mélange eutectique de sel FLiBe, qui est utilisé en tant que solvant, de modérateur et réfrigérant dans un grand nombre hypothétique fondus conceptions de réacteurs de sel.
Acoustique
Le faible poids et une grande rigidité de béryllium rendent utile comme matériau pour haute fréquence Haut-parleurs. Parce que le béryllium est coûteux (plusieurs fois plus que le titane ), difficiles à façonner en raison de sa fragilité, et toxiques cas de mauvaise manipulation, le béryllium tweeters sont limités à la maison haut de gamme, audio pro, et applications de sonorisation. En raison de la haute performance de béryllium en acoustique, à des fins de marketing de certains produits sont réclamés d'être faite de la matière quand ils ne sont pas.
Électronique
Le béryllium est un type p en dopant III-V semi-conducteurs composés. Il est largement utilisé dans des matériaux tels que GaAs, AlGaAs, InGaAs et InAlAs augmenté de épitaxie par faisceau moléculaire (MBE). Feuille de béryllium Croix-laminée est un excellent support structurel pour les cartes de circuits imprimés dans la technologie de montage en surface. Dans les applications électroniques critiques, le béryllium est à la fois un support structurel et dissipateur de chaleur. L'application nécessite également un coefficient de dilatation thermique qui est bien adapté à l'alumine et polyimide-verre substrats. L'oxyde de béryllium-béryllium composite " E-Matériaux "ont été spécialement conçus pour ces applications électroniques et ont l'avantage supplémentaire que le coefficient de dilatation thermique peut être adapté pour correspondre à divers matériaux de substrat.
oxyde de béryllium est utile pour de nombreuses applications qui nécessitent les propriétés combinées d'une isolant électrique et un excellent conducteur de chaleur, avec force et dureté élevée, et un point de fusion très élevé. oxyde de béryllium est fréquemment utilisé comme une plaque de base d'isolant en haute puissance transistors en fréquences radio des émetteurs pour les télécommunications. l'oxyde de béryllium est également étudiée pour une utilisation dans l'augmentation de la conductivité thermique du dioxyde d'uranium des pastilles de combustible nucléaire. composés de béryllium ont été utilisés dans les tubes fluorescents, mais cette utilisation a été abandonnée en raison de la maladie bérylliose qui a développé dans les travailleurs qui faisaient les tubes.
Précautions
Environ 35 microgrammes de béryllium se trouve dans le corps humain, mais ce montant ne sont pas considérés comme nuisibles. Le béryllium est chimiquement similaire à du magnésium et ne peut donc déplacer d' enzymes, qui les amène à un dysfonctionnement. Chronique bérylliose est une pulmonaire et systémique maladie granulomateuse causée par l'inhalation de poussières ou de vapeurs contaminées par le béryllium; soit de grandes quantités sur une courte période ou de petites quantités sur une longue période peut conduire à cette maladie. Les symptômes de la maladie peuvent prendre jusqu'à 5 années à se développer; environ un tiers des patients atteints de mourir et les survivants sont laissés handicapés. Le Agence Internationale pour la Recherche sur le Cancer (CIRC) classe les composés de béryllium et comme cancérogènes de catégorie 1.
La maladie aiguë de béryllium sous la forme d' une pneumonie chimique a été signalée pour la première en Europe en 1933 et aux États-Unis en 1943. Un sondage a révélé que près de 5% des travailleurs dans les usines de fabrication des lampes fluorescentes en 1949 aux États-Unis avaient des maladies pulmonaires liées béryllium- . Bérylliose chronique ressemble à de nombreux égards la sarcoïdose, et le diagnostic différentiel est souvent difficile. Il a tué certains des premiers travailleurs à la conception d'armes nucléaires, comme Herbert L. Anderson.
Les premiers chercheurs goûté béryllium et ses divers composés pour la douceur afin de vérifier sa présence. Équipement de diagnostic moderne ne nécessite plus cette procédure très risqué et aucune tentative ne devrait être faite à ingérer cette substance hautement toxique. Le béryllium et ses composés doivent être manipulés avec beaucoup de soin et des précautions particulières doivent être prises lors de la réalisation de toute activité qui pourrait entraîner le rejet de poussières de béryllium ( cancer du poumon est un résultat possible d'une exposition prolongée à la poussière de béryllium en charge). Bien que l'utilisation de composés de béryllium dans les tubes d'éclairage fluorescent a été abandonnée en 1949, le potentiel d'exposition au béryllium existe dans les industries nucléaires et de l'aérospatiale et dans le raffinage du métal de béryllium et de la fusion des alliages contenant du béryllium, la fabrication de dispositifs électroniques, et de la la manipulation d'un autre matériau contenant du béryllium.
Un test réussi pour le béryllium dans l'air et sur les surfaces a été récemment élaboré et publié en tant que volontaire ASTM D7202 norme internationale de consensus. La procédure utilise diluer bifluorure d'ammonium pour la dissolution et la détection de fluorescence avec le béryllium lié à hydroxybenzoquinoline sulfoné, permettant jusqu'à 100 fois la détection plus sensible que la limite recommandée pour la concentration du béryllium en milieu de travail. Fluorescence augmente avec la concentration de béryllium. La nouvelle procédure a été testée avec succès sur une grande variété de surfaces et est efficace pour la détection de la dissolution et de ultratrace réfractaire d'oxyde de béryllium et son siliceux (ASTM D7458 de).
